乙醇催化脱水制乙烯
- 格式:ppt
- 大小:230.00 KB
- 文档页数:18

第1篇实验名称:制取乙烯实验日期:2023年X月X日实验目的:1. 学习实验室制取乙烯的方法。
2. 掌握乙醇脱水反应的原理和操作步骤。
3. 了解反应条件对产物的影响。
4. 培养实验操作技能和安全意识。
实验原理:乙醇在浓硫酸的催化作用下,加热至170℃左右时,会发生消去反应,生成乙烯和水。
反应方程式如下:\[ C_2H_5OH \xrightarrow{H_2SO_4, 170℃} C_2H_4 + H_2O \]实验仪器与试剂:1. 仪器:酒精灯、试管、试管夹、烧杯、铁架台、导管、集气瓶、橡胶塞、玻璃片、温度计。
2. 试剂:无水乙醇、浓硫酸、碎瓷片。
实验步骤:1. 取一支干燥的试管,加入约5ml无水乙醇。
2. 慢慢加入浓硫酸,边加边振荡,使混合液均匀。
3. 在试管中加入少量碎瓷片,防止暴沸。
4. 用橡胶塞密封试管,插入温度计,温度计的水银球应位于液面以下。
5. 将试管固定在铁架台上,用酒精灯加热,控制温度在170℃左右。
6. 观察反应现象,当观察到有气体产生时,将导管插入集气瓶中,收集乙烯气体。
7. 实验结束后,关闭酒精灯,将试管中的液体倒入烧杯中,用水冲洗试管。
8. 将收集到的乙烯气体用点燃的火柴检验,观察火焰的颜色和声音。
实验现象:1. 加热过程中,试管内出现大量气泡,表明有气体产生。
2. 集气瓶中收集到的气体,用火柴点燃,火焰明亮,伴有“嘭”的一声,表明气体为乙烯。
实验结果:1. 成功制取乙烯气体。
2. 实验过程中,温度控制在170℃左右,反应现象明显。
实验分析:1. 本实验成功制取了乙烯气体,验证了乙醇在浓硫酸催化下加热至170℃左右可以发生消去反应生成乙烯。
2. 实验过程中,温度对反应有重要影响,温度过高或过低都会影响产物的生成。
3. 实验过程中,应注意安全操作,避免发生意外。
实验总结:1. 本实验学习了实验室制取乙烯的方法,掌握了乙醇脱水反应的原理和操作步骤。
2. 通过实验,了解了反应条件对产物的影响,培养了实验操作技能和安全意识。

乙醇在活性氧化铝催化下脱水制乙烯的实验研究作者:周仁鸽来源:《化学教学》2009年第02期文章编号:1005-6629(2009)02-0012-03中图分类号:G633.8文献标识码:C普通高中课程标准实验教科书《有机化学基础》(选修)[1]的第69页中曾提到:乙醇可在Al2O3作用下发生脱水反应。
教材虽然没有对其作进一步描述,但由于这一内容在以往的高中化学教材从未提及,因此,教师们对此既迷惑又很感兴趣,苦于各套高中教材均没有给出乙醇在Al2O3作用下发生脱水反应的具体条件与实验的装置,教师们相继尝试了各套教材中实验室制己烯的装置与方法来做上述实验,但均未能成功。
笔者查阅了国内的相关资料,也未发现对该实验的深入研究,由此笔者对其进行了如下的探索。
从反应机理来看,乙醇脱水反应是按照单分子消除(E1)机理进行的[2]:在酸的作用下, 乙醇分子上不容易离去的基团—C—OH转变成易离去的基团—C—O+H2, C—O键断裂脱水形成C+, C+的邻位碳原子上失去一个质子, 一对电子转移过来中和正电荷形成双键。
从反应机理上看, 生成C+的一步是整个反应的速控步骤, 且醇的脱水反应是一个可逆反应。
可以通过控制H+的浓度即用较浓的酸来使反应向右进行, 因此宜采用酸性物质作为催化剂。
那么,Al2O3能否作为乙醇脱水的催化剂呢?大学教材《基础有机化学》[3]第277页提到:在工业上,常用醇于350℃~400℃(另有资料显示为350℃~450℃[4])在氧化铝或硅酸盐表面脱水,此反应不发生重排,如:C2H5OH CH2=CH2+H2O活性氧化铝是工业上乙醇法制乙烯的主要催化剂,其反应温度一般为420℃左右。
从理论分析,氧化铝作为乙醇脱水制乙烯的催化剂是可行的,根据上述反应条件,笔者设计了如下的实验:1 反应装置2 实验过程与现象3 实验分析与结论从上述实验中可知,将乙醇吸附在石棉绒中,有利于乙醇产生稳定的蒸汽,同时也可作为催化剂的载体,而石棉绒本身在这种状况下并没有起到明显的催化效果,因此,此处的石棉绒也可用其他具有一定耐温性与吸附性的材料代替,如:用红砖砸成赤豆大小的颗粒。

实验室制备乙烯方程式
乙烯是一种重要的有机化合物,广泛应用于化工、医药、塑料等领域。
实验室制备乙烯的方法有很多种,其中最常用的方法是通过脱水剂将乙醇脱水制备乙烯。
乙烯的制备方程式如下:
C2H5OH → C2H4 + H2O
在实验室中,可以使用浓硫酸或浓磷酸作为脱水剂,将乙醇中的水分去除,使其分解为乙烯和水。
这个反应是一个典型的脱水反应,也是一个烷基化反应。
乙烯的制备过程中,需要注意以下几点:
1. 实验室中制备乙烯需要使用专门的设备,如反应釜、冷凝器等。
2. 在制备过程中,需要控制反应温度和反应时间,以保证反应的效率和产物的纯度。
3. 乙烯是一种易燃易爆的气体,需要注意安全操作,避免产生火灾和爆炸等危险。
乙烯的制备方法不仅在实验室中有应用,也在工业生产中得到广泛应用。
随着科技的不断发展,乙烯的制备方法也在不断改进和创新,以满足不同领域的需求。
乙烯的制备方程式是C2H5OH → C2H4 + H2O,通过脱水剂将乙醇脱水制备乙烯。
在实验室中制备乙烯需要注意安全操作和反应条件的控制,以保证反应的效率和产物的纯度。
随着科技的不断发展,乙烯的制备方法也在不断创新和改进,以满足不同领域的需求。

实验室制备乙烯乙烯是一种重要的有机化合物,也是世界上最重要的工业原料之一。
乙烯的制备技术有很多种,其中最常用的是石油天然气的裂解法和乙醇的脱水法。
然而,在实验室中也可以通过不同的方法制备乙烯。
本文就来介绍一下实验室制备乙烯的方法及其原理。
方法一:酸催化脱水法实验室中制备乙烯最常用的方法之一是酸催化脱水法,这是一种通过酸的作用将乙醇分解成水和乙烯的方法。
该方法适用于小规模实验,操作简单。
所需材料:1. 乙醇(醇类)2. 浓硫酸(酸类)3. 烘干管(玻璃器皿)操作方法:1. 在一个烘干管中加入约2毫升的浓硫酸。
2. 将1毫升的乙醇滴入烘干管中,并充分搅拌。
3. 把烘干管倾斜放在三角巾上或支架上进行加热,加热温度为80-100℃,加热时间为10-15分钟。
4. 加热后,将得到的气体收集在干净的试管中,可以使用气液分离装置将液体和气体分离。
5. 最后将收集到的气体称量,可以测定收率和纯度。
原理:乙醇在浓硫酸催化下失去一个水分子并形成乙烯。
具体反应式如下:CH3CH2OH → CH2CH2 + H2O浓硫酸在此反应中充当了脱水剂的角色,同时起到了催化剂的作用。
方法二:碘代氢酸脱碘反应法碘代氢酸脱碘反应法是另一种实验室制备乙烯的方法。
该方法是通过加热Zn-Cu粉末和碘代氢酸的混合物得到的,其中碘代氢酸起到催化作用。
1. 碘代氢酸2. 锌粉3. 铜粉4. 三角瓶5. 钨丝1. 在一个三角瓶中加入碘代氢酸、锌粉和铜粉,混合均匀。
2. 在三角瓶底部放置一个石棉网,并在网上方放置一个小锅,在锅中加入适量的水。
3. 将三角瓶通过橡皮塞固定在小锅中,并将三角瓶的嘴部通过另一个橡皮塞连接到钨丝上。
4. 打开钨丝的电源,加热三角瓶,控制温度在250-270℃之间。
5. 加热后,将三角瓶中产生的气体通过气液分离器或气体瓶收集。
碘代氢酸脱碘反应是通过碘代氢酸的催化作用将乙烷氧化成乙烯的过程。
具体反应式如下:这种方法有其优点,即制备的乙烯非常纯净,但操作稍有复杂,需要控制温度和气体产生速度。

化学乙烯的制备方法有哪些
乙烯的制备方法有以下几种:
1. 石油裂解法:通过加热石油馏分,使其裂解产生乙烯和其他烃类化合物。
2. 乙烯水解法:将乙烷与水加热反应,利用催化剂将乙烷转化为乙烯。
3. 乙醇脱水法:将乙醇加热至高温,去除水分,生成乙烯。
4. 乙烯烷酮法:通过乙烯与酸烷醇的酯类反应,在碱性催化剂存在下,生成相应的烷酮,并通过加热酮类产物解离生成乙烯。
5. 乙烯氯化法:将乙烷与氯气在高温条件下反应,生成1,2-二氯乙烷,再通过碱性催化剂的作用分解生成乙烯。
以上是常用的乙烯制备方法,具体使用哪种方法取决于实际生产需求和技术条件。

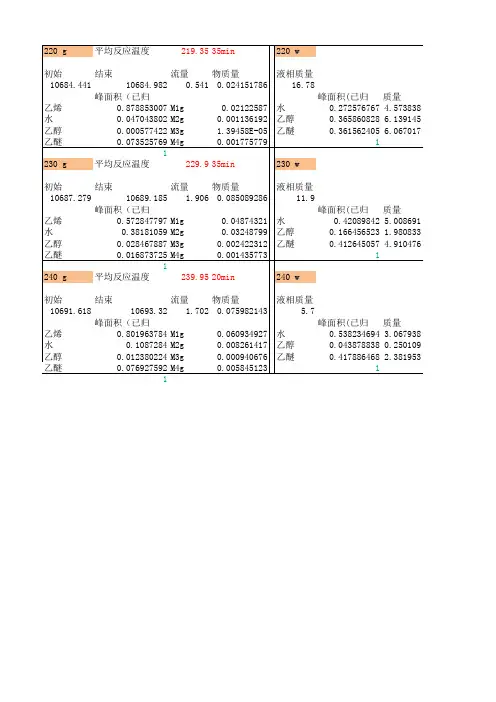

实验室制乙烯的方程式
实验室制乙烯的方程式
乙烯是一种重要的有机化合物,广泛应用于化工、医药、橡胶等领域。
实验室制乙烯的方法有很多种,其中最常用的是通过酸催化剂催化乙
醇脱水反应制得。
实验步骤:
1.将纯乙醇倒入反应瓶中,加入适量的浓硫酸作为催化剂。
2.将反应瓶与冷却器连接,冷却器的另一端连接到水泵,用于抽取反应产生的水蒸气。
3.在反应瓶上方加热器,加热器的另一端连接到冷却水循环器,用于控制反应温度。
4.开启水泵和冷却水循环器,开始加热反应瓶。
5.反应进行时,观察冷却器中的水量,当产生的水蒸气被完全抽出时,停止反应。
6.将反应产物通过冷却器和收集瓶收集。
反应方程式:
C2H5OH → C2H4 + H2O
乙醇经过酸催化剂的作用,发生脱水反应,生成乙烯和水。
实验注意事项:
1.实验过程中应注意安全,避免接触浓硫酸和乙醇等有害物质。
2.反应时应控制反应温度,避免产生过高的温度,导致反应失控。
3.反应产生的水蒸气应及时抽出,以免影响反应的进行。
4.实验结束后,应及时清洗反应瓶和冷却器等设备,避免产生危险。
总结:
实验室制乙烯的方法简单、易操作、成本低廉,适用于小规模制备。
但是,该方法反应产物纯度较低,需要经过后续的分离纯化处理,才能得到高纯度的乙烯。

制备乙烯的工艺流程
《制备乙烯的工艺流程》
乙烯是一种重要的化工原料,广泛应用于塑料、合成橡胶、溶剂等方面。
其制备工艺主要包括石油裂解和乙醇脱水两种方法。
下面将分别介绍这两种制备乙烯的工艺流程。
一、石油裂解法制备乙烯
石油裂解是利用高温和催化剂将原油或重油裂解成低碳烷烃和芳烃的过程。
其中,乙烯是其中的重要产物之一。
其具体工艺流程如下:
1. 原料准备:选用适合的原油或重油作为裂解的原料。
2. 加热裂解:原料经加热后,进入裂解炉,在催化剂的作用下,发生烷烃和芳烃的裂解反应。
3. 分离提取:裂解产物经过冷却后,进行分离提取,将目标产物乙烯进行提取和纯化。
4. 收集储存:最后将提取得到的乙烯进行收集和储存,为后续生产利用做准备。
二、乙醇脱水法制备乙烯
乙醇脱水法是利用醇类化合物在高温下发生脱水反应,制备乙
烯的一种方法。
其工艺流程如下:
1. 乙醇准备:选用高纯度的乙醇作为原料,进行准备和储存。
2. 脱水反应:将乙醇加热至适当温度,通过搅拌或加入催化剂,促使乙醇分子发生脱水反应,生成乙烯。
3. 产品提取:对反应产物进行冷却和提取,将得到的乙烯进行分离和纯化。
4. 收集储存:将提取得到的乙烯进行收集和储存,为后续生产利用做准备。
通过上述两种工艺流程,可以得到高纯度的乙烯原料,为后续的工业生产提供了可靠的原料保障。
随着化工技术的不断发展,乙烯制备工艺也在不断完善和改进,以满足市场对乙烯的需求。

一、实验目的1. 理解乙醇制备乙烯的反应原理和过程。
2. 掌握乙醇制备乙烯的实验操作技能。
3. 学习并验证乙烯的物理和化学性质。
二、实验原理乙醇在浓硫酸的催化作用下,加热至170℃时,会发生消去反应生成乙烯和水。
反应方程式如下:C2H5OH → CH2=CH2↑ + H2O三、实验仪器与药品1. 仪器:蒸馏烧瓶、酒精灯、石棉网、温度计、冷凝管、锥形瓶、洗气瓶、导管、集气瓶、酒精、浓硫酸、氢氧化钠溶液、溴水、酸性高锰酸钾溶液。
2. 药品:乙醇、浓硫酸、氢氧化钠溶液、溴水、酸性高锰酸钾溶液。
四、实验步骤1. 准备工作(1)检查仪器是否完好,确保实验安全。
(2)配制乙醇溶液:将4ml乙醇与12ml浓硫酸混合,边加边摇。
(3)准备洗气瓶:将氢氧化钠溶液加入洗气瓶中。
2. 乙醇制备乙烯(1)在125ml蒸馏烧瓶中加入4ml乙醇,12ml浓硫酸。
(2)放入约1g P2O5及少量碎瓷片。
(3)塞上温度计,连接好装置。
(4)强热反应物,使温度迅速上升至160-170℃,调节火焰,保持此范围温度和乙烯气流均匀产生。
(5)收集乙烯气体:将乙烯气体通过导管导入集气瓶中。
3. 乙烯性质试验(1)与卤素反应a. 将收集到的乙烯气体通入含有0.5ml 1%Br2/CCl4的试管中,观察现象。
b. 观察溴水褪色。
(2)氧化a. 将收集到的乙烯气体通入含有0.5ml 0.1%KmnO4和0.5ml 10%H2SO4的试管中,观察现象。
b. 观察酸性高锰酸钾褪色。
(3)可燃性a. 采用安全点火法,点燃乙烯气体。
b. 观察乙烯燃烧产生黑烟。
4. 实验结束(1)关闭酒精灯,熄灭火焰。
(2)整理实验仪器,回收药品。
五、结果与讨论1. 实验结果(1)乙醇在浓硫酸的催化作用下,加热至170℃时,成功制备了乙烯。
(2)乙烯与卤素反应,溴水褪色;与酸性高锰酸钾反应,褪色。
(3)乙烯具有可燃性,燃烧产生黑烟。
2. 讨论与分析(1)实验过程中,注意控制反应温度在160-170℃范围内,以确保乙烯的生成。

乙烯的合成途径
乙烯的主要合成途径有以下几种:
1. 石油炼制过程中的裂解:在炼油厂中,通过高温下将石油分子裂解成低分子量的化合物,其中包括乙烯。
2. 生物发酵法:通过微生物进行发酵,产生乙烯。
这种方法的成本较高,工业化程度较低,目前仅用于研究用途。
3. 乙烯气相催化合成法:在高温和高压下,通过乙烷和空气在催化剂的作用下进行反应,生成乙烯和水。
这种方法可以得到高纯度的乙烯,但能耗较高。
4. 煤化工法:在煤炭气化的过程中,产生一定量的乙烯。
这种方法在中国较为常见,由于煤炭资源丰富,成本较低。
5. 乙醇脱水法:将乙醇加热至高温,去除其中的水分,生成乙烯。
这种方法成本较低,但需要使用大量的乙醇作为原料。
丙二酸合成丙二酸是一种重要的有机化合物,广泛应用于染料、杀菌剂、食品添加剂等领域。
其化学合成方法较为复杂,需要经过多个步骤才能得到目标产物。
本文将围绕丙二酸化学合成方法进行分步骤阐述。
第一步:乙醇脱水制取乙烯乙烯是合成丙二酸的重要原料之一。
通过乙醇脱水得到高纯度的乙烯是制备丙二酸的必要步骤。
将乙醇在高温下与过量稀硫酸催化剂反应,可以产生乙烯和水。
乙烯被捕集并净化,以去除杂质。
第二步:乙烯氧化制备乙烯酸乙烯酸也是制备丙二酸的重要原料之一。
将分离纯化的乙烯与空气或纯氧混合,在高温和高压下将乙烯氧化,可以得到乙烯酸。
乙烯酸可以通过冷却、结晶、过滤等步骤进行分离和纯化。
第三步:将乙烯酸和乙烯缩合制备丙烯酸将乙烯酸和乙烯混合,经过酸催化、加热反应后,可以缩合得到丙烯酸。
在这个步骤中,丙烯酸是通过两个分子的简单缩合得到,但产生的反应物是混合物,需要经过后续的纯化和分离步骤来得到高纯度的丙烯酸。
第四步:丙烯酸酯化制备丙二酸二甲酯将丙烯酸和甲醇混合,使用硫酸等酸催化剂,在适宜的温度和压力下进行酯化反应,可以得到丙二酸二甲酯。
丙二酸二甲酯是丙二酸的重要前体,在后续的步骤中会得到最终的目标产物。
第五步:水解制备丙二酸将丙二酸二甲酯与水混合,在碱催化下进行水解反应,可以得到目标产物丙二酸。
水解步骤需要注意反应条件,过高或过低的酸碱度或温度都会影响反应效果。
得到的丙二酸可以通过分离、纯化、结晶等步骤得到高纯度的产品。
总结:丙二酸的化学合成方法是通过多个步骤将原材料转化为目标产物的过程,同时需要注意反应条件和步骤操作的细节。
通过合理控制反应条件和原材料质量,可以得到高纯度的丙二酸产物,为相关领域的应用提供重要的化学原料。