一次性使用无菌注射器系列产品相关技术标准清单
- 格式:doc
- 大小:46.50 KB
- 文档页数:2

一次性使用无菌注射器等种医疗器械生产环节
风险清单和检查要点
Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】
食药监械监〔2016〕37号附件
一次性使用无菌注射器等25种医疗器械生产环节风险清单和检查要点
目录
一、一次性使用无菌注射器生产环节风险清单和检查要点
二、一次性使用输液器生产环节风险清单和检查要点
三、一次性使用静脉留置针生产环节风险清单和检查要点
四、一次性使用真空采血系统——采血管生产环节风险清单和检查要点(1)
一次性使用真空采血系统——静脉采血针生产环节风险清单和检查要点(2)
五、骨接合植入物(金属接骨板、金属接骨螺钉)生产环节风险清单和检查要点
六、脊柱内固定金属植入物生产环节风险清单和检查要点
七、人工关节风险清单和检查要点
八、人工晶状体生产环节风险清单和检查要点
九、血管支架生产环节风险清单和检查要点
十、乳房植入体生产环节风险清单和检查要点
十一、医用透明质酸钠凝胶(鸡冠提取法)生产环节风险清单和检查要点。

食药监械监〔2016〕37号附件一次性使用无菌注射器等25种医疗器械生产环节风险清单和检查要点目录一、一次性使用无菌注射器生产环节风险清单和检查要点 (1)二、一次性使用输液器生产环节风险清单和检查要点 (7)三、一次性使用静脉留置针生产环节风险清单和检查要点 (13)四、一次性使用真空采血系统-采血管生产环节风险清单和检查要点(1) (17)一次性使用真空采血系统-静脉采血针生产环节风险清单和检查要点(2) (20)五、骨接合植入物(金属接骨板、金属接骨螺钉)生产环节风险清单和检查要点 (23)六、脊柱内固定金属植入物生产环节风险清单和检查要点 (27)七、人工关节风险清单和检查要点 (31)八、人工晶状体生产环节风险清单和检查要点 (36)九、血管支架生产环节风险清单和检查要点 (38)十、乳房植入体生产环节风险清单和检查要点 (40)十一、医用透明质酸钠凝胶(鸡冠提取法)生产环节风险清单和检查要点 (43)十二、同种异体骨植入物生产环节风险清单和检查要点 (46)十三、天然胶乳橡胶避孕套生产环节风险清单和检查要点 (52)十四、血液净化用设备生产环节风险清单和检查要点 (57)十五、血液净化用器具(接触血液的管路)生产环节风险清单和检查要点 (59)十六、血液净化用器具(过滤/透析/吸附器械)生产环节风险清单和检查要点 (63)十七、透析粉、透析浓缩液生产环节风险清单和检查要点 (66)十八、中心静脉导管生产环节风险清单和检查要点 (69)十九、封堵器系统产品生产环节风险清单和检查要点 (73)二十、角膜接触镜生产环节风险清单和检查要点 (76)二十一、麻醉系统生产环节风险清单和检查要点 (80)二十二、医用防护服生产环节风险清单及检查要点 (83)二十三、医用防护口罩生产环节风险清单及检查要点 (89)二十四、一次性使用非电驱动式输注泵生产环节风险清单和检查要点 (94)二十五、定制式义齿生产环节风险清单和检查要点 (96)一、一次性使用无菌注射器生产环节风险清单和检查要点二、一次性使用输液器生产环节风险清单和检查要点三、一次性使用静脉留置针生产环节风险清单和检查要点四、一次性使用真空采血系统——采血管生产环节风险清单和检查要点(1)一次性使用真空采血系统——静脉采血针生产环节风险清单和检查要点(2)五、骨接合植入物(金属接骨板、金属接骨螺钉)生产环节风险清单和检查要点六、脊柱内固定金属植入物生产环节风险清单和检查要点七、人工关节风险清单和检查要点八、人工晶状体生产环节风险清单和检查要点九、血管支架生产环节风险清单和检查要点十、乳房植入体生产环节风险清单和检查要点十一、医用透明质酸钠凝胶(鸡冠提取法)生产环节风险清单和检查要点十二、同种异体骨植入物生产环节风险清单和检查要点。

无菌医疗器械质量检验相关标准(一)医疗器械生物相容性试验GB/T 16886.3 医疗器械生物学评价第 3部分:遗传毒性、致癌性和生殖毒性试验GB/T 16886.4 医疗器械生物学评价第 4部分:与血液相互作用试验选择GB/T 16886。
5 医疗器械生物学评价第 5部分:体外细胞毒性试验GB/T 16886。
6 医疗器械生物学评价第 6部分:植入后局部反应试验GB/T 16886.7 医疗器械生物学评价第 7部分:环氧乙烷灭菌残留量GB/T 16886.8 医疗器械生物学评价第 8部分:生物学试验参照样品的选择和定性GB/T 16886。
10 医疗器械生物学评价第 10 部分:刺激与致敏试验GB/T 16886.11 医疗器械生物学评价第 11 部分:全身毒性试验GB/T 16886.12 医疗器械生物学评价第 12 部分:样品制备和参照样品GB/T 16886.13 医疗器械生物学评价第 13 部分:聚合物医疗器械降解产物的定性与定量GB/T 16886。
14 医疗器械生物学评价第 14 部分:陶瓷降解产物的定性与定量分析GB/T 16886。
15 医疗器械生物学评价第 15 部分:金属与合金降解产物的定性与定量GB/T 16886。
16 医疗器械生物学评价第 16 部分:降解产物与可溶出物的毒代动力学研究设计)GB/T 16886.17 医疗器械生物学评价第 17 部分:根据健康风险评价确定可溶出物允许极限的方法GB/T 16886.18 医疗器械生物学评价第 18 部分:材料化学定性GB/T 16886.19 医疗器械生物学评价第 19 部分:材料理化、机械和形态定性GB/T 16886.20 医疗器械生物学评价第 20 部分:医疗器械免疫毒理学试验原理和方法GB/T16175 医用有机硅材料生物学评价试验方法GB/T 16886。
9 医疗器械生物学评价第 9部分:潜在降解产物的定性与定量总则YY/T 0473 外科植入物聚交酯共聚物和共混物体外降解试验YY/T 0474 外科植入物用聚L-丙交酯树脂及制品体外降解试验YY/T 0567。

SMIC/检测(班)医疗器械注册产品标准SMIC/检测(班)00000-2010一次性使用输液器重力输液式Infusion sets for single use, gravity fee2010-12-10发布2010-12-13实施上海医疗器械高等专科学校发布SMIC/检测(班)00000-2010前言本标准是SMIC/检测(班) 00000-2010的初定版。
本标准中华人民共和国国家标准GB 8368-2005(一次性使用输液器重力输液式)。
本标准的附录A,附录B和附录C是规范性附录,附录NA和附录NB是资料性附录。
本标准由上海医疗器械高等专科学校归口。
本标准由检测技术及应用肖婷组起草。
本标准主要起草人:肖婷、徐一君、吴维纶。
本标准主要资料检索人:吴维纶、薛国瑞。
本标准主要实验规划人:薛圣、薛子鸣、温景麟。
本标准首席发布于2010年。
SMIC/检测(班)00000-2010一次性使用输液器1 范围本标准规定了一次性使用医用输液器的要求,以保证与输液容器和静脉器具相适应。
本标准的第二个目的是为输液器所用材料的性能及质量规范提供指南,并给出了输液器组件的标记。
2 规范性引用文件下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T8368-2005一次性使用输液器重力输液式(GB/T8368-2005,idt ISO 8536-4:2004((医用输液器具—第4部分:一次性使用输液器,重力输液式)。
GB/T1962.1-2001注射器、注射针及其他医疗器械6%锥度(鲁尔)圆锥接头第1部分:通用要求(GB/T1962.1-2001,idtISO594-1:1986)GB/T1962.2-2001注射器、注射针及其他医疗器械6%锥度(鲁尔)圆锥接头第2部分:锁定锥头(GB/T1962.2-2001,idtISO594-2:1998)GB/T6682-1992 分析实验室用水规范和试验方法(neqISO3696:1987)GB/T14233.1医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T14233.2医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB15811-2001一次性使用无菌注射针(eqvISO7864:1993)YY0466 医疗器械用于医疗器械标签、标记和提供信息的符号(YY0466-2003,ISO15223: 2000,IDT)ISO14644-1:1999 洁净室和相关控制环境—第1部分:空气洁净度分级3 通用要求3.1 输液器组件的命名输液器组件的名称如图1所示,输液器进气器件如图2所示。
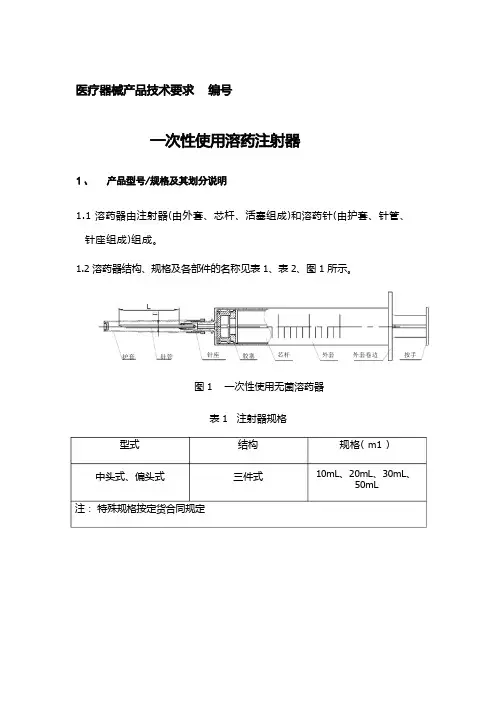
1.1 溶药器由注射器(由外套、芯杆、活塞组成)和溶药针(由护套、针管、 针座组成)组成。
1.2 溶药器结构、规格及各部件的名称见表 1、表 2、图 1 所示。
图 1 一次性使用无菌溶药器表 1 注射器规格型式中头式、偏头式注: 特殊规格按定货合同规定规格( m1 )10mL 、20mL 、30mL 、50mL结构三件式外套卷边 护套胶塞针管外套 针座按手芯杆表 2 溶药针基本尺寸及极限偏差 单位: mm2.1.1 注射器外观要求应符合 GB 15810-2001 中 5.1 条规定。
2.1.2 注射器标尺要求应符合 GB 15810-2001 中 5.2.1 条规定。
2.1.3 注射器附加标尺要求应符合 GB 15810-2001 中 5.2.2 条规定。
2.1.4 注射器标尺的刻度容量线应符合 GB 15810-2001 中 5.3 条规定。
2.1.5 注射器标尺上的计量数字应符合 GB 15810-2001 中 5.4 条规定。
2.1.6 注射器标尺的印刷应符合 GB 15810-2001 中 5.5 条规定。
2.1.7 注射器外套应符合 GB 15810-2001 中 5.6 条规定。
2.1.8 注射器按手间距应符合 GB 15810-2001 中 5.7 条规定。
2.1.9 注射器活塞应符合 GB 15810-2001 中 5.8 条规定。
2.1.10 注射器锥头要求D极限偏 差 ±0.03直孔针、侧孔针—-2.5注: 特殊规格按定货合同规定。
极限偏 差±0.03尺寸 尺寸规格 型式+1.51.201.603032351612 L2.1.10.1 锥头直径应符合GB 15810-2001 中5.9.1 条规定。
2.1.10.2 锥头外圆锥接头应符合GB 15810-2001 中5.9.2 条规定。
2.1.10.3 中头式注射器,锥头应符合GB 15810-2001 中5.9.3 条规定。

食药监械监〔2016〕37号附件一次性使用无菌注射器等25种医疗器械生产环节风险清单和检查要点目录一、一次性使用无菌注射器生产环节风险清单和检查要点...................................二、一次性使用输液器生产环节风险清单和检查要点 ....................三、一次性使用静脉留置针生产环节风险清单和检查要点 ................四、一次性使用真空采血系统-采血管生产环节风险清单和检查要点(1)..............................................................一次性使用真空采血系统-静脉采血针生产环节风险清单和检查要点(2).......................................................五、骨接合植入物(金属接骨板、金属接骨螺钉)生产环节风险清单和检查要点......................................................六、脊柱内固定金属植入物生产环节风险清单和检查要点 ................七、人工关节风险清单和检查要点....................................八、人工晶状体生产环节风险清单和检查要点 ..........................九、血管支架生产环节风险清单和检查要点 ............................十、乳房植入体生产环节风险清单和检查要点 .......................... 十一、医用透明质酸钠凝胶(鸡冠提取法)生产环节风险清单和检查要点............................................................ 十二、同种异体骨植入物生产环节风险清单和检查要点 .................. 十三、天然胶乳橡胶避孕套生产环节风险清单和检查要点 ................ 十四、血液净化用设备生产环节风险清单和检查要点 .................... 十五、血液净化用器具(接触血液的管路)生产环节风险清单和检查要点............................................................ 十六、血液净化用器具(过滤/透析/吸附器械)生产环节风险清单和检查要点........................................................ 十七、透析粉、透析浓缩液生产环节风险清单和检查要点 ................十八、中心静脉导管生产环节风险清单和检查要点 ...................... 十九、封堵器系统产品生产环节风险清单和检查要点 .................... 二十、角膜接触镜生产环节风险清单和检查要点 ........................ 二十一、麻醉系统生产环节风险清单和检查要点 ........................ 二十二、医用防护服生产环节风险清单及检查要点 ...................... 二十三、医用防护口罩生产环节风险清单及检查要点 .................... 二十四、一次性使用非电驱动式输注泵生产环节风险清单和检查要点....... 二十五、定制式义齿生产环节风险清单和检查要点 ......................一、一次性使用无菌注射器生产环节风险清单和检查要点二、一次性使用输液器生产环节风险清单和检查要点三、一次性使用静脉留置针生产环节风险清单和检查要点四、一次性使用真空采血系统——采血管生产环节风险清单和检查要点(1)一次性使用真空采血系统——静脉采血针生产环节风险清单和检查要点(2)五、骨接合植入物(金属接骨板、金属接骨螺钉)生产环节风险清单和检查要点六、脊柱内固定金属植入物生产环节风险清单和检查要点七、人工关节风险清单和检查要点八、人工晶状体生产环节风险清单和检查要点九、血管支架生产环节风险清单和检查要点十、乳房植入体生产环节风险清单和检查要点十一、医用透明质酸钠凝胶(鸡冠提取法)生产环节风险清单和检查要点十二、同种异体骨植入物生产环节风险清单和检查要点。


《一次性使用无菌注射器》国家标准编制说明一、任务来源本标准是根据国家标准化管理委员会下达的2006年第一批制修订国家标准项目计划通知(国标委计划[2006]48号)而修订的。
计划项目编号是20065424-Q-464。
本标准由全国医用注射器(针)标准化技术委员会归口管理,由上海康德莱企业发展集团股份有限公司、成都市新津事丰医疗器械有限公司、山东威高集团医用高分子制品股份有限公司、江西洪达医疗器械集团有限公司、上海市医疗器械检测所负责起草。
二、修定标准的目的及意义一次性使用无菌注射器是目前应用最广泛的无菌医疗器械之一。
其产品标准在国内应用已近三十年,最近一版距今已有十六年。
随着科学技术的发展和对临床安全不断提高,原国家标准已经不适应这种需求。
ISO国际标准化组织已于2017年修订了ISO 7886-1:2017《一次性使用无菌皮下注射器第1部分:手动注射器》的发行稿。
该标准对原ISO标准进行了较大修订。
它更多考虑的是在设计上充分保证产品的安全性要求。
为适应这种变化,相对应的国家标准有必要进行修订。
三、产品适用范围本标准规定了一次性使用无菌注射器(以下简称注射器)的分类与命名、要求、试验方法、包装、标识等。
本标准适用于供抽吸液体或抽吸液体后立即注射用的手动注射器。
本标准不适用于胰岛素注射器、玻璃注射器、永久带针注射器、带有动力驱动注射泵的注射器、自毁型固定剂量疫苗注射器、带防止再次使用特性的注射器、由制造厂预装药液的注射器以及与药液配套的注射器等。
本标准规定的不带针注射器应与符合GB 15811要求的一次性使用无菌注射针配套使用。
四、关于技术指标的说明本标准修改采用ISO 7886-1:2017《一次性使用无菌皮下注射器第1部分:手动注射器》本标准与GB15810-2001相比主要技术差异如下:1.修改了适用范围。
修定原因:与ISO 7886-1:2017标准保持一致。
一次性使用无菌注射器作为一个单器械,必须联合一次性使用无菌注射针组成组合器械应用于临床。

一次性使用无菌末梢采血针组成:与采血笔配套使用的采血针由不锈钢针、塑柄和保护帽三部分组成。
独立使用的采血针主体结构由针体、弹射部件和外壳三部分组成。
适用范围:一次性使用无菌末梢采血针无治疗或诊断作用,供人体指尖、耳垂等循环末梢点刺取血样化验用1.1 产品型号1.1.1与采血笔配套使用的采血针由不锈钢针、塑柄和保护帽三部分组成,共分为两个型号Ⅰ型和Ⅱ型。
1.1.2独立使用的采血针主体结构由针体、弹射部件和外壳三部分组成,共分为一个型号Ⅳ型1.2 产品规格1.2.1与采血笔配套使用的采血针Ⅰ型分为21G、23G、25G、26G、27G、28G、30G 共7个规格1.2.2与采血笔配套使用的采血针Ⅱ型分为21G、23G、25G、26G、27G、28G、30G 共7个规格1.2.3 独立使用的采血针Ⅳ型分为21G、23G、25G、26G、27G、28G、30G共7个规格1.3 型号划分说明根据其外形可分为以下型号:Ⅰ、Ⅱ为与采血笔配套使用的采血针,Ⅳ为独立使用的采血针。
各型号分为7个规格,针线直径代表其规格。
1.4采血针组成材质Ⅰ、Ⅱ型不锈钢针采用GB/T4240-2009规定的06Cr19Ni10不锈钢丝制成,塑柄和保护帽采用符合YY/T0114-2008的聚乙烯料制成。
Ⅳ型采血针主体结构由针体、弹射部件和外壳三部分组成,其中针体的不锈钢针采用GB/T4240-2009规定的06Cr19Ni10不锈钢丝制成,针体的塑柄和保护帽采用符合GB/T 12672-2009 丙烯腈-丁二烯-苯乙烯(ABS)树脂制作,弹射部件采用符合GB/T 22271.1-2008 塑料聚甲醛(POM)制作,外壳采用符合GB/T 2546.1-2006 塑料聚丙烯(PP)制作。
2.1采血针的基本尺寸应符合1.2中表1采血针基本尺寸的要求。
2.2采血针不锈钢针尖不得有毛刺、弯钩和白点等缺陷。
2.3采血针的塑柄不应有明显的毛边、污渍及缺肉等缺陷。

食药监械监〔2016〕37号附件一次性使用无菌注射器等25种医疗器械生产环节风险清单和检查要点目录一、一次性使用无菌注射器生产环节风险清单和检查要点 (1)二、一次性使用输液器生产环节风险清单和检查要点 (7)三、一次性使用静脉留置针生产环节风险清单和检查要点 (13)四、一次性使用真空采血系统-采血管生产环节风险清单和检查要点(1)1ﻩ7一次性使用真空采血系统-静脉采血针生产环节风险清单和检查要点(2)ﻩ20五、骨接合植入物(金属接骨板、金属接骨螺钉)生产环节风险清单和检查要点23ﻩ六、脊柱内固定金属植入物生产环节风险清单和检查要点 (27)七、人工关节风险清单和检查要点 (31)八、人工晶状体生产环节风险清单和检查要点............................................................................................. 36九、血管支架生产环节风险清单和检查要点38ﻩ十、乳房植入体生产环节风险清单和检查要点ﻩ40十一、医用透明质酸钠凝胶(鸡冠提取法)生产环节风险清单和检查要点............................................... 43十二、同种异体骨植入物生产环节风险清单和检查要点4ﻩ6十三、天然胶乳橡胶避孕套生产环节风险清单和检查要点 (52)十四、血液净化用设备生产环节风险清单和检查要点 ................................................................................ 57十五、血液净化用器具(接触血液的管路)生产环节风险清单和检查要点 (59)十六、血液净化用器具(过滤/透析/吸附器械)生产环节风险清单和检查要点63ﻩ十七、透析粉、透析浓缩液生产环节风险清单和检查要点66ﻩ十八、中心静脉导管生产环节风险清单和检查要点ﻩ69十九、封堵器系统产品生产环节风险清单和检查要点73ﻩ二十、角膜接触镜生产环节风险清单和检查要点76ﻩ二十一、麻醉系统生产环节风险清单和检查要点......................................................................................... 80二十二、医用防护服生产环节风险清单及检查要点83ﻩ二十三、医用防护口罩生产环节风险清单及检查要点 (89)二十四、一次性使用非电驱动式输注泵生产环节风险清单和检查要点ﻩ94。

无菌注射器生产标准
1.材料选择:
2.注射器尺寸:
根据不同的使用需求,无菌注射器有不同的尺寸和容量可供选择,如1ml、2ml、5ml等。
生产商应确保注射器的准确度和一致性,使得用户能够方便地使用。
3.注射器结构:
注射器一般由注射器筒、活塞、帽子、切割口等组成。
生产商应确保注射器的结构合理,紧密结合,不易漏药液或者污染。
4.注射器的外观:
注射器的外观应无明显缺陷,如气泡、异物等。
外观的美观和整洁对于提高产品质量也很重要。
5.注射器的无菌性:
6.注射器的包装:
7.注射器的质量控制:
生产商应建立全面的质量管理体系,包括原材料的采购、生产过程的控制、成品的检测等,确保注射器的质量符合相关标准和要求。
8.注射器的生产环境:
综上所述,无菌注射器的生产标准十分重要,直接关系到医疗器械的安全和有效性。
生产商应遵守相关的标准,确保材料的安全性、注射器的
无菌性和质量的稳定性,以提供高质量的无菌注射器产品。
此外,生产商还应加强质量管理,建立全面的质量控制体系,确保产品的质量符合标准和要求。
矿产资源开发利用方案编写内容要求及审查大纲
矿产资源开发利用方案编写内容要求及《矿产资源开发利用方案》审查大纲一、概述
㈠矿区位置、隶属关系和企业性质。
如为改扩建矿山, 应说明矿山现状、
特点及存在的主要问题。
㈡编制依据
(1简述项目前期工作进展情况及与有关方面对项目的意向性协议情况。
(2 列出开发利用方案编制所依据的主要基础性资料的名称。
如经储量管理部门认定的矿区地质勘探报告、选矿试验报告、加工利用试验报告、工程地质初评资料、矿区水文资料和供水资料等。
对改、扩建矿山应有生产实际资料, 如矿山总平面现状图、矿床开拓系统图、采场现状图和主要采选设备清单等。
二、矿产品需求现状和预测
㈠该矿产在国内需求情况和市场供应情况
1、矿产品现状及加工利用趋向。
2、国内近、远期的需求量及主要销向预测。
㈡产品价格分析
1、国内矿产品价格现状。
2、矿产品价格稳定性及变化趋势。
三、矿产资源概况
㈠矿区总体概况
1、矿区总体规划情况。
2、矿区矿产资源概况。
3、该设计与矿区总体开发的关系。
㈡该设计项目的资源概况
1、矿床地质及构造特征。
2、矿床开采技术条件及水文地质条件。
一次性使用无菌手术包适用范围:用于临床外科手术使用。
1.1 型号一次性使用无菌手术包部件包括手术巾、医用粘膜、海绵条、集液袋、鼻撑架、圆帽(患者使用)。
其中手术巾、医用粘膜、集液袋、鼻撑架、圆帽(患者使用)为外购。
产品型号的表示方法如下:SS- □□□□型空白或英文字母,英文字母表示由未带字母型号发展而来。
三位为阿拉伯数字,代表产品序列号SS是英文Surgical Serial 两词第一个字母的组合1.2 型号的划分各型号产品的部件构成见表1.表1 SS系列一次性使用无菌手术包部件构成2.1 尺寸不同型号产品的部件尺寸见表1, 鼻撑架宽度误差0.1厘米。
其余部件尺寸的相对误差为标注尺寸的10%,四舍五入至0.1厘米。
2.2 部件材质2.2.1 手术巾材质为非织造布,也称无纺布。
2.2.2 医用粘膜材质为聚氨酯或聚乙烯膜,也称外科手术膜,为具有医疗器械注册证产品。
2.2.3 海绵条材质为医用海绵,为具有医疗器械注册证产品。
2.2.4 集液袋材质为塑料袋。
2.2.5 圆帽为非织造布(无纺布)制品。
2.2.6 鼻撑架为长条形金属制品或塑料制品。
2.3性能要求2.3.1 手术巾性能指标应满足表2要求。
表2 手术巾性能指标要求2.3.2 医用粘膜应满足如下要求:a)持粘性:在烘箱内试验期间,贴于不锈钢板上粘膜顶端下滑应不超过5mm;b)剥离强度:每1厘米宽度所需平均力应不小于0.5N。
2.3.3 海绵条吸液速度小于10s/cm。
2.3.4 集液袋在容纳其容量要求的水时应无泄漏。
2.3.5 圆帽展开直径52厘米,每平米重量大于25g。
2.3.6 鼻撑架端部不外露,可被弯曲并保持。
2.4 外观要求部件组成符合产品型号要求,手术巾无破损,各部件无异物残留。
2.5 无菌要求灭菌方法为Co60辐射灭菌,应无菌。
2.6 包装要求产品应以密闭包装形式交付,产品包装完好,无破损污染。