硫酸亚铁溶液的配制
- 格式:docx
- 大小:94.02 KB
- 文档页数:6

硫酸亚铁生成氧化铁硫酸亚铁生成氧化铁是一种重要的化学反应,其在实际应用中有着广泛的应用,例如防锈、催化剂等。
本文将分步骤阐述硫酸亚铁生成氧化铁的过程。
第一步:准备实验原料在进行硫酸亚铁生成氧化铁的实验中,我们需要准备一定量的硫酸亚铁、氢氧化钠、氢氧化铁等实验原料。
其中,硫酸亚铁是反应的主要原料,其重要作用在于提供亚铁离子来参与反应。
第二步:制备硫酸亚铁溶液在本实验中,我们需要先制备一定质量浓度的硫酸亚铁溶液。
具体实验方法是将适量的硫酸亚铁粉末加入一定量的蒸馏水中,并用磁力搅拌器将其彻底混合,直到硫酸亚铁完全溶解。
第三步:制备氨水为了保证反应的顺利进行,我们还需要准备一定质量浓度的氨水。
具体实验方法是将一定量的氨气通过蒸馏水中,并进行恰当的调节,直到氨水的浓度符合实验要求。
第四步:制备氢氧化铁溶液接下来,我们需要制备一定质量浓度的氢氧化铁溶液,其具体实验方法与制备硫酸亚铁溶液类似,为将适量的氢氧化铁加入蒸馏水中,并用磁力搅拌器将其混合均匀。
第五步:反应过程在准备好上述实验原料后,我们就可以开始进行硫酸亚铁生成氧化铁的反应过程。
具体实验操作是,将制备好的氢氧化铁溶液缓缓滴入已经调节好的硫酸亚铁溶液中,同时不断搅拌。
在反应过程中,加入氨水调节反应系统的酸碱度,以保证反应的顺利进行。
这时可以观察到反应液逐渐变成咖啡色,并沉淀出氧化铁。
当反应结束后,用滤纸和水洗净沉淀物,并将其放至烘箱中干燥,得到氧化铁的产物。
总结:通过上述实验过程,我们可以得到硫酸亚铁生成氧化铁的产物。
在实际应用中,氧化铁不仅可以用作防锈剂,而且还是一种重要的催化剂,在有机合成中具有广泛的应用。

硫酸亚铁铵标准溶液硫酸亚铁铵标准溶液是化学实验室常用的一种溶液,通常用于分析化学中的定量分析和质量分析。
它的制备方法简单,但需要严格按照标准操作程序进行,以确保制得的溶液浓度准确,稳定性好。
本文将介绍硫酸亚铁铵标准溶液的制备方法和注意事项。
首先,制备硫酸亚铁铵标准溶液需要准备好一定质量分数的硫酸亚铁铵固体和一定体积分数的硫酸。
在实验室中,通常会使用已知浓度的硫酸亚铁铵固体和硫酸来制备标准溶液。
在制备过程中,需要严格控制固体和溶液的质量和体积,以确保制得的标准溶液浓度准确。
其次,制备硫酸亚铁铵标准溶液的步骤如下:1. 称取一定质量分数的硫酸亚铁铵固体,加入适量去离子水中,充分溶解,得到一定体积分数的硫酸亚铁铵溶液。
2. 称取一定体积分数的硫酸,加入适量去离子水中,充分稀释,得到一定体积分数的硫酸溶液。
3. 将硫酸亚铁铵溶液和硫酸溶液按照一定比例混合,充分搅拌均匀,得到硫酸亚铁铵标准溶液。
在制备过程中,需要注意以下几点:1. 质量分数的硫酸亚铁铵固体和体积分数的硫酸的测量和称取要准确,以确保制得的标准溶液浓度准确。
2. 溶解硫酸亚铁铵固体时,需要充分搅拌并加热,直至完全溶解。
3. 混合硫酸亚铁铵溶液和硫酸溶液时,需要充分搅拌均匀,以确保溶液浓度均匀稳定。
4. 制备好的硫酸亚铁铵标准溶液需要存放在干燥、阴凉、避光的环境中,避免溶液浓度发生变化。
最后,制备好的硫酸亚铁铵标准溶液可以用于化学实验中的定量分析和质量分析。
在使用过程中,需要注意标准溶液的保存和使用方法,以确保实验结果的准确性和可靠性。
总之,硫酸亚铁铵标准溶液是化学实验室中常用的一种溶液,制备方法简单,但需要严格按照标准操作程序进行。
制备好的标准溶液可以用于化学实验中的定量分析和质量分析,为实验结果的准确性和可靠性提供保障。
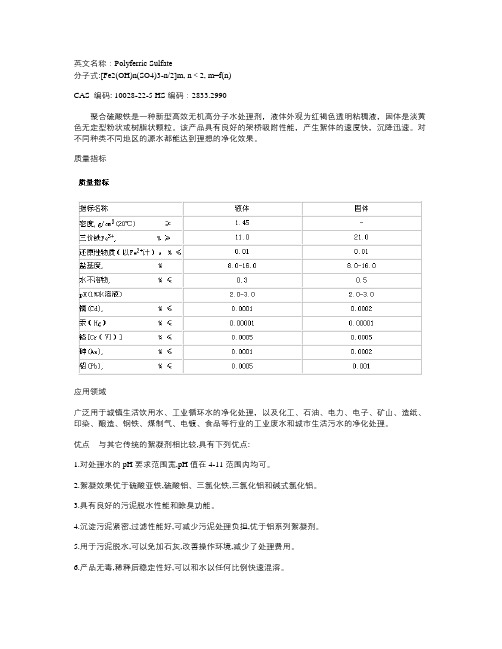
英文名称:Polyferric Sulfate分子式:[Fe2(OH)n(SO4)3-n/2]m, n<2, m=f(n)CAS 编码: 10028-22-5 HS编码:2833.2990聚合硫酸铁是一种新型高效无机高分子水处理剂,液体外观为红褐色透明粘稠液,固体是淡黄色无定型粉状或树脂状颗粒。
该产品具有良好的架桥吸附性能,产生絮体的速度快,沉降迅速。
对不同种类不同地区的源水都能达到理想的净化效果。
质量指标应用领域广泛用于城镇生活饮用水、工业循环水的净化处理,以及化工、石油、电力、电子、矿山、造纸、印染、酿造、钢铁、煤制气、电镀、食品等行业的工业废水和城市生活污水的净化处理。
优点与其它传统的絮凝剂相比较,具有下列优点:1.对处理水的pH要求范围宽,pH值在4-11范围内均可。
2.絮凝效果优于硫酸亚铁,硫酸铝、三氯化铁,三氯化铝和碱式氯化铝。
3.具有良好的污泥脱水性能和除臭功能。
4.沉淀污泥紧密,过滤性能好,可减少污泥处理负担,优于铝系列絮凝剂。
5.用于污泥脱水,可以免加石灰,改善操作环境,减少了处理费用。
6.产品无毒,稀释后稳定性好,可以和水以任何比例快速混溶。
7.可在多种水处理设施上使用,絮凝体形成迅速,若与有机高分子絮凝剂复合协同作用,则能取得更加理想的效果。
8.对废水中的硫化物和金属离子除去率远远优于铝系列絮凝剂。
对于悬浮物、COD、BOD的去除率也高于传统絮凝剂。
通常硫化物的去除率为80-95%,COD去除率为60-95%,BOD去除率大于60%,悬浮物去除率为70-99.7%,重金属去除率70-90%。
9.不含氯离子,它不像碱、三氯化铝和三氯化铁那样对水处理设施产生严重腐蚀。
使用方法1.液体可直接投加,也可配制成10%-30%的水溶液;固体配制成5%-20%的水溶液。
使用时,应先根据处理水量,源水性质、浊度和加药方式及工艺等配制相应浓度水溶液。
配制浓度不应低于5%,并且不宜贮存时间过长,最好在24小时内用完。

常用试剂的配制一、标准溶液的配制1、硫酸H2SO4溶液的配制:1000mL浓度c1/2H2SO4=L,即cH2SO4=L的硫酸溶液的配制:取3mL左右的浓硫酸缓缓注入1000mL水中,冷却,摇匀;新配制的硫酸需要标定,其标定方法如下:称取于270-300 ℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,溶于50mL水中,加10滴溴甲酚绿-甲基红指示液,用配制好的硫酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色;同时做空白试验取50mL水,加10滴溴甲酚绿-甲基红指示液,同样用硫酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色;计算公式为:式中:m:无水碳酸钠的质量,g;V1:滴定时所用的硫酸的体积,mL;V2:空白滴定时所用的硫酸的体积,mL;M:无水硫酸钠的相对分子质量,g/mol,M1/2Na2CO3=;测定氨氮时,氨氮含量的计算:氨氮:氨氮含量,mg/L;V1:滴定水样时所用的硫酸的体积,mL;V2:空白滴定时所用的硫酸的体积,mL;M:硫酸溶液的浓度,mol/L;V:水样的体积, mL;2、重铬酸钾K2Cr2O7溶液的配制1000mL浓度c1/6K2Cr2O7=L,即cK2Cr2O7= mol/L的重铬酸钾溶液的配制:称取于120 ℃下干燥2h的重铬酸钾溶于水中,并移入容量瓶中,定容至1000mL,摇匀,备用;3、硫酸亚铁铵标准溶液的配制:1000mL mol/L硫酸亚铁铵标准溶液的配制:称取39.5g硫酸亚铁铵溶于水中,边搅拌边缓慢加入20mL浓硫酸,冷却后移入1000 mL容量瓶中,加水稀释至刻度线,摇匀;临用前,需用重铬酸钾标准溶液进行标定;标定方法如下:准确吸取 mL重铬酸钾标准溶液于锥形瓶中,加入100 mL水,缓慢加入30 mL浓硫酸,混匀;冷却后,加入3滴试亚铁灵指示剂,用硫酸亚铁铵溶液进行滴定,溶液的颜色由黄色经蓝绿色编为红褐色即为终点;硫酸亚铁铵浓度的计算公式如下:c:硫酸亚铁铵的浓度,mol/L;V:硫酸亚铁铵滴定时用的量,mL;在测定COD时,COD的计算公式为:式中:COD:COD的含量,mg/L;c:硫酸亚铁铵的浓度,mol/L;V:滴定空白时硫酸亚铁铵标准溶液的用量,mL;:滴定水样时硫酸亚铁铵标准溶液的用量,mL;V1V:水样的体积, mL;二、指示剂的配制1、试亚铁灵指示剂称取邻菲罗啉,硫酸亚铁溶于水中,热水浴中加热使之溶解,稀释至100mL,保存于棕色试剂瓶中;2、甲基红-亚甲基蓝混合指示剂称取0.1g亚甲基蓝,溶于95%乙醇,用95%乙醇稀释至100mL;然后称取0.1g甲基红,溶于95%乙醇,用95%乙醇稀释至100mL;分别取50mL亚甲基蓝和100mL甲基红溶液混匀即可;3、溴甲酚绿-甲基红指示剂称取0.1g溴甲酚绿,溶于95%乙醇,用95%乙醇稀释至100mL;称取0.2g甲基红,溶于95%乙醇,用95%乙醇稀释至100mL;分别取30mL溴甲酚绿,10mL甲基红溶液,混匀即可;。

一、实验目的1. 掌握硫酸亚铁的制备方法。
2. 熟悉实验基本操作,如称量、溶解、过滤、蒸发等。
3. 掌握实验条件的控制方法,如温度、时间等。
4. 分析实验结果,了解硫酸亚铁的制备过程及影响因素。
二、实验原理硫酸亚铁是一种重要的无机化合物,广泛应用于医药、化工、食品等行业。
实验原理如下:铁屑与稀硫酸反应生成硫酸亚铁和氢气:Fe + H2SO4 → FeSO4 + H2↑将反应后的溶液过滤,除去不溶物,得到硫酸亚铁溶液。
然后通过蒸发浓缩、冷却结晶,得到硫酸亚铁晶体。
三、实验材料与仪器1. 实验材料:铁屑、稀硫酸、蒸馏水、玻璃棒、烧杯、漏斗、滤纸、蒸发皿、酒精灯、温度计、电子天平。
2. 仪器:铁架台、铁圈、石棉网。
四、实验步骤1. 称取3.5g铁屑,放入100mL烧杯中。
2. 量取20mL 3M稀硫酸溶液,加入烧杯中。
3. 将烧杯放置在铁架台上,用玻璃棒搅拌溶液,观察反应现象。
4. 将烧杯放在石棉网上,用酒精灯加热溶液,保持温度在60℃左右。
5. 反应30分钟后,停止加热,待溶液冷却至室温。
6. 将溶液过滤,收集滤液。
7. 将滤液转移至蒸发皿中,用酒精灯加热蒸发,直至溶液表面出现晶膜。
8. 停止加热,待晶体完全析出后,用滤纸吸干水分。
9. 称量晶体质量,计算产率。
五、实验结果与分析1. 实验结果根据实验数据,得到以下结果:实验组晶体质量/g 产率/%1 2.5 71.42 2.6 74.33 2.7 76.82. 结果分析(1)温度对实验的影响:随着温度的升高,硫酸亚铁的产率逐渐增加。
在60℃时,产率最高,说明在该温度下,反应进行得较为充分。
(2)反应时间对实验的影响:随着反应时间的延长,硫酸亚铁的产率逐渐增加。
在30分钟时,产率最高,说明在该时间范围内,反应已经基本完成。
(3)铁屑质量对实验的影响:实验结果表明,随着铁屑质量的增加,硫酸亚铁的产率也随之增加。
但增加幅度逐渐减小,说明在一定范围内,铁屑质量对产率的影响较大。

硫酸亚铁标定方法全文共四篇示例,供读者参考第一篇示例:硫酸亚铁是一种重要的化学试剂,广泛应用于环境监测、药物制备、电子工业等领域。
硫酸亚铁的浓度标定是化学分析中常见的一项工作,确保实验结果的准确性和可靠性。
本文将详细介绍硫酸亚铁标定的方法和步骤,希望对读者有所帮助。
一、硫酸亚铁标定方法硫酸亚铁的标定可采用氧化还原滴定法或复合指示剂法,其中氧化还原滴定法是最常用的一种方法。
硫酸亚铁与某种氧化剂(如高锰酸钾)在酸性条件下发生氧化还原反应,通过加入一种指示剂(如甲基橙)来观察反应终点,从而确定硫酸亚铁的浓度。
1.准备硫酸亚铁溶液和氧化剂溶液,分别称取一定体积的硫酸亚铁和氧化剂,将其分别稀释至一定浓度。
2.取一定体积的硫酸亚铁溶液倒入烧杯中,加入适量的酸性溶液(如盐酸)来维持酸性条件。
3.加入适量的指示剂(如甲基橙),开始滴定。
4.逐滴加入氧化剂溶液,观察颜色变化。
当溶液由无色变为浅粉红色(或其他颜色),即为反应终点。
5.记录氧化剂的体积V1,计算出硫酸亚铁的浓度。
1.实验室操作要注意安全,避免硫酸亚铁和氧化剂溶液的飞溅和接触皮肤。
2.滴定过程中要缓慢滴加氧化剂,以免超过终点造成误差。
3.选择合适的指示剂,确保能够清晰地观察到颜色变化。
4.滴定前后要注意清洗玻璃仪器,避免混杂。
5.反复测定,取平均值,提高测定结果的准确性。
硫酸亚铁标定是一项重要的实验操作,需要仔细、细致地操作。
只有通过正确的方法和步骤,才能得到准确可靠的浓度结果,为化学分析提供可靠的数据支持。
希望读者能够通过本文对硫酸亚铁标定方法有一个更深入的了解。
第二篇示例:硫酸亚铁标定是一种常用的化学分析方法,用于测定样品中含量未知的物质的浓度。
硫酸亚铁标定方法在化学实验中应用广泛,常用于测定氧化还原反应中产生的氧化物质的浓度。
下面将详细介绍硫酸亚铁标定方法的原理、步骤和注意事项。
一、硫酸亚铁标定方法的原理:硫酸亚铁标定方法是基于氧化还原反应原理的一种分析方法。
硫酸亚铁的正确使用阅读:3940 次[字体:大中小] 施用硫酸亚铁(一)硫酸亚铁,又称黑矾,应密封保管,谨防受潮,若受潮,就会渐渐氧化而成为不易被植物吸收的三价铁,其有效性就会大大下降。
(二)应现施现配,常见有些花友为图省劲,往往一次制造很多矾水液以供长时间屡次施用,这是很不科学的。
由于黑矾长时间在水中会渐渐氧化成不易被吸收的三价铁。
(三)施用量不宜过大,次数不宜过勤。
据多年的经历,盆土掺加硫酸亚铁以每盆5克至7克为宜,灌溉或喷施以0.2%至0.5%为宜。
若用量过大,追施次数过勤,会引起植株中毒,使根变灰黑而腐朽,一起还因它的拮抗效果而影响其他营养元素的吸收。
(四)应选用适合的水制造,硫酸亚铁在石灰质碱性水中很简单成为三价铁的氧化物沉积,成为难以被植物运用的状况。
最佳选用雨、雪水或凉开水。
若是万不得已运用碱性水制造,应在每10升水中加进1克至2克磷酸二氢钾,使其成为微酸性的“改进水”。
在碱性水中加3%的食醋,也有较好的效果。
(五)在碱性土中掺施硫酸亚铁,应用时需施入适当钾肥(但不宜施草木灰),由于钾元素有利于铁在植物体内移动,能进步硫酸亚铁的有效性。
(六)水培花木施用硫酸亚铁液应避免日晒。
阳光照耀含铁的营养液,会使铁在溶液中沉积,下降其有效性。
故宜用黑布(或黑纸)遮住容器或搬入室内避光处。
(七)硫酸亚铁同腐熟的有机肥液混合施用效果非常好,因有机质分化产品,对铁有络合效果,能进步铁的溶解度。
(八)不宜一起施入氨态氮肥以及同铁有拮抗效果的元素,氨态氮(如硫酸铵、碳酸氨、磷酸铵和尿素等)在水土中能使有机质与铁络合物受到破坏,并把二价铁氧化成不易被吸收的三价铁。
钙、镁、锰、铜等元素对铁有拮抗效果,能下降铁的有效性,故应严厉约束这些元素的用量,在施用硫酸亚铁时最佳不一起施用含这些元素的肥料。
硫酸亚铁是调理酸碱度的,不是肥料,所以,那些以为“宁稀勿浓”的说法是不对的。
还有一个常见的过错即是依照阐明的用量。
由于每盆土的酸碱度不一样,每莳花对酸碱度的需求也不一样,所以用量不可能是一致的。
硫酸亚铁铵的制备(2010-06-27 09:29:56)转载标签:教育实验三硫酸亚铁铵的制备一实验目的:1. 学会利用溶解度的差异制备硫酸亚铁铵;掌握硫酸亚铁、硫酸亚铁铵复盐的性质。
2. 掌握水浴、减压过滤等基本操作;学习pH试纸、吸管、比色管的使用;学习限量分析。
二实验原理:1.铁屑溶于H2SO4,生成FeSO4:Fe + H2SO4=FeSO4 + H2↑2. 通常,亚铁盐在空气中易氧化。
例如,硫酸亚铁在中性溶液中能被溶于水肿的少量氧气氧化并进而与水作用,甚至析出棕黄色的碱式硫酸铁(或氢氧化铁)沉淀。
若往硫酸亚铁溶液中加入与FeSO4相等的物质的量(mol)的硫酸铵,则生成复盐硫酸亚铁铵。
硫酸亚铁铵比较稳定,它的六水合物(NH4)2SO4·FeSO4·6H2O不易被空气氧化,在定量分析中常用以配制亚铁离子的标准溶液。
像所有的复盐那样,硫酸亚铁铵在水中的溶解度比组成它的每一组份FeSO4或(NH4)2SO4的溶解度都要小。
蒸发浓缩所得溶液,可制得浅绿色的硫酸亚铁铵(六水合物)晶体。
FeSO4与(NH4)2SO4等物质的量作用,生成溶解度较小的硫酸亚铁铵:FeSO4 + (NH4)2SO4 + 6H2O =(NH4)2SO4·FeSO4·6H2O硫酸亚铁铵比较稳定,定量分析中常用来配制亚铁离子的标液;和其他复盐一样,硫酸亚铁铵的溶解度比它的每一组分要小。
3.比色原理:Fe3+ + n SCN- = Fe(SCN)n(3-n) (红色) 用比色法可估计产品中所含杂质Fe3+的量。
Fe3+由于能与SCN-生成红色的物质[Fe(SCN)]2+,当红色较深时,表明产品中含Fe3+较多;当红色较浅时,表明产品中含Fe3+较少。
所以,只要将所制备的硫酸亚铁铵晶体与KSCN 溶液在比色管中配制成待测溶液,将它所呈现的红色与含一定Fe3+量所配制成的标准Fe(SCN)]2+溶液的红色进行比较,根据红色深浅程度相仿情况,即可知待测溶液中杂质Fe3+的含量,从而可确定产品的等级。
溶液的配制
总磷10%氨基磺酸:称10g氨基磺酸溶于1000ml水中。
1. 氯化亚锡——甘油:称
2.5g氯化亚锡,加2ml浓盐酸和100ml 甘油(丙三醇)溶解。
2.钼酸钠——硫酸:将100ml浓硫酸加到900ml水中冷却后,
加入10g钼酸钠溶解。
3.过硫酸钾:将40g过硫酸钾溶于1000ml水中。
4.1+35硫酸:将14ml浓硫酸加入到490ml水中。
5.硫酸银:称10g硫酸银溶于1000ml浓硫酸中。
6.试亚铁录:称1.4g邻菲罗啉,0.70g硫酸亚铁溶于100ml
蒸馏水中。
7.硼酸:称20g硼酸溶于1000ml水中。
8.甲基红——甲基兰:称0.20g甲基红溶于100ml95%乙醇,
另称0.10g亚甲基兰溶于50ml90%乙醇,以两份混合溶于一起。
9.氯化钾保护液:称22.35g氯化钾溶于100ml水中。
供排水车间技术组
2016年2月16日。
硫酸亚铁溶液保存时加铁粉的原因
因为亚铁离子易被空气中的氧气氧化,加少量铁粉可以阻止亚铁离子的氧化.
配制硫酸亚铁时加入少量硫酸是防止亚铁离子水解。
1、配制硫酸亚铁时亚铁离子容易水解,这时候需要加入少量硫酸。
2、硫酸亚铁配制中要加硫酸和铁粉,稀硫酸防水解,铁粉防氧化。
Fe³⁺+3H₂O= Fe(OH)₃+ 3H ⁺
加酸后平衡向左移,可抑制Fe3+的水解。
3、在易水解的金属盐溶液加相应酸防水解,在易氧化的金属盐溶液加相应金属单质防氧化,在既易水解又易氧化的金属盐溶液同时加相应酸防水解加相应金属单质防氧化,是实验室常见做法。
硫酸亚铁溶于水,几乎不溶于乙醇。
其水溶液冷时在空气中缓慢氧化,在热时较快氧化。
加入碱或露光能加速其氧化。
相对密度(d15)1.897。
有刺激性。
无水硫酸亚铁是白色粉末,含结晶水的是浅绿色晶体,晶体俗称“绿矾”,溶于水水溶液为浅绿色。
4,受高热分解放出有毒的气体。
在实验室中,可以用硫酸铜溶液与铁反应获得。
在干燥空气中会风化。
在潮湿空气中易氧化成难溶于水的棕黄色碱式硫酸铁。
10%水溶液对石蕊呈酸性(Ph值约3.7)。
加热至70~73℃失去3分子水,至80~123℃失去6分子水,至156℃以上转变成碱式硫酸铁。
硫酸亚铁溶液的配制
硫酸亚铁溶液的配制方法
一、制备:
1、应用试剂:
A、硫酸亚铁GB664-65分析纯或工业品
B、硫酸GB625-65分析纯
C、碳酸氢钠GB640-65分析纯
2、配制方法:
每配制1升1N硫酸亚铁溶液,称取280克硫酸亚铁,溶于800mL 水内,用脱脂棉,或玻璃丝,过滤,然后加入已冷却的稀硫酸,56mL比重1.84的硫酸滴入144mL水内,200mL,混合匀后加入棕色细口瓶内,再加10~20克碳酸氢钠,存放暗处,以备标定。
每配制1升0.64N,0.02T,硫酸亚铁溶液,称取硫酸亚铁177克,溶解于400mL水内,用脱脂棉,或玻璃丝,过滤,加500mL已冷却的稀硫酸,比重1.84的硫酸滴入250mL水内,混合匀后加入棕色细口瓶内,再加10~20克碳酸氢钠,存放暗处备用,若有结晶,将澄清虹吸入另一棕色细口瓶内。
每配制1升0.1N硫酸亚铁溶液,称取28克硫酸亚铁,溶解于600mL水内,用脱脂棉,或玻璃丝,过滤,加320mL已冷却1.84的硫酸,混合匀后加入棕色细口瓶内,再加10~20克碳酸氢钠,存放暗处,以备标定。
注:加入碳酸氢钠的目的,在于产生的CO将溶洞液与空气隔绝,以延长其有效期。
二、标定:
1、重铬酸钾法:
1,、原理:
在一定酸度下,硫酸亚铁与重铬酸钾作用,生成硫酸高铁和硫酸铬在接近终点时,加入二苯胺磺酸钠,或二苯胺,指示剂被重铬酸钾氧化,使溶液呈兰紫色,终点时,指示剂又还原成无色,溶液呈现铬离子的绿色,即为终点,为了使终点明晰,加入适当磷酸,以隐蔽三价铁离了的扰。
重铬酸钾与硫酸亚铁的化学反应方程式为: 6Fe(NH4)2(SO4)2+K2Cr2O7+7H2SO4=3Fe2(SO4)3+Cr2(S O4)3+K2SO4+6(NH4)2SO4+7H2O
应用试剂: A、重铬酸钾基准试剂,当量=M/6=49.032
使用前于140~150?烘箱内烘2~3小时,然后放入干燥内冷却备用。
B、二苯胺磺酸钠0.5%溶液
硫酸亚铁标准溶液
C、二苯胺1%硫酸溶液
D、磷酸HGB3-120-65分析纯比重1.70
E、硫酸GB625-65分析纯
3,测定方法:
1N硫酸亚铁溶液:称取重铬酸钾1.3~1.4克,称准至0.0001克,放入250mL的锥形瓶内,加50mL水,3mL浓硫酸,溶解后加15mL 浓磷酸,用1N硫酸亚铁溶液滴定,快到终点时,加入二苯胺磺酸钠溶液3滴,或二苯胺溶液5滴,,继续滴至溶液由兰紫色突变为油绿色。
0.64N,0.02T,硫酸亚铁溶液:称取重铬酸钾0.8~0.9克,称准至0.0001克,放入250mL的锥形瓶内,加50mL水,3mL浓硫酸,溶解后加15mL浓磷酸,用0.64N硫酸亚铁溶液滴定,快到终点时,加入二苯胺磺酸钠溶液3滴,或二苯胺溶液5滴,,继续滴至溶液由兰紫色突变为油绿色。
0.1N硫酸亚铁溶液:称取重铬酸钾0.13~0.14克,称准至0.0001克,放入250mL的锥形瓶内,加50mL水,3mL浓硫酸,溶解后加10mL浓磷酸,用0.1N硫酸亚铁溶液滴定,快到终点时,加入二苯胺磺酸钠溶液3滴,或二苯胺溶液5滴,,继续滴至溶液由兰紫色突变为油绿色。
如何配置硫酸亚铁溶液
硫酸亚铁溶于水后电离产生的亚铁离子具有较强的还原性,也能较大程度地发生水解反应;配置硫酸亚铁溶液不能直接向水中加硫酸亚铁固体溶解;正确的配制方法是:向稀硫酸中加入硫酸亚铁固体(防止水解生成氢氧化亚铁),溶解后,再加入少量还原铁粉(防止亚铁离子被溶解氧氧化);一般硫酸亚铁这样的不稳定的溶液,基本上是现用现配,不宜长时间保存;
硫酸亚铁溶于水后电离产生的亚铁离子具有较强的还原性,也能较大程度地发生水解反应;配置硫酸亚铁溶液不能直接向水中加硫酸亚铁固体溶解;
正确的配制方法是:
向稀硫酸中加入硫酸亚铁固体(防止水解生成氢氧化亚铁),
溶解后,再加入少量还原铁粉(防止亚铁离子被溶解氧氧化);
一般硫酸亚铁这样的不稳定的溶液,基本上是现用现配,不宜长时间保存。
硫酸亚铁标准溶液如何配置
硫酸亚铁是一种蓝绿色单斜结晶或颗粒,无气味,可溶于水,几乎不溶于乙醇,其水溶液为浅绿色,用途广泛,可用于色谱分析试剂点滴分析测定铂、硒、亚硝酸盐和硝酸盐。
硫酸亚铁还可以作为还原剂、制造铁氧体、净水、聚合催化剂、照相制版等。
那么硫酸亚铁标准溶液该如何配置呢?首先我们需准备以下几种试剂:硫酸亚铁-分析纯或工业品、硫酸-分析纯、碳酸氢钠-分析纯。
具体步骤如下:
一、配置:
1、称取280克硫酸亚铁,溶于800ml水中;
2、用脱脂棉或玻璃丝过滤;
3、加入冷却后的稀硫酸200ml,混合均匀后倒入棕色的细口瓶子内;
4、可加入碳酸氢钠并放置在暗处进行保存。
二、滴定(重络酸钾法):
称取重络酸钾1.3-1.4克,放入250ml的锥形瓶内,加50ml 水3ml浓硫酸,溶解后加15ml浓磷酸,用1N硫酸亚铁溶液进行滴定,快到终点时加入二苯胺磺酸钠溶液,滴至溶液由紫色变为油绿色。
三、计算:(硫酸亚铁标准溶液的浓度计算公式如下)
其中:
G——重络酸钾重量
V——硫酸亚铁的用量
0.049——每毫克当量重络酸钾克数。