化学选修四_等效平衡
- 格式:ppt
- 大小:1.33 MB
- 文档页数:48

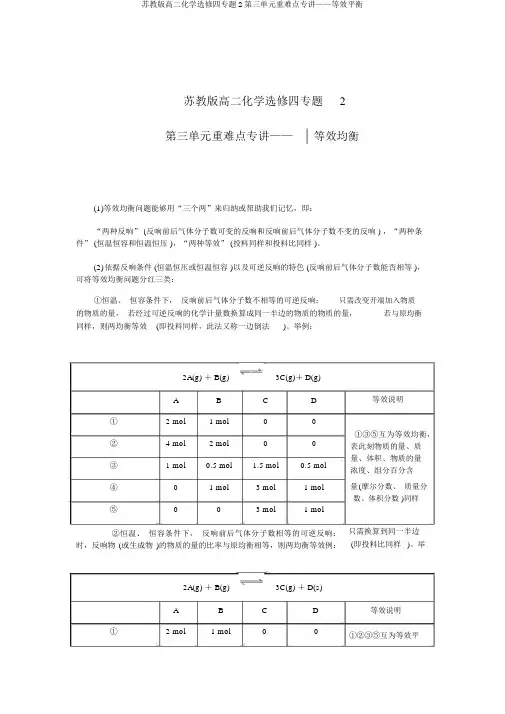
苏教版高二化学选修四专题2第三单元重难点专讲——| 等效均衡(1)等效均衡问题能够用“三个两”来归纳或帮助我们记忆,即:“两种反响” (反响前后气体分子数可变的反响和反响前后气体分子数不变的反响 ) ,“两种条件” (恒温恒容和恒温恒压 ),“两种等效” (投料同样和投料比同样 )。
(2)依据反响条件 (恒温恒压或恒温恒容 )以及可逆反响的特色 (反响前后气体分子数能否相等 ),可将等效均衡问题分红三类:①恒温、恒容条件下,反响前后气体分子数不相等的可逆反响:只需改变开端加入物质的物质的量,若经过可逆反响的化学计量数换算成同一半边的物质的物质的量,若与原均衡同样,则两均衡等效(即投料同样,此法又称一边倒法)。
举例:2A(g) + B(g)3C(g)+ D(g)A B C D① 2 mol 1 mol00② 4 mol 2 mol00③ 1 mol0.5 mol 1.5 mol0.5 mol④0 1 mol 3 mol 1 mol⑤00 3 mol 1 mol②恒温、恒容条件下,反响前后气体分子数相等的可逆反响:时,反响物(或生成物)的物质的量的比率与原均衡相等,则两均衡等效例:等效说明①③⑤互为等效均衡,表此刻物质的量、质量、体积、物质的量浓度、组分百分含量(摩尔分数、质量分数、体积分数 )同样只需换算到同一半边(即投料比同样)。
举2A(g) + B(g)3C(g) + D(s)A B C D等效说明① 2 mol 1 mol00①②③⑤互为等效平② 4 mol 2 mol 0 0 ③ 1 mol 0.5 mol 1.5 mol 0.5 mol ④ 0 1 mol3 mol 1 mol ⑤3 mol1 mol衡,表此刻组分百分含量 (摩尔分数、 质量分数、体积分数 )同样③恒温、 恒压条件下, 反响前后气体分子数随意型的可逆反响:只需按化学计量数换算到同一半边后, 各物质的物质的量之比与原均衡相等,则两均衡等效(即投料比同样 )。





第3节化学平衡——等效平衡教学目标1.构建等效平衡的模型,掌握等效平衡在解题中的应用2.通过对化学反应进行方向及其应用的学习,提高运用比较、归纳的能力,培养学生学习化学思维能力,以及应用理论解决实际问题能力3.建立化学平衡的观点,并通过分析化学平衡的建立,增强学生的归纳和形象思维能力教学重点等效平衡教学难点等效平衡教学过程一、导入水往低处流,而不会自发的向上流;一般在室温下,冰块会融化,铁器在潮湿空气中会生锈,甲烷与氧气的混合气体遇明火就燃烧,这些过程都是自发的。
这些不用借助于外力就可以自动进行的自发过程的共同特点是,体系会对外部做功或释放热量,即体系趋向于从高能状态转变为低能状态。
那是否就意味着放热反应自发进行,吸热反应就是非自发进行呢?二、知识讲解等效平衡对于一些学生理解起来不是特别容易,希望老师在讲解此内容的时候多一些耐心,重点讲典型例题和习题。
考点1 等效平衡含义及原理1.含义在一定条件下(等温等容或等温等压),对同一可逆反应体系,起始时加入物质的物质的量不同,而达到化学平衡时,同种物质的百分含量相同。
2.原理同一可逆反应,当外界条件一定时,反应无论从正反应开始,还是从逆反应开始,最后都能达到平衡状态。
其中平衡混合物中各物质的含量相同。
由于化学平衡状态与条件有关,而与建立平衡的途径无关。
因而同一可逆反应,从不同的状态开始,只要达到平衡时条件(温度、浓度、压强等)完全相同,则可形成等效平衡。
考点2 等效平衡规律对于可逆反应aA(g)+bB(g)cC(g)+dD(g)三、例题精析使用建议说明:此处内容主要用于教师课堂的精讲,每个题目结合试题本身、答案和解析部分,教师有的放矢的进行讲授或与学生互动练习。
例题1 一定温度下,在3个体积均为1.0 L 的恒容密闭容器中反应2H 2(g)+CO(g)CH 3OH(g) 达到平衡。
下列说法正确的是A .该反应的正反应放热B .达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大C .达到平衡时,容器Ⅱ中c(H 2)大于容器Ⅲ中c(H 2)的两倍D .达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大【答案】AD【解析】A 项,根据Ⅰ、Ⅲ中数据可知反应开始时Ⅰ中加入的H 2、CO 与Ⅲ中加入甲醇的物质的量相当,平衡时甲醇的浓度:Ⅰ>Ⅲ,温度:Ⅰ<Ⅲ,即升高温度平衡逆向移动,该反应正向为放热反应,所以A 项正确。
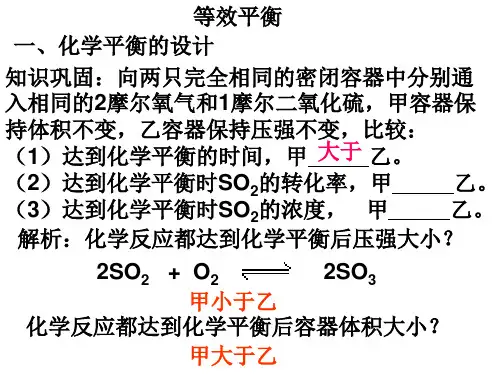

1.等效平衡的原理 在一定条件(恒温、恒容或恒温、恒压)下,只是起始加入情况不同的同一可逆反应达到平衡后,任何相同组分的物质的量分数(或体积分数)均相同,这样的化学平衡互称等效平衡. 2.等效平衡的建立 化学平衡状态的建立与条件(如浓度、温度、压强等)有关,而与建立平衡时的途径无关,因而同一可逆反应,从不同的状态开始,只要达到平衡时的条件(浓度、温度、压强等)完全相同,则可形成等效平衡. 如常温常压下,可逆反应: 2SO2 +O2 ⇌2SO3 ①2mol 1mol 0 ②0 0 2mol ③1mol 0.5mol 1mol ①从正反应开始,②从逆反应开始,③从正、逆反应同时开始,由于①、②、③三种情况如果按方程式的化学计量数比折算成同一方向的反应物,对应各组分的物质的量均相等如将②、③折算为①],因此三者为等效平衡。 3.等效平衡的规律 (1)恒温、恒容条件下的等效平衡 Ⅰ类:在恒温、恒容条件下,对于反应前后气体化学计量数不相等的可逆反应,只改变起始时加入物质的物质的量,若通过可逆反应的化学计量数之比换算成同一边物质的物质的量,所得反应物(或生成物)的物质的量与原起始量对应相同,则两平衡等效.简记:必须对应相同. Ⅱ类:在恒温、恒容条件下,对于反应前后气体化学计量数相等的可逆反应,只改变起始时加入物质的物质的量,若通过可逆反应的化学计量数之比换算成同一边物质的物质的量,所得反应物(或生成物)的物质的量之比与原起始量之比对应相同,则两平衡等效.简记:对应成比例. (2)恒温、恒压条件下的等效平衡 在恒温、恒压条件下,对于反应前后气体化学计量数任意性的可逆反应,只改变起始时加 入物质的物质的量,若通过可逆反应的化学计量数之比换算成同一边物质的物质的量,所得反应物(或生成物)的物质的量之比与原起始量之比对应相同,则两平衡等效.简记:对应成比例 【重难点指数】★★★
【重难点考向一】恒温恒容条件下,反应前后气体化学计量数不相等的可逆反应 【例1】在一密闭的容器中充入2mol A和1mol B发生反应:2A(g)+B(g)⇌xC(g),达到平衡后,C的体积分数为w%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为w%,则x的值为( ) A.只能为2 B.只能为3 C.可能为2,也可能为3 D.无法确定 【答案】C