乙酸乙酯的工业生产方法
- 格式:docx
- 大小:15.85 KB
- 文档页数:4

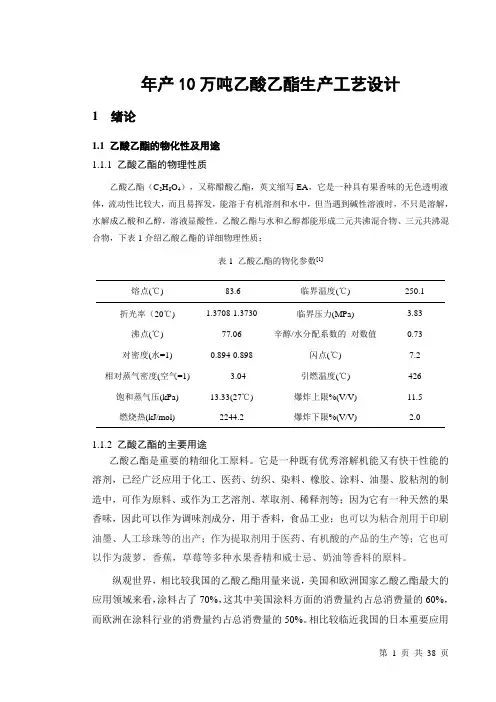
年产10万吨乙酸乙酯生产工艺设计1 绪论1.1 乙酸乙酯的物化性及用途1.1.1 乙酸乙酯的物理性质乙酸乙酯(C2H8O4),又称醋酸乙酯,英文缩写EA,它是一种具有果香味的无色透明液体,流动性比较大,而且易挥发,能溶于有机溶剂和水中,但当遇到碱性溶液时,不只是溶解,水解成乙酸和乙醇,溶液显酸性。
乙酸乙酯与水和乙醇都能形成二元共沸混合物、三元共沸混合物,下表1介绍乙酸乙酯的详细物理性质:表1 乙酸乙酯的物化参数[1]熔点(℃) -83.6 临界温度(℃) 250.1 折光率(20℃) 1.3708-1.3730 临界压力(MPa) 3.83 沸点(℃) 77.06 辛醇/水分配系数的对数值0.73 对密度(水=1) 0.894-0.898 闪点(℃) 7.2 相对蒸气密度(空气=1) 3.04 引燃温度(℃) 426 饱和蒸气压(kPa) 13.33(27℃) 爆炸上限%(V/V) 11.5燃烧热(kJ/mol) 2244.2 爆炸下限%(V/V) 2.01.1.2 乙酸乙酯的主要用途乙酸乙酯是重要的精细化工原料。
它是一种既有优秀溶解机能又有快干性能的溶剂,已经广泛应用于化工、医药、纺织、染料、橡胶、涂料、油墨、胶粘剂的制造中,可作为原料、或作为工艺溶剂、萃取剂、稀释剂等;因为它有一种天然的果香味,因此可以作为调味剂成分,用于香料,食品工业;也可以为粘合剂用于印刷油墨、人工珍珠等的出产;作为提取剂用于医药、有机酸的产品的生产等;它也可以作为菠萝,香蕉,草莓等多种水果香精和威士忌、奶油等香料的原料。
纵观世界,相比较我国的乙酸乙酯用量来说,美国和欧洲国家乙酸乙酯最大的应用领域来看,涂料占了70%,这其中美国涂料方面的消费量约占总消费量的60%,而欧洲在涂料行业的消费量约占总消费量的50%。
相比较临近我国的日本重要应用在涂料,油墨两方面,分别约占总消费量的40%和30%。
我国主要应用于涂料,粘合剂和制药等领域[3]。

乙醛生成乙酸乙酯的化学方程式乙醛生成乙酸乙酯的化学方程式如下所示:
CH3CHO + CH3COOH → CH3COOC2H5 + H2O
这里,乙醛(CH3CHO)和乙酸(CH3COOH)发生了酯化反应,生成
了乙酸乙酯(CH3COOC2H5)和水(H2O)。
酯化反应是有机化学中常见
的一种反应,也是合成香精、涂料、塑料等工业产品的重要反应之一。
乙酸乙酯是一种无色透明的液体,具有醇类的香气,主要用于作
为溶剂、增塑剂、着香剂、涂料、化妆品等方面。
其制备方法除了酯
化反应外,还可以通过醇解反应、酸催化反应、酐解反应等多种方式
得到。
通过对乙酸乙酯的制备方法多样性与反应条件的深入研究,有
望进一步提高其合成效率与产品品质。
在实际生产中,乙醛生成乙酸乙酯的酯化反应通常采用液相反应,通常以过量醋酸作为催化剂,调节反应温度和时间,实现产率与纯度
的平衡。
在反应过程中,应注意操作的安全性和卫生标准,避免产生
污染物和有毒气体,保护环境和人们的健康。
总之,乙醛生成乙酸乙酯的化学方程式揭示了有机化学的基本原
理与应用,而酯化反应作为一种重要的有机合成方法,能够产生有用
的工业和生活产品。
对于化学学习者和化工从业人员,通过学习具体
反应的化学机理和实际应用,能够更深入地理解化学原理和操作技术,为实现绿色化学和可持续发展做出贡献。

乙酸乙酯的生产吴尚08化工040803222摘要:介绍了乙酸乙酯的原料及产品的价格和物理数据等,同时对工业生产乙酸乙酯的反应机理、工艺路线、工艺流程、主要设备、产品分离、三废处理进行了分类介绍。
关键词:乙酸乙酯;生产工艺;物理数据乙酸乙酯,又名醋酸乙酯,是乙酸的主要下游产品,是重要的精细化工原料。
它是一种具有优异溶解性能和快干性能的溶剂,已广泛应用于化工、医药、纺织、染料、橡胶、涂料、油墨、胶粘剂的生产中,或作为原料、或作为工艺溶剂、萃取剂、稀释剂等等;由于它具有天然水果香味,因此还可作为调香剂组分,应用于香料、食品工业中;也可作为粘合剂用于印刷油墨、人造珍珠等的生产;作为提取剂用于医药、有机酸的产品的生产等;此外还可用作生产菠萝、香蕉、草莓等水果香精和威士忌、奶油等香料的原料。
近年来乙酸乙酯在国内外的应用增长较快,随着国内涂料、粘合剂产品环保要求的进一步提高,乙酸乙酯作为无毒溶剂,其应用得到广泛的重视,我国涂料行业已逐渐使用环保型涂料,因此将会进一步推动乙酸乙酯的市场增长。
一、乙酸乙酯的物理参数外观:无色澄清液体。
香气:有强烈的醚似的气味,清灵、微带果香的酒香,易扩散,不持久。
熔点(℃):-83.6;折光率(20℃):1.3708—1.3730;沸点(℃):77.06;相对密度(水=1):0.894—0.898;相对蒸气密度(空气=1):3.04;饱和蒸气压(kPa):13.33(27℃);燃烧热(kJ/mol):2244.2;临界温度(℃):250.1;临界压力(MPa):3.83;辛醇/水分配系数的对数值:0.73;闪点(℃)(开杯):7.2;引燃温度(℃):426;爆炸上限%(V/V):11.5;爆炸下限%(V/V):2.0;室温下的分子偶极距:6.555*10^-30;溶解性:微溶于水,溶于醇、酮、醚、氯仿等多数有机溶剂。
二、乙酸乙酯的主要生产工艺目前,乙酸乙酯的工业生产方法主要有醋酸酯化法、乙醛缩合法、乙醇脱氢法和醋酸/乙烯加成4种。

乙酸乙酯的制备实验报告乙酸乙酯的制备实验报告引言乙酸乙酯是一种常见的有机化合物,具有水果香味,广泛应用于食品、药品、涂料等领域。
本实验旨在通过酯化反应制备乙酸乙酯,并探究反应条件对产率的影响。
实验材料与方法实验材料包括乙酸、乙醇、硫酸、酒精灯、冷却器、滴管等。
实验方法主要分为三个步骤:酸催化、酯化反应、分离纯化。
实验步骤第一步:酸催化首先,在实验室通风橱中取一定量的乙酸和乙醇,分别加入两个干净的试管中。
然后,将试管放入水浴中加热,使其温度保持在50-60摄氏度。
接着,将一滴硫酸滴入乙酸试管中,并迅速将两个试管连在一起,通过冷却器连接。
第二步:酯化反应在酸催化的条件下,将乙酸试管中的液体缓慢滴入乙醇试管中,并同时加热。
反应进行时,观察到试管中产生了白色的沉淀,这是硫酸与乙醇反应生成的硫酸乙酯。
继续加热,直至反应完全进行。
第三步:分离纯化待反应结束后,将试管取出,冷却至室温。
然后,将试管中的液体倒入分液漏斗中,并加入适量的蒸馏水。
轻轻摇晃分液漏斗,使两相液体充分混合。
等待一段时间,直至两相分离。
然后,打开分液漏斗的放液口,将底层的水层倒掉,留下上层的有机相。
结果与讨论通过实验,我们成功合成了乙酸乙酯。
观察到酯化反应进行时,产生了白色的沉淀,这是硫酸与乙醇反应生成的硫酸乙酯。
在分离纯化步骤中,通过分液漏斗将乙酸乙酯与水分离,得到了纯净的乙酸乙酯。
实验中,我们还探究了反应条件对产率的影响。
在酸催化的条件下,反应温度的选择对产率起着重要作用。
过高的温度会导致产率下降,因为乙酸乙酯易于挥发。
而过低的温度则会延缓反应速率,影响反应的进行。
因此,适宜的反应温度是保证高产率的关键。
此外,反应时间也对产率有影响。
反应时间过短,反应还未完全进行,产率自然较低。
反应时间过长,反应可能过度进行,导致副反应的发生。
因此,合理控制反应时间,确保反应充分进行,是提高产率的关键。
结论通过本实验,我们成功合成了乙酸乙酯,并探究了反应条件对产率的影响。

乙酸乙酯的合成工艺1.乙酸乙酯简介乙酸乙酯又称醋酸乙酯(分子式:C4H8O2 )。
纯净的乙酸乙酯是无色透明具有刺激性气味的液体,是一种用途广泛的精细化工产品,具有优异的溶解性、快干性,用途广泛,是一种非常重要的有机化工原料和极好的工业溶剂,被广泛用于醋酸纤维、乙基纤维、氯化橡胶、乙烯树脂、乙酸纤维树酯、合成橡胶、涂料及油漆等的生产过程中。
其主要用途有:作为工业溶剂,用于涂料、粘合剂、乙基纤维素、人造革、油毡着色剂、人造纤维等产品中;作为粘合剂,用于印刷油墨、人造珍珠的生产;作为提取剂,用于医药、有机酸等产品的生产;作为香料原料,用于菠萝、香蕉、草莓等水果香精和威士忌、奶油等香料的主要原料。
用作溶剂,及用于染料和一些医药中间体的合成。
是食用香精中用量较大的合成香料之一,大量用于调配香蕉、梨、桃、菠萝、葡萄等香型食用香精。
是硝酸纤维素、乙基纤维素、乙酸纤维素和氯丁橡胶的快干溶剂,也是工业上使用的低毒性溶剂。
还可用作纺织工业的清洗剂和天然香料的萃取剂,也是制药工业和有机合成的重要原料。
2.乙酸乙酯的合成方法目前世界上工业乙酸乙酯主要制备方法有乙酸酯化法、乙醛缩合法、乙烯加成法和乙醇脱氢法等。
传统的乙酸酯化法工艺在国外被逐步淘汰,而大规模生产装置主要是乙醛缩合法和乙醇脱氢法,我国多采用乙酸酯化法进行生产。
2.1.乙酸乙醇酯化法乙酸乙醇酯化法是乙酸和乙醇在浓硫酸催化作用下发生酯化反应来产乙酸乙酯, 该法在欧美被广泛采用, 如目前世界上最大生产厂商BP-Amoco公司, 采用酯化法生产EA, 其生产能力达200Kt/a。
但酯化法存在硫酸腐蚀性强、副反应多、副产物处理困难及对环境造成污染等缺点。
近年来, 各国积极开发固体酸酯化催化剂来代替硫酸, 如采用沸石分子筛固载的固体酸催化剂。
但这些催化剂价格较贵, 活性下降快, 工业应用尚不多。
2.2.乙醛酸合法乙醛缩合法是将即两分子乙醛在乙醇(三乙氧基铝)作用下, 经反应生产乙酸乙酯。

乙酸乙酯的制取操作方法在一个大试管里注入3mL乙醇,然后一边摇动一边慢慢加入浓硫酸、乙酸各2mL,用小火加热试管里的混合物。
把产生的蒸气经导管通到3毫升饱和Na2CO3溶液的上方约2--3mm处,注意观察盛有Na2CO3溶液的试管的变化,待有透明的油状液体浮在液面上,取下盛有碳酸钠溶液的试管,并停止加热,振荡盛有碳酸钠溶液的试管后静置,待溶液分层后,观察上层液体,并闻气味。
实验现象生成有香味的无色液体。
实验结论乙酸和乙醇在浓硫酸作用下发生反应生成乙酸乙酯。
它有果香味,不溶于水,与饱和碳酸钠溶液分层。
浓硫酸在其反应过程中起催化吸水作用。
实验考点1、酯化反应原理;2、浓硫酸作用;3、对可逆反应的考查。
经典考题1、将乙酸和含氧的同位素1880的乙醇在硫酸存在下共热充分反应,得到的混合物中,含18O的物质A. 只有水B. 只有乙酸乙酯C. 有水和乙醇D. 有乙酸乙酯和乙醇试题难度:易2、由乙酸、乙酸乙酯、己烯、环十二烷组成的混合物,经测定氧的质量分数为13.2%,则混合物中碳的质量分数为A. 74.4%B. 68.4%C. 79.2%D. 56.8%试题难度:中3、下列操作中错误的是A. 除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯B. 除去苯中的少量苯酚:加入NaOH溶液,振荡、静置分层后,除去水层C. 除去CO2中的少量SO2:通过盛有饱和NaHCO3溶液的洗气瓶D. 提取溶解在水中的少量碘:加入CCl4,振荡、静置分层后。
取出有机层再分离试题难度:中答案1 答案:D解析:反应原理:酸脱羟基醇脱氢。
2 答案:A解析:因为每一种分子中C、H个数比均为1:2,所以,无论怎样混合,C、H的质量比均为6:1,而二者质量分数加和为1-13.2%=86.8%。
3 答案:A解析:该反应可逆,即乙酸不可能完全反应掉,杂质不能完全除掉。
煮菜时加酒加醋为什么产生香味厨师在烧菜时,总喜欢在加了酒以后,再搁些醋。

乙烯和乙酸催化合成乙酸乙酯的工艺流程1.首先,将乙烯和乙酸混合在催化剂的存在下。
First, mix ethylene and acetic acid in the presence of a catalyst.2.然后,将混合物在一定的温度和压力下进行催化反应。
Then, catalyze the mixture under certain temperature and pressure.3.催化反应会使乙酸和乙烯发生酯化反应。
The catalytic reaction will cause acetic acid and ethylene to undergo esterification reaction.4.酯化反应产生的乙酸乙酯可以通过精馏得到纯净的产物。
The ethyl acetate produced by the esterification reaction can be obtained pure through distillation.5.收集纯净的乙酸乙酯以供进一步的工业应用。
Collect the pure ethyl acetate for further industrial application.6.该工艺流程可以在工业生产中大规模应用。
This process can be applied on a large scale in industrial production.7.催化剂的选择对反应的速率和产物的纯度至关重要。
The choice of catalyst is crucial for the reaction rate and the purity of the product.8.温度和压力的控制可以影响反应的收率和选择性。
Control of temperature and pressure can affect the reaction yield and selectivity.9.通过控制反应条件,可以提高乙酸乙酯的产率。

乙酸乙酯的制法一、什么是乙酸乙酯1、乙酸乙酯,听起来好像有点复杂,其实它就是一种非常常见的有机化合物,广泛存在于水果的香气里。
你知道吗?你吃过的很多水果,特别是苹果、梨、葡萄,它们散发的那种甜美的香气,往往就是乙酸乙酯在“背后”默默地奉献着。
你闻到的那股清新水果香味,就是它在向你打招呼呢。
所以说,乙酸乙酯有着天然的芳香气息,也常常被用来制作香料和调味品。
它不仅有香气,还带着点点甜美,简直是“调皮”的化学小精灵。
2、除了香气,乙酸乙酯的用途可真不少。
化学工业里,它是个大明星!在溶剂中,乙酸乙酯作为一个溶剂,能溶解许多物质,甚至是油漆、涂料、油墨等一些顽固的小家伙,它都能“搞定”。
你可以想象一下它那种“身手”多么灵活,真是溶解界的“高手”了。
乙酸乙酯也常用于药物合成和实验室里,基本上在化学反应中,它总是能“搭上台”,帮忙提供一些反应条件。
3、今天我们要聊的就是,怎么自己动手做出这款“小香精”,从原料到操作,看看怎样才能在家里制造出这神奇的乙酸乙酯。
这一过程既有趣又简单,关键是要把握好步骤,不然它可不会乖乖地“出来”。
所以,话不多说,接下来就看看它的制造流程吧。
二、乙酸乙酯的制备方法1、想要制作乙酸乙酯,首先得准备好两个主角:乙酸和乙醇。
嗯,乙酸也就是我们常见的醋酸,它可是家家户户厨房里的“必备良品”。
而乙醇呢,就是日常生活中大部分酒精饮品的成分,别看它这么“简单”,它可不能少了。
两个原料看似平凡,但在化学的舞台上,它们可是一对儿黄金搭档。
准备好这两位角色,你就有了做乙酸乙酯的基础。
2、接下来要进行的就是所谓的酯化反应啦。
简单来说,就是让乙酸和乙醇在一个“温暖”的环境下发生反应。
你可能会问,什么样的“温暖”?这个“温暖”就是需要加热,而且还需要用一个催化剂来帮忙加速反应。
催化剂通常是浓硫酸,它能够帮助反应更快地进行。
你想象一下,它就像是一位“加速器”,让两位主角乙酸和乙醇在反应中更加“激情四射”。
3、然后呢,我们就需要把这反应进行到底。

一、乙酸和乙醇生成乙酸乙酯的化学方程式在化学反应中,乙酸与乙醇可以通过酸酐的酯化反应生成乙酸乙酯。
其化学方程式可以用如下式子表示:CH3COOH + C2H5OH → CH3COOC2H5 + H2O其中,CH3COOH代表乙酸,C2H5OH代表乙醇,CH3COOC2H5代表乙酸乙酯,H2O代表水。
这个化学反应是一个典型的酯化反应,属于酸催化酯化反应。
在这个反应中,乙酸起到了酸催化剂的作用,促进了反应的进行。
二、乙酸和乙醇生成乙酸乙酯的反应机理乙酸和乙醇生成乙酸乙酯的反应机理实际上是一个酸催化酯化反应,具体可以分为以下几个步骤:1. 乙酸与乙醇发生酸碱中和反应,生成乙酸根离子和乙醇正离子;2. 乙酸根离子和乙醇正离子发生亲核加成,生成乙酸乙酯,同时释放一个氢离子;3. 生成的氢离子与反应中剩余的乙醇正离子发生质子迁移,恢复为乙醇。
整个反应过程中,乙酸起到了催化剂的作用,促进了乙醇和乙酸的酯化反应。
三、乙酸乙酯的用途乙酸乙酯在工业上有着广泛的用途,主要包括以下几个方面:1. 作为有机合成中间体,可以用于生产香精香料、染料、医药等化工产品;2. 作为溶剂,可以用于印刷油墨、油漆、胶粘剂等工业领域;3. 作为香料,可以用于生产食品和香水中;4. 作为润滑剂,可以用于润滑油和添加剂中。
乙酸乙酯的广泛应用使得与乙酸和乙醇之间的酯化反应成为一种重要的化工反应。
四、乙酸和乙醇生成乙酸乙酯的实验室制备在实验室中,可以通过以下步骤制备乙酸乙酯:1. 取一定量的乙酸和乙醇,按摩尔比混合在一起;2. 在混合物中加入一定量的硫酸或者磷酸作为酸催化剂;3. 将混合物进行加热反应,通常在回流装置中进行;4. 反应结束后,通过蒸馏法或者其他提取方法,可以得到纯净的乙酸乙酯。
这种方法能够实现乙酸和乙醇的高效反应,得到良好的产率和纯度的乙酸乙酯。
五、乙酸和乙醇生成乙酸乙酯的工业制备在工业生产中,乙酸和乙醇生成乙酸乙酯通常采用酸催化酯化反应,主要包括以下几个步骤:1. 将一定比例的乙酸和乙醇混合在一起;2. 在混合物中加入一定量的酸催化剂,通常采用硫酸或者磷酸;3. 在适当的温度和压力下进行反应,促使酯化反应的进行;4. 反应结束后,通过蒸馏分离和纯化操作,得到纯净的乙酸乙酯。

年产10万吨乙酸乙酯生产工艺设计1 绪论1.1 乙酸乙酯的物化性及用途1.1.1 乙酸乙酯的物理性质乙酸乙酯(C2H8O4),又称醋酸乙酯,英文缩写EA,它是一种具有果香味的无色透明液体,流动性比较大,而且易挥发,能溶于有机溶剂和水中,但当遇到碱性溶液时,不只是溶解,水解成乙酸和乙醇,溶液显酸性。
乙酸乙酯与水和乙醇都能形成二元共沸混合物、三元共沸混合物,下表1介绍乙酸乙酯的详细物理性质:表1 乙酸乙酯的物化参数[1]熔点(℃) -83.6 临界温度(℃) 250.1 折光率(20℃) 1.3708-1.3730 临界压力(MPa) 3.83 沸点(℃) 77.06 辛醇/水分配系数的对数值0.73 对密度(水=1) 0.894-0.898 闪点(℃) 7.2 相对蒸气密度(空气=1) 3.04 引燃温度(℃) 426 饱和蒸气压(kPa) 13.33(27℃) 爆炸上限%(V/V) 11.5燃烧热(kJ/mol) 2244.2 爆炸下限%(V/V) 2.01.1.2 乙酸乙酯的主要用途乙酸乙酯是重要的精细化工原料。
它是一种既有优秀溶解机能又有快干性能的溶剂,已经广泛应用于化工、医药、纺织、染料、橡胶、涂料、油墨、胶粘剂的制造中,可作为原料、或作为工艺溶剂、萃取剂、稀释剂等;因为它有一种天然的果香味,因此可以作为调味剂成分,用于香料,食品工业;也可以为粘合剂用于印刷油墨、人工珍珠等的出产;作为提取剂用于医药、有机酸的产品的生产等;它也可以作为菠萝,香蕉,草莓等多种水果香精和威士忌、奶油等香料的原料。
纵观世界,相比较我国的乙酸乙酯用量来说,美国和欧洲国家乙酸乙酯最大的应用领域来看,涂料占了70%,这其中美国涂料方面的消费量约占总消费量的60%,而欧洲在涂料行业的消费量约占总消费量的50%。
相比较临近我国的日本重要应用在涂料,油墨两方面,分别约占总消费量的40%和30%。
我国主要应用于涂料,粘合剂和制药等领域[3]。
乙酸乙酯的制备实验步骤乙酸乙酯是一种常用的有机溶剂,广泛应用于涂料、胶水、油墨等工业领域。
下面将介绍乙酸乙酯的制备实验步骤。
1. 实验准备首先,准备好所需的实验器材和试剂。
实验器材包括反应瓶、冷凝管、滴液漏斗等。
试剂包括乙酸、乙醇、浓硫酸等。
2. 反应过程将适量的乙酸和乙醇按照1:1的摩尔比例加入反应瓶中。
为了促进反应的进行,加入少量的浓硫酸作为催化剂。
在反应过程中,要注意反应瓶密封良好,以防挥发物的损失。
3. 加热反应将反应瓶加热到适当的温度,一般在60-80摄氏度之间。
加热过程中,可以轻轻摇晃反应瓶,以促进混合和反应的进行。
4. 冷却冷凝在反应瓶的口部连接上冷凝管,冷凝管的一端放入冷水中,使其与反应瓶紧密连接。
通过冷凝管,将反应瓶中的气体冷却后转化为液体,并收集到另一个容器中。
5. 分离纯化将收集到的液体放置一段时间,使乙酸乙酯与水分离。
由于乙酸乙酯比水密度小,可以较容易地分离两者。
将分离得到的乙酸乙酯转移到干燥的容器中。
6. 干燥处理为了去除乙酸乙酯中的水分和杂质,可以使用干燥剂进行处理。
常用的干燥剂有无水硫酸钠、无水氯化钙等。
将干燥剂加入乙酸乙酯中,并搅拌一段时间,使其吸附水分和杂质。
7. 过滤蒸馏将干燥后的乙酸乙酯通过滤纸过滤,去除残留的干燥剂。
然后,进行蒸馏操作,以进一步提纯乙酸乙酯。
通过控制温度,使乙酸乙酯蒸发并重新凝结,收集纯净的乙酸乙酯。
8. 保存储存将制备好的乙酸乙酯转移到干燥的密封容器中,并存放在阴凉干燥的地方。
避免阳光直射和高温,以防乙酸乙酯挥发或分解。
通过以上步骤,我们可以制备出较纯的乙酸乙酯。
在实验过程中,需要注意安全操作,避免接触皮肤和吸入挥发物。
此外,实验中的反应条件和操作方法可以根据需要进行调整和改进,以提高乙酸乙酯的产率和纯度。
制备乙酸乙酯方程式乙酸乙酯制备方法1. 介绍乙酸乙酯是一种类型的有机化合物,由乙醇和乙酸的经典的酯化反应所产生。
乙酸乙酯是一种重要的有机化合物,用于药剂、清洗剂和化妆品等多种领域。
一些工业领域也会使用它来增加燃料高度,润滑油,抗腐蚀剂和延长食品的寿命等等。
乙酸乙酯可以由乙酸和乙醇直接缩合而生成,同时也可以从乙醇和有机酸间接缩合生成。
乙酸乙酯在室温下稳定,但它在高温下也能轻松地挥发掉。
2. 溶剂选择乙酸乙酯需要反应的乙醇和乙酸的选择是制备乙酸乙酯的关键。
由于反应涉及到有机溶剂的使用,所以选择它们将决定反应的正常进行。
乙酸乙酯的制备可以在溶剂,如水、乙醚、乙醇、氯仿、甲醇、丙酮等中进行。
各种溶剂的选择取决于反应温度,溶剂的毒性和反应加速剂的使用。
其中,乙醚和氯仿是最常用的溶剂。
3. 反应条件乙醇和乙酸可以在不同的反应条件下进行酯化反应,其中乙醇成为活性反应体,乙酸是反应试剂。
首先,反应在常压下进行,但也可以在加压条件下进行,加压反应能够提高反应产物的纯度和反应速率。
此外,反应也可以在催化剂的作用下进行,常用的催化剂有烷磺酸钠、重碳酸钾、HCl等,可以加速反应的进行。
4. 反应过程乙酸乙酯的反应是一种多级反应,呈现出多个反应步骤,其中最重要的是酯化反应。
反应1:乙醇与乙酸发生络合CH3CH2OH + CH3COOH → CH3CH2OHCH2COOC2H5反应2:乙酸乙酯随着水脱酯形成乙醇和乙酸CH3CH2OHCH2COOC2H5+H2O → CH3CH2OH+ CH3COOH反应3:再次发生络合,产生乙酸乙酯CH3CH2OH+ CH3COOH → CH3CH2OHCH2COOC2H5以上,就是乙酸乙酯制备方法的介绍,从溶剂的选择到反应的条件以及反应的过程,更多的乙酸乙酯制备方法以及其他信息,请参考专业的化学书籍或者网络资源。
乙烯合成乙酸乙酯的合成路线乙烯合成乙酸乙酯的合成路线_________________________________________________________________________乙烯可以经过一系列化学反应,通过合成乙酸乙酯,从而在工业上获得广泛的应用。
本文将介绍乙烯合成乙酸乙酯的合成路线,以及每一步的反应原理和应用。
#### 一、乙烯氧化反应乙烯氧化反应是生产乙酸乙酯的重要步骤,它是将乙烯分解为乙醛和亚甲基苯的过程。
乙烯的氧化反应可以采用两种方法:一是催化氧化,使用氧化剂(如溴、氧化钒、氧化铜)催化乙烯的氧化反应;另一种是氧化聚合反应,使用氧化剂(如溴、氧化钒、氧化铜)催化乙烯的氧化聚合反应。
催化氧化法利用溴、氧化钒或氧化铜作为催化剂,在常温常压条件下,把乙烯氧化分解为乙醛和亚甲基苯。
反应过程中,溴将乙烯的双键分开,形成单键亚甲基苯;氧化钒或氧化铜将单键亚甲基苯氧化为乙醛。
氧化聚合法利用溴或氢氧化物作为氧化剂,在常温常压条件下,乙烯发生聚合反应,形成乙醛和亚甲基苯。
反应过程中,溴将乙烯的双键分开,形成单键亚甲基苯;氢氧化物将单键亚甲基苯进行氧化聚合反应,形成乙醛。
#### 二、乙醛合成乙酸乙酯在乙烯合成乙酸乙酯的过程中,乙醛是一个重要的中间体。
它是通过将乙烯以水为介质加入金属杂原子酸来进行循环加成反应而生成的。
循环加成反应通常利用金属杂原子酸作为催化剂,如金属油酸、金属棕榈酸、金属聚酰胺或金属异丁醛。
在循环加成反应中,金属杂原子酸将乙烯与水分子中的氢原子形成一个新的C-H键,将其转化为两个不同的物质—乙醛和水。
在循环加成反应过程中,金属杂原子酸具有很强的加成作用,因此通常不会出现副反应。
循环加成反应生成的乙醛还不能直接使用,必须通过另一步反应——Esterification——才能最终生成乙酸乙酯。
Esterification是一种特殊的加成反应,它是将一个有机物中的一个原子与一个无机物中的原子形成一个新的C-O-C-H键的过程。
.制取乙酸乙酯的要点归纳乙酸的酯化反应制乙酸乙酯的方程式:CH3COOH + CH3CH2OH === CH3COOC2H5 + H2O(此反应为可逆反应、需加热、浓硫酸作催化剂、吸水剂)关于药品加入的几种顺序的解释:第一种:先加入乙酸后缓慢加入浓硫酸,并不断搅拌。
再加入乙醇。
这个方法的好处是可以减少乙醇的挥发。
但由于乙酸中加入浓硫酸后放热,使乙酸产生挥发而损失原料,从工业角度的“最低廉成本制取最大量产物”的原则考虑,乙酸较乙醇贵,所以这个方法可行但一般不取用。
第二种:先加入乙酸和乙醇,之后再缓慢加入浓硫酸,并不断搅拌。
这个方法比上面一个安全。
但同样会造成原料挥发而产生损失。
如果对比起来,第二种方法优于第一种方法。
第三种:最佳的药品加入的顺序:先加乙醇→再加浓硫酸→最后加乙酸→然后加热原因解释:酯化反应是一个可逆反应。
为了提高酯的产量,必须尽量使反应向有利于生成酯的方向进行。
一般是使反应物酸和醇中的一种过量。
在工业生产中,究竟使哪种过量为好,一般视原料是否易得、价格是否便宜以及是否容易回收等具体情况而定。
而在实验室里一般采用乙醇过量的办法,乙醇的质量分数要高,如能用无水乙醇代替质量分数为95%的乙醇效果会更好。
催化作用使用的浓硫酸量很少,一般只要使硫酸的质量达到乙醇质量的3%就可完成催化作用,但为了能除去反应中生成的水,应使浓硫酸的用量再稍多一些。
由于浓硫酸的密度比乙醇和醋酸和密度都要大。
浓硫酸与乙醇混合后会放出大量的热。
若先加浓硫酸,由于乙醇的密度小,加入后会浮在液体表面,导致在表面放热,使表面的液体沸腾、溅出,很危险。
此种方法当然也会造成乙醇挥发损失,但前面说过,乙醇相对乙酸便宜。
所以冰醋酸放到最后加。
注意事项:1、制备乙酸乙酯时反应温度不宜过高,要保持在60 ℃~70 ℃左右,温度过高时会产生乙醚和亚硫酸等杂质。
液体加热至沸腾后,应改用小火加热。
事先可在试管中加入几片碎瓷片,以防止液体暴沸。
年产30万吨乙酸乙酯的工艺设计摘要乙酸乙酯是重要的精细化工原料。
它是一种具有优异溶解性能和快干性能的溶剂,已广泛应用于生产中。
目前,乙酸乙酯的工业生产方法已趋于成熟,而乙醛缩合法因其具有原料来源广泛、绿色、环保等优点在众多生产方法中脱颖而出最具发展前景。
本设计采用乙醛缩合法,对工艺中的主要设备进行物料与能量衡算,并对乙酸乙酯的精馏塔、反应器进行了设计选型。
根据设计要求对设备进行选型。
就脱乙醇塔而言,塔体压力为常压,回流比取3,操作条件:X D=99%、X W=0.01。
计算出塔板数为46块,塔高22.4m。
对塔体的主要尺寸设计:精馏段:算得堰长为0.72m,出口堰高为0.045m,堰宽为0.106m,降液管底隙高度为0.028m;提馏段:算得堰长为1.2,出口堰高为0.049m,堰宽为0.176m,降液管底隙高度为0.027m。
对于反应器选择连续型搅拌反应釜:算得筒体高度4.8m,筒体和封头直径3m,内筒筒体厚度为10mm。
设计中,首先根据工艺操作的要求和特点,参照相关工艺的资料,绘制工艺流程图,然后根据工艺计算结构设计的最终数据画出主要设备图。
设计满足安全生产要求,而且经济合理。
关键词:乙酸乙酯,乙醛缩合法,物料衡算,精馏塔,工艺流程图PRODUCTION DESIGN WITH AN ANNUALOUTPUT OF 300 THOUSANDS TONS OFETHYL ACETATEABSTRACTEthyl acetate is an important fine chemical raw material. It is a kind of excellent solubility and fast-drying solvent, has been widely used in production. At present, the industrial production of ethyl acetate have been more and more mature, and the condensation of acetaldehyde because of its wide raw material sources, green, environmental protection and other advantages stand out from many production methods in the most development prospect.The condensation of acetaldehyde had been used in the design, material and energy balance calculation of the main process equipment, and distillation tower, reactor for ethyl acetate were design selection. According to the design requirements, we selected the suitable equipment. As far as alcohol tower, the tower body was at atmospheric pressure, reflux ratio was 3, the operating conditions: X D=99%, X W=0.01. We could calculate that the plate number was 46, the height of the tower was 22.4m. The main dimensions design of tower body: rectifying section: the length of the weir was 0.72m, the outlet height of the weir was 0.045m, the width was 0.106m, the down comer height of the bottom clearance was 0.028m; stripping section: the length of weir was 1.2mr, the outlet height of the weir was 0.049m, the width was 0.176m, the down comer height of the bottom clearance was 0.027m. The reactor was selected continuous stirred tank reactor: the height of cylinder was 4.8m by calculation, the diameter of cylinder and head was 3m, the thickness of the inner cylinder was 10mm. In the design, according to the process requirements and characteristics, reference to the related process data, wecould draw a process flow diagram, then according to the process of structure design and calculation of the final data to draw the main equipment. The design satisfied the requirement of safe production, and reasonable in economy.KEY WORDS: ethyl acetate, acetaldehyde, material balance, distillation, process flow diagram符号说明符号意义单位A 传热面积m2弓形降液管面积m2Af塔截面积m2ATC 气体负荷系数m/s定压比热容kJ/(kg·℃) CPD 精馏塔直径md阀孔直径m 0E 液流收缩系数全塔效率ETe雾沫夹带量kg液/kg气vF 原料液流量kmol/hH 塔高m塔底空间高度mHBH塔顶空间高度m D降液管内清液层高度mHd进料板处高度mHF干板阻力m液柱hc板上充气液层阻力m液柱hl气相通过浮阀塔板的压降m液柱hph w出口堰高mh o w堰上液层高度mK0传热系数W/(m2·℃) L 精馏塔液相流量kmol/hl w堰长mM A A物质的分子量N 实际塔板数块P 操作压力KPaΔP p单层塔板压降Pat 物料温度℃t∆平均温度差℃mu 速度m/s V 精馏塔气相流量kmol/h W d弓形降液管宽度m Ws 破沫区宽度mx馏出液中易挥发组分摩尔分数dx原料液中易挥发组分摩尔分数fx釜残液中易挥发组分摩尔分数Wα相对挥发度θ液体在降液管中停留时间sρL液相密度kg/m3ρv气相密度kg/m3t 孔心距mμl粘度Pa s⋅目录摘要 (I)前言 (9)第1章工艺流程的确定 (16)§1.1 本课题设计的内容和要求 (16)§1.1.1 设计要求 (16)§1.1.2 具体设计内容 (16)§1.2 设计方案的确定 (16)§1.2.1 设计原理 (17)§1.2.2 工艺流程 (18)第2章物料衡算 (20)§2.1 数据采集 (20)§2.1.1 全流程的工艺数据 (20)§2.1.2 催化剂的配方 (20)§2.1.3 操作条件 (20)§2.1.4 原料和产品的控制指标 (21)§2.2 一步缩合反应釜的物料衡算 (22)§2.3 二步缩合反应釜的物料衡算 (23)§2.4 单效蒸发器的物料衡算 (24)§2.5 脱乙醛塔的物料衡算 (26)§2.6 脱乙醇塔的物料衡算 (27)§2.7 脱重组分塔物料衡算 (28)第3章热量衡算 (30)§3.1 基本数据 (30)§3.2 一步缩合反应釜的热量衡算 (31)§3.3 二步缩合釜热量衡算 (32)§3.4 单效蒸发器的热量衡算 (32)§3.5 冷凝器的热量衡算 (34)§3.6 脱乙醛塔的热量衡算 (35)§3.6.1 再沸器的热负荷 (35)§3.6.2 冷凝器的冷凝量 (36)§3.7 脱乙醇塔的热量衡算 (36)§3.7.1 再沸器的热负荷 (36)§3.7.2 冷凝器的冷凝量 (37)§3.8 脱重组分精馏塔的热量衡算 (37)§3.8.1 再沸器的热负荷 (37)§3.8.2 冷凝器的冷凝量 (38)第4章设备选型及车间布置经济核算 (39)§4.1 缩合釜的设计 (39)§4.1.1 缩合釜体的设计 (39)§4.1.2 搅拌装置的设计 (41)§4.2 单效蒸发器的设计与选型 (42)§4.2.1 蒸发器的选择理由 (42)§4.2.2 蒸发器计算与设计 (42)§4.3 脱乙醛塔的设计与计算 (44)§4.3.1 基础数据 (45)§4.3.2 塔径的确定 (48)§4.3.3 塔板结构设计 (49)§4.3.4 塔板布置 (51)§4.3.5 流体力学验算 (52)§4.3.6 塔高的确定 (54)§4.4 脱乙醇塔的设计 (55)§4.4.1 基础数据 (55)§4.4.2 塔径的确定 (59)§4.4.3 塔板结构设计 (60)§4.4.4 塔板布置 (61)§4.4.5 流体力学验算 (63)§4.4.6 塔高的确定 (65)§4.5 脱重组分塔的选型与计算 (66)§4.5.1 相关计算 (66)§4.5.2 塔体结构 (67)§4.6 辅助设备的选型 (68)§4.6.1 泵的选型 (68)§4.6.2 再沸器的选型 (68)§4.6.3 冷凝器选型 (69)§4.6.4 工艺设备一览表 (69)§4.7 车间布置的基本原则和要求 (70)§4.7.1 车间布置的基本原则 (70)§4.7.2 车间布置的要求 (71)§4.8 本设计的生产车间布置 (74)§4.9 建设项目投资 (74)§4.9.1固定资产投资估算 (75)§4.9.2 建设期贷款利息 (75)§4.9.3 流动资金估算 (75)§4.10 生产成本估算 (76)§4.10.1 直接材料费 (76)§4.10.2 生产人员工资及福利 (76)§4.10.3 制造费用 (76)§4.11 经济效益 (77)§4.12 投资回收年限 (78)§4.13 核算总结 (78)第5章总结 (79)§5.1 乙酸乙酯的生产流程 (79)§5.2 生产设备设计 (79)参考文献 (80)致谢 (82)附录 (83)外文资料译文及原文 (84)前言乙酸乙酯(EA),又名醋酸乙酯,英文名称:Ethyl acetate。
乙酸乙酯的制备装置一、引言乙酸乙酯是一种常用的有机溶剂,广泛应用于涂料、油墨、胶水等领域。
其制备方法有很多种,其中较为常见的是酯化反应法。
本文将介绍乙酸乙酯的制备装置及其工艺流程。
二、工艺流程1. 原料准备:将乙酸和乙醇按照一定比例配制好,并将其过滤除杂质。
2. 反应釜加热:将反应釜加热至适当温度,通入惰性气体保护反应物。
3. 加入催化剂:将硫酸或者盐酸等催化剂加入反应釜中。
4. 加入原料:将预先配制好的乙酸和乙醇缓慢地加入反应釜中。
5. 反应结束:观察到反应结束后,停止加热并冷却。
6. 分离产物:分离出产生的乙酸乙酯并进行后续处理。
三、制备装置1. 反应釜反应釜是整个制备过程中最关键的设备之一。
它通常由不锈钢制成,具有耐腐蚀、耐高温等特点。
反应釜内部还配有搅拌器,以保证反应物能够充分混合并加速反应速率。
同时,反应釜还需要配备加热系统和冷却系统,以控制反应温度。
2. 催化剂添加系统催化剂是酯化反应中必不可少的一环。
在制备乙酸乙酯过程中,通常使用硫酸作为催化剂。
因此,需要配备一套催化剂添加系统,在适当的时候向反应釜中加入催化剂。
3. 加料系统在制备乙酸乙酯过程中,需要将预先配制好的乙酸和乙醇缓慢地加入到反应釜中。
因此,需要配备一个精准的加料系统,并且要能够控制加料速度和时间。
4. 分离设备在反应结束后,需要将产生的乙酸乙酯从反应物中分离出来,并进行后续处理。
这个过程通常使用蒸馏法进行分离。
因此,需要配备一个蒸馏塔或者其他分离设备。
四、安全注意事项1. 在加热过程中,要注意控制温度,避免反应釜内的温度过高导致爆炸等事故。
2. 在添加催化剂时,要注意催化剂的浓度和用量,避免过量使用导致反应不受控制。
3. 在加料过程中,要注意加料速度和时间,并且要保证反应釜内的压力不会超过设备承受范围。
4. 在分离产物时,要注意蒸馏塔内部的压力和温度,并且要做好防爆措施。
五、总结乙酸乙酯是一种重要的有机溶剂,在工业生产中有广泛应用。
乙酸乙酯的工业生产方法乙酸乙酯(EA)又名醋酸乙酯,是醋酸的种重要的下游产品,具有优异的溶解性、快干性,在工业中主要用作生产涂料(油漆和瓷漆)、粘合剂、乙基纤维素、人造革、油毡着色剂以及人造纤维等的溶剂,也可作为粘合剂用于印刷油墨、人造珍珠等的生产,作为捉取剂用于医药、有机酸的产品的生产等•,此外还可用作生产渡萝、香蕉、◎莓等水果香精和威士忌、奶油等香料的原料,用途十分广泛,发展前景看好。
目前,乙酸乙酯的工业生产方法主要有醋酸酯化法、乙醛缩合法、乙醇脱氢法和醋酸/乙烯加成法4种。
传统的醋酸酯化法工艺在国外彼逐步淘汰,而人规模生产装置主要采用乙醛缩合•法、乙醇脱氢法和醋酸/乙烯加成法,其中新建装置多采用醋酸/乙烯加成法,我国的乙酸乙酯则主要采用醋酸酯化法进行生产。
1醋酸酯化法醋酸酯化法是乙酸乙酯最常见的生产方法,是在催化剂(通常为硫酸)存在下,醋酸和乙醇发生酯化反应生成乙酸乙酯,该方法适用于拥有人量低成本乙醇的地区。
传统的酯化法生产匚艺技术成熟,原料供应充足,生产工艺简单,投资少,在世界范圉内,尤其是在美国和西欧地区被广泛采用。
由于酯化反应可逆,转化率只有约67%,为增加转化率,•般釆用乙醇过量的方法,并在反应过程中不断分离出生成的水。
根据生产需要,既可采取间歇生产,也可采取连续式生产。
该法存在反应温度高,乙酸利用率低,易发生副反应,产品处理困难、催化剂对设备腐蚀性强, 废液污染环境以及生产成本高等缺点。
而对传统醋酸酯化法工艺以浓硫酸为催化剂的诸多问题,新近研究开发匚作主要集中在对催化剂和生产工艺的改进上。
主要有分了•筛合成法、杂多酸合成法、联产法以及催化精憎法等。
1. 1分子筛法分了•筛合成法主要是指以分了筛,可固载的催化剂等作催化剂的合成方法。
此种工艺是将催化剂经过特殊处理,固载到某种团体物质上,制成人小均匀有-定粒度的颗粒,然后填装到特制的反应器中。
此反应器下部是容器,起到加热物料的作用。
中部装催化剂,起到催化缩合的作用,上部是持僻段,起到分离产品的作用。
工艺过程为:用耐酸泵将配好的物料(酸稍过量)输送到反应器下部,加热到150°C左右汽化,控制反应器中部反应温度在110-120C起缩合反应,反应混合物在精谓分离,未反应的物料返回到反应器下部继续反应。
精憎段的温度控制在75C左右,得到含酯量在94%以上的粗产品,若需要得到含酯量在98驰以上的产品,用无水硫酸镁干燥即可。
分了筛法具有工艺流程短、设备紧凑且少,生产连续化、产品得率高,产品成本低,设备腐蚀小,催化剂寿命长等优点,不足之处是反应器制作技术妥求高,设备制造费用人,物料需要加热到较高温度,热量损失大,且物料返回较多等。
1.2杂多酸合成法此种乙酸乙酯合成法包括使用多元固体酸直接催化的生产方法。
此种匸艺是将预先制好的杂多酸催化剂加入到反应物料中起催化作用。
工艺过程为:用耐酸泵将配好的反应物料(酸稍过量)输送到缩合釜,加入催化剂升温到120-1309进行缩合反应,产品混合物人精係塔进行分离,精谓塔温度控制在70C左右,得到含酯虽在95喘左右的粗产品,再用无水硫酸镁进行干燥脱水处理可得到含量98%以上的产品,未反应的物料返回到缩合釜循环使用。
杂多酸合成法具有设备技术要求不高,制造费用低,操作简单,物料反应较完全,产品得率较高,缩合温度较'低,热能耗低,设备腐蚀小,缺点是设备多,总投资费用人,工艺流程长,生产周期较长,催化剂需要特别制造技术,价格昂贵等。
1.3催化精憎法催化精僻法以固体酸为催化剂的连续催化精谓法,属非均相反应精馆过程,是酯化反应的发展力向,与以浓硫酸为催化剂的间歇搅拌式传统酯化生产工艺相比具有酯化连续进行,转化率高; 设备紧凑,占地面积小,设备生产能力人;副产品少,后处理简单,流程较短:催化剂可多次使用,再生后催化剂性能没有下降;不会与硫酸•样沾染反应物,产物纯度高,色泽浅;三废扌IE放少,产品质量较高等优点。
近年来,催化精傭的研丸由20世纪80年代的纯匸艺开发向过程共同规律研究的方向发展,在应用基础研究、工程研究、匚艺开发与应用等方面都取得了可喜的进展。
但由于催化精谓的复杂性,许多问题还有待进•步深入研究。
各种催化精谓结构下的传质传热、塔内流体力学、伴有反应体系汽液平衡的实验测:定等都十分空缺。
过程动态模拟还很不成熟, 全速率动态模拟报道不多。
塔的设计及过程集成刚刚起步,开发通用的动力学控制条件下的设计方法是当务之急。
催化持傑过程控制方面的研究还几乎为空白。
另外催化剂热稳定性及使用寿命方面还需进-步提高。
我国在20世纪90年代初期就对用固体酸作酯化催化剂的催化精谓法进行了研究。
1995年, 广西化工研究院就以酒精和冰醋酸为原料,采用固体酸催化剂,通过连续催化精镭-萃取的匸艺合成了乙酸乙酯。
该工艺与传统酯化工艺相比,具有设备生产能力强、能耗低等特点。
长春工业人学化工学院的研究人员以自制的填料型SO,27A12O3-A1和S0,:7Zr0:-Al;0-Al固体酸为催化剂,在宜径30mm的不锈钢催化精谓塔中进行乙酸乙酯的合成研究,考察了回流比、进料酸醇摩尔比、进料流量等操作参数对反应和分离过程的影响。
结果农明,适宜的操作条件为: 回流比为3,酸醇摩尔比为5,乙醇进料流虽为1 mol/h o所制备的S0.27Zr0:-Al:03-A 1和SO.27A1A-A 1固体酸催化剂在催化精谓塔中显示出较好的反应特性,并且前者的催化活性略高于后者的催化活性。
北京服装学院材料科学与工程学院研究人员在高度2000mm、直径30mm的催化精谓塔中进行了以H卩沸石做催化剂,乙酸和乙醇直接合成乙酸乙酯的研究。
对理论塔板进行了计算,考察了装填方式、进料位置、回流比、酸醇比、乙醇进料空速等对酯化反应过程的影响,得到适宜的工艺条件为:乙酸从第2块理论板进料,乙醇从第13块理论板进料;塔内各段填料的装填高度比为精谓段:反应段:提憎段=5: 3: 1:乙醇进料质量空速为0.62:乙酸/乙醇侧线进料物质的量比3: 1,回流比R=l,反应6h后塔顶得到的乙酸乙酯质量分数85. 06%,酯总收率达到77%。
大连工业人学化匚与材料学院研究人员研究了1-己基毗唉氟硼酸盐离了•液体的合成及衣征,并利用1-己基毗唳氟硼酸盐离/液体作溶剂和催化剂,通过酯化反应在反应箱镭装置中合成乙酸乙酯。
考察了回流比、进料比及离(液体用量对反应精谓的影响,并考察了离了液体的重复使用性能。
结果农明,该离J'•液体为Lewis酸,具有催化濟性,将其用于酯化反应,可使选择性得到显著的提高,离/液体重复使用5次,其催化沾性基本不变。
适宜的反应条件(进料比)为: n(乙酸):n(乙醇)=1.1:1.0,离子液体用量为n(乙酸):n(离子液体)=8. 0: 1.0,回流比为3.0。
另外,由于1-己基毗旋氟硼酸盐离了液体几乎没有蒸汽压,所以不会因为挥发而造成对环境的污染,同时它对设备也没有腐蚀。
所以以1 -己基毗旋氟硼酸盐离/液体作为溶剂和催化剂,在催化反应精谓装置中合成乙酸乙酯,可以减少对设备的腐蚀和环境的污染。
1.4联产法BP公司开发的乙酸乙酯/醋酸丁酯联产工艺(又名切换法)与传统的酯化匸艺原理完全相同,只是工艺流程有所改进。
原料乙醇、正丁醇和醋酸进入反应塔反应得到含有酸酸乙酯和醋酸丁酯的混合物流。
反应产物进入•级分谓塔分离出含有乙酸乙酯、醋酸丁酯和水及少量未反应乙醇和低沸点组分而不含正丁醇的塔顶物流。
物流进入二级分傑塔之前先通过倾析分离出水分,在二级分谓塔反应剩余的乙醇和生成的低沸点组分从塔顶分出,不含未反应的醇类和低沸点组分的粗酯产品从塔底引出,进人三级分傑塔,从三级分谓塔塔顶得到乙酸乙酯,而从塔底得到醋酸正丁酯。
如果进三级分离塔的物流中仍含有•定量的丁醇,还需要增加四级分傑塔将其分僻岀来。
联产法工艺与传统酯化法工艺相比,可延长开工时间,降低投资和操作费用,其显著特点是灵洁性强, 乙酸乙酯和醋酸丁酯的产量可根据市场需求灵活调整。
从而可以降低投资成本和操作成本。
以前建设的酯化法乙酸乙酯装置或醋酸丁酯装置都可以投入少量资金改造为切换法。
但工艺仍存在硫酸酯化法的固有缺点,即腐蚀严重,副反应多、副产物处理困难等。
2乙醛缩合法乙醛缩合制乙酸乙酯工艺由俄罗斯化学家Tisehenko于20世纪初开发成功,因而该工艺又称为Tisehenko工艺。
缩合法在催化剂乙醇铝的存在下,乙醛氧化缩合生成乙酸乙酯。
采用该丄艺时,如果反应过程中有2种醛存在,则可以生产出混合酯类,如乙酸乙酯和醋酸丁酯。
由乙醛生产乙酸乙酯包括催化剂制备、反应、分离和精係4人部分。
在氯化铝和少量的氯化锌存在下将铝粉加入盛有乙醇和乙酸乙酯混合物的溶液中溶解得到乙氧基铝溶液。
催化剂制备装置与主体装置分开,制备反应过程产生的含氢废气经冷冻回收冷凝物后排放,制备得到的催化剂溶液搅拌均匀后备用。
乙酸和催化剂溶液连续进入反应塔,控制反应物的比例,使进料在混合时就有约98% 的乙醛转化为目的产物,1.5%的乙醛在此后的搅拌条件下转化。
通过间接盐水冷却维持反应温度在0°C,反应混合物在反应塔内的停留时间约1小时后进入分离装置。
分离装置中粗乙酸乙酯从塔顶蒸出,塔底残渣用水混合得到乙醇和氢氧化铝,将乙醇与蒸出组分•起送入精係塔,在此回收未反应的乙醛并将其返回反应塔,乙醇和乙酸乙酯恒沸物用于制备乙氧基铝催化剂溶液。
如有必要,乙酸乙酯还可进一步进行干燥由乙醛生产酸酸乙酯的第•步实际上先由乙烯制取乙醛,由乙烯生产乙醛通常在氯化耙存在下于液和中进行(即Waeker X艺)。
根据保持催化剂活性方法的不同,又有两种工艺可选择,•种为•步法工艺,即乙醛和氧气•起进入反应器进行反应;另•种是两步法工艺,即乙烯氧化为乙醛在•个反应器内进行,而催化剂的空气再生在另•反应器内进行,两种匸艺在经济上并无人的差异。
该工艺在常压低温下(0-20°C)进行,反应条件温和,反应转化率和收率都比较高,对设备要求不高,生产成本较醋酸酯化法低,缺点是受原料来源的限制,只有在乙醛价格处于低位时才具有竞争力。
因此该装置•般应建在乙烯-乙醛联合装置内。
日本主要釆取此工艺路线,装置能力已达20万吨/年。
另外,催化剂乙醇铝通过加水生成氢氧化铝排放而无法回收,直接排放将会污染环境。
黑龙江省科学院石油化学研究分院开发了以乙醛为原料,在醇铝催化剂作用下,经•步缩合生产乙酸乙酯的工艺,缩合反应结束后反应液中残存的催化剂加水分解破坏。
缩合反应的选择性和乙醛的转化率均达到99%以上。
上海石油化工公司于2001年2月采用该技术建成•套277 吨/年工业生产装:置。
另外中石化南化公司研究院也开发了乙醛缩合匚艺,并且具备匸业化的条件,综合技术经济指标已经达到国外同类技术水平。