实验七血红蛋白
- 格式:doc
- 大小:20.00 KB
- 文档页数:3

血红蛋白的凝胶过滤植物098 原硕0901080808摘要:用凝胶过滤分离血红蛋白样品,理解凝胶过滤原理,熟悉凝胶过滤操作方法。
关键字:血红蛋白,凝胶过滤一、研究背景及目的:凝胶过滤(gel [filtration] chromatography ; gel filtration chromatography ; GFC)作为一种常用的分离过滤方法,是实验中的常用手段之一,具有它的突出优点是层析所用的凝胶属于惰性载体,不带电荷,吸附力弱,操作条件比较温和,可在相当广的温度范围下进行,不需要有机溶剂,并且对分离成分理化性质的保持有独到之处。
对于高分子物质有很好的分离效果等优点。
在很多方面都有所应用:⑴脱盐:高分子(如蛋白质、核酸、多糖等)溶液中的低分子量杂质,可以用凝胶层析法除去,这一操作称为脱盐。
本法脱盐操作简便、快速、蛋白质和酶类等在脱盐过程中不易变性。
适用的凝胶为SephadexG-10、15、25或Bio-Gel-p-2、4、6.柱长与直径之比为5-15,样品体积可达柱床体积的25%-30%,为了防止蛋白质脱盐后溶解度降低会形成沉淀吸附于柱上,一般用醋酸铵等挥发性盐类缓冲液使层析柱平衡,然后加入样品,再用同样缓冲液洗脱,收集的洗脱液用冷冻干燥法除去挥发性盐类。
⑵用于分离提纯:凝胶层析法已广泛用于酶、蛋白质、氨基酸、多糖、激素、生物碱等物质的分离提纯。
凝胶对热原有较强的吸附力,可用来去除无离子水中的致热原制备注射用水。
⑶测定高分子物质的分子量:用一系列已知分子量的标准品放入同一凝胶柱内,在同一条件下层析,记录每一分钟成分的洗脱体积,并以洗脱体积对分子量的对数作图,在一定分子量范围内可得一直线,即分子量的标准曲线。
测定未知物质的分子量时,可将此样品加在测定了标准曲线的凝胶柱内洗肿后,根据物质的洗脱体积,在标准曲线上查出它的分子量。
⑷高分子溶液的浓缩:通常将SephadexG-25或50干胶投入到稀的高分子溶液中,这时水分和低分子量的物质就会进入凝胶粒子内部的孔隙中,而高分子物质则排阻在凝胶颗粒之外,再经离心或过滤,将溶胀的凝胶分离出去,就得到了浓缩的高分子溶液所以理解其原理及应用方法也是很重要的,本实验通对血红蛋白采用凝胶过滤,理解凝胶过滤的基本原理,熟悉和掌握凝胶过滤的基本操作技术。

一血红蛋白的提取和分离实验的方法:1:实验材料,仪器,试剂及试剂的配制(1)实验材料:新鲜的鸡血(2)实验仪器:离心机,烧杯(100ml),胶头滴管,玻璃棒,离心管架,漏斗,纱布等。
(3)实验试剂:饱和(NH4)2SO4溶液(PH=6.0~7.0),柠檬酸钠溶液,生理盐水,蒸馏水。
(4)试剂的配制:1. 饱和(NH4)2SO4溶液的配制:100ml蒸馏水中溶解76g(NH4)2SO4,用氨水滴PH值至6.5左右;2.生理盐水的配制:取9gNaCl溶于1000ml蒸馏水中。
3.柠檬酸钠溶液的配制:6g柠檬酸钠溶于100ml生理盐水中(可收集100ml鸡血)。
2:实验步骤:(1)收集并清洗鸡血:用盛有柠檬酸钠溶液的烧杯装新鲜的鸡血(防止鸡血凝固),然后将鸡血用300ml生理盐水稀释,充分搅拌后转移到50ml离心管中,离心(V=5000rpm)5min(此步可除去血清蛋白)。
(2)破碎鸡血细胞:小心倒掉上清,下层细胞加入50ml的蒸馏水,剧烈震荡10min,离心(V=5000rpm)10min.。
取上清溶液,即血红蛋白的溶液,用多层纱布过滤。
(3)盐析分离血红蛋白:向滤液中逐渐加入(NH4)2SO4饱和溶液,边加边摇,约加入与血红蛋白溶液相同体积时,溶液出现浑浊。
静止20min,离心10min(v=5000rpm).。
红色沉淀就是分离出来的血红蛋白。
血红蛋白溶液通过盐析并离心后得到红色沉淀,此时上清溶液基本无色,表明该沉淀就是我们分离得到的血红蛋白,无需用其他方式进行验证。
下面就几点进行讨论;1我们购买鸡血时,为了防止鸡血凝固,把鸡血收集到事先准备好的盛有柠檬酸钠溶液的瓶子里,可以放置一白天,若要过夜,温度须控制在4摄氏度。
2我们用蒸馏水使细胞涨破而不用甲苯(有毒),既简单又安全,同时还可以将血红蛋白溶液进行稀释。
3用盐析法进行蛋白质分离试验,比通过色谱柱,减少了实验难度,降低了试验成本,缩短的试验时间。
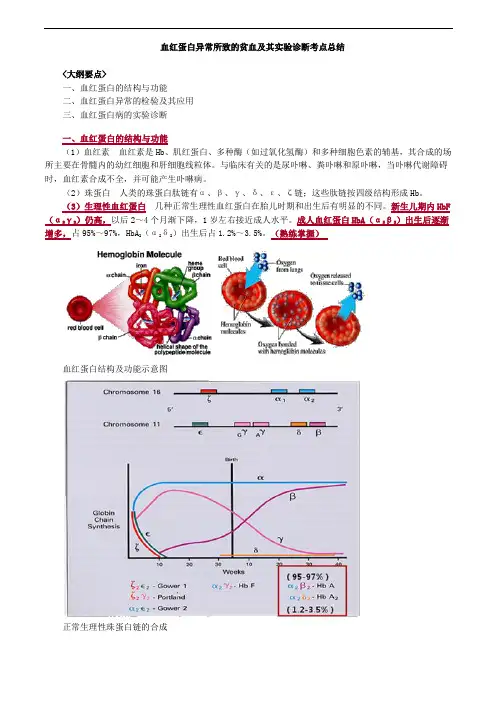
血红蛋白异常所致的贫血及其实验诊断考点总结<大纲要点>一、血红蛋白的结构与功能二、血红蛋白异常的检验及其应用三、血红蛋白病的实验诊断一、血红蛋白的结构与功能(1)血红素血红素是Hb、肌红蛋白、多种酶(如过氧化氢酶)和多种细胞色素的辅基,其合成的场所主要在骨髓内的幼红细胞和肝细胞线粒体。
与临床有关的是尿卟啉、粪卟啉和原卟啉,当卟啉代谢障碍时,血红素合成不全,并可能产生卟啉病。
(2)珠蛋白人类的珠蛋白肽链有α、β、γ、δ、ε、ζ链;这些肽链按四级结构形成Hb。
(3)生理性血红蛋白几种正常生理性血红蛋白在胎儿时期和出生后有明显的不同。
新生儿期内HbF (α2γ2)仍高,以后2~4个月渐下降,1岁左右接近成人水平。
成人血红蛋白HbA(α2β2)出生后逐渐增多,占95%~97%,HbA2(α2δ2)出生后占1.2%~3.5%。
(熟练掌握)血红蛋白结构及功能示意图正常生理性珠蛋白链的合成二、血红蛋白异常的检验及其应用1.血红蛋白电泳(原理了解,其余掌握)2.抗碱血红蛋白测定(熟练掌握)3.异丙醇沉淀试验(掌握)4.红细胞包涵体试验(掌握)5.HbA2测定(熟练掌握)6.珠蛋白肽链分析(掌握)7.红细胞镰变试验(掌握)1.血红蛋白电泳原理:根据不同的血红蛋白带有不同的电荷,等电点不同,在一定的pH缓冲液中,缓冲液的pH大于Hb的等电点时其带负电荷,电泳时在电场中向阳极泳动,反之,Hb带正电荷向阴极泳动。
经一定电压和时间的电泳,不同的血红蛋白所带电荷不同、相对分子质量不同,其泳动方向和速度不同,可分离出各自的区带,同时对电泳出的各区带进行电泳扫描,可进行各种血红蛋白的定量分析。
参考值:pH8.6TEB缓冲液醋酸纤维膜电泳,正常血红蛋白电泳区带:HbA>95%、HbF<2%、HbA2为1.0%~3.1%。
pH8.6TEB缓冲液适合于检出HbA、HbA2、HbS、HbC,但HbF不易与HbA分开,HbH与HbBarts不能分开和显示,应再选择其他缓冲液进行电泳分离。

实验汇报实验名称:血红蛋白电泳项目名称:两种碱性血红蛋白样品处理方法的电泳结果实验时间:2018年9月17日实验室:龙泉驿区妇幼保健院检验科实验人员:杨松报告单位:成都温伦科技有限公司一、实验目的:1、掌握生理盐水处理血红蛋白样品的方法2、掌握四氯化碳处理血红蛋白样品的方法3、掌握电泳仪实验的操作4、分析两种碱性血红蛋白样品处理方法电泳结果的不同二、实验原理:血红蛋白电泳就是利用在电场的作用下, 由于待分离样品中各种分子带电性质以及分子本身大小, 形状等性质的差异, 使带电分子产生不同的迁移速度, 从而对样品进行分离, 鉴定或提纯的技术,在临床检验中, 主要用于分离各类蛋白分子。
三、实验方法:琼脂糖电泳法四、实验器械:样品:10个EDTA抗凝管抽取的病人全血样品试剂:0.9%生理盐水500ml,四氯化碳500ml,界面液250ml,美国Helena Spife3000血红蛋白电泳检测试剂盒器材:移液枪,一次性移液枪头若干,EDTA抗凝管10个,玻璃试管10个设备:美国Helena Spife3000 全自动电泳仪五、实验步骤:1、取得医院检验科EDTA抗凝管抽取的病人全血样品10个,编号为1,2,3......10。
2、将1-10号十个个样品分别用移液枪取200ul到玻璃试管中,编号为1-1,2-1,3-1,.....10-1。
3、将1-10号10个样品进行生理盐水前处理,处理方法如下:-用0.9%生理盐水混匀,3500 rpm离心10分钟.-吸走弃去清液。
-以上步骤连续进行三次。
-完全吸走弃去上清液。
-20ul制作后的样本+80ul溶血素,混匀。
-取溶血后的样本17ul加入样品孔。
4、将1-1到10-1号10个样品进行四氯化碳前处理,处理方法如下:-用0.9%生理盐水溶液5000μL与样品混合。
-3000rpm离心5分钟。
-弃去上清液,只留下红细胞。
-加入200ul 蒸馏水溶解红细胞。
-加入300ul 的四氯化碳,混合均匀,3000rpm离心5分钟。

血红蛋白测定实验一、实验目的与任务了解XF—1B型(或Hb—2000型)血红蛋白仪的使用方法,掌握血红蛋白的测定技术。
有训练运动员在较好训练效果的影响下血红蛋白正常值高于正常成年人,因此,血红蛋白的测定是评定训练效果的重要指标。
二、原理测定血红蛋白的方法很多,常见的有直接比色,光电比色法,沙利氏比色法(间接比色法)。
我们现在实验室用的是XF—1B型和Hb—2000型血红蛋白仪。
此仪器是采用氰化高铁法,应用光电比色的原理测定血红蛋白值的,其原理是:将全血样品20ul注入5ml氰化高铁血红蛋白稀释液内(亦称文—齐氏液),作251倍稀释,溶化红细胞释出血红蛋白。
稀释剂将血红蛋白先转变成高铁血红蛋白,再转化为氰化高铁血红蛋白。
然后,再用XF—1B 型(或Hb—2000型)Hb仪比色法直接测定显示浓度数,不需任何换算(每次测定只需5秒钟)。
三、实验器材XF—1B型和Hb—2000型血红蛋白仪、一次性血细胞吸管(刻度10~20ul)、采血针、75%酒精、消毒棉球、培养皿、烧杯、可调加液器、试管架、血红蛋白测定试剂(文—齐氏液)、氰化高铁血红蛋白标准液。
四、实验步骤1、插上电源,打开血红蛋白仪电源开关,按动进样开关,重复三次吸入蒸馏水,并通电预热20~30分钟。
观察显示是否为“零”。
(按出Hb仪器左下角“测试—定标”按键,使之处于“测试”状态。
)2、取试管一支,加入Hb测定试剂(文—齐氏液)5ml,放在试管架上备用。
3、采血、比色:先消毒,再用采血针在耳垂或无名指尖处采血,用干棉球擦去第一滴血,待第二滴血自然流出一大滴时,用血细胞吸管取血液20ul(注意:吸管内不可有气泡,否则需重新采血)。
擦去吸管外血液后,轻轻吹入测定管底部,并回吸数次洗净吸管,然后充分混合均匀。
待5分钟后,置Hb仪上比色。
4、记录:直接读数,记录下来。
Hb值通常以每100 ml血液中含Hb若干克来表示。
(g/ml)。
本仪器采用国际单位制(g/L),可直接显示Hb值(g/L)。

血红蛋白病实验室检查
……
我国北京、上海等大城市已建立先进的基因诊断技术,对多种遗传血液病如血友病,α海洋性贫血、β-海洋性贫血、异常血红蛋白病等成功地进行了基因诊断和产前基因诊断:
1.常用基因诊断方法为抽提全血、干纸片血、羊水细胞、绒毛细胞DNA作DNA点杂交,适用于诊断基因缺失的遗传病,如α海洋性贫血病人α珠蛋白基因不同程度的缺失。
2.限制性内切酶酶谱法,适用于诊断基因突变改变了限制酶切点或DNA缺失而改变酶解片段大小长短的遗传病。
3.限制性片段多态性分析(RFLP),RFLP按孟德尔方式遗传,如某种遗传病基因与特异的RFLP紧密相连,即可将这一多态片段作为"遗传标记",通过RFLP连锁分析推测该家庭成员和胎儿是否携带遗传病基因,RFLP连锁分析适用于诊断任何一种单基因遗传病。
4.寡核苷酸杂交是一种直接基因诊断技术,对于基因突变部位的碱基序列已查明的遗传病,均可以直接检测和鉴定其突变的基因。
5.聚合酶链反应(PCR)DNA体外扩增,此种高效DNA分析技术可以直接通过PCR产物的电泳分析进行基因诊断,适用于诊断基因缺失或部分DNA缺失所致的遗传病。
6.对非缺失型突变基因可结合限制酶切位点的改变,如与RFLP 位点相连锁,则可用限制酶消化PCR扩增产物,直接电泳分析,不需应用基因探针进行分子杂交,大大简化实验操作,使基因诊断可在半天内完成。


第1篇一、实验目的1. 观察红细胞的基本形态和结构。
2. 了解红细胞在血液中的功能。
3. 掌握使用显微镜观察红细胞的基本方法。
二、实验原理红细胞是血液中数量最多的血细胞,其主要功能是运输氧气和二氧化碳。
红细胞含有血红蛋白,这是一种含铁的蛋白质,能够在氧含量高的环境中与氧结合,在氧含量低的环境中释放氧。
通过显微镜观察红细胞,可以了解其形态、大小、颜色等特征。
三、实验材料与器材1. 实验材料:外周血或抗凝血(EDTA抗凝)。
2. 实验器材:显微镜、载玻片、盖玻片、微量吸管、改良Neubauer计数板、RBC 稀释液、生理盐水、75%乙醇、消毒棉签、载玻片、盖玻片。
四、实验步骤1. 制备血涂片- 取一小试管,加入2.0 ml RBC稀释液。
- 采血10μl,用消毒棉签擦去管外血液,轻轻吹入试管底部。
- 清洗吸管2~3次,立即混匀。
- 将混合后的血液充入计数室,静置3~5分钟。
2. 显微镜观察- 使用低倍镜找到红细胞计数区域,观察红细胞的形态、大小、颜色等特征。
- 使用高倍镜依次计数中央大方格内4角和正中5个中方格内的红细胞数。
3. 结果记录与分析- 记录观察到的红细胞数量、大小、形状等特征。
- 分析红细胞的正常形态和异常情况。
五、实验结果1. 红细胞数量:每升血液中红细胞数量约为4.5-5.5×10^12个。
2. 红细胞形态:呈双凹圆碟形,大小均匀,边缘光滑。
3. 红细胞颜色:呈红色。
六、实验讨论1. 红细胞是血液中数量最多的细胞,其主要功能是运输氧气和二氧化碳。
血红蛋白的存在使得红细胞能够与氧结合,在氧含量高的环境中释放氧,在氧含量低的环境中结合氧。
2. 观察到的红细胞数量、大小、形状等特征与正常红细胞一致,说明本次实验结果可靠。
3. 在实验过程中,应严格控制实验条件,避免因操作不当导致实验结果不准确。
七、实验结论1. 红细胞是血液中数量最多的细胞,其主要功能是运输氧气和二氧化碳。
2. 观察到的红细胞数量、大小、形状等特征与正常红细胞一致,说明本次实验结果可靠。

6.1 血红蛋白测定(氰化高铁法)消光系数法和标准曲线法任选其一测定血红蛋白。
1.6.1.1 光系数法1.6.1.1.1 原理血红蛋白(haemoglobin,Hb)被铁氰化钾氧化后生成高铁血红蛋白,再生氰离子结合形成氰化高铁血红蛋白(红色),氰化高铁血红蛋白(红色)极为稳定,在540nm波长下,毫克分子消光系数为44,据此,用分光光度法测其光密度,运用消光系数作血红蛋白的定量测定。
1.6.1.1.2 仪器721型或其它型号的分光光度比色计。
10微升量吸管。
1.6.1.1.3 试剂称取碳酸氢纳()140毫克\铁氰化钾200毫克、氰化钾50毫克,用水溶解并稀释到1000毫升。
贮存於棕色试剂瓶内,在暗处或冰箱(+4℃)保存,至少可稳定数月到一年。
1.6.1.1.4 实验步骤1.6.1.1.4.1 试剂2.5毫升於5毫升带盖试管中,加入10微升血液,混匀后,放置15分钟。
1.6.1.1.4.2 选用0.5厘米光径比色杯,于540nm波长下,以试剂调零点,将所得样品管之光密度乘以73.6,即为血红蛋白之浓度(克%)。
计算公式如下:Ct=待测的血红蛋白(克%)浓度。
D 540 = 氰化高铁血红蛋白在540nm波长下测出的光密度。
HICN251=测定时血液的稀释倍数(血10微升加入试剂2.5毫升中)44=氰化高铁血红蛋白的毫克分子消光系数0.5=比色杯的光径10000=将(毫克/升)换算成(克%)的数字1.6.1.1.5 注意事项1.6.1.1.5.1 试剂不要放在聚乙烯瓶内,以免因氰离子与其反应而使试剂作用降低。
1.6.1.1.5.2 仪器因mM消光系数法完全依靠仪器的吸光度来计算,故此法要求所用的仪器性能要符合要求(如仪器的波长准确与否,以及灵敏度及线性等),否则将直接影响测定的结果。
1.6.1.1.5.3仪器在使用前最好以WHO规定的氰化高铁血红蛋白参考液校正后再使用。
参考液最好选用ICSH9国际血液学标准化委员会)确定的由RIV(莅国立公共卫生研究院)制定的氰化高铁血红蛋白参考液或上海医学化验所制血的氰化高铁血红蛋白标准液。

一、实验目的1. 掌握鸡血红蛋白的提取方法。
2. 学习比色法测定血红蛋白含量的原理。
3. 培养实验操作技能,提高实验数据分析能力。
二、实验原理血红蛋白是一种红色含铁的蛋白质,存在于红细胞中,具有携带氧气和二氧化碳的功能。
本实验采用比色法测定鸡血红蛋白含量,其原理是基于血红蛋白在特定波长下具有特定的光吸收特性。
通过比较标准溶液和样品溶液的光吸收值,计算出样品中血红蛋白的含量。
三、实验材料与仪器1. 实验材料:新鲜鸡血、生理盐水、蒸馏水、95%乙醇、盐酸、氢氧化钠、邻苯二甲酸氢钾、邻苯二甲酸氢钾标准溶液等。
2. 实验仪器:分光光度计、电子天平、移液器、试管、烧杯、比色皿等。
四、实验步骤1. 鸡血红蛋白提取(1)取新鲜鸡血,用生理盐水洗涤红细胞,去除血浆。
(2)将洗涤后的红细胞放入烧杯中,加入95%乙醇,使红细胞充分膨胀。
(3)用玻璃棒搅拌,使红细胞破裂,释放出血红蛋白。
(4)将混合液过滤,去除细胞碎片和杂质。
2. 标准曲线绘制(1)取一系列干净试管,加入不同体积的邻苯二甲酸氢钾标准溶液,依次编号。
(2)向每个试管中加入蒸馏水,使总体积达到一定量。
(3)将混合液振荡均匀,使邻苯二甲酸氢钾充分溶解。
(4)用分光光度计测定每个试管的光吸收值,以邻苯二甲酸氢钾浓度为横坐标,光吸收值为纵坐标,绘制标准曲线。
3. 鸡血红蛋白含量测定(1)取一系列干净试管,分别加入不同体积的鸡血红蛋白提取液,依次编号。
(2)向每个试管中加入蒸馏水,使总体积达到一定量。
(3)用分光光度计测定每个试管的光吸收值。
(4)根据标准曲线,计算鸡血红蛋白含量。
五、实验结果与分析1. 标准曲线绘制通过绘制标准曲线,发现邻苯二甲酸氢钾浓度与光吸收值呈线性关系,相关系数R²为0.999。
2. 鸡血红蛋白含量测定根据标准曲线,计算出鸡血红蛋白含量为(以mg/mL计)。
六、实验结论通过本实验,成功提取了鸡血红蛋白,并利用比色法测定了其含量。

血红蛋白分析报告尊敬的先生/女士,感谢您选择本实验室进行血红蛋白分析。
根据您提供的样本,我们进行了详细的分析和测量,并将结果汇总如下。
1. 样本信息样本编号:[编号]样本类型:[全血/血清/血浆]采样日期:[日期]报告日期:[日期]2. 分析结果2.1 总血红蛋白浓度总血红蛋白浓度是衡量血液中总血红蛋白含量的指标。
根据本次分析,您的总血红蛋白浓度为[数值] g/dL。
2.2 血红蛋白比容值血红蛋白比容值是衡量血细胞中血红蛋白的含量的指标。
根据本次分析,您的血红蛋白比容值为[数值] %。
2.3 红细胞计数红细胞计数是衡量血液中红细胞数量的指标。
根据本次分析,您的红细胞计数为[数值] x 10^6/μL。
2.4 血红蛋白平均含量(Mean Corpuscular Hemoglobin,MCH)血红蛋白平均含量是衡量平均每个红细胞中血红蛋白含量的指标。
根据本次分析,您的血红蛋白平均含量为[数值] pg。
2.5 血红蛋白平均浓度(Mean Corpuscular Hemoglobin Concentration,MCHC)血红蛋白平均浓度是衡量红细胞中血红蛋白浓度的指标。
根据本次分析,您的血红蛋白平均浓度为[数值] g/dL。
2.6 红细胞平均体积(Mean Corpuscular Volume,MCV)红细胞平均体积是衡量平均每个红细胞体积的指标。
根据本次分析,您的红细胞平均体积为[数值] fL。
3. 结论与建议综合以上分析结果,我们得出以下结论与建议:- 您的总血红蛋白浓度和血红蛋白比容值在正常范围内,表示您的血液中的血红蛋白含量和红细胞生产状况良好。
- 您的红细胞计数符合正常范围,说明您的红细胞数量正常。
- 您的血红蛋白平均含量、血红蛋白平均浓度和红细胞平均体积也在正常范围内,反映了红细胞中的血红蛋白含量均匀合适。
鉴于以上分析结果,您目前的血红蛋白状况良好,无需特殊治疗或进一步检查。
然而,我们仍建议您保持良好的饮食和生活习惯,定期进行体检和血液检查以监测您的健康状况。
血红蛋白标准血红蛋白是人体内一种重要的蛋白质,它携带着氧气在全身循环。
血红蛋白标准是指血液中血红蛋白的含量符合正常范围的标准,对于人体健康至关重要。
本文将对血红蛋白标准进行详细介绍,以便更好地了解和关注自身健康。
血红蛋白标准的正常范围通常是指成年男性为130-175g/L,成年女性为120-160g/L。
血红蛋白含量的测定通常通过血液检测来进行,可以通过抽血在实验室中进行检验。
血红蛋白的正常范围是保证人体正常生理功能的重要指标之一,它直接关系到人体供氧能力和健康状况。
血红蛋白标准的测定通常需要考虑到年龄、性别、生理周期等因素。
儿童和青少年的血红蛋白标准值通常略高于成年人,而孕妇在怀孕期间由于胎儿的需求,血红蛋白标准值也会有所提高。
因此,在进行血红蛋白标准的测定时,需要考虑到个体的特殊情况,以便更准确地评估健康状况。
血红蛋白标准的异常值可能会提示一些疾病的存在。
比如,血红蛋白含量偏低可能是贫血的表现,贫血可能由于营养不良、慢性疾病、失血等原因引起。
而血红蛋白含量偏高可能是慢性肺部疾病、肾脏疾病等的表现。
因此,及时进行血红蛋白标准的检测,对于早期发现和治疗一些疾病具有重要意义。
保持良好的生活习惯对于维持血红蛋白标准也是非常重要的。
均衡的饮食、适量的运动、良好的作息习惯都能有助于维持正常的血红蛋白含量。
此外,定期进行体检,及时发现并治疗潜在的健康问题也是非常重要的。
总之,血红蛋白标准是人体健康的重要指标之一,它直接关系到人体供氧能力和健康状况。
了解血红蛋白标准的正常范围,及时进行检测和调整生活方式,对于维持健康至关重要。
希望本文能够帮助读者更好地了解和关注自身的健康,保持良好的血红蛋白标准,远离疾病的困扰。
专题五 DNA和蛋白质技术课题三血红蛋白的提取和分离一、学习目标1、会说出凝胶色谱法和电泳法分离生物大分子的原理。
(学习重点、难点)2、能写出血红蛋白提取和分离的步骤。
(学习重点)二、学法指导通过图片模型理解凝胶色谱法分离蛋白质的原理;通过观看视频来理解血红蛋白提取和分离的过程三、课前热身一、基础知识1.凝胶色谱法(1)概念:凝胶色谱法也称做分配色谱法,是根据____________的大小分离蛋白质的有效方法。
(2)原理:大多数凝胶是一些微小的________球体,内部有许多贯穿的通道,当____________不同的蛋白质通过凝胶时,________________的蛋白质容易进入凝胶内部的通道,路程________,移动速度较慢;而______________的蛋白质无法进入凝胶内部的通道,只能在凝胶外部移动,路程________,移动速度较快。
____________不同的蛋白质因此得以分离。
2.缓冲溶液(1)作用:在一定范围内,缓冲溶液能抵制外界的________对溶液pH的影响,维持pH基本不变。
(2)配制:通常由1~2种________溶解于水中配制而成。
调节________的使用比例就可以制得在不同pH范围内使用的缓冲液。
3.电泳(1)概念:是指_______粒子在电场的作用下发生_______的过程。
(2)原理:许多重要的生物大分子,如多肽、核酸等都具有可解离的基团,在一定的________下,这些基团会带上____________。
在电场的作用下,这些________分子会向着与其所带电荷________的电极移动。
电泳利用了待分离样品中各种分子________的差异以及________的大小、________不同,使带电分子产生不同的________,从而实现样品中各种分子的分离。
(3)常用的电泳方法:琼脂糖凝胶电泳和______________电泳。
二、实验操作蛋白质的提取和分离一般分为四步:________、粗分离、纯化和纯度鉴定。
一、实验目的1. 掌握变性血红蛋白检测的基本原理和方法。
2. 学习使用分光光度计进行定量分析。
3. 分析变性血红蛋白与正常血红蛋白的差异性,了解其生物学意义。
二、实验原理血红蛋白是红细胞中的一种含铁的蛋白质,主要负责氧气的运输。
在正常生理状态下,血红蛋白以氧合状态存在,呈红色。
当血红蛋白受到某些因素(如氧化剂、药物等)的作用时,会发生构象变化,导致其失去携带氧气的能力,形成变性血红蛋白。
本实验通过检测变性血红蛋白的吸光度,判断其含量,从而了解血红蛋白的变性程度。
三、实验材料1. 实验试剂:盐酸溶液、氰化钾溶液、蒸馏水、标准血红蛋白溶液、变性血红蛋白溶液。
2. 实验仪器:分光光度计、移液器、试管、试管架、烧杯等。
四、实验步骤1. 准备标准曲线:取一系列试管,分别加入不同浓度的标准血红蛋白溶液,然后加入一定量的盐酸溶液,充分混合。
以蒸馏水为空白对照,在540nm波长处测定吸光度,以血红蛋白浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
2. 样品处理:取一定量的变性血红蛋白溶液,加入适量盐酸溶液,充分混合。
3. 测定吸光度:以蒸馏水为空白对照,在540nm波长处测定变性血红蛋白溶液的吸光度。
4. 计算变性血红蛋白含量:根据标准曲线,计算样品中变性血红蛋白的含量。
五、实验结果与分析1. 标准曲线:绘制标准曲线后,发现吸光度与血红蛋白浓度呈线性关系,相关系数R²为0.999。
2. 变性血红蛋白含量:根据标准曲线,计算得出样品中变性血红蛋白的含量为X mg/mL。
3. 分析与讨论:(1)本实验结果表明,变性血红蛋白在540nm波长处的吸光度与其含量呈线性关系,说明分光光度法可用于检测变性血红蛋白的含量。
(2)通过本实验,我们了解到变性血红蛋白与正常血红蛋白在吸光度上存在差异,变性血红蛋白的吸光度较低,这与其失去携带氧气的能力有关。
(3)在临床医学中,变性血红蛋白的检测有助于诊断某些疾病,如高铁血红蛋白血症等。
7岁小孩血红蛋白正常值范围
对于七岁的小孩来说,血红蛋白的正常值范围通常在115-135g/L之间。
血红
蛋白是红细胞中的主要成分,对于维持人体正常的呼吸和新陈代谢起着重要的作用。
正常的血红蛋白浓度有利于帮助身体细胞获取足够的氧气,对于孩子的正常生长发育至关重要。
然而,正常值范围并不代表血红蛋白浓度在此范围中的任何一个数值都是健康的。
有一些环境因素,如营养不良、常见病、以及其他慢性疾病,都可能导致血红蛋白浓度的增加或减少。
若孩子的血红蛋白值低于正常范围,则可能会导致贫血,需要通过改善饮食和生活习惯来提高血红蛋白的浓度。
如果血红蛋白值过高,则可能导致一些健康问题,如血栓和心脏疾病的风险增加。
血红蛋白的正常值范围可以通过血液检查得出。
一般在医生的指引下完成血液检查。
血液检查通常包括全血细胞计数和血红蛋白检测两部分。
检查结果出来后,由医生解读并给出适当的健康建议。
如果孩子的血红蛋白浓度偏离正常值,医生
会建议家长采取相应的措施,比如改变饮食习惯和生活方式,或者在必要的时候进行药物治疗。
总的来说,七岁孩子的血红蛋白正常值范围为115-135g/L。
然而这个值并非绝对,其他因素如孩子的身体状况、环境因素等都可能影响到血红蛋白的浓度。
因此,家长应定期为孩子进行血液检查,并在必要时咨询专业医生的意见。
如有你有帮助,请购买下载,谢谢!
209页
实验七 脱辅基血红蛋白的制备和重组
一、实验目的
1. 了解生物化学中典型的血红蛋白的性质和结构以及结合在蛋白上的辅基的作用。
2. 学习一种生物无机生化科研中常用的为金属酶和蛋白质代换金属离子的方法。
3. 学习快速扫描分光光度计的使用及紫外可见吸收光谱的应用。
4. 学习柱层析和透析袋脱盐的方法。
二、实验原理
血红蛋白(Hemoglobin)是由二价铁Fe(Ⅱ)血红素作为辅基与多肽链结合组成的一种
结合蛋白,它是由四个亚基组成的四聚体,分子量大约为65000。四个亚基中,两个亚
基具有相同的氨基酸序列,称为α—亚基,每条链含141个氨基酸,另外两个氨基酸序
列相同的亚基,称为β—亚基,各含146个氨基酸。两种亚基有其各自的二级、三级空
间结构,亚基之间以非共价键结合在一起。每个亚基中均含有一个血红素辅基,血红素
是一个铁原卟啉Ⅳ,它处于一个疏水环境,此疏水环境对血红蛋白的可逆载氧功能起着
非常重要的作用。Fe(Ⅱ)在血红蛋白中始终是以+2价还原态存在的,若被氧化成Fe(Ⅲ),
则称为高铁血红蛋白,它就失去了可逆载氧功能。
血红素辅基与血红蛋白均以非共价键相连,其中包括 Fe(Ⅱ)与近端组氨酸(F8His)上
的Nε上的配位键;卟啉环侧链丙酸阴离子与蛋白氨基酸侧链之间的盐桥;以及卟啉环
中乙烯基与蛋白的疏水相互作用。在酸性条件下,由于蛋白的变性而使这些作用变得很
弱,以至于高铁血红素可以从血红蛋白的疏水区中游离出来。利用高铁血红素在丁酮中
的溶解度大大高于它在水溶液中的溶解度的性质,用多次丁酮萃取的方法将血红素与蛋
白分离。分离得到的脱辅基血红蛋白(ApoHb)可以用金属卟啉化合物(例如高铁血红素、
钴卟啉、铜卟啉等)进行重组,生成各种不同金属卟啉的血红蛋白。
由于高铁血红蛋白的紫外可见吸收光谱中,在405nm处有很强的特征吸收峰,而脱
辅基血红蛋白只在280nm处有蛋白的特征吸收峰,当将高铁血红素加入ApoHb溶液中后,
重组成功的高铁血红蛋白又会在405nm处出现它的特征吸收峰,因而血红蛋白的脱辅基
与重组试验均可用紫外可见分光光度计进行检测。
三、实验方法
1. 氧合血红蛋白的制备(供全班学生使用)
在市血站购买一袋人血,用高速冷冻离心机4000r/min离心10min,取下层血球加四
倍体积的0.9% NaCl洗血球,再用4000r/min离心10min,如此重复2~3次,取下层血
球,按1∶1(v/v)体积比加甲苯,振荡2分钟以上,使血球破膜,8000r/min离心20min,
弃去上层甲苯和中层脂肪,取下层血球沉淀,加10分之一沉淀体积的9% NaCl,激烈振
如有你有帮助,请购买下载,谢谢!
210页
荡混合,4000r/min离心10min,弃沉淀,取上层红黑色血红蛋白溶液,再用8000r/min
离心10min,弃上层,取下层血红蛋白溶液用滤纸过滤,因过滤很慢,可放4℃冰箱内过
滤过夜,然后装透析袋,4℃对H2O透析除NaCl和甲苯,换2~3次予冷的H2O,由透
析袋内取出血红蛋白溶液置入一锥形瓶,取样分析血红蛋白(Hb)的浓度:取5l Hb,加
3.0ml H2O(稀释601倍),用分光光度计作250nm~700nm的扫描,并检测Hb在415nm、
541nm和576nm处的三个特征峰值:A415、A541和A576,已知这三个特征峰的吸光系数
值为:
415 =125 l/mmol、541 =13.5 l/mmol、576 =14.6 l/mmol。
由公式: 浓度C=(A×稀释倍数)/ ,即可计算出制备的氧合血红蛋白Hb的浓度CHb。
2. 氧合血红蛋白(Hb)氧化成高铁血红蛋白
取已知浓度(约3~6 mmol/L)的氧合血红蛋白2 ml,置于5 ml小烧杯或10 ml试管内
放入冰浴,用下式计算需加入过量1.3倍的K3Fe(CN)6 的量 (10mg/ml)(Mw=329.26):
用移液管吸取所需加入的K3Fe(CN)6,在缓慢搅拌下滴入Hb内,直到血红蛋白的颜
色从鲜红色变成棕黑色。
装一根1.8cm×22cm的Sephadex G-25凝胶脱盐柱,用10mmol/L pH7.0的磷酸盐缓
冲液平衡脱盐柱,将制成的高铁血红蛋白溶液全部上柱,用4℃H2O洗脱,用量筒收集
高铁血红蛋白,再用H2O将其稀释至1.0~1.5mmol/L (因为过浓不利于脱辅基,太稀又
会脱不完全),记录总体积,取样稀释200~300倍,作250~700nm的扫描,得重组前
高铁血红蛋白的紫外可见吸收光谱图,检测峰值A405。
3.脱辅基 (以下步骤均在冰浴或4℃下进行)
高铁血红蛋白用1.0mol/L HCl粗调,再用0.1mol/L HCl细调溶液pH=1.8~2.0 (这一
步是关键,pH太高,脱辅基不完全,pH过低蛋白会变性),将溶液置入具塞试管内,加
入等体积予冷丁酮,手摇振荡萃取,静止分层,弃上层丁酮,取下层溶液,如此反复萃
取几次,直至上层丁酮无色为止。
取下层浅绿色脱辅基后蛋白溶液装透析袋,4℃对 1L 5 mmol/L NaHCO3透析0.5
~
1 h,以除HCl,再对H2O(4℃)透析两次,以除丁酮,再对4℃ 200 ml 0.1mol/L pH7.0
磷酸盐缓冲液透析1 h,中间取出透析袋倒置二次(此时会出现少量白色变性蛋白沉淀)。
取出袋内溶液,用8000r/min离心10 min(4℃),取上层清液,测体积(脱辅基血红蛋
白ApoHb),立即存于冰浴。取样稀释10~20倍,作250nm-700nm扫描,作峰检测得
A278蛋白吸收峰值,(以0.1mol/L pH7.0磷酸盐缓冲液作参比)。计算脱辅基血红蛋白
(ApoHb)的浓度CApoHb:
(ApoHb的 278=13.1 L/mmol)
如有你有帮助,请购买下载,谢谢!
211页
4. 重组高铁血红蛋白
取3.0ml ApoHb,用0.01mol/L NaOH配制5mg/ml的高铁血红素(Hemin,Mw=651.5) ,
计算Hemin的加入量(过量1.5倍):
缓慢搅拌下,用10~15min滴加所需体积的Hemin到3.0ml ApoHb中,并在冰浴中
再放置1 h,用1mol/L NaOH粗调和0.1mol/L NaOH细调溶液pH=9~10,溶液颜色变为
棕黑色。
再用G-25脱盐柱脱去过量的Hemin等,脱盐柱用0.1mol/L pH7.0磷酸盐缓冲液平衡
和洗脱,用量筒收集重组后的高铁血红蛋白,测量总体积,取样稀释后作250nm~700nm
扫描,测峰值A405,最后计算重组率:
由扫描所得的各个紫外可见吸收光谱图,可以清楚地看到血红蛋白脱辅基前后和重
组后的效果。