普通化学第七章酸碱平衡
- 格式:pdf
- 大小:839.01 KB
- 文档页数:40

化学中的酸碱平衡原理酸碱平衡是化学领域中一个重要的原理,它在许多方面都具有广泛的应用。
本文将介绍酸碱平衡的基本概念、性质以及相关的计算方法,以帮助读者更好地理解和应用酸碱平衡原理。
一、酸碱的定义和性质在化学中,酸碱是指具有特定性质的化合物。
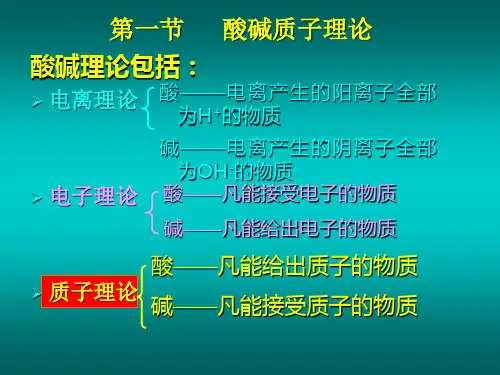
根据布朗斯特德酸碱理论,酸是可以给出氢离子(H+)的物质,碱是可以接受氢离子的物质。
例如,HCl是一种酸,因为它在水中会生成H+离子;而NaOH是一种碱,因为它可以接受H+离子形成Na+离子和OH-离子。
酸碱的性质主要包括以下几个方面:1. pH值:pH值是衡量溶液酸碱程度的指标,它是用于表示溶液中氢离子浓度的负对数。
pH值范围从0到14,数值越小表示溶液越酸,数值越大表示溶液越碱,pH值为7表示中性。
2. 颜色指示剂:酸碱溶液的酸碱性质可以用颜色指示剂来判断。
例如,酸性溶液中的酚酞指示剂呈现红色,而碱性溶液中则呈现黄色。
3. 中和反应:酸和碱发生反应会产生中和反应。
在中和反应中,酸的H+离子和碱的OH-离子结合生成水(H2O)分子。
二、酸碱平衡的重要性酸碱平衡在自然界和生活中都起着重要的作用。
以下是一些关于酸碱平衡重要性的例子:1. 生理调节:人体内部的许多生理过程都需要酸碱平衡维持在正常范围内。
例如,血液的pH值需要保持在严格的范围内,否则会对身体功能产生负面影响。
2. 土壤调节:土壤中的酸碱性对农作物的生长有很大影响。
不同的植物对土壤酸碱度有不同的适应性,因此调节土壤的酸碱平衡可以改善农作物的生长环境。
3. 化学实验:在化学实验中,准确控制和调节酸碱平衡可以保证实验的准确性和重复性。
三、酸碱平衡的计算方法在化学实验和工业生产中,需要计算酸碱溶液的浓度、反应速率等参数。
下面是几种常见的酸碱平衡计算方法:1. 酸碱平衡方程式:具体的酸碱反应可以用化学方程式表示。
例如,HCl + NaOH → NaCl + H2O就代表了盐酸和氢氧化钠反应生成氯化钠和水。
2. 酸碱浓度计算:根据溶液中H+和OH-离子的浓度可以计算出其酸碱程度。

化学平衡与酸碱平衡化学平衡和酸碱平衡是化学反应中非常重要的概念。
本文将介绍化学平衡和酸碱平衡的定义、原理以及如何计算平衡常数。
一、化学平衡的定义和原理化学平衡是指在封闭容器中,反应物生成生成物的速度相等,反应物和生成物的浓度保持不变的状态。
当一个化学反应到达平衡状态时,反应物与生成物之间的摩尔比例会保持相同。
化学平衡遵循勒夏特列瓦第二原理,即“当一个系统处于平衡时,化学反应的正反应速率相等”。
这意味着在平衡时,正反应和逆反应的速率相等,而且反应物和生成物的浓度不再发生变化。
化学平衡可以用反应物和生成物的浓度来表达。
平衡常数(Kc)表示在给定温度下,反应物和生成物浓度的比例。
Kc的计算可以通过平衡方程式的系数来确定。
二、酸碱平衡的定义和原理酸碱平衡是指酸和碱在溶液中的反应达到平衡状态。
酸性溶液中的氢离子(H+)浓度高于水的浓度,而碱性溶液中的氢离子浓度低于水的浓度。
酸碱平衡是通过酸碱反应来实现的。
酸碱反应中,酸质子(H+)会与碱的氢氧根离子(OH-)结合形成水分子(H2O)。
这种转化过程是平衡的,即生成H2O的速率等于生成H+和OH-的速率。
酸碱平衡的强弱可以用酸碱反应中的离子浓度来衡量。
酸性溶液中的pH值小于7,碱性溶液中的pH值大于7,中性溶液中的pH值等于7。
三、平衡常数的计算在化学平衡中,平衡常数(Kc)用于描述反应物和生成物浓度之间的关系。
平衡常数的计算可以根据平衡方程式的化学式进行。
化学式的各个物质的摩尔比例可以确定平衡常数。
平衡常数的值表示当体系处于平衡状态时,反应物和生成物浓度的比例。
平衡常数的值越大,表示反应向生成物一边偏移;当平衡常数的值趋近于1时,表示反应物和生成物浓度几乎相等;当平衡常数的值小于1时,表示反应向反应物一边偏移。
四、总结化学平衡和酸碱平衡是化学反应中重要的概念。
化学平衡遵循勒夏特列瓦第二原理,表示在平衡状态下反应物和生成物的浓度保持不变。
酸碱平衡是通过酸碱反应实现的,反应中酸质子和碱的氢氧根离子相结合形成水分子。

化学反应的酸碱平衡化学反应是物质变化的过程,而酸碱平衡则是化学反应中重要的概念之一。
酸碱平衡指的是在化学反应中酸和碱的相对浓度,以及它们之间的化学反应的平衡状态。
一、酸碱的定义酸和碱是化学反应中的两种基本物质。
根据物质释放出的氢离子(H+)和氢氧根离子(OH-)的相对浓度,可以将其定义为酸或碱。
- 酸是指在溶液中释放出氢离子(H+)的物质,如盐酸(HCl)。
- 碱是指在溶液中释放出氢氧根离子(OH-)的物质,如氢氧化钠(NaOH)。
其实,酸和碱并不仅限于溶液,它们也可以是固体或气体形态。
二、酸碱反应酸碱反应是指酸和碱之间发生化学反应的过程。
在酸碱反应中,通常会生成水和盐。
例如,当盐酸和氢氧化钠反应时,产生水和氯化钠:HCl + NaOH → H2O + NaCl在上述化学反应中,酸(盐酸)和碱(氢氧化钠)生成了水和盐(氯化钠)。
这种反应也被称为中和反应。
三、pH值与酸碱平衡为了衡量溶液的酸碱性,科学家引入了pH值作为酸碱度的指标。
pH值的范围从0到14,pH值越低表示溶液越酸,而pH值越高表示溶液越碱。
pH值为7的溶液被认为是中性的。
在酸碱平衡中,有一个重要的概念叫做离子反应,即酸和碱之间产生的离子之间的相互作用。
离子反应是酸碱反应中起关键作用的一种反应类型。
四、酸碱指示剂为了检测溶液的酸碱性,人们通常使用酸碱指示剂。
酸碱指示剂是一种能够根据溶液的pH值而发生颜色变化的物质。
常见的酸碱指示剂有表格酸、品红等。
它们在酸性溶液和碱性溶液中呈现出不同的颜色,这也是由于它们的分子结构在不同的酸碱环境下发生变化。
五、酸碱平衡的应用酸碱平衡在许多领域都有着广泛的应用,以下是一些例子:1. 生活中常见的洗涤剂就是一种酸碱中和的产物。
洗涤剂中的酸碱物质能够中和油脂的酸性,帮助清洁衣物。
2. 农业领域中,土壤的酸碱度对农作物的生长有着重要影响。
根据土壤的酸碱性,选择适宜的肥料和调节方法,有助于提高农作物产量。
3. 化学工业中,酸碱反应被广泛用于生产过程中的中和、沉淀和脱色等步骤。


酸碱平衡与酸碱滴定学习要求:1.熟悉弱电解质的特点,弱电解质的离解平衡,离解度及其影响因素,离解平衡常数,离解度和离解平衡常数之间的关系—稀释定律。
掌握酸碱平衡理论及溶液pH值的计算;2.掌握缓冲溶液的含义;掌握缓冲溶液酸碱度的计算,了解缓冲溶液的选择和配制。
3.了解酸碱指示剂的作用原理,掌握其理论变色点和变色范围,掌握指示剂的选择。
4.掌握各类酸碱滴定曲线的特点、化学计量点pH的计算及指示剂的选择;掌握影响pH 突跃范围大小的因素;5.掌握各类酸碱准确滴定、分步滴定及指示剂的选择依据,了解酸碱滴定法的应用,掌握酸碱滴定结果的计算。
前面已介绍了化学平衡的一般规律,本章主要讨论水溶液中的酸碱平衡。
酸碱平衡在生物体中也同样存在,生物体液需要维持一定的pH范围,pH的改变将会影响生物体内细胞的活性。
因此酸碱平衡及其有关反应与生物化学反应有密切关系。
与气相中的反应相比,溶液的反应活化能较低,热效应较小,因此反应速率快,而且其平衡常数受温度、压力的影响较小,一般可以只考虑浓度1对平衡的影响。
酸碱滴定法是酸碱反应为基础的滴定分析方法。
它不仅能用于水溶液体系,也可用于非水溶液体系,因此酸碱滴定法是滴定分析中最重要的和应用最广泛的方法之一。
在酸碱滴定中,溶液的pH如何随滴定剂的加入而发生变化,如何选择合适指示剂使其变色点与化学计量点接近,如何将酸碱滴定法用于实际测定中等,都是必须掌握的内容。
本章将学习酸碱平衡和酸碱滴定法的基本原理和应用实例。
第一节电解质溶液一、电解质的分类电解质是一类重要的化合物。
凡是在水溶液或熔融状态下能解离出离子而导电的化合物叫做电解质,如NaCl。
1923年,德拜(P. J. W.Debye)和休格尔(E. Hückel)提出强电解质理论,电解质可分为强电解质和弱电解质两大类。
强电解质在水溶液中是能完全解离成离子的化合物,如离子型化合物:NaCl、=1,因此处理问题通常可进近似地1在本章讨论中的所涉及的溶液都是较稀的溶液,活度系数i用浓度代替活动度。



化学酸碱平衡知识点总结1. 酸碱平衡的定义酸碱平衡是指人体内液体中的酸碱物质维持在一定的平衡状态,使液体pH值维持在7.35-7.45之间,以维持机体内外环境的稳定性。
酸碱平衡主要由呼吸系统、肾脏和缓冲系统协同调节,以维持正常的pH值。
2. pH值的测定和变化pH值是酸碱度的指标,是指液体的酸碱性程度。
pH值越小,表示酸性越强;pH值越大,表示碱性越强;pH=7表示中性。
人体内液体的pH值受多种因素影响,包括饮食、代谢产物、呼吸和排泄等。
正常人体内液体的pH值约为7.35-7.45,在这个范围内可以维持正常的生理功能;如果pH值偏离这个范围,就会导致酸碱平衡失调,影响人体健康。
3. 酸碱平衡失调的原因和症状酸碱平衡失调是指人体内液体中的酸碱物质不能维持在正常范围内,导致pH值偏离正常范围,出现酸中毒或碱中毒。
酸碱平衡失调的原因包括呼吸功能障碍、肾脏功能障碍、代谢性失调等。
酸中毒和碱中毒的症状包括疲乏、头痛、恶心、呕吐、心悸、肌肉无力、昏迷等,严重时可危及生命。
4. 调节酸碱平衡的生理机制人体内部有多种调节酸碱平衡的生理机制,包括呼吸系统的CO2排出、肾脏的H+排泄、尿液的排泄等。
呼吸系统通过排除CO2调节血液中的H+浓度,肾脏通过排泄H+离子和生成碳酸氢盐调节酸碱平衡,尿液中的pH值与酸碱平衡有密切关系。
此外,人体内还存在缓冲系统,包括蛋白质、磷酸盐和碳酸氢盐等缓冲物质,可以中和过多的酸或碱,起到维持酸碱平衡的作用。
5. 酸碱平衡与健康酸碱平衡对人体健康有重要影响。
长期的酸中毒或碱中毒会损害多个器官系统,影响生理功能。
饮食和生活习惯可以对酸碱平衡产生影响,包括饮食中的酸性食物、有氧运动和睡眠等。
因此,了解酸碱平衡对于预防疾病、保持健康具有重要意义。
综上所述,酸碱平衡是人体生理活动中的重要环节,它受呼吸、肾脏和缓冲系统的调节,对维持正常的生理功能和健康具有重要作用。
了解酸碱平衡的相关知识有助于预防酸碱平衡失调和相关疾病,促进人体健康。

化学中的酸碱平衡化学是一门研究物质的性质和变化的科学领域。
在化学中,酸碱平衡是一个基本而重要的概念,它影响着许多化学反应和生物系统中的许多过程。
本文将深入探讨化学中的酸碱平衡,包括其定义、性质、应用和影响。
一、酸碱平衡的定义酸和碱是化学中两种基本的化学物质,它们的性质可以通过其氢离子(H+)浓度来定义。
酸是指具有高氢离子浓度的物质,而碱则是指具有低氢离子浓度的物质。
这种氢离子浓度的度量通常通过pH值来表示,pH值越低表示酸性越强,而pH值越高表示碱性越强。
中性物质的pH值为7,例如纯水。
酸碱平衡的关键概念是酸碱中和反应,它发生在酸和碱混合在一起时,氢离子和氢氧根离子(OH-)结合以形成水和其他盐。
这个反应的一般方程式如下:H+ + OH- → H2O这个反应是酸碱中和反应的基础,它消除了高氢离子浓度和高氢氧根离子浓度之间的差异,使溶液变得中性。
二、酸碱的性质酸和碱有各自的一些特征和性质,可以帮助我们识别它们。
下面是一些常见的酸碱性质:1. 酸的性质:- 酸味酸,例如柠檬汁和醋。
- 酸会腐蚀金属。
- 酸能改变天然指示剂的颜色,通常变红。
- 酸在水中释放氢离子,增加溶液的H+浓度。
2. 碱的性质:- 碱味苦,例如苏打水和肥皂。
- 碱具有滑腻的感觉,称为皂性。
- 碱能改变天然指示剂的颜色,通常变绿或蓝。
- 碱在水中释放氢氧根离子,增加溶液的OH-浓度。
这些性质使我们能够在实验室中区分酸和碱,同时也为了理解它们在自然界和工业中的应用提供了基础。
三、酸碱平衡的应用酸碱平衡在许多领域都有广泛的应用,以下是一些示例:1. 化学实验室:在化学实验中,酸碱平衡用于调整溶液的pH值,以控制反应速率和产物的形成。
这对于合成化合物和分析物质非常重要。
2. 生物体内:生物体内的许多生化反应都受到酸碱平衡的调节。
例如,人体的血液维持着严格的pH范围,以确保酶的正常功能和生理过程的进行。
3. 水处理:酸碱平衡在污水处理和饮用水净化中发挥关键作用。

第七章酸碱平衡与酸碱滴定学习要求:1.熟悉弱电解质的特点,弱电解质的离解平衡,离解度及其影响因素,离解平衡常数,离解度和离解平衡常数之间的关系—稀释定律。
掌握酸碱平衡理论及溶液pH值的计算;2.掌握缓冲溶液的含义;掌握缓冲溶液酸碱度的计算,了解缓冲溶液的选择和配制。
3.了解酸碱指示剂的作用原理,掌握其理论变色点和变色范围,掌握指示剂的选择。
4.掌握各类酸碱滴定曲线的特点、化学计量点pH的计算及指示剂的选择;掌握影响pH 突跃范围大小的因素;5.掌握各类酸碱准确滴定、分步滴定及指示剂的选择依据,了解酸碱滴定法的应用,掌握酸碱滴定结果的计算。
前面已介绍了化学平衡的一般规律,本章主要讨论水溶液中的酸碱平衡。
酸碱平衡在生物体中也同样存在,生物体液需要维持一定的pH范围,pH的改变将会影响生物体内细胞的活性。
因此酸碱平衡及其有关反应与生物化学反应有密切关系。
与气相中的反应相比,溶液的反应活化能较低,热效应较小,因此反应速率快,而且其平衡常数受温度、压力的影响较小,一般可以只考虑浓度1对平衡的影响。
酸碱滴定法是酸碱反应为基础的滴定分析方法。
它不仅能用于水溶液体系,也可用于非水溶液体系,因此酸碱滴定法是滴定分析中最重要的和应用最广泛的方法之一。
在酸碱滴定中,溶液的pH如何随滴定剂的加入而发生变化,如何选择合适指示剂使其变色点与化学计量点接近,如何将酸碱滴定法用于实际测定中等,都是必须掌握的内容。
本章将学习酸碱平衡和酸碱滴定法的基本原理和应用实例。
第一节电解质溶液一、电解质的分类电解质是一类重要的化合物。
凡是在水溶液或熔融状态下能解离出离子而导电的化合物叫做电解质,如NaCl。
1923年,德拜(P. J. W.Debye)和休格尔(E. Hückel)提出强电解质理论,电解质可分为强电解质和弱电解质两大类。
强电解质在水溶液中是能完全解离成离子的化合物,如离子型化合物:NaCl、=1,因此处理问题通常可进近似地1在本章讨论中的所涉及的溶液都是较稀的溶液,活度系数i用浓度代替活动度。