7第七章酸碱平衡_中国农大
- 格式:doc
- 大小:118.00 KB
- 文档页数:6

第七章酸碱平衡紊乱第1节概述一、概念维持体液酸碱度的相对恒定是机体举行正常生命活动的须要条件。
普通哺乳动物的细胞外液为弱碱性,PH为7.25-7.54,平均值为7.4,变动范围较小,各种动物之间差异不大。
在正常代谢过程中,固然机体不断生成酸性或碱性物质,也常常摄取一些酸性或碱性食物,但是依赖体液的缓冲系统,以及肺和肾的调节功能,血浆pH值仍稳定在正常范围内。
维持体液酸碱度的相对稳定性,称为酸碱平衡。
病理情况下,由各种致病因素引起酸碱超负荷或调节机制障碍而导致的体液环境酸碱稳定性破坏,称为酸碱平衡紊乱。
主要调节机制:①血液缓冲系统的调节:最重要的缓冲对是[HCO3一]/[H2CO3]缓冲对。
②肺的调节:通过CO2呼出量调节H2CO3的浓度。
③肾脏的调节:主要通过重吸收HCO3一和排出H+举行调节。
④细胞内外的调节:通过细胞内外H+-Na+、H+-K+等离子交换的方式举行调节。
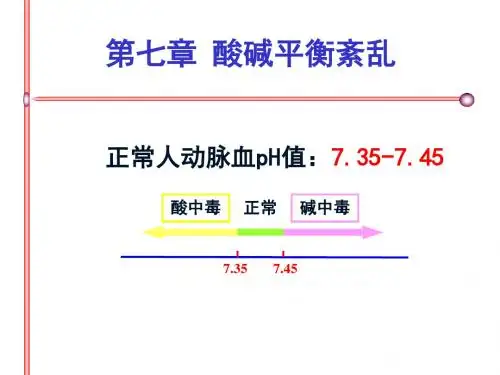
二、常用指标1.血液pH:与呼吸性因素及代谢性因素密切相关。
pH大于正常表明碱中毒;pH小于正常表明酸中毒。
2.血浆CO2分压(PaCO2):指血浆中呈物理溶解状态的CO2分子所产生的张力,是反映呼吸性酸碱平衡障碍的主要指标。
·呼吸性酸中毒时,PaCO2高于正常(通气不足有CO2潴留)·呼吸性碱中毒时,PaCO2低于正常(CO2呼出过多)3.血浆CO2结合力(CO2CP):指血浆中呈化学结合状态的CO2量,即血浆中HCO3—含量,是反映代谢性酸碱平衡障碍的主要指标。
·代谢性酸中毒时,血浆CO2CP降低,血浆中HCO3—含量降低·代谢性碱中毒时,血浆CO2CP升高,血浆中HCO3—含量升高第 1 页/共8 页第2节酸中毒体内[HCO3—]↓或[H2CO3]↑时,[HCO3—]/[H2CO3]比值减少,血液pH值降低,称为酸中毒。
一、代谢性酸中毒代谢性酸中毒是以血浆HCO3—原发性减少为特征的病理过程,pH值降低,是酸碱平衡紊乱中最为常见的一种类型,主要见于体内固定酸生成过多(如反刍动物瘤胃酸中毒、酮病)、酸性物质摄入过多(如大量使用水杨酸)、酸性物质排出减少(如肾功能不全)或碱性物质丧失过多(如肠液走失)。






第七章 酸碱平衡与酸碱滴定法章节测试题一、选择题1.根据酸碱质子理论,在水溶液中既可作酸亦可作碱的物质是 。
A. Cl - B. NH 4+ C. HCO 3- D. H 3O +2.向0.10 mol·L -1 HCl 溶液中通H 2S 气体至饱和(0.10 mol·L -3),溶液中S 2- 浓度为(H 2S :θa 1K = 9.1 ⨯ 10-8,θa21K = 1.1 ⨯ 10-12) 。
A. 1.0 ⨯ 10-18 mol·L -1 B. 1.1 ⨯ 10-12 mol·L -1 C. 1.0 ⨯ 10-19 mol·L -1D. 9.5 ⨯ 10-5 mol·L -13.将pH=4.00的强酸溶液与pH=12.00的强碱溶液等体积混合,则混合后溶液的pH 为 。
A. 8.00B. 9.00C. 11.69D. 12.00 4.0.2 mol·L -3甲酸溶液中3.2% 的甲酸解离,它的解离常数是 。
A. 9.6 ⨯ 10-3 B . 4.8 ⨯ 10-5 C. 1.25 ⨯ 10-6 D. 2.0 ⨯ 10-45.测定(NH 4)2SO 4中的氮时,不能用NaOH 标准溶液直接滴定,这是因为 。
A. NH 3 的K b 太小 B. (NH 4)2SO 4不是酸C. NH 4+的K a 太小D. (NH 4)2SO 4中含游离H 2SO 4 6.下列溶液用酸碱滴定法能准确滴定的是 。
A. 0.1 mol ∙L -1 HF (p K a = 3.18) B. 0.1 mol ∙L -1 HCN (p K a = 9.21)C. 0.1 mol ∙L -1NaAc [p K a (HAc) = 4.74]D. 0.1 mol ∙L -1 NH 4Cl [p K b (NH 3) = 4.75]7.用NaOH 标准溶液滴定0.1mol ∙ L -1HCl-0.1mol ∙ L -1 H 3PO 4混合液,在滴定曲线上出现突跃的个数为 。
A. 1B. 2C. 3D. 48.将浓度相同的下列溶液等体积混合后,能使酚酞指示剂显红色的溶液是 。
A. 氨水+醋酸 B. 氢氧化钠+醋酸 C. 氢氧化钠+盐酸 D. 六亚甲基四胺+盐酸9.在下列多元酸或混合酸中,用NaOH 溶液滴定时出现两个滴定突跃的是 。
A. H 2S (θa 1K = 1.3×10-7,θa 2K = 7.1×10-15)B. H 2C 2O 4 (θa 1K = 5.9×10-2,θa 2K = 6.4×10-5)C. H 3PO 4 (θa 1K = 7.6×10-3, θa 2K = 6.3×10-8,θa 3K = 4.4×10-13 )D. HCl+一氯乙酸 (一氯乙酸的θK = 1.4×10-3)10.用双指示剂法测定可能含有NaOH 及各种磷酸盐的混合液。
现取一定体积的该试液,用HCl 标准溶液滴定,以酚酞为指示剂,用去HCl 18.02 mL 。
然后加入甲基橙指示剂继续滴定至橙色时,又用去20.50mL,则此溶液的组成是 。
A. Na 3PO 4B. Na 2HPO 4C. NaOH+Na 3PO 4D. Na 3PO 4+Na 2HPO 4 二、填空题1.下列离子中,HCO 3-、 [Fe(OH)5(H 2O)5]2-、S 2-、NH 4+ 只能作碱的是_________;只能作酸的是__________;既可作碱又可作酸的是__________________。
2.向一磷酸 (θa 1K = 7.6⨯10-3 θa 2K = 6.3⨯10-8 θa 3K = 4.4⨯10-13)溶液中加入NaOH 至溶液 pH = 8.00 ,此时溶液中浓度最大的磷酸型体为____________,其次为_________。
3.已知 K a ( HCOOH)= 1.8⨯10-4,K a ( HAc)= 1.8⨯10-5, K b (NH 3)= 1.8⨯10-5 , 欲配制 pH = 10.00的缓冲溶液,应选用的缓冲对是___________________, 酸与其共轭碱的浓度比为 ______________。
4.NaOH 溶液浓度标定后由于保存不妥吸收了CO 2,以此标准溶液测定草酸摩尔质量时,结果__________;若以此标准溶液测定H 3PO 4浓度(甲基橙为指示剂)其结果_________。
(填“偏高”、“偏低”或“无影响”)5.在酸碱滴定中, 滴定剂与被测物浓度通常在0.1 mol ∙L 左右。
若浓度太稀,则______________ ;而浓度太大,则__________________。
6.酸碱指示剂的理论变色范围为________________________ _;变色点为___________,选择指示剂的原则是__________________________________. 7.测定尿素CO(NH 2)2中的含氮量时,先对试样品进行预处理:加H 2SO 4,加热,尿素先被氧化成CO 2和H 2O ,其中的氮转变为NH 4+后,加入中性甲醛,发生如下反应:4NH 4++6HCHO=(CH 2)6N 4H ++3H ++6H 2O ,然后用_______标准溶液滴定,滴定反应方程式为_______________,化学计量点pH 为___ (终点产物浓度为0.1 mol·L -1)。
应选用_________作指示剂。
8.配制NaOH 标准溶液时未除净CO 32-,今以草酸(H 2C 2O 4·2H 2O)标定其浓度后,用以测定HAc 浓度,测得结果________;若用以测定HCl-NH 4Cl 混合液中HCl 浓度,其结果______。
(填“偏高”、“偏低”或“无影响”)9.已知H 2PO 4的K θal =7.5⨯10-3,K a2θ=6.2⨯10-8,K a3θ=2.2⨯10-13。
欲用磷酸盐配制缓冲液,若选用Na 2HPO 4作为酸,可配制成pH 为 至 范围的缓冲液;若选用Na 2PO 4作为碱,可配制pH 为 至 范围内的缓冲液。
三、简答题:请用质子酸碱理论解释在水溶液中NH 3与HPO 42-哪一个碱性强?(已知:K b (NH 3·H 2O) = 1.8×10-5;H 3PO 4 θa 1K = 7.6×10-3,θa 2K = 6.3×10-8,θa 3K = 4.4×10-13) 四、计算题1.人体血液中有H 2CO 3 -HCO 3-缓冲对起作用,若测得人血的pH = 7.20,且已知H 2CO 3 的p θa 1K = 6.10,试计算:(1) )CO c(H )HCO (323-c 浓度比值(2) 若c (HCO 3-) = 2.3 mmol·L -1,求c (H 2CO 3) = ?2.已知:p K a (HCOOH)=3.75,p K a (HAc) =4.75,p θa 1K (H 3PO 4) =2.12; 欲配制pH =3.5的缓冲溶液500mL ,并使溶液中酸的浓度为0.20mol·L -1。
应选用哪种缓冲对?需称取多少固体钠盐?3.测定某工业烧碱中NaOH 和Na 2CO 3的质量分数,称取试样2.546 g ,溶于水并定容于250 mL 容量瓶中,取出25.00 mL ,以甲基橙为指示剂,滴定到橙色时, 用去HCl 标准溶液24.86 mL 。
另取25.00 mL 溶液,加入过量BaCl 2,以酚酞为指示剂,滴定到红色刚褪,用去HCl 标准溶液23.74 mL ,又知中和0.4852 g 硼砂(Na 2B 4O 7·10H 2O)需要此HCl 标准溶液24.37 mL 。
计算该试样NaOH 和Na 2CO 3的质量分数。
[M (Na 2B 4O 7·10H 2O) = 381.4 g·mol -1, M r (NaOH) = 40.00,M (Na 2CO 3) = 106.0g·mol -1]4.称取1.250 g 纯一元弱酸HA , 溶于适量水后稀释至50.00 mL , 然后用0.1000mol ∙L NaOH 溶液进行电位滴定,从滴定曲线查出滴定至化学计量点时NaOH 溶液用量为37.10 mL 。
当滴入7.42 mL NaOH 溶液时,测得pH = 4.30。
计算:(1)一元弱酸HA 的摩尔质量; (2)HA 的解离常数K a ;(3)滴定至化学计量点时溶液的pH 。
5.c (KHC 8H 4O 4)=0.1 mol·L -1的KHC 8H 4O 4溶液能否用酸碱滴定法滴定?为什么?化学计量点的pH 为多少?(终点产物的浓度为0.050 mol·L -1)采用何指示剂?已知H 2C 8H 4O 4的θa 1K =1.1×10-3 θa21K =3.9×10-6 参考答案:一、 选择题:1. C2. C3. C4.D5. C6. A7. B8. B9. C 10. D 二、填空题:1. S 2-;NH 4+;HCO 3-、 [Fe(OH)5(H 2O)5]2-2. HPO 42- 、H 2PO 4-3. NH 3-NH 4Cl , 0.1784. 偏高;无影响5. 滴定突跃范围太小,终点误差大; 造成浪费6.1)HIn (p pH θ±=K , )HIn (p θK , 酸碱指示剂的变化范围全部或一部分在滴定的突跃范围内7. NaOH ,(CH 2)6N 4H + +OH -= (CH 2)6N 4 +H 2O ; 9.1, 酚酞 8. 无,偏低9. 11.66~13.66; 11.66~13.66; 三、简答题答:NH 3+ H 2O= NH 4+ +OH - K b (NH 3·H 2O) = 1.8 ⨯10-5;HPO 42-+H 2O=H 2PO 4- +OH - K b2=K w /K a2= 10-14/(6.3 ⨯10-8)=1.58⨯10-7由此可见,NH 3·H 2O 的碱性要强。
四、计算题1. 解:(2) c(H 2CO 3) = 0.08⨯2.3= 0.184 mmol·L -1 2. 选取HCOOH-HCOONa 为缓冲对, 因为 pH=p K a-lg c a /c b 3.5=3.75-lg c a /c bc a /c b =1.778 有C b =0.1125 mol·L -1 m (HCOONa)=0.1125⨯0.5⨯68=3.825g 3. c (HCl) = 0.1044 mol·L -1 w (NaOH) = ×100% = 38.94% w (Na2CO3) = ×100% = 2.43% 4. 解:(1)HA + NaOH = NaA + H 2O物质量比为1:1,得到1.250/M = 0.1 ×37.10 ⨯ 10-3 得M =336.93 g·mol -1(2)(37.1-7.42) ⨯0.10=2.968 mmol0.742 mmol NaA 与2.968 mmol 的HA 构成了缓冲溶液baa lgp pH c c K -= 4.3= p K a-lg(2.968/0.742) p K a=4.3+0.6=4.9 K a=1.3×10-5c 0(NaA)=0.1 ×37.10 /87.10=0.043 mol·L -1,20W b K cK >> 因为400b>K c[OH-]==b K c 06-15.810(mol L )-=⨯⋅ pOH=5.24, pH=8.765. 解:KHC 8H 4O 4 + NaOH = KNaC 8H 4O 4 + H 2O 2a 0K c = 0.1×3.9×10-6 =3.9×10-7 >10-8,可以用强碱滴定51.13210-=⨯ pOH=4.95, pH=9.05。