初中常见化合物化学式
- 格式:doc
- 大小:34.00 KB
- 文档页数:3

初中常见化学式及俗称
在初中化学中,我们经常会遇到各种化学式和俗称。
以下是一些常见的化学式及俗称:
1. H2O:俗称水,是一种无色、透明的液体,是地球生物体内最常见的化合物之一。
2. NaCl:俗称食盐,是由钠离子和氯离子组成的晶体,常用于调味和食品加工中。
3. CO2:俗称二氧化碳,是一种无色、无味的气体,常见于工业、农业和生活中。
4. O2:俗称氧气,是一种无色、无味的气体,是人类和动物呼吸所需的气体之一。
5. CH4:俗称甲烷,是一种无色、无味的气体,是天然气的主要成分之一。
6. CaCO3:俗称方解石,是一种白色的晶体,是大理石、珊瑚和贝壳的主要成分之一。
7. Fe:俗称铁,是一种金属元素,常用于制造各种工具和机械。
8. Cu:俗称铜,是一种金属元素,常用于制造电线、管道、硬币等物品。
以上是初中化学中常见的化学式及俗称,了解它们可以帮助我们更好地理解化学知识。
- 1 -。

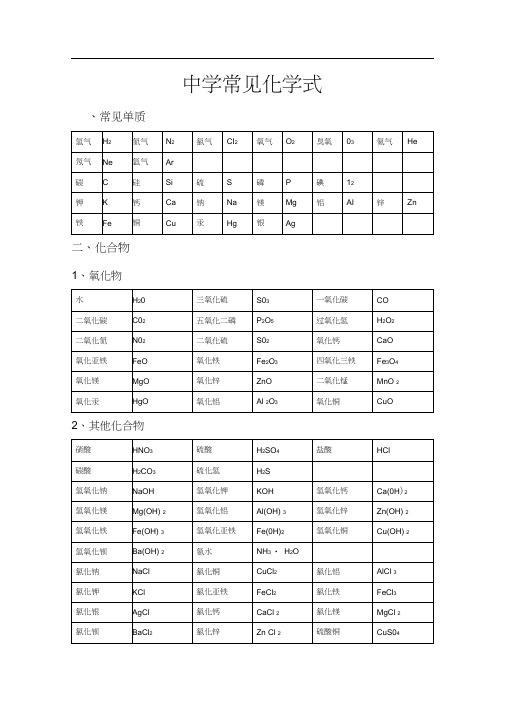
初中常见化学式及化学方程式常见的化学式一、常见单质氢气H2氮气N2氯气Cl2氧气O2臭氧O3氦气He氖气Ne氩气Ar碳C硅Si硫S磷P碘I2钾K钙Ca钠Na镁Mg铝Al锌Zn铁Fe铜Cu汞Hg银Ag二、化合物1、氧化物水H2O三氧化硫SO3一氧化碳CO二氧化碳CO2五氧化二磷P2O5过氧化氢H2O2二氧化氮NO2二氧化硫SO2氧化钙CaO氧化亚铁FeO氧化铁Fe2O3四氧化三铁Fe3O4氧化镁MgO氧化锌ZnO二氧化锰MnO2氧化汞HgO氧化铝Al2O3氧化铜CuO2、其他化合物硝酸HNO3硫酸H2SO4盐酸HCl碳酸H2CO3硫化氢H2S氢氧化钠NaOH氢氧化钾KOH氢氧化钙Ca(OH)2氢氧化镁Mg(OH)2氢氧化铝Al(OH)3氢氧化锌Zn(OH)2氢氧化铁Fe(OH)3氢氧化亚铁Fe(OH)2氢氧化铜Cu(OH)2氢氧化钡Ba(OH)2氨水NH3·H2O氯化钠NaCl氯化铜CuCl2氯化铝AlCl33、常见有机化合物初中化学方程式全〔已配平〕.一、化合反应一、镁在空气中燃烧:2Mg+ O2点燃2MgO2、铁在氧气中燃烧:3Fe +2O2点燃Fe3O43、铝在空气中燃烧:4Al+ 3O2点燃2Al2O34、氢气在空气中燃烧:2H2 +O2点燃2H2O5、红磷在空气中燃烧:4P +5O2点燃2P2O56、硫粉在空气中燃烧:S+ O2点燃SO27、碳在氧气中充分燃烧:C +O点燃CO2八、碳在氧气中不充分燃烧:2C +O2点燃2CO9、二氧化碳通过灼热碳层:C +CO2高温2CO10、一氧化碳在氧气中燃烧:2CO +O点燃2CO211、二氧化碳和水反应〔二氧化碳通入紫色石蕊试液〕:CO2 +H2O === H2CO312、生石灰溶于水:CaO+ H2O === Ca(OH)213、无水硫酸铜作枯燥剂:CuSO4 +5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na+ Cl2点燃2NaCl二、分解反应1五、实验室用双氧水制氧气:2H2O2 MnO2 2H2O +O2↑16、加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2+O2↑17、水在直流电的作用下分解:2H2O 通电2H2↑+O2↑18、碳酸化学物理学报不稳定而分解:H2CO3 === H2O +CO2↑19、高温煅烧石灰石〔二氧化碳工业制法〕:CaCO3高温CaO+ CO2↑三、置换反应20、铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu21、锌和稀硫酸反应〔实验室制氢气〕:Zn+ H2SO4 == ZnSO4+H2↑22、镁和稀盐酸反应:Mg +2HCl === MgCl2 +H2↑23、氢气恢复氧化铜:H2 +CuO 加热Cu +H2O24、木炭恢复氧化铜:C+ 2CuO 高温2Cu +CO2↑25、甲烷在空气中燃烧:CH4 +2O点燃CO2+2H2O26、水蒸气通过灼热碳层:H2O +C 高温H2 +CO27、焦炭恢复氧化铁:3C +2Fe2O3高温4Fe +3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+ CuSO4 == Cu(OH)2↓+ Na2SO429、甲烷在空气中燃烧:CH4 +2O2点燃CO2 +2H2O30、酒精在空气中燃烧:C2H5OH+ 3O2点燃2CO2 +3H2O31、一氧化碳恢复氧化铜:CO +CuO 加热Cu+ CO232、一氧化碳恢复氧化铁:3CO+ Fe2O3高温2Fe+ 3CO233、二氧化碳通过澄清石灰水〔查验二氧化碳〕:Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O34、氢氧化钠和二氧化碳反应〔除去二氧化碳〕:2NaOH+ CO2 ==== Na2CO3 +H2O35、石灰石〔或小学音乐教案大理石〕与稀盐酸反应〔二氧化碳的实验室制法〕:CaCO3 +2HCl === CaCl2 +H2O +CO2↑36、碳酸钠与浓盐酸反应〔泡沫灭火器的原理〕: Na2CO3+ 2HCl === 2NaCl +H2O +CO2↑一.物质与氧气的反应:〔1〕单质与氧气的反应:1. 镁在空气中燃烧:2Mg+ O2点燃2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃Fe3O43. 铜在空气中受热:2Cu+ O2加热2CuO4. 铝在空气中燃烧:4Al +3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 +O2点燃2H2O6. 红磷在空气中燃烧:4P+ 5O2点燃2P2O57. 硫粉在空气中燃烧:S +O2 点燃SO28. 碳在氧气中充分燃烧:C+ O2点燃CO29. 碳在氧气中不充分燃烧:2C+ O2点燃2CO〔2〕化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+ O2点燃2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃CO2 2H2O12. 酒精在空气中燃烧:C2H5OH +3O2点燃2CO2+3H2O二.几个分解反应:13. 水在直流电解:2H2O 通电2H2↑+ O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO3加热2CuO +H2O +CO2↑15. 加热氯酸钾〔有少量的二氧化锰〕:2KClO3 ==== 2KCl+ 3O2↑16. 加热高锰酸钾:2KMnO4 加热K2MnO4 +MnO2 +O2↑17. 碳酸不稳定而分解:H2CO3 === H2O +CO2↑18. 高温煅烧石灰石:CaCO高温CaO +CO2↑三.几个氧化恢复反应:19. 氢气恢复氧化铜:H2+ CuO 加热Cu+ H2O20. 木炭恢复氧化铜:C+ 2CuO 高温2Cu +CO2↑2 初三化学方程式大合集21. 焦炭恢复氧化铁:3C+ 2Fe2O高温4Fe+ 3CO2↑22. 焦炭恢复四氧化三铁:2C +Fe3O4高温3Fe+ 2CO2↑23. 一氧化碳恢复氧化铜:CO +CuO 加热Cu+ CO224. 一氧化碳恢复氧化铁:3CO+ Fe2O3高温2Fe +3CO225. 一氧化碳恢复四氧化三铁:4CO +Fe3O4高温3Fe+ 4CO2四.单质、氧化物、酸、碱、盐的彼此关系〔1〕金属单质+酸-------- 盐+氢气〔置换反应〕26. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑27. 铁和稀硫酸Fe +H2SO4 = FeSO4+ H2↑28. 镁和稀硫酸Mg +H2SO4 = MgSO4 +H2↑29. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn +2HCl === ZnCl2+ H2↑31. 铁和稀盐酸Fe+ 2HCl === FeCl2+ H2↑32. 镁和语文教案格式稀盐酸Mg 2HCl === MgCl2+ H2↑33. 铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑〔2〕金属单质+ 盐〔溶液〕------- 另一种金属+另一种盐34. 铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu35. 锌和硫酸铜溶液反应:Zn+ CuSO4 === ZnSO4+ Cu36. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 === Cu(NO3)2 +Hg 〔3〕碱性氧化物+酸-------- 盐+ 水37. 氧化铁和稀盐酸反应:Fe2O3+ 6HCl === 2FeCl3+ 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 === Fe2(SO4)3+ 3H2O39. 氧化铜和稀盐酸反应:CuO +2HCl ==== CuCl2 +H2O40. 氧化铜和稀硫酸反应:CuO +H2SO4 ==== CuSO4+ H2O41. 氧化镁和稀硫酸反应:MgO+ H2SO4 ==== MgSO4+ H2O42. 氧化钙和稀盐酸反应:CaO +2HCl ==== CaCl2 +H2O〔4〕酸性氧化物+碱-------- 盐+水43.苛性钠暴露在空气中变质:2NaOH +CO2 ==== Na2CO3+H2O44.苛性钠吸收二氧化硫气体:2NaOH +SO2 ==== Na2SO3 +H2O45.苛性钠吸收三氧化硫气体:2NaOH+ SO3 ==== Na2SO4+ H2O46.消石灰放在空气中变质:Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O47. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 ==== CaSO3↓+H2O〔5〕酸+碱-------- 盐+水48.盐酸和烧碱起反应:HCl+ NaOH ==== NaCl+ H2O49. 盐酸和氢氧化钾反应:HCl+ KOH ==== KCl+H2O50.盐酸和氢氧化初中家长会课件铜反应:2HCl+ Cu(OH)2 ==== CuCl2 +2H2O51. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 ==== CaCl2 +2H2O52. 盐酸和氢氧化铁反应:3HCl+ Fe(OH)3 ==== FeCl3 +3H2O53.氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 ==== AlCl3 +3H2O54.硫酸和烧碱反应:H2SO4 +2NaOH ==== Na2SO4 +2H2O55.硫酸和氢氧化钾反应:H2SO4 +2KOH ==== K2SO4 +2H2O56.硫酸和氢氧化铜反应:H2SO4 +Cu(OH)2 ==== CuSO4 +2H2O57. 硫酸和氢氧化铁反应:3H2SO4 +2Fe(OH)3==== Fe2(SO4)3+ 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O〔6〕酸+盐-------- 另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO3 +2HCl === CaCl2 H2O +CO2↑ 60.碳酸钠与稀盐酸反应: Na2CO3 +2HCl === 2NaCl +H2O+ CO2↑ 61.碳酸镁与稀盐酸反应: MgCO3 +2HCl === MgCl2 +H2O+CO2↑ 62.盐酸和硝酸银溶液反应:HCl+ AgNO3=== AgCl↓+ HNO363.硫酸和碳酸钠反应:Na2CO3 +H2SO4 === Na2SO4 +H2O +CO2↑64.硫酸和氯化钡溶液反应:H2S O4 +BaCl2 ==== BaSO4↓+ 2HCl 〔7〕碱+盐-------- 另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH CuSO4 ==== Cu(OH)2↓ Na2SO4 66.氢氧化钠与氯化铁:3NaOH FeCl3 ==== Fe(OH)3↓ 3NaCl 67.氢氧化钠与氯化镁:2NaOH MgCl2 ==== Mg(OH)2↓ 2NaCl68. 氢氧化钠与氯化铜:2NaOH CuCl2 ==== Cu(OH)2↓ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 Na2CO3 === CaCO3↓ 2NaOH〔8〕盐+ 盐----- 两种新盐70.氯化钠溶液新概念英语第二册和硝酸银溶液:NaCl +AgNO3 ==== AgCl↓+ NaNO371.硫酸钠和氯化钡:Na2SO4+ BaCl2 ==== BaSO4↓+ 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+ H2O === H2CO373.生石灰溶于水:CaO+ H2O === Ca(OH)274.氧化钠溶于水:Na2O +H2O ==== 2NaOH75.三氧化硫溶于水:SO3 +H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热CuSO4 5H2O77.无水硫酸铜作枯燥剂:CuSO4+ 5H2O ==== CuSO4·5H2化学方程式反应现象应用2Mg+ O点燃或Δ2MgO 猛烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg +O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+ O2点燃或Δ2CuO 红色金属变成黑色固体4Al+ 3O2点燃或Δ2Al2O3银白金属变成白色固体3Fe+ 2O2点燃Fe3O4 猛烈燃烧、火星四射、生成黑色固体、放热4Fe+3O2高温2Fe2O3C+ O2点燃CO2猛烈燃烧、白光、放热、使石灰水变浑浊S +O2点燃SO2剧大学英语四级烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2 O2点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体〔水〕高能燃料4P +5O2 点燃2P2O5猛烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+ CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体〔水〕甲烷和天然气的燃烧2C2H2+ 5O2点燃2H2O +4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体〔水〕氧炔焰、焊接切割金属2KClO3MnO2、Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4 MnO2 +O2↑ 紫色变成黑色、生成使带火星木条复燃的气体实验室制备氧论文气2HgOΔ2Hg+ O2↑ 红色变成银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+ O2↑ 水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO +H2O+ CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O+ CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+ H2SO4=ZnSO4 +H2↑ 有大量气泡产生、锌粒慢慢溶解实验室制备氢气Fe +H2SO4=FeSO4 +H2↑ 有大量气泡产生、金属颗粒慢慢溶解Mg +H2SO4 =MgSO4 +H2↑ 有大量气泡产生、金属颗粒慢慢溶解2Al+ 3H2SO4=Al2(SO4)3+ 3H2↑ 有大量气泡产生、金属颗粒慢慢溶解Fe2O3+3H2Δ 2Fe +3H2O 红色慢慢变成银白色、试管壁有液体冶炼金属、利用氢气的恢复性Fe3O4 +4H2 Δ3Fe+ 4H2O 黑色慢慢变成银白色英语翻译、试管壁有液体冶炼金属、利用氢气的恢复性WO3 +3H2Δ W +3H2O 冶炼金属钨、利用氢气的恢复性MoO3 +3H2ΔMo +3H2O 冶炼金属钼、利用氢气的恢复性2Na+ Cl2Δ或点燃2NaCl 猛烈燃烧、黄色火焰离子化合物的形成、H2 +Cl2点燃或光照2HCl 点燃惨白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4 +2NaOH=Cu(OH)2↓+ Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒缘故2CO +O2点燃2CO2蓝色火焰煤气燃烧C+ CuO 高温2Cu+ CO2↑ 黑色慢慢变成红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+ 3C 高温4Fe+ 3CO2↑ 冶炼金属Fe3O4 +2C高温3Fe+ 2CO2↑ 冶炼金属C+ CO2 高温2COCO2+H2O = H2CO3碳酸使石蕊变红证明碳酸的酸性小学三语文教学论文H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2 +CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2查验和石灰浆粉刷墙壁CaCO3 +H2O+ CO2 = Ca(HCO3)2 白色沉淀慢慢溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+ H2O +CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+ H2O +CO2↑ 产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO高温CaO +CO2↑ 工业制备二氧化碳和生石灰CaCO3 +2HCl=CaCl2+ H2O +CO2↑ 固体慢慢溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢初中化学方程式汇总一、氧气的性质:〔1〕单质与氧气的反应:〔化合反应〕1. 镁在空气中燃烧:2Mg+ O2点燃2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃Fe3O43. 铜在空气中受热:2Cu+ O2加热2CuO4. 铝在空气中燃烧:4Al +3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 +O点燃2H2O6. 红磷在空气中燃烧〔研究空气组成的实验〕:4P +5O2点燃2P2O57. 硫粉在空气中燃烧:S +O点燃SO28. 碳在氧气中充分燃烧:C +O2点燃CO29. 碳在氧气中不充分燃烧:2C +O2点燃2CO〔2〕化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+O2点燃2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃CO2 +2H2O12. 酒精在空气中燃烧:C2H5OH +3O2点燃2CO2 +3H2O〔3〕氧气的来源:13.玻义耳研究空气的成份实验2HgO 加热Hg +O2 ↑14.加热高锰酸钾:2KMnO4加热K2MnO4+ MnO2 +O2↑〔实验室制氧气原理1〕15.过氧化氢在二氧化锰作催化剂条件下分解反应:H2O2 MnO22H2O+ O2↑〔实验室制氧气原理2〕二、自然界中的水:16.水在直流电的作用下分解〔研究水的组成实验〕:2H2O 通电2H2↑+O2 ↑ 17.生石灰溶于水英语六级作文:CaO +H2O == Ca(OH)218.二氧化碳可溶于水:H2O+CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg+ O2点燃2MgO20.铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu21.氢气恢复氧化铜:H2 +CuO 加热Cu +H2O22. 镁恢复氧化铜:Mg+ CuO 加热Cu +MgO四、碳和碳的氧化物:〔1〕碳的化学性质23. 碳在氧气中充分燃烧:C + O2点燃CO224.木炭恢复氧化铜:C + 2CuO 高温2Cu+ CO2↑25.焦炭恢复氧化铁:3C + 2Fe2O3高温4Fe + 3CO2↑〔2〕煤炉中发生的三个反应:〔几个化合反应〕26.煤炉的底层:C +O点燃CO227.煤炉的中层:CO2+ C 高温2CO28.煤炉的上部蓝色火焰的产生:2CO +O2点燃2CO2〔3〕二氧化碳的制法与性质:29.大理石与稀盐酸反应〔实验室制二氧化碳〕:CaCO3+ 2HCl == CaCl2+ H2O +CO2↑30.碳酸不稳定而分解:H2CO3 == H2O +CO2↑31.二氧化碳可溶于水:H2O +CO2== H2CO332.高温煅烧石灰石〔工业制二氧化碳〕:CaCO3高温CaO+ CO2↑ 33.石灰水与中学历史教学园地二氧化碳反应〔辨别二氧化碳〕:Ca(OH)2 +CO2 === CaCO3↓+H2O〔4〕一氧化碳的性质:34.一氧化碳恢复氧化铜:CO+ CuO 加热Cu +CO2 35.一氧化碳的可燃性:2CO +O2点燃2CO2其它反应:36.碳酸钠与稀盐酸反应〔灭火器的原理〕:Na2CO3 2HCl == 2NaCl+ H2O +CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 +2O2点燃CO2 +2H2O 38.酒精在空气中燃烧:C2H5OH +3O2 点燃2CO2 +3H2O 39.氢气中空气中燃烧:2H2+ O2点燃2H2O六、金属〔1〕金属与氧气反应:40.镁在空气中燃烧:2Mg+ O2点燃2MgO41.铁在氧气中燃烧:3Fe +2O2点燃Fe3O442. 铜在空气中受热:2Cu +O2加热2CuO43. 铝在空气中形成氧化膜:4Al+ 3O2 = 2Al2O3〔2〕金属单质酸-------- 盐氢气〔置换反应〕44. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑45. 铁和稀硫酸Fe +H2SO4 = FeSO4 +H2↑46. 镁和稀硫酸Mg +H2SO4 = MgSO4+ H2↑47. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑48. 锌和稀盐酸Zn+ 2HCl == ZnCl2+ H2↑49. 铁和稀盐酸Fe +2HCl == FeCl2 +H2↑50. 镁和稀盐酸Mg +2HCl == MgCl2+ H2↑51.铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑〔3〕金属单质盐如何学好高中物理〔溶液〕------- 新金属新盐52. 铁和硫酸铜溶液反应:Fe +CuSO4 == FeSO4 +Cu53. 锌和硫酸铜溶液反应:Zn +CuSO4 ==ZnSO4 +Cu54. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 == Cu(NO3)2 +Hg 〔3〕金属铁的治炼原理:55.3CO +2Fe2O3 高温4Fe +3CO2↑七、酸、碱、盐一、酸的化学性质〔1〕酸金属-------- 盐氢气〔见上〕〔2〕酸金属氧化物-------- 盐水56. 氧化铁和稀盐酸反应:Fe2O3 +6HCl ==2FeCl3 +3H2O57. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 == Fe2(SO4)3 +3H2O58. 氧化铜和稀盐酸反应:CuO +2HCl ==CuCl2 +H2O59. 氧化铜和稀硫酸反应:CuO+ H2SO4 == CuSO4+ H2O〔3〕酸碱-------- 盐水〔中和反应〕60.盐酸和烧碱起反应:HCl +NaOH == NaCl+H2O61. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 == CaCl2+2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 == AlCl3 +3H2O63. 硫酸和烧碱反应:H2SO4+ 2NaOH == Na2SO4 +2H2O 〔4〕酸盐-------- 另一种酸另一种盐64.大理石与稀盐酸反应:CaCO3+2HCl == CaCl2 +H2O+ CO2↑ 65.碳酸钠与稀盐酸反应: Na2CO3 +2HCl == 2NaCl+ H2O+ CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 +HCl== NaCl+H2O+ CO2↑ 67. 硫酸和氯化钡溶液反应:H2SO4 +BaCl2 == BaSO4↓+2HCl 2、碱的幼儿园小班音乐教案化学性质〔1〕碱非金属氧化物-------- 盐水68.苛性钠暴露在空气中变质:2NaOH+CO2 == Na2CO3+ H2O 69.苛性钠吸收二氧化硫气体:2NaOH +SO2 == Na2SO3 +H2O 70.苛性钠吸收三氧化硫气体:2NaOH+ SO3 == Na2SO4 +H2O 71.消石灰放在空气中变质:Ca(OH)2+ CO2 == CaCO3↓+H2O 72. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 == CaSO3↓+ H2O 〔2〕碱酸-------- 盐水〔中和反应,方程式见上〕〔3〕碱盐-------- 另一种碱另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 +Na2CO3 == CaCO3↓+ 2NaOH 3、盐的化学性质〔1〕盐〔溶液〕金属单质------- 另一种金属另一种盐74. 铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu〔2〕盐酸-------- 另一种酸另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 +2HCl == 2NaCl +H2O+ CO2↑ 碳酸氢钠与稀盐酸反应:NaHCO3 +HCl== NaCl+ H2O +CO2↑ 〔3〕盐碱-------- 另一种碱另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 +Na2CO3 == CaCO3↓+ 2NaOH 〔4〕盐盐----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl +AgNO3== AgCl↓+NaNO3 78.硫酸钠和氯化钡:Na2SO4 +BaCl2== BaSO4↓+2NaCl一、其他反应类型一、二氧化碳通入澄清石灰水中:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O二、氢氧化钠在空气中变质:CO 2+ 2NaOH = Na 2CO 3 + H 2O3、氢氧化钠溶液吸收二氧化硫:SO 2 + 2NaOH ==Na 2SO 3+ H 2O4、一氧化碳恢复氧化铜:CO + CuO Cu + CO 2五、酒精燃烧:C 2H 5OH + 3O 2 2CO 2 + 3H 2O 六、甲烷燃烧:CH 4 + 2O 2 CO 2 + 2H 2O △点燃 点燃。

常见化学式➢常见的化学式一、常见单质二、化合物初中化学方程式全(已配平).一、化合反应1、镁在空气中燃烧:2Mg+ O2点燃 2MgO2、铁在氧气中燃烧:3Fe +2O2点燃 Fe3O43、铝在空气中燃烧:4Al+ 3O2点燃 2Al2O34、氢气在空气中燃烧:2H2 +O2点燃 2H2O5、红磷在空气中燃烧:4P +5O2点燃 2P2O56、硫粉在空气中燃烧: S+ O2点燃 SO27、碳在氧气中充分燃烧:C +O2 点燃 CO28、碳在氧气中不充分燃烧:2C +O2点燃 2CO9、二氧化碳通过灼热碳层: C +CO2高温 2CO10、一氧化碳在氧气中燃烧:2CO +O2 点燃 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O === H2CO312、生石灰溶于水:CaO+ H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 +5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na+ Cl点燃 2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O +O2↑16、加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 +O2↑17、水在直流电的作用下分解:2H2O 通电 2H2↑+O2↑18、碳酸化学物理学报不稳定而分解:H2CO3 === H2O +CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温 CaO+ CO2↑三、置换反应20、铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu21、锌和稀硫酸反应(实验室制氢气):Zn+ H2SO4 == ZnSO4+H2↑22、镁和稀盐酸反应:Mg +2HCl === MgCl2 +H2↑23、氢气还原氧化铜:H2 +CuO 加热 Cu +H2O24、木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑25、甲烷在空气中燃烧:CH4 +2O2 点燃 CO2+2H2O26、水蒸气通过灼热碳层:H2O +C 高温 H2 +CO27、焦炭还原氧化铁:3C +2Fe2O3高温 4Fe +3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+ CuSO4 == Cu(OH)2↓+ Na2SO429、甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O30、酒精在空气中燃烧:C2H5OH+ 3O2点燃 2CO2 +3H2O31、一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO232、一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe+ 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+ CO2 ==== Na2CO3 +H2O35、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 +2HCl === CaCl2 +H2O +CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3+ 2HCl === 2NaCl +H2O +CO2↑一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃 Fe3O43. 铜在空气中受热:2Cu+ O2加热 2CuO4. 铝在空气中燃烧:4Al +3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H2 +O2点燃 2H2O6. 红磷在空气中燃烧:4P+ 5O2点燃 2P2O57. 硫粉在空气中燃烧: S +O2 点燃 SO28. 碳在氧气中充分燃烧:C+ O2点燃 CO29. 碳在氧气中不充分燃烧:2C+ O2点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+ O2点燃 2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2 2H2O12. 酒精在空气中燃烧:C2H5OH +3O2点燃 2CO2+3H2O二.几个分解反应:13. 水在直流电的作用下分新概念英语第一册解:2H2O 通电 2H2↑+ O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO3加热 2CuO +H2O +CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl+ 3O2↑16. 加热高锰酸钾:2KMnO4 加热 K2MnO4 +MnO2 +O2↑17. 碳酸不稳定而分解:H2CO3 === H2O +CO2↑18. 高温煅烧石灰石:CaCO3 高温 CaO +CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2+ CuO 加热 Cu+ H2O20. 木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑2 初三化学方程式大合集21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe+ 3CO2↑22. 焦炭还原四氧化三铁:2C +Fe3O4高温 3Fe+ 2CO2↑23. 一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe +3CO225. 一氧化碳还原四氧化三铁:4CO +Fe3O4高温 3Fe+ 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+酸 -------- 盐+氢气(置换反应)26. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑27. 铁和稀硫酸Fe +H2SO4 = FeSO4+ H2↑28. 镁和稀硫酸Mg +H2SO4 = MgSO4 +H2↑29. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn +2HCl === ZnCl2+ H2↑31. 铁和稀盐酸Fe+ 2HCl === FeCl2+ H2↑32. 镁和语文教案格式稀盐酸Mg 2HCl === MgCl2+ H2↑33. 铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(2)金属单质+盐(溶液) ------- 另一种金属+另一种盐34. 铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu35. 锌和硫酸铜溶液反应:Zn+ CuSO4 === ZnSO4+ Cu36. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 === Cu(NO3)2 +Hg (3)碱性氧化物+酸 -------- 盐+水37. 氧化铁和稀盐酸反应:Fe2O3+ 6HCl === 2FeCl3+ 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 === Fe2(SO4)3+ 3H2O39. 氧化铜和稀盐酸反应:CuO +2HCl ==== CuCl2 +H2O40. 氧化铜和稀硫酸反应:CuO +H2SO4 ==== CuSO4+ H2O41. 氧化镁和稀硫酸反应:MgO+ H2SO4 ==== MgSO4+ H2O42. 氧化钙和稀盐酸反应:CaO +2HCl ==== CaCl2 +H2O (4)酸性氧化物+碱 -------- 盐+水43.苛性钠暴露在空气中变质:2NaOH +CO2 ==== Na2CO3+H2O 44.苛性钠吸收二氧化硫气体:2NaOH +SO2 ==== Na2SO3 +H2O 45.苛性钠吸收三氧化硫气体:2NaOH+ SO3 ==== Na2SO4+ H2O46.消石灰放在空气中变质:Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 ==== CaSO3↓+H2O(5)酸+碱 -------- 盐+水48.盐酸和烧碱起反应:HCl+ NaOH ==== NaCl+ H2O49. 盐酸和氢氧化钾反应:HCl+ KOH ==== KCl+H2O50.盐酸和氢氧化初中家长会课件铜反应:2HCl+ Cu(OH)2==== CuCl2 +2H2O51. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 ==== CaCl2 +2H2O52. 盐酸和氢氧化铁反应:3HCl+ Fe(OH)3 ==== FeCl3 +3H2O53.氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 ==== AlCl3 +3H2O54.硫酸和烧碱反应:H2SO4 +2NaOH ==== Na2SO4 +2H2O55.硫酸和氢氧化钾反应:H2SO4 +2KOH ==== K2SO4 +2H2O56.硫酸和氢氧化铜反应:H2SO4 +Cu(OH)2 ==== CuSO4 +2H2O57. 硫酸和氢氧化铁反应:3H2SO4 +2Fe(OH)3==== Fe2(SO4)3+ 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+盐 -------- 另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO3 +2HCl === CaCl2 H2O +CO2↑ 60.碳酸钠与稀盐酸反应: Na2CO3 +2HCl === 2NaCl +H2O+ CO2↑ 61.碳酸镁与稀盐酸反应: MgCO3 +2HCl === MgCl2 +H2O+CO2↑ 62.盐酸和硝酸银溶液反应:HCl+ AgNO3=== AgCl↓+ HNO363.硫酸和碳酸钠反应:Na2CO3 +H2SO4 === Na2SO4 +H2O +CO2↑64.硫酸和氯化钡溶液反应:H2S O4 +BaCl2 ==== BaSO4↓+ 2HCl(7)碱+盐 -------- 另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH CuSO4 ==== Cu(OH)2↓ Na2SO466.氢氧化钠与氯化铁:3NaOH FeCl3 ==== Fe(OH)3↓ 3NaCl 67.氢氧化钠与氯化镁:2NaOH MgCl2 ==== Mg(OH)2↓ 2NaCl68. 氢氧化钠与氯化铜:2NaOH CuCl2 ==== Cu(OH)2↓ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 Na2CO3 === CaCO3↓ 2NaOH(8)盐+盐 ----- 两种新盐70.氯化钠溶液新概念英语第二册和硝酸银溶液:NaCl +AgNO3 ==== AgCl↓+ NaNO371.硫酸钠和氯化钡:Na2SO4+ BaCl2 ==== BaSO4↓+ 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+ H2O === H2CO373.生石灰溶于水:CaO+ H2O === Ca(OH)274.氧化钠溶于水:Na2O +H2O ==== 2NaOH75.三氧化硫溶于水:SO3 +H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 5H2O77.无水硫酸铜作干燥剂:CuSO4+ 5H2O ==== CuSO4·5H2化学方程式反应现象应用2Mg+ O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg +O点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+ O点燃或Δ2CuO 红色金属变为黑色固体4Al+ 3O点燃或Δ2Al2O3银白金属变为白色固体3Fe+ 2O点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe +3O2高温2Fe2O3C+ O2点燃CO2剧烈燃烧、白光、放热、使石灰水变浑浊S +O2点燃SO2剧大学英语四级烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2 O2点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P +5O2 点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O点燃2H2O+ CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+ 5O2点燃2H2O +4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2、Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4 MnO2 +O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧论文气2HgOΔ2Hg+ O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+ O2↑ 水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO +H2O+ CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O+ CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+ H2SO4=ZnSO4 +H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe +H2SO4=FeSO4 +H2↑ 有大量气泡产生、金属颗粒逐渐溶解Mg +H2SO4 =MgSO4 +H2↑ 有大量气泡产生、金属颗粒逐渐溶解2Al+ 3H2SO4=Al2(SO4)3+ 3H2↑ 有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2Δ 2Fe +3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4 +4H2 Δ3Fe+ 4H2O 黑色逐渐变为银白色英语翻译、试管壁有液体冶炼金属、利用氢气的还原性WO3 +3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性MoO3 +3H2ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+ Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4 +2NaOH=Cu(OH)2↓+ Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2CO +O点燃2CO2蓝色火焰煤气燃烧C+ CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+ 3C 高温4Fe+ 3CO2↑ 冶炼金属Fe3O4 +2C高温3Fe+ 2CO2↑ 冶炼金属C+ CO2 高温2COCO2+H2O = H2CO3碳酸使石蕊变红证明碳酸的酸性小学三语文教学论文H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2 +CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3 +H2O+ CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+ H2O +CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+ H2O +CO2↑ 产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温 CaO +CO2↑ 工业制备二氧化碳和生石灰CaCO3 +2HCl=CaCl2+ H2O +CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢初中化学方程式汇总一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃 Fe3O43. 铜在空气中受热:2Cu+ O2加热 2CuO4. 铝在空气中燃烧:4Al +3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 +O2 点燃 2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P +5O2点燃 2P2O57. 硫粉在空气中燃烧: S +O2 点燃 SO28. 碳在氧气中充分燃烧:C +O2点燃 CO29. 碳在氧气中不充分燃烧:2C +O2点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+O2点燃 2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O12. 酒精在空气中燃烧:C2H5OH +3O2点燃 2CO2 +3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO 加热 Hg +O2 ↑14.加热高锰酸钾:2KMnO4加热 K2MnO4+ MnO2 +O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应: H2O2MnO22H2O+ O2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2通电2H2↑+O2 ↑17.生石灰溶于水英语六级作文:CaO +H2O == Ca(OH)218.二氧化碳可溶于水: H2O+CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg+ O2点燃 2MgO20.铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu21.氢气还原氧化铜:H2 +CuO 加热 Cu +H2O22. 镁还原氧化铜:Mg+ CuO 加热 Cu +MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2点燃 CO224.木炭还原氧化铜:C + 2CuO 高温 2Cu+ CO2↑25.焦炭还原氧化铁:3C + 2Fe2O3高温 4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C +O2 点燃 CO227.煤炉的中层:CO2+ C 高温 2CO28.煤炉的上部蓝色火焰的产生:2CO +O2点燃 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3+ 2HCl == CaCl2+ H2O +CO2↑30.碳酸不稳定而分解:H2CO3 == H2O +CO2↑31.二氧化碳可溶于水: H2O +CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3高温 CaO+ CO2↑ 33.石灰水与中学历史教学园地二氧化碳反应(鉴别二氧化碳):Ca(OH)2 +CO2 === CaCO3↓+H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热 Cu +CO2 35.一氧化碳的可燃性:2CO +O2点燃 2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 2HCl == 2NaCl+ H2O +CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O 38.酒精在空气中燃烧:C2H5OH +3O2 点燃 2CO2 +3H2O 39.氢气中空气中燃烧:2H2+ O2点燃 2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg+ O2点燃 2MgO41.铁在氧气中燃烧:3Fe +2O2点燃 Fe3O442. 铜在空气中受热:2Cu +O2加热 2CuO43. 铝在空气中形成氧化膜:4Al+ 3O2 = 2Al2O3(2)金属单质酸 -------- 盐氢气(置换反应)44. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑45. 铁和稀硫酸Fe +H2SO4 = FeSO4 +H2↑46. 镁和稀硫酸Mg +H2SO4 = MgSO4+ H2↑47. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑48. 锌和稀盐酸Zn+ 2HCl == ZnCl2+ H2↑49. 铁和稀盐酸Fe +2HCl == FeCl2 +H2↑50. 镁和稀盐酸Mg +2HCl == MgCl2+ H2↑51.铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(3)金属单质盐怎样学好高中物理(溶液) ------- 新金属新盐52. 铁和硫酸铜溶液反应:Fe +CuSO4 == FeSO4 +Cu53. 锌和硫酸铜溶液反应:Zn +CuSO4 ==ZnSO4 +Cu54. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 == Cu(NO3)2 +Hg(3)金属铁的治炼原理:55.3CO +2Fe2O3 高温 4Fe +3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸金属 -------- 盐氢气(见上)(2)酸金属氧化物-------- 盐水56. 氧化铁和稀盐酸反应:Fe2O3 +6HCl ==2FeCl3 +3H2O57. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 == Fe2(SO4)3 +3H2O58. 氧化铜和稀盐酸反应:CuO +2HCl ==CuCl2 +H2O59. 氧化铜和稀硫酸反应:CuO+ H2SO4 == CuSO4+ H2O(3)酸碱 -------- 盐水(中和反应)60.盐酸和烧碱起反应:HCl +NaOH == NaCl+H2O61. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 == CaCl2+2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 == AlCl3 +3H2O63. 硫酸和烧碱反应:H2SO4+ 2NaOH == Na2SO4 +2H2O(4)酸盐 -------- 另一种酸另一种盐64.大理石与稀盐酸反应:CaCO3+2HCl == CaCl2 +H2O+ CO2↑ 65.碳酸钠与稀盐酸反应: Na2CO3 +2HCl == 2NaCl+ H2O+ CO2↑ 66.碳酸氢钠与稀盐酸反应:NaHCO3 +HCl== NaCl+H2O+ CO2↑ 67. 硫酸和氯化钡溶液反应:H2SO4 +BaCl2 == BaSO4↓+2HCl 2、碱的幼儿园小班音乐教案化学性质(1)碱非金属氧化物 -------- 盐水68.苛性钠暴露在空气中变质:2NaOH+CO2 == Na2CO3+ H2O 69.苛性钠吸收二氧化硫气体:2NaOH +SO2 == Na2SO3 +H2O 70.苛性钠吸收三氧化硫气体:2NaOH+ SO3 == Na2SO4 +H2O 71.消石灰放在空气中变质:Ca(OH)2+ CO2 == CaCO3↓+H2O 72. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 == CaSO3↓+ H2O (2)碱酸-------- 盐水(中和反应,方程式见上)(3)碱盐 -------- 另一种碱另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 +Na2CO3 == CaCO3↓+ 2NaOH 3、盐的化学性质(1)盐(溶液)金属单质------- 另一种金属另一种盐74. 铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu(2)盐酸-------- 另一种酸另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 +2HCl == 2NaCl +H2O+ CO2↑ 碳酸氢钠与稀盐酸反应:NaHCO3 +HCl== NaCl+ H2O +CO2↑(3)盐 碱 -------- 另一种碱 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 +Na 2CO 3 == CaCO 3↓+ 2NaOH (4)盐 盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl +AgNO 3 == AgCl↓+NaNO 3 78.硫酸钠和氯化钡:Na 2SO 4 +BaCl 2 == BaSO4↓+2NaCl一、其他反应类型1、二氧化碳通入澄清石灰水中:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O2、氢氧化钠在空气中变质:CO 2+ 2NaOH = Na 2CO 3 + H 2O3、氢氧化钠溶液吸收二氧化硫:SO 2 + 2NaOH ==Na 2SO 3+ H 2O4、一氧化碳还原氧化铜:CO + CuO Cu + CO 25、酒精燃烧:C 2H 5OH + 3O 2 2CO 2 + 3H 2O6、甲烷燃烧:CH 4 + 2O 2 CO 2 + 2H 2O△点燃 点燃。


初中常见化学式初中常见化学方程式20.碳酸分解H2CO3 △CO2+H2O21.煅烧石灰石CaCO3高温CaO+CO2↑22.氧化汞受热分解2HgO△2Hg +O2↑三.氧化还原反应:23.氢气还原氧化铜H2+CuO△Cu+H2O24.碳还原氧化铜C+2CuO△2Cu+CO225.碳还原氧化铁3C+2Fe2O3高温4Fe+3CO2↑26.碳还原四氧化三铁2C+Fe3O4高温3Fe+2CO2↑27.一氧化碳还原氧化铜CO+CuO加热Cu+CO2↑28.一氧化碳还原氧化铁3CO+Fe2O3高温2Fe+3CO2↑29.一氧化碳还原四氧化三铁4CO+Fe3O4高温3Fe 4CO2↑四.其它反反应:30.氧化钙与水反应CaO+H2O=Ca(OH)231.氧化钠与水反应Na2O+H2O=2NaOH32.三氧化硫与水反应SO3+H2O=H2SO433.木碳与二氧化碳反应C+CO2 高温2CO五.二氧化碳类:34.二氧化碳与水反应CO2+H2O=H2CO335.二氧化碳与澄清石灰水反应(检验二氧化碳)CO2+Ca(OH)2=CaCO3↓+H2O36.实验室制取二氧化碳CaCO3+2HCl=CaCl2+H2O+CO2↑37.泡沫灭火的原理Na2CO3+2HCl=2NaCl+H2O+CO2↑38.氢氧化钠与二氧化碳的反应2NaOH+CO2=Na2CO3+H2O39.氢氧化钠与二氧化硫的反应2NaOH+SO2=Na2SO3+H2O化学方程式配平的几种方法一、观察法观察法配平化学方程式是最基本的方法也是常用的配平方法,任何特殊的配平方法都离不开观察法的配合。
对于一些比较简单的化学反应,配平时可直接观察看出结果。
对于这样的化学方程式,首先观察某反应物与生成物的关系,根据关系确定反应物与生成物的化学计量数。
例如配平时,通过观察很容易看出,反应方程式左边是一个氧原子,而反应方程式右边是两个氧原子,在前配2,结果中氢原子的个数变成4,再在前配上2,观察可以看出此化学方程式已配平:。

初中常见化学式➢常见的化学式初中化学方程式全〔已配平〕. 一、化合反响 1、镁在空气中燃烧:2Mg+ O 2点燃 2MgO 2、铁在氧气中燃烧:3Fe +2O 2点燃 Fe 3O 43、铝在空气中燃烧:4Al+ 3O 2点燃 2Al 2O 34、氢气在空气中燃烧:2H 2 +O 点燃 2H 2O 5、红磷在空气中燃烧:4P 点燃 2P 2O 56、硫粉在空气中燃烧:点燃 SO 27、碳在氧气中充分燃烧:2 点燃 CO 2 8、碳在氧气中不充分燃烧:2 点燃 2CO 9、二氧化碳通过+CO 高温 2CO 102CO +O 2 点燃 2CO 211、:CO 2+H 2O === H 23溶于水:CaO+ H 2O === Ca(OH)213、无水硫酸铜作枯燥剂:CuSO 4+5H 2O ==== CuSO 4·5H 2O 14、钠在氯气中燃烧:2Na+ Cl 2点燃 2NaCl 二、分解反响 15、实验室用双氧水制氧气:2H 2O 2MnO 2 2H 2O +O 2↑162KMnO 4 加热 K 2MnO4 + MnO 2+O 2↑172H 2O 通电 2H 2↑+O 2↑物理学报不稳定而分解:H 2CO 3 === H 2O +CO 2↑工业制法〕:CaCO 高温 CaO+ CO 2↑三、置换反响 20、铁和硫酸铜溶液反响:Fe+ CuSO 4 == FeSO 4 :Zn+ H 2SO 4 == ZnSO 4+H 2↑22、镁和稀盐酸反响:Mg +2HCl === MgCl 2+H 2↑23、氢气复原氧化铜:H 2+CuO 加热 Cu +H 2O 24、木炭复原氧化铜:C+ 2CuO 高温 2Cu +CO 2↑25、甲烷在空气CH 4+2O 2 点燃 CO 2+2H 2O 26、H 2O +C 高温 H 2+CO 27、2O 3高温 4Fe +3CO2↑其他 28铜溶液反响:2NaOH+ CuSO 4 2↓+ Na 2SO4 29、甲烷在空气中燃烧:CH 4+2O 2点燃 CO 2+2H 2O 30、酒精在空气中燃烧:C 2H 5OH+ 3O 2点燃 2CO 2+3H 2O 31、一氧化CO +CuO 加热 Cu+ CO 2323CO+ Fe 2O 3高温 2Fe+ 3CO 233:Ca(OH)2+ CO 2 3 ↓+ H 2O 34、氢氧化钠和二氧化碳反响〔除去二氧化碳〕:2NaOH+ CO 2 ==== Na 2CO 3 +H 2O 35、石灰石〔或小学音乐教案某某石〕与稀盐酸反响〔二氧化碳的实验室制法〕:CaCO 3+2HCl === CaCl 2+H 2O +CO 2↑36、碳酸钠与浓盐酸反响〔泡沫灭火器的原理〕: Na2CO 3+ 2HCl === 2NaCl +H 2O +CO 2↑一. 物质与氧气的反响: 〔1〕单质与氧气的反响: 1. 镁在空气中燃烧:2Mg+ O 2点燃 2MgO 2. 铁在氧气中燃烧:3Fe+ 2O 点燃 Fe 3O 43. 铜在空气中受热:加热 2CuO 4. 铝在空气中燃烧:4Al 点燃 2Al 2O 3 5. 氢气中空气中燃烧:2H 22 点燃 2H 2O 6. 红磷在空气中燃烧:点燃 2P 2O 57. 硫粉在空气中燃烧: 2 点燃 SO 2 8. 碳在氧气中充分燃烧:点燃 CO 2 9. 碳在氧气中不充分燃烧:点燃 2CO 〔2一氧化碳在氧气中燃烧:2CO+ O 点燃 2CO 211. 甲烷在空气中燃烧:CH 4+2O 2点燃 CO 2 2H 2O 12. 25OH +3O 2点燃 2CO 2+3H 2O 13. 水在直流电的作用下分新概念英语第一册解:2H2O 通电 2H2↑+ O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO加热 2CuO +H2O+CO2↑15. :2KClO3216. 加热高锰酸钾:2KMnO4 加热 K2MnO4+MnO2+O2↑17. 碳酸不稳定而分解:H2CO3=== H2O+CO2↑18. CaCO3高温 CaO +CO2↑三.几个氧化复原反响:19.氢气复原氧化铜:H2+ CuO 加热 Cu+2木炭复原氧化铜:C+ 2CuO 高温 2Cu+CO2↑2 21. 焦炭复原氧化铁:3C+ 2Fe2O高温 4Fe+3CO2↑22. 焦炭复原四氧化三铁:2C +Fe3O4高温 3Fe+ 2CO2↑23.氧化铜:CO +CuO 加热 Cu+ CO2 24. 一氧化碳复原氧化铁:3CO+ Fe2O高温 2Fe+3CO225. 4CO +Fe3O4高温 3Fe+ 4CO2化物、酸、碱、盐的相互关系〔1〕金属单质+盐+氢气〔置换反响〕26. 锌和稀硫酸Zn+ H2SO4= ZnSO4+ H2↑27. 铁和稀硫酸Fe +H2SO4= FeSO4+H 2↑28. 镁和稀硫酸Mg +H2SO4= MgSO4+H2↑29. 铝和稀硫酸2Al+ 3H2SO4=Al2(SO4)3+3H2↑30. 锌和稀盐酸Zn +2HCl === ZnCl2+ H2↑31. 铁和稀盐酸Fe+2HCl === FeCl2+ H2↑32. 镁和语文教案格式稀盐酸Mg 2HCl === MgCl2+ H2↑33.铝和稀盐酸2Al+ 6HCl == 2AlCl3+3H2↑〔2〕金属单质+盐〔溶液〕 ------- 另一种金属+另一种盐34. 铁和硫酸铜溶液反响:Fe+ CuSO4=== FeSO4+ Cu 35. 锌和硫酸铜溶液反响:Zn+ CuSO4 === ZnSO4+ Cu 36. 铜和硝酸汞溶液反响:Cu+Hg(NO3)2=== Cu(NO3)2+Hg 〔3〕碱性氧化物+酸 -------- 盐+水37. 氧化铁和稀盐酸反响:Fe2O3+ 6HCl === 2FeCl3+ 3H2O 38. 氧化铁和稀硫酸反响:Fe2O3+3H2SO4=== Fe2(SO4)3+ 3H2O 39. 氧化铜和稀盐酸反响:CuO +2HCl ==== CuCl2+H2O40. 氧化铜和稀硫酸反响:CuO +H2SO4==== CuSO4+ H2O 41. 氧化镁和稀硫酸反响:MgO+ H2SO4==== MgSO4+ H2O 42. 氧化钙和稀盐酸反响:CaO +2HCl ====CaCl2+H2O 〔4〕酸性氧化物+碱 -------- 盐+水43.苛性钠暴露在空气中变质:2NaOH +CO2 ==== Na2CO3+H2O 44.苛性钠吸收二氧化硫气体:2NaOH +SO2====Na2SO3+H2O 45.苛性钠吸收三氧化硫气体:2NaOH+ SO3==== Na2SO4+ H2O 46.消石灰放在空气中变质:Ca(OH)2+ CO2==== CaCO3↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2+SO2==== CaSO3↓+H2O 〔5〕酸+碱 -------- 盐+水48.盐酸和烧碱起反响:HCl+ NaOH ==== NaCl+ H2O 49. 盐酸和氢氧化钾反响:HCl+ KOH ====KCl+H2O 50.盐酸和氢氧化初中家长会课件铜反响:2HCl+ Cu(OH)2==== CuCl2+2H2O51. 盐酸和氢氧化钙反响:2HCl+ Ca(OH)2 ==== CaCl2+2H2O 52. 盐酸和氢氧化铁反响:3HCl+ Fe(OH)3 ==== FeCl3+3H2O 53.氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3 ==== AlCl3+3H2O 54.硫酸和烧碱反响:H2SO4 +2NaOH ==== Na2SO4+2H2O55.硫酸和氢氧化钾反响:H2SO4 +2KOH ==== K2SO4+2H2O 56.硫酸和氢氧化铜反响:H 2SO4 +Cu(OH)2==== CuSO4+2H2O 57. 硫酸和氢氧化铁反响:3H2SO4+2Fe(OH)3====Fe2(SO4)3+ 6H2O 58. 硝酸和烧碱反响:HNO3+ NaOH ==== NaNO3+H2O 〔6〕酸+盐-------- 另一种酸+另一种盐59.某某石与稀盐酸反响:CaCO3+2HCl === CaCl2H 2O +CO2↑60.碳酸钠与稀盐酸反响: Na2CO3+2HCl === 2NaCl +H2O+ CO2↑61.碳酸镁与稀盐酸反响: MgCO3 +2HCl === MgCl2+H2O+CO2↑62.盐酸和硝酸银溶液反响:HCl+ AgNO3 === AgCl↓+ HNO363.硫酸和碳酸钠反响:Na2CO3+H2SO4===Na2SO4+H2O +CO2↑64.硫酸和氯化钡溶液反响:H2SO4+BaCl2==== BaSO4↓+ 2HCl 〔7〕碱+盐 -------- 另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH CuSO4====Cu(OH)2↓ Na2SO466.氢氧化钠与氯化铁:3NaOH FeCl3==== Fe(OH)3↓ 3NaCl67.氢氧化钠与氯化镁:2NaOH MgCl2 ==== Mg(OH)2↓ 2NaCl 68. 氢氧化钠与氯化铜:2NaOH CuCl2==== Cu(OH)2↓ 2NaCl 69. 氢氧化钙与碳酸钠:Ca(OH)2Na2CO3=== CaCO 3↓ 2NaOH 〔8〕盐+ 盐 ----- 两种新盐 70.氯化钠溶液新概念英语第二册和硝酸银溶液:NaCl +AgNO 3 ==== AgCl ↓+ NaNO 371.硫酸钠和氯化钡:Na 2SO 4+ BaCl 2 ==== BaSO 4↓+ 2NaCl 五.其它反响: 72.二氧化碳溶解于水:CO 2+ H 2O === H 2CO 3 73.生石灰溶于水:CaO+ H 2O === Ca(OH)274.氧化钠溶于水:Na 2O +H 2O ==== 2NaOH 75.三氧化硫溶于水:SO 3+H 2O ==== H 2SO 476.硫酸铜晶体受热分解:CuSO 4·5H 2O 加热 CuSO 4 5H 2O 77.无水硫酸铜作枯燥剂:CuSO 4+ 5H 2O ==== CuSO 4·5H 2反响现象 应用 2Mg+ O 2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟 白色信号弹 2Hg +O 点燃或Δ2HgO 银白液体、生成红色固体 拉瓦锡实验 2Cu+ O 点燃或Δ2CuO 固体 4Al+ 3O 点燃或Δ2Al 2O 3 2O 点燃Fe3O4 剧烈 4Fe +3O2高温2Fe 2O 3点燃CO 2 剧烈燃烧、白光、放热、使石灰水变浑浊 S +O 2点燃SO 2热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰 2H 2 O 点燃2H 2O 淡蓝火焰、放热、生成使无水CuSO 4变蓝的液体〔水〕 高能燃料 4P +5O2 点燃2P 2O 5 剧烈燃烧、大量白烟、放热、生成白色固体 证明空气中氧气含量 CH 4点燃2H 2O+ CO 2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO 4 甲烷和天然气的燃烧 2C 2H 2+ 5O 2点燃2H 2O +4CO 2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO 4变蓝的液体〔水〕 氧炔焰、焊接切割金属 2KClO 3MnO2、Δ2KCl +3O 2↑ 生成使带火星的木条复燃的气体 实验室制备氧气 2KMnO 4Δ K2MnO 4 MnO 2+O 2↑ 紫色变为黑色、生成使带火星木条复燃的气体 实验 2HgO Δ2Hg+ O 2↑ 红色变为银白、生成使带火星木条复燃的气体 拉瓦锡实验通电2H 2↑+ O 2↑ 水通电分解为氢气和氧气 电解水 Cu 2(OH)2CO 3Δ2CuO +H 2O+ CO 2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体 4HCO 3ΔNH 3↑+ H 2O+ CO 2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体 Zn+ H 2SO 4=ZnSO 4+H 2↑ 有大量气泡产生、锌粒逐渐溶解 实验室制备氢气 Fe +H 2SO 4=FeSO 4+H 2↑ 有大量气泡产生、金属颗粒逐渐溶解 Mg +H 2SO 4 =MgSO 4+H 2↑ 有大量气泡产生、金属颗粒逐渐溶解 2Al+ 3H 2SO 4=Al 2(SO4)3+ 3H 2↑ 有大量气泡产生、金属颗粒逐渐溶解 Fe 2O 3+3H 2Δ 2Fe +3H 2O 红色逐渐变为银白色、试管壁有液体 Fe 3O 4+4H 2 Δ3Fe+ 4H 2O 黑色逐渐变为银白色英语翻译、试管壁有液体 冶炼金属、 WO 3+3H 2Δ W +3H 2O 冶炼金属钨、利用氢气的复原性 MoO 3+3H 2ΔMo +3H 2O 冶炼金属钼、 2Na+ Cl 2Δ或点燃2NaCl 剧烈燃烧、 离子化合物的形成、 H 2+Cl 点燃或光照 2HCl 白雾 共价化合物的形成、制备盐酸 4 2↓+ Na 2SO 4 蓝色沉淀生成、上部为澄清溶液 质量守恒定律实验 2C +O 2点燃2CO 煤炉中常见反响、空气污染物之一、煤气中毒原因 2CO +O 点燃2CO 2 煤气燃烧 C+ CuO 高温2Cu+ CO 2↑ 黑色逐渐变为红色、 冶炼金属 23+ 3C 高温4Fe+ 3CO 2↑ 冶炼金属 Fe 3O 4+2C 高温3Fe+ 2CO 2↑ 冶炼金属 C+ CO2 高温2CO CO 2+H 2O = H 2CO 3 碳酸使石蕊变红 2 3 ΔCO 2↑+ H 2O 石蕊红色褪去 Ca(OH)2 +CO 2= CaCO 3↓+ H 2O 澄清石灰水变浑浊 检验和石灰浆粉刷墙壁 CaCO 3 +H 2O+ CO 2 = Ca(HCO 3)2 白色沉淀逐渐溶解 溶洞的形成,石头的风化 Ca(HCO 3)2Δ CaCO 3↓+ H 2O +CO 2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体 水垢形成. 2NaHCO 3ΔNa 2CO 3+ H 2O +CO 2↑ 产生使澄清石灰水变浑浊的气体 小苏打蒸馒头 CaCO 3 高温 CaO +CO 2↑工业制备二氧化碳和生石灰 CaCO 3 +2HCl=CaCl 2+ H 2O +CO 2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 实验室制备二氧化碳、除水垢初中化学方程式汇总 一、 氧气的性质: 〔1〕单质与氧气的反响:〔化合反响〕 1. 镁在空气中燃烧:2Mg+ O 点燃 2MgO 2. 铁在氧气中燃烧:3Fe+ 2O 点燃 Fe 3O 43. 铜在空气中受热:2Cu+ O 加热 2CuO 4. 铝在空气中燃烧:4Al +3O2 点燃2Al 2O 35. 氢气中空气中燃烧:2H 2 2 点燃 2H 2O 6. 验〕:4P +5O 2点燃 2P 2O 5 S +O 2 点燃 SO 2 8. 碳在氧气中充分燃烧:C +O 点燃 CO 29. 碳在氧气中不充分燃烧:2C +O 点燃 2CO 〔2〕化一氧化碳在氧气中燃烧:2CO+O 点燃 2CO 2 11. 甲烷在空气中燃烧:CH 4+2O 2点燃 CO 2+2H 2O 12. C 2H 5OH +3O 2点燃 2CO 2+3H 2O 〔3〕 13.玻义耳研究空气的成分实验 2HgO 加热 Hg 2 ↑14.加热高锰酸钾:2KMnO 4加热 K 2MnO 4+ MnO 2+O 2↑.过氧化氢在二氧化锰作催化剂条件下分解反响: H 2O 2MnO 22H 2O+ O 2↑〔实验室制氧气原理2〕 二、自然界中的水: 16实验〕:2H 2O 通电 2H 2↑+O 2 ↑17.生石灰溶于水英语六级作文:CaO +H 2O == Ca(OH)218 H 2O+CO 2==H 2CO 3三、质量守恒定律: 19.镁在空气中燃烧:2Mg+ O 2点燃 2MgO 20.铁和硫酸铜溶液反响:Fe+ CuSO 4 === FeSO 4+ Cu 21.氢气复原氧化铜:H 2 +CuO 加热 Cu +H 2O 22. 镁复原氧化铜:Mg+ CuO 加热 Cu +MgO 〕碳的化学性质 23. 碳在氧气中充分燃烧:C + O 点燃 CO 224.木炭复原氧化铜:C + 2CuO 高温 2Cu+ CO 2↑25. 3 高温 4Fe + 3CO 2↑〔2〔几个化合反响〕 26+O 2 点燃 CO 227.煤炉的中层:CO 2+ C 高温 2CO 28.煤炉的上部蓝色火焰的产生:点燃 2CO 2〔3 29.某某石与稀盐酸反响〔实: CaCO 3+ 2HCl == CaCl 2+ H 2O +CO 2↑30.碳酸不稳定而分解:H 2CO 3 == H 2O +CO 2↑31.二氧化碳可溶于水: H 2O +CO 2== H 2CO 3 32.高温煅烧石灰石〔工业制二氧化碳〕:CaCO 3高温 CaO+ CO 2↑33.石灰水与中学历史教学园2+CO 2 === CaCO 3↓+H 2O 〔4〕一氧化碳的性质: 34.一氧化碳复原氧化铜:CO+ CuO 加热 Cu +CO 235.一氧化碳的可燃性:2CO +O 2点燃 2CO 2其它反响: 36理〕: Na 2CO 32O +CO 2↑五、燃料与其利用: 37.甲烷在空气中燃烧:CH 4+2O 点燃 CO 2+2H 2O 38.酒精在空气中燃烧:C 2H 5OH +3O2 点燃 2CO 2+3H 2O 39. 2H 2+ O 点燃 2H 2O 六、金属 〔1〕 40. 镁在空气中燃烧:2Mg+ O 点燃 2MgO . 铁在氧气中燃烧:3Fe +2O 点燃 Fe 3O 442. 铜在空气中受热:2加热 2CuO 43. 2 = 2Al 2O 3〔2〕金属单质 酸盐 氢气 〔置换反响〕 44. 锌和稀硫酸Zn+ H 2SO 4 = ZnSO 4+ H 2↑45. 铁和稀硫酸Fe +H 2SO 4 = FeSO 4+H 2↑46. 镁和稀硫酸Mg +H 2SO 4 = MgSO 4+ H 2↑47. 铝和稀硫酸2Al+ 3H 2SO 4 = Al 2(SO 4)3+3H 2↑48. 锌和稀盐酸Zn+ 2HCl == ZnCl 2+ H 2↑49. 铁和稀盐酸Fe +2HCl == FeCl 2+H 2↑50. 镁和稀盐酸Mg +2HCl == MgCl 2+ H 2↑51.铝和稀盐酸2Al+ 6HCl == 2AlCl 3+3H 2↑〔3〕金属单质 盐怎样学好高中物理〔溶液〕 ------- 新金属 新盐 52. 铁和硫酸铜溶液反响:Fe +CuSO 4 == FeSO 4+Cu 53. 锌和硫酸铜溶液反响:Zn +CuSO 4 ==ZnSO 4+Cu 54. 铜和硝酸汞溶液反响:Cu +Hg(NO 3)2 == Cu(NO 3)2+Hg 〔3〕金属铁的治炼原理: 55.3CO +2Fe 2O 3 高温 4Fe +3CO 2↑七、酸、碱、盐 1、酸的化学性质 〔1〕word酸金属 -------- 盐氢气〔见上〕〔2〕酸金属氧化物-------- 盐水 56. 氧化铁和稀盐酸反响:Fe2O3+6HCl ==2FeCl3+3H2O 57. 氧化铁和稀硫酸反响:Fe2O3+3H2SO4 == Fe2(SO4)3+3H2O 58. 氧化铜和稀盐酸反响:CuO +2HCl==CuCl2+H2O 59. 氧化铜和稀硫酸反响:CuO+ H2SO4 == CuSO4+ H2O 〔3〕酸碱-------- 盐水〔中和反响〕 60.盐酸和烧碱起反响:HCl +NaOH == NaCl+H2O61. 盐酸和氢氧化钙反响:2HCl+ Ca(OH)2 == CaCl2+2H2O 62. 氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 == AlCl3+3H2O 63. 硫酸和烧碱反响:H2SO4+ 2NaOH== Na2SO4+2H2O 〔4〕酸盐 -------- 另一种酸另一种盐 64.某某石与稀盐酸反响:CaCO3+2HCl == CaCl2+H2O+ CO2↑65.碳酸钠与稀盐酸反响: Na2CO3+2HCl ==2NaCl+ H2O+ CO2↑66.碳酸氢钠与稀盐酸反响:NaHCO3+HCl== NaCl+H2O+ CO2↑67. 硫酸和氯化钡溶液反响:H2SO4+BaCl2== BaSO4↓+2HCl 2、碱的幼儿园小班音乐教案化学性质〔1〕碱非金属氧化物 -------- 盐水 68.苛性钠暴露在空气中变质:2NaOH+CO2== Na2CO3+ H2O 69.苛性钠吸收二氧化硫气体:2NaOH +SO2== Na2SO3+H2O 70.苛性钠吸收三氧化硫气体:2NaOH+ SO3== Na2SO4+H2O 71.消石灰放在空气中变质:Ca(OH)2+ CO2== CaCO3↓+H2O 72. 消石灰吸收二氧化硫:Ca(OH)2+SO2== CaSO3↓+ H2O 〔2〕碱酸-------- 盐水〔中和反响,方程式见上〕〔3〕碱盐 -------- 另一种碱另一种盐 73. 氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3== CaCO3↓+ 2NaOH 3、盐的化学性质〔1〕盐〔溶液〕金属单质------- 另一种金属另一种盐 74. 铁和硫酸铜溶液反响:Fe+ CuSO4==FeSO4+Cu 〔2〕盐酸-------- 另一种酸另一种盐 75.碳酸钠与稀盐酸反响:Na2CO3+2HCl == 2NaCl +H2O+ CO2↑碳酸氢钠与稀盐酸反响:NaHCO3+HCl== NaCl+H 2O +CO2↑〔3〕盐碱 -------- 另一种碱另一种盐 76. 氢氧化钙与碳酸钠:Ca(OH)2 +Na2CO3== CaCO3↓+ 2NaOH 〔4〕盐盐 ----- 两种新盐 77.氯化钠溶液和硝酸银溶液:NaCl +AgNO3== AgCl↓+NaNO378.硫酸钠和氯化钡:Na2SO4+BaCl2== BaSO4↓+2NaCl 一、其他反响类型1、二氧化碳通入澄清石灰水中:CO2 + Ca(OH)2== CaCO3↓+ H2O2、氢氧化钠在空气中变质:CO2+ 2NaOH = Na2CO3+ H2O3、氢氧化钠溶液吸收二氧化硫:SO2 + 2NaOH==Na2SO3+ H2O4、一氧化碳复原氧化铜:CO + CuO Cu + CO25、酒精燃烧:C2H5OH + 3O22CO2+ 3H2O6、甲烷燃烧:CH4 + 2O2CO2+ 2H2O△点燃点燃。

初中常见化学式及化学方程式➢常见的化学式一、常见单质二、化合物初中化学方程式全(已配平).一、化合反应1、镁在空气中燃烧:2Mg+ O2点燃 2MgO2、铁在氧气中燃烧:3Fe +2O2点燃 Fe3O43、铝在空气中燃烧:4Al+ 3O2点燃 2Al2O34、氢气在空气中燃烧:2H2 +O2点燃 2H2O5、红磷在空气中燃烧:4P +5O2点燃 2P2O56、硫粉在空气中燃烧: S+ O2点燃 SO27、碳在氧气中充分燃烧:C +O2 点燃 CO28、碳在氧气中不充分燃烧:2C +O2点燃 2CO9、二氧化碳通过灼热碳层: C +CO2高温 2CO10、一氧化碳在氧气中燃烧:2CO +O2 点燃 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O === H2CO312、生石灰溶于水:CaO+ H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 +5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na+ Cl点燃 2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O +O2↑16、加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 +O2↑17、水在直流电的作用下分解:2H2O 通电 2H2↑+O2↑18、碳酸化学物理学报不稳定而分解:H2CO3 === H2O +CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温 CaO+ CO2↑三、置换反应20、铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu21、锌和稀硫酸反应(实验室制氢气):Zn+ H2SO4 == ZnSO4+H2↑22、镁和稀盐酸反应:Mg +2HCl === MgCl2 +H2↑23、氢气还原氧化铜:H2 +CuO 加热 Cu +H2O24、木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑25、甲烷在空气中燃烧:CH4 +2O2 点燃 CO2+2H2O26、水蒸气通过灼热碳层:H2O +C 高温 H2 +CO27、焦炭还原氧化铁:3C +2Fe2O3高温 4Fe +3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+ CuSO4 == Cu(OH)2↓+ Na2SO429、甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O30、酒精在空气中燃烧:C2H5OH+ 3O2点燃 2CO2 +3H2O31、一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO232、一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe+ 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+ CO2 ==== Na2CO3 +H2O35、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 +2HCl === CaCl2 +H2O +CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3+ 2HCl === 2NaCl +H2O +CO2↑一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃 Fe3O43. 铜在空气中受热:2Cu+ O2加热 2CuO4. 铝在空气中燃烧:4Al +3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H2 +O2点燃 2H2O6. 红磷在空气中燃烧:4P+ 5O2点燃 2P2O57. 硫粉在空气中燃烧: S +O2 点燃 SO28. 碳在氧气中充分燃烧:C+ O2点燃 CO29. 碳在氧气中不充分燃烧:2C+ O2点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+ O2点燃 2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2 2H2O12. 酒精在空气中燃烧:C2H5OH +3O2点燃 2CO2+3H2O二.几个分解反应:13. 水在直流电的作用下分新概念英语第一册解:2H2O 通电 2H2↑+ O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO3加热 2CuO +H2O +CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl+ 3O2↑16. 加热高锰酸钾:2KMnO4 加热 K2MnO4 +MnO2 +O2↑17. 碳酸不稳定而分解:H2CO3 === H2O +CO2↑18. 高温煅烧石灰石:CaCO3 高温 CaO +CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2+ CuO 加热 Cu+ H2O20. 木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑2 初三化学方程式大合集21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe+ 3CO2↑22. 焦炭还原四氧化三铁:2C +Fe3O4高温 3Fe+ 2CO2↑23. 一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe +3CO225. 一氧化碳还原四氧化三铁:4CO +Fe3O4高温 3Fe+ 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+酸 -------- 盐+氢气(置换反应)26. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑27. 铁和稀硫酸Fe +H2SO4 = FeSO4+ H2↑28. 镁和稀硫酸Mg +H2SO4 = MgSO4 +H2↑29. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn +2HCl === ZnCl2+ H2↑31. 铁和稀盐酸Fe+ 2HCl === FeCl2+ H2↑32. 镁和语文教案格式稀盐酸Mg 2HCl === MgCl2+ H2↑33. 铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(2)金属单质+盐(溶液) ------- 另一种金属+另一种盐34. 铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu35. 锌和硫酸铜溶液反应:Zn+ CuSO4 === ZnSO4+ Cu36. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 === Cu(NO3)2 +Hg (3)碱性氧化物+酸 -------- 盐+水37. 氧化铁和稀盐酸反应:Fe2O3+ 6HCl === 2FeCl3+ 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 === Fe2(SO4)3+ 3H2O39. 氧化铜和稀盐酸反应:CuO +2HCl ==== CuCl2 +H2O40. 氧化铜和稀硫酸反应:CuO +H2SO4 ==== CuSO4+ H2O41. 氧化镁和稀硫酸反应:MgO+ H2SO4 ==== MgSO4+ H2O42. 氧化钙和稀盐酸反应:CaO +2HCl ==== CaCl2 +H2O (4)酸性氧化物+碱 -------- 盐+水43.苛性钠暴露在空气中变质:2NaOH +CO2 ==== Na2CO3+H2O 44.苛性钠吸收二氧化硫气体:2NaOH +SO2 ==== Na2SO3 +H2O 45.苛性钠吸收三氧化硫气体:2NaOH+ SO3 ==== Na2SO4+ H2O46.消石灰放在空气中变质:Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 ==== CaSO3↓+H2O(5)酸+碱 -------- 盐+水48.盐酸和烧碱起反应:HCl+ NaOH ==== NaCl+ H2O49. 盐酸和氢氧化钾反应:HCl+ KOH ==== KCl+H2O50.盐酸和氢氧化初中家长会课件铜反应:2HCl+ Cu(OH)2==== CuCl2 +2H2O51. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 ==== CaCl2 +2H2O52. 盐酸和氢氧化铁反应:3HCl+ Fe(OH)3 ==== FeCl3 +3H2O53.氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 ==== AlCl3 +3H2O54.硫酸和烧碱反应:H2SO4 +2NaOH ==== Na2SO4 +2H2O55.硫酸和氢氧化钾反应:H2SO4 +2KOH ==== K2SO4 +2H2O56.硫酸和氢氧化铜反应:H2SO4 +Cu(OH)2 ==== CuSO4 +2H2O57. 硫酸和氢氧化铁反应:3H2SO4 +2Fe(OH)3==== Fe2(SO4)3+ 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+盐 -------- 另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO3 +2HCl === CaCl2 H2O +CO2↑ 60.碳酸钠与稀盐酸反应: Na2CO3 +2HCl === 2NaCl +H2O+ CO2↑ 61.碳酸镁与稀盐酸反应: MgCO3 +2HCl === MgCl2 +H2O+CO2↑ 62.盐酸和硝酸银溶液反应:HCl+ AgNO3=== AgCl↓+ HNO363.硫酸和碳酸钠反应:Na2CO3 +H2SO4 === Na2SO4 +H2O +CO2↑64.硫酸和氯化钡溶液反应:H2S O4 +BaCl2 ==== BaSO4↓+ 2HCl(7)碱+盐 -------- 另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH CuSO4 ==== Cu(OH)2↓ Na2SO466.氢氧化钠与氯化铁:3NaOH FeCl3 ==== Fe(OH)3↓ 3NaCl 67.氢氧化钠与氯化镁:2NaOH MgCl2 ==== Mg(OH)2↓ 2NaCl68. 氢氧化钠与氯化铜:2NaOH CuCl2 ==== Cu(OH)2↓ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 Na2CO3 === CaCO3↓ 2NaOH(8)盐+盐 ----- 两种新盐70.氯化钠溶液新概念英语第二册和硝酸银溶液:NaCl +AgNO3 ==== AgCl↓+ NaNO371.硫酸钠和氯化钡:Na2SO4+ BaCl2 ==== BaSO4↓+ 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2+ H2O === H2CO373.生石灰溶于水:CaO+ H2O === Ca(OH)274.氧化钠溶于水:Na2O +H2O ==== 2NaOH75.三氧化硫溶于水:SO3 +H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 5H2O77.无水硫酸铜作干燥剂:CuSO4+ 5H2O ==== CuSO4·5H2化学方程式反应现象应用2Mg+ O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg +O点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+ O点燃或Δ2CuO 红色金属变为黑色固体4Al+ 3O点燃或Δ2Al2O3银白金属变为白色固体3Fe+ 2O点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe +3O2高温2Fe2O3C+ O2点燃CO2剧烈燃烧、白光、放热、使石灰水变浑浊S +O2点燃SO2剧大学英语四级烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2 O2点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P +5O2 点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O点燃2H2O+ CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+ 5O2点燃2H2O +4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2、Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4 MnO2 +O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧论文气2HgOΔ2Hg+ O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+ O2↑ 水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO +H2O+ CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O+ CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+ H2SO4=ZnSO4 +H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe +H2SO4=FeSO4 +H2↑ 有大量气泡产生、金属颗粒逐渐溶解Mg +H2SO4 =MgSO4 +H2↑ 有大量气泡产生、金属颗粒逐渐溶解2Al+ 3H2SO4=Al2(SO4)3+ 3H2↑ 有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2Δ 2Fe +3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4 +4H2 Δ3Fe+ 4H2O 黑色逐渐变为银白色英语翻译、试管壁有液体冶炼金属、利用氢气的还原性WO3 +3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性MoO3 +3H2ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+ Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4 +2NaOH=Cu(OH)2↓+ Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2CO +O点燃2CO2蓝色火焰煤气燃烧C+ CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+ 3C 高温4Fe+ 3CO2↑ 冶炼金属Fe3O4 +2C高温3Fe+ 2CO2↑ 冶炼金属C+ CO2 高温2COCO2+H2O = H2CO3碳酸使石蕊变红证明碳酸的酸性小学三语文教学论文H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2 +CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3 +H2O+ CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+ H2O +CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+ H2O +CO2↑ 产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温 CaO +CO2↑ 工业制备二氧化碳和生石灰CaCO3 +2HCl=CaCl2+ H2O +CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢初中化学方程式汇总一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃 Fe3O43. 铜在空气中受热:2Cu+ O2加热 2CuO4. 铝在空气中燃烧:4Al +3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 +O2 点燃 2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P +5O2点燃 2P2O57. 硫粉在空气中燃烧: S +O2 点燃 SO28. 碳在氧气中充分燃烧:C +O2点燃 CO29. 碳在氧气中不充分燃烧:2C +O2点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+O2点燃 2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O12. 酒精在空气中燃烧:C2H5OH +3O2点燃 2CO2 +3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO 加热 Hg +O2 ↑14.加热高锰酸钾:2KMnO4加热 K2MnO4+ MnO2 +O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应: H2O2MnO22H2O+ O2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2通电2H2↑+O2 ↑17.生石灰溶于水英语六级作文:CaO +H2O == Ca(OH)218.二氧化碳可溶于水: H2O+CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg+ O2点燃 2MgO20.铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu21.氢气还原氧化铜:H2 +CuO 加热 Cu +H2O22. 镁还原氧化铜:Mg+ CuO 加热 Cu +MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2点燃 CO224.木炭还原氧化铜:C + 2CuO 高温 2Cu+ CO2↑25.焦炭还原氧化铁:3C + 2Fe2O3高温 4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C +O2 点燃 CO227.煤炉的中层:CO2+ C 高温 2CO28.煤炉的上部蓝色火焰的产生:2CO +O2点燃 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3+ 2HCl == CaCl2+ H2O +CO2↑30.碳酸不稳定而分解:H2CO3 == H2O +CO2↑31.二氧化碳可溶于水: H2O +CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3高温 CaO+ CO2↑ 33.石灰水与中学历史教学园地二氧化碳反应(鉴别二氧化碳):Ca(OH)2 +CO2 === CaCO3↓+H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热 Cu +CO2 35.一氧化碳的可燃性:2CO +O2点燃 2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 2HCl == 2NaCl+ H2O +CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O 38.酒精在空气中燃烧:C2H5OH +3O2 点燃 2CO2 +3H2O 39.氢气中空气中燃烧:2H2+ O2点燃 2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg+ O2点燃 2MgO41.铁在氧气中燃烧:3Fe +2O2点燃 Fe3O442. 铜在空气中受热:2Cu +O2加热 2CuO43. 铝在空气中形成氧化膜:4Al+ 3O2 = 2Al2O3(2)金属单质酸 -------- 盐氢气(置换反应)44. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑45. 铁和稀硫酸Fe +H2SO4 = FeSO4 +H2↑46. 镁和稀硫酸Mg +H2SO4 = MgSO4+ H2↑47. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑48. 锌和稀盐酸Zn+ 2HCl == ZnCl2+ H2↑49. 铁和稀盐酸Fe +2HCl == FeCl2 +H2↑50. 镁和稀盐酸Mg +2HCl == MgCl2+ H2↑51.铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(3)金属单质盐怎样学好高中物理(溶液) ------- 新金属新盐52. 铁和硫酸铜溶液反应:Fe +CuSO4 == FeSO4 +Cu53. 锌和硫酸铜溶液反应:Zn +CuSO4 ==ZnSO4 +Cu54. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 == Cu(NO3)2 +Hg(3)金属铁的治炼原理:55.3CO +2Fe2O3 高温 4Fe +3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸金属 -------- 盐氢气(见上)(2)酸金属氧化物-------- 盐水56. 氧化铁和稀盐酸反应:Fe2O3 +6HCl ==2FeCl3 +3H2O57. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 == Fe2(SO4)3 +3H2O58. 氧化铜和稀盐酸反应:CuO +2HCl ==CuCl2 +H2O59. 氧化铜和稀硫酸反应:CuO+ H2SO4 == CuSO4+ H2O(3)酸碱 -------- 盐水(中和反应)60.盐酸和烧碱起反应:HCl +NaOH == NaCl+H2O61. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 == CaCl2+2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 == AlCl3 +3H2O63. 硫酸和烧碱反应:H2SO4+ 2NaOH == Na2SO4 +2H2O(4)酸盐 -------- 另一种酸另一种盐64.大理石与稀盐酸反应:CaCO3+2HCl == CaCl2 +H2O+ CO2↑ 65.碳酸钠与稀盐酸反应: Na2CO3 +2HCl == 2NaCl+ H2O+ CO2↑ 66.碳酸氢钠与稀盐酸反应:NaHCO3 +HCl== NaCl+H2O+ CO2↑ 67. 硫酸和氯化钡溶液反应:H2SO4 +BaCl2 == BaSO4↓+2HCl 2、碱的幼儿园小班音乐教案化学性质(1)碱非金属氧化物 -------- 盐水68.苛性钠暴露在空气中变质:2NaOH+CO2 == Na2CO3+ H2O 69.苛性钠吸收二氧化硫气体:2NaOH +SO2 == Na2SO3 +H2O 70.苛性钠吸收三氧化硫气体:2NaOH+ SO3 == Na2SO4 +H2O 71.消石灰放在空气中变质:Ca(OH)2+ CO2 == CaCO3↓+H2O 72. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 == CaSO3↓+ H2O (2)碱酸-------- 盐水(中和反应,方程式见上)(3)碱盐 -------- 另一种碱另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 +Na2CO3 == CaCO3↓+ 2NaOH 3、盐的化学性质(1)盐(溶液)金属单质------- 另一种金属另一种盐74. 铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu(2)盐酸-------- 另一种酸另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 +2HCl == 2NaCl +H2O+ CO2↑ 碳酸氢钠与稀盐酸反应:NaHCO3 +HCl== NaCl+ H2O +CO2↑(3)盐 碱 -------- 另一种碱 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 +Na 2CO 3 == CaCO 3↓+ 2NaOH (4)盐 盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl +AgNO 3 == AgCl↓+NaNO 3 78.硫酸钠和氯化钡:Na 2SO 4 +BaCl 2 == BaSO4↓+2NaCl一、其他反应类型1、二氧化碳通入澄清石灰水中:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O2、氢氧化钠在空气中变质:CO 2+ 2NaOH = Na 2CO 3 + H 2O3、氢氧化钠溶液吸收二氧化硫:SO 2 + 2NaOH ==Na 2SO 3+ H 2O4、一氧化碳还原氧化铜:CO + CuO Cu + CO 25、酒精燃烧:C 2H 5OH + 3O 2 2CO 2 + 3H 2O6、甲烷燃烧:CH 4 + 2O 2 CO 2 + 2H 2O△点燃 点燃。

初中常有物质化学式一、常有单质化学式氢气H2氮气N2氯气Cl 2氧气O2 臭氧O3 氦气He氖气Ne氩气Ar碳C硅Si 硫S磷P碘I2钾K 钙Ca钠Na镁Mg铝Al锌Zn 铁Fe铜Cu汞Hg银Ag二、化合物化学式1、氧化物水H2 O 三氧化硫SO3 一氧化碳CO 二氧化碳CO2五氧化二磷P2O5 过氧化氢H2O2 二氧化氮NO2 二氧化硫SO2氧化钙CaO 氧化亚铁FeO 氧化铁Fe2O3 四氧化三铁Fe3O4氧化镁MgO氧化锌ZnO二氧化MnO2氧化汞HgO锰氧化铝Al 2O3氧化铜CuO氧化亚Cu2O铜2、其余化合物硝酸HNO3硫酸H2SO4盐酸HCl碳酸H2CO3硫化氢H2S醋酸CH3COOH 氢氧化NaOH氢氧化KOH钠钾氢氧化Ca(OH)2氢氧化Mg(OH)2氢氧化Al(OH) 3氢氧化Zn(OH)2 钙镁铝锌氢氧化Fe(OH)3氢氧化Fe(OH)2氢氧化Cu(OH)2氢氧化Ba(OH)2 铁亚铁铜钡氨水NH3·H2O氨气NH3氯化钠NaCl氯化铜CuCl2氯化铝AlCl 3氯化钾KCl氯化亚FeCl2氯化铁FeCl3铁氯化银AgCl氯化钙CaCl2氯化镁MgCl2氯化钡BaCl2KMnO4 锰酸钾K2MnO4 氯化锌ZnCl2 硫酸铜CuSO4 高锰酸钾氯酸钾KClO3 碳酸钙CaCO3 硝酸钾KNO3 硝酸钠NaNO3硝酸铁Fe(NO3) 3硝酸亚Fe(NO3) 2硝酸铝Al(NO3) 3碳酸钠Na2 CO3铁NaHCO3 硫酸铁Fe2(SO4) 3 碳酸钙CaCO3 碳酸铵(NH4) 2CO3 碳酸氢钠硫酸亚FeSO4 硝酸银AgNO3 硝酸钡Ba(NO3) 2 硝酸铵NH4NO3 铁硫酸钡BaSO4 硫酸钠Na2SO4 硫酸铝Al 2(SO4) 3 甲烷CH4酒精C2H5OH 葡萄糖C6H12O6 蔗糖C12H22O11 淀粉(C6H10O5)n。

初中常见化学式➢ 常见的化学式一、常见单质二、化合物1、氧化物2、其他化合物3、常见有机化合物初中化学方程式全(已配平).一、化合反应1、镁在空气中燃烧:2Mg O2点燃 2MgO2、铁在氧气中燃烧:3Fe 2O2点燃 Fe3O43、铝在空气中燃烧:4Al 3O2点燃 2Al2O34、氢气在空气中燃烧:2H2 O2点燃 2H2O5、红磷在空气中燃烧:4P 5O2点燃 2P2O56、硫粉在空气中燃烧: S O2点燃 SO27、碳在氧气中充分燃烧:C O2 点燃CO28、碳在氧气中不充分燃烧:2C O2点燃 2CO9、二氧化碳通过灼热碳层: C CO2高温 2CO10、一氧化碳在氧气中燃烧:2CO O2 点燃 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 H2O === H2CO312、生石灰溶于水:CaO H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na Cl2点燃 2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2MnO2 2H2O O2↑16、加热高锰酸钾:2KMnO4 加热 K2MnO4 MnO2 O2↑17、水在直流电的作用下分解:2H2O 通电 2H2↑ O2↑18、碳酸化学物理学报不稳定而分解:H2CO3 === H2O CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温 CaO CO2↑三、置换反应20、铁和硫酸铜溶液反应:Fe CuSO4 == FeSO4 Cu21、锌和稀硫酸反应(实验室制氢气):Zn H2SO4 == ZnSO4H2↑22、镁和稀盐酸反应:Mg 2HCl === MgCl2 H2↑23、氢气还原氧化铜:H2 CuO 加热 Cu H2O24、木炭还原氧化铜:C 2CuO 高温2Cu CO2↑25、甲烷在空气中燃烧:CH4 2O2 点燃 CO2 2H2O26、水蒸气通过灼热碳层:H2O C 高温H2 CO27、焦炭还原氧化铁:3C 2Fe2O3高温4Fe 3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH CuSO4 == Cu(OH)2↓ Na2SO429、甲烷在空气中燃烧:CH4 2O2点燃CO2 2H2O30、酒精在空气中燃烧:C2H5OH 3O2点燃 2CO2 3H2O31、一氧化碳还原氧化铜:CO CuO加热Cu CO232、一氧化碳还原氧化铁:3CO Fe2O3高温2Fe 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 CO2==== CaCO3 ↓ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH CO2 ==== Na2CO3 H2O35、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 2HCl === CaCl2 H2O CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3 2HCl=== 2NaCl H2O CO2↑一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg O2点燃 2MgO2. 铁在氧气中燃烧:3Fe 2O2点燃 Fe3O43. 铜在空气中受热:2Cu O2加热 2CuO4. 铝在空气中燃烧:4Al 3O2点燃 2Al2O35. 氢气中空气中燃烧:2H2 O2点燃 2H2O6. 红磷在空气中燃烧:4P 5O2点燃 2P2O57. 硫粉在空气中燃烧: S O2 点燃 SO28. 碳在氧气中充分燃烧:C O2点燃CO29. 碳在氧气中不充分燃烧:2C O2点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO O2点燃 2CO211. 甲烷在空气中燃烧:CH4 2O2点燃 CO2 2H2O12. 酒精在空气中燃烧:C2H5OH 3O2点燃2CO23H2O二.几个分解反应:13. 水在直流电的作用下分新概念英语第一册解:2H2O 通电2H2↑ O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO3加热2CuO H2O CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl 3O2↑16. 加热高锰酸钾:2KMnO4 加热 K2MnO4 MnO2 O2↑17. 碳酸不稳定而分解:H2CO3 === H2O CO2↑18. 高温煅烧石灰石:CaCO3 高温 CaO CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2 CuO 加热Cu H2O20. 木炭还原氧化铜:C 2CuO 高温2Cu CO2↑2 初三化学方程式大合集21. 焦炭还原氧化铁:3C 2Fe2O3 高温4Fe 3CO2↑22. 焦炭还原四氧化三铁:2C Fe3O4高温 3Fe 2CO2↑23. 一氧化碳还原氧化铜:CO CuO 加热 Cu CO224. 一氧化碳还原氧化铁:3CO Fe2O3高温2Fe 3CO225. 一氧化碳还原四氧化三铁:4CO Fe3O4高温 3Fe 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质酸 -------- 盐氢气(置换反应)26. 锌和稀硫酸Zn H2SO4 = ZnSO4 H2↑27. 铁和稀硫酸Fe H2SO4 = FeSO4 H2↑28. 镁和稀硫酸Mg H2SO4 = MgSO4 H2↑29. 铝和稀硫酸2Al 3H2SO4 = Al2(SO4)3 3H2↑30. 锌和稀盐酸Zn 2HCl === ZnCl2 H2↑31. 铁和稀盐酸Fe 2HCl === FeCl2 H2↑32. 镁和语文教案格式稀盐酸Mg 2HCl === MgCl2 H2↑33. 铝和稀盐酸2Al 6HCl == 2AlCl3 3H2↑(2)金属单质盐(溶液) ------- 另一种金属另一种盐34. 铁和硫酸铜溶液反应:Fe CuSO4 === FeSO4 Cu35. 锌和硫酸铜溶液反应:Zn CuSO4 === ZnSO4 Cu36. 铜和硝酸汞溶液反应:Cu Hg(NO3)2 === Cu(NO3)2 Hg(3)碱性氧化物酸 -------- 盐水37. 氧化铁和稀盐酸反应:Fe2O3 6HCl === 2FeCl3 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 3H2SO4 === Fe2(SO4)3 3H2O39. 氧化铜和稀盐酸反应:CuO 2HCl ==== CuCl2 H2O40. 氧化铜和稀硫酸反应:CuO H2SO4 ==== CuSO4 H2O41. 氧化镁和稀硫酸反应:MgO H2SO4 ==== MgSO4 H2O42. 氧化钙和稀盐酸反应:CaO 2HCl ==== CaCl2 H2O(4)酸性氧化物碱 -------- 盐水43.苛性钠暴露在空气中变质:2NaOH CO2 ==== Na2CO3 H2O 44.苛性钠吸收二氧化硫气体:2NaOH SO2 ==== Na2SO3 H2O 45.苛性钠吸收三氧化硫气体:2NaOH SO3 ==== Na2SO4 H2O 46.消石灰放在空气中变质:Ca(OH)2 CO2 ==== CaCO3 ↓ H2O 47. 消石灰吸收二氧化硫:Ca(OH)2 SO2 ==== CaSO3↓ H2O(5)酸碱 -------- 盐水48.盐酸和烧碱起反应:HCl NaOH ==== NaCl H2O49. 盐酸和氢氧化钾反应:HCl KOH ==== KCl H2O50.盐酸和氢氧化初中家长会课件铜反应:2HCl Cu(OH)2 ==== CuCl2 2H2O51. 盐酸和氢氧化钙反应:2HCl Ca(OH)2 ==== CaCl2 2H2O52. 盐酸和氢氧化铁反应:3HCl Fe(OH)3 ==== FeCl3 3H2O53.氢氧化铝药物治疗胃酸过多:3HCl Al(OH)3 ==== AlCl3 3H2O54.硫酸和烧碱反应:H2SO4 2NaOH ==== Na2SO4 2H2O55.硫酸和氢氧化钾反应:H2SO4 2KOH ==== K2SO4 2H2O56.硫酸和氢氧化铜反应:H2SO4 Cu(OH)2 ==== CuSO4 2H2O57. 硫酸和氢氧化铁反应:3H2SO4 2Fe(OH)3==== Fe2(SO4)3 6H2O58. 硝酸和烧碱反应:HNO3 NaOH ==== NaNO3 H2O(6)酸盐 -------- 另一种酸另一种盐59.大理石与稀盐酸反应:CaCO3 2HCl === CaCl2 H2O CO2↑60.碳酸钠与稀盐酸反应: Na2CO3 2HCl === 2NaCl H2O CO2↑61.碳酸镁与稀盐酸反应: MgCO3 2HCl === MgCl2 H2O CO2↑62.盐酸和硝酸银溶液反应:HCl AgNO3=== AgCl↓ HNO363.硫酸和碳酸钠反应:Na2CO3 H2SO4 === Na2SO4 H2O CO2↑64.硫酸和氯化钡溶液反应:H2S O4 BaCl2 ==== BaSO4↓ 2HCl (7)碱盐 -------- 另一种碱另一种盐65.氢氧化钠与硫酸铜:2NaOH CuSO4 ==== Cu(OH)2↓ Na2SO4 66.氢氧化钠与氯化铁:3NaOH FeCl3 ==== Fe(OH)3↓ 3NaCl 67.氢氧化钠与氯化镁:2NaOH MgCl2 ==== Mg(OH)2↓ 2NaCl68. 氢氧化钠与氯化铜:2NaOH CuCl2 ==== Cu(OH)2↓ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 Na2CO3 === CaCO3↓ 2NaOH (8)盐盐 ----- 两种新盐70.氯化钠溶液新概念英语第二册和硝酸银溶液:NaCl AgNO3==== AgCl↓ NaNO371.硫酸钠和氯化钡:Na2SO4 BaCl2 ==== BaSO4↓ 2NaCl五.其它反应:72.二氧化碳溶解于水:CO2 H2O === H2CO373.生石灰溶于水:CaO H2O === Ca(OH)274.氧化钠溶于水:Na2O H2O ==== 2NaOH75.三氧化硫溶于水:SO3 H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 5H2O 77.无水硫酸铜作干燥剂:CuSO4 5H2O ==== CuSO4·5H2化学方程式反应现象应用2Mg O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu O2点燃或Δ2CuO 红色金属变为黑色固体4Al 3O2点燃或Δ2Al2O3银白金属变为白色固体3Fe 2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热4Fe 3O2高温2Fe2O3C O2点燃CO2剧烈燃烧、白光、放热、使石灰水变浑浊S O2点燃SO2剧大学英语四级烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2 O2点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P 5O2 点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH42O2点燃2H2O CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2 5O2点燃2H2O 4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2、Δ2KCl 3O2↑生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4 MnO2 O2↑紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧论文气2HgOΔ2Hg O2↑红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑ O2↑水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO H2O CO2↑绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑ H2O CO2↑白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn H2SO4=ZnSO4 H2↑有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe H2SO4=FeSO4 H2↑有大量气泡产生、金属颗粒逐渐溶解Mg H2SO4 =MgSO4 H2↑有大量气泡产生、金属颗粒逐渐溶解2Al 3H2SO4=Al2(SO4)3 3H2↑有大量气泡产生、金属颗粒逐渐溶解Fe2O3 3H2Δ 2Fe 3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4 4H2 Δ3Fe 4H2O 黑色逐渐变为银白色英语翻译、试管壁有液体冶炼金属、利用氢气的还原性WO3 3H2Δ W 3H2O 冶炼金属钨、利用氢气的还原性MoO3 3H2ΔMo 3H2O 冶炼金属钼、利用氢气的还原性2Na Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2 Cl2点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4 2NaOH=Cu(OH)2↓ Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2CO O2点燃2CO2蓝色火焰煤气燃烧C CuO 高温2Cu CO2↑黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3 3C高温4Fe 3CO2↑冶炼金属Fe3O4 2C高温3Fe 2CO2↑冶炼金属C CO2 高温2COCO2H2O = H2CO3碳酸使石蕊变红证明碳酸的酸性小学三语文教学论文H2CO3 ΔCO2↑ H2O 石蕊红色褪去Ca(OH)2 CO2= CaCO3↓ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3 H2O CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓ H2O CO2↑白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3 H2O CO2↑产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温 CaO CO2↑工业制备二氧化碳和生石灰CaCO3 2HCl=CaCl2 H2O CO2↑固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢初中化学方程式汇总一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg O2点燃2MgO2. 铁在氧气中燃烧:3Fe 2O2点燃 Fe3O43. 铜在空气中受热:2Cu O2加热 2CuO4. 铝在空气中燃烧:4Al 3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2 O2 点燃 2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P 5O2点燃2P2O57. 硫粉在空气中燃烧: S O2 点燃SO28. 碳在氧气中充分燃烧:C O2点燃 CO29. 碳在氧气中不充分燃烧:2C O2点燃2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO O2点燃 2CO211. 甲烷在空气中燃烧:CH4 2O2点燃 CO2 2H2O12. 酒精在空气中燃烧:C2H5OH 3O2点燃 2CO2 3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO 加热 Hg O2 ↑14.加热高锰酸钾:2KMnO4加热K2MnO4 MnO2 O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应: H2O2MnO22H2O O2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电2H2↑ O2 ↑17.生石灰溶于水英语六级作文:CaO H2O == Ca(OH)218.二氧化碳可溶于水: H2O CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg O2点燃2MgO20.铁和硫酸铜溶液反应:Fe CuSO4 === FeSO4 Cu21.氢气还原氧化铜:H2 CuO 加热 Cu H2O22. 镁还原氧化铜:Mg CuO 加热 Cu MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C O2点燃 CO224.木炭还原氧化铜:C 2CuO 高温2Cu CO2↑25.焦炭还原氧化铁:3C 2Fe2O3高温4Fe 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C O2 点燃 CO227.煤炉的中层:CO2 C 高温 2CO28.煤炉的上部蓝色火焰的产生:2CO O2点燃 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 2HCl == CaCl2 H2O CO2↑30.碳酸不稳定而分解:H2CO3 == H2O CO2↑31.二氧化碳可溶于水: H2O CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3高温 CaO CO2↑33.石灰水与中学历史教学园地二氧化碳反应(鉴别二氧化碳):Ca(OH)2 CO2 === CaCO3↓ H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO CuO 加热 Cu CO235.一氧化碳的可燃性:2CO O2点燃2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 2HCl == 2NaCl H2O CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 2O2点燃 CO2 2H2O38.酒精在空气中燃烧:C2H5OH 3O2 点燃2CO2 3H2O39.氢气中空气中燃烧:2H2 O2点燃 2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg O2点燃2MgO41.铁在氧气中燃烧:3Fe 2O2点燃 Fe3O442. 铜在空气中受热:2Cu O2加热2CuO43. 铝在空气中形成氧化膜:4Al 3O2 = 2Al2O3(2)金属单质酸 -------- 盐氢气(置换反应)44. 锌和稀硫酸Zn H2SO4 = ZnSO4 H2↑45. 铁和稀硫酸Fe H2SO4 = FeSO4 H2↑46. 镁和稀硫酸Mg H2SO4 = MgSO4 H2↑47. 铝和稀硫酸2Al 3H2SO4 = Al2(SO4)3 3H2↑48. 锌和稀盐酸Zn 2HCl == ZnCl2 H2↑49. 铁和稀盐酸Fe 2HCl == FeCl2 H2↑50. 镁和稀盐酸Mg 2HCl == MgCl2 H2↑51.铝和稀盐酸2Al 6HCl == 2AlCl3 3H2↑(3)金属单质盐怎样学好高中物理(溶液) ------- 新金属新盐52. 铁和硫酸铜溶液反应:Fe CuSO4 == FeSO4 Cu53. 锌和硫酸铜溶液反应:Zn CuSO4 ==ZnSO4 Cu54. 铜和硝酸汞溶液反应:Cu Hg(NO3)2 == Cu(NO3)2 Hg(3)金属铁的治炼原理:55.3CO 2Fe2O3 高温 4Fe 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸金属 -------- 盐氢气(见上)(2)酸金属氧化物-------- 盐水56. 氧化铁和稀盐酸反应:Fe2O3 6HCl ==2FeCl3 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 3H2SO4 == Fe2(SO4)3 3H2O58. 氧化铜和稀盐酸反应:CuO 2HCl ==CuCl2 H2O59. 氧化铜和稀硫酸反应:CuO H2SO4 == CuSO4 H2O(3)酸碱 -------- 盐水(中和反应)60.盐酸和烧碱起反应:HCl NaOH == NaCl H2O61. 盐酸和氢氧化钙反应:2HCl Ca(OH)2 == CaCl2 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl Al(OH)3 == AlCl3 3H2O63. 硫酸和烧碱反应:H2SO4 2NaOH == Na2SO4 2H2O(4)酸盐 -------- 另一种酸另一种盐64.大理石与稀盐酸反应:CaCO32HCl == CaCl2 H2O CO2↑65.碳酸钠与稀盐酸反应: Na2CO3 2HCl == 2NaCl H2O CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 HCl== NaCl H2O CO2↑67. 硫酸和氯化钡溶液反应:H2SO4 BaCl2 == BaSO4↓ 2HCl 2、碱的幼儿园小班音乐教案化学性质(1)碱非金属氧化物 -------- 盐水68.苛性钠暴露在空气中变质:2NaOH CO2 == Na2CO3 H2O 69.苛性钠吸收二氧化硫气体:2NaOH SO2 == Na2SO3 H2O 70.苛性钠吸收三氧化硫气体:2NaOH SO3 == Na2SO4 H2O 71.消石灰放在空气中变质:Ca(OH)2 CO2 == CaCO3↓ H2O 72. 消石灰吸收二氧化硫:Ca(OH)2 SO2 == CaSO3↓ H2O(2)碱酸-------- 盐水(中和反应,方程式见上)(3)碱盐 -------- 另一种碱另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 Na2CO3 == CaCO3↓ 2NaOH3、盐的化学性质(1)盐(溶液)金属单质------- 另一种金属另一种盐74. 铁和硫酸铜溶液反应:Fe CuSO4 == FeSO4 Cu(2)盐酸-------- 另一种酸另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 2HCl == 2NaCl H2O CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 HCl== NaCl H2O CO2↑(3)盐碱 -------- 另一种碱另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 Na2CO3 == CaCO3↓ 2NaOH (4)盐盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl AgNO3== AgCl↓ NaNO3 78.硫酸钠和氯化钡:Na2SO4 BaCl2== BaSO4↓ 2NaCl一、其他反应类型1、二氧化碳通入澄清石灰水中:CO2 Ca(OH)2 == CaCO3↓ H2O2、氢氧化钠在空气中变质:CO2 2NaOH = Na2CO3 H2O3、氢氧化钠溶液吸收二氧化硫:SO2 2NaOH==Na2SO3 H2O4、一氧化碳还原氧化铜:CO CuO Cu CO25、酒精燃烧:C2H5OH 3O2 2CO2 3H2O6、甲烷燃烧:CH4 2O2 CO2 2H2O。

初中常见化学式及化学方程式➢常见的化学式一、常见单质二、化合物初中化学方程式全(已配平)。
一、化合反应1、镁在空气中燃烧:2Mg+ O2点燃 2MgO2、铁在氧气中燃烧:3Fe +2O2点燃 Fe3O43、铝在空气中燃烧:4Al+ 3O2点燃 2Al2O34、氢气在空气中燃烧:2H2 +O2点燃 2H2O5、红磷在空气中燃烧:4P +5O2点燃 2P2O56、硫粉在空气中燃烧: S+ O2点燃 SO27、碳在氧气中充分燃烧:C +O2 点燃 CO28、碳在氧气中不充分燃烧:2C +O2点燃 2CO9、二氧化碳通过灼热碳层: C +CO2高温2CO10、一氧化碳在氧气中燃烧:2CO +O点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 +H2O === H2CO312、生石灰溶于水:CaO+ H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 +5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na+ Cl点燃 2NaCl二、分解反应15、实验室用双氧水制氧气:16、加热高锰酸钾:17、水在直流电的作用下分解:18、碳酸化学物理学报不稳定而分解:19、高温煅烧石灰石(二氧化碳工业制法):三、置换反应铁和硫酸铜溶液反应:锌和稀硫酸反应(实验室制氢气):镁和稀盐酸反应:21、氢气还原氧化铜:22、木炭还原氧化铜:23、甲烷在空气中燃烧:24、水蒸气通过灼热碳层:25、焦炭还原氧化铁:26、氢氧化钠溶液与硫酸铜溶液反应:27、甲烷在空气中燃烧:30、酒精在空气中燃烧:C2H5OH+ 3O2点燃 2CO2 +3H2O31、一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO232、一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe+ 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+ CO2 ==== Na2CO3 +H2O35、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 +2HCl === CaCl2 +H2O +CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3+ 2HCl === 2NaCl +H2O +CO2↑一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO2。

初中常见化学式及化学方程式常见的化学式一、常见单质初中化学方程式全(已配平)一、化合反应1、镁在空气中燃烧:2Mg+ O点燃 2MgO2、铁在氧气中燃烧:3Fe +2O点燃 Fe3O43、铝在空气中燃烧:4Al+ 3O点燃 2Al2O34、氢气在空气中燃烧:2H2 +O点燃 2H2O5、红磷在空气中燃烧:4P +5O点燃 2P2O56、硫粉在空气中燃烧: S+ O点燃 SO27、碳在氧气中充分燃烧:C +O2 点燃CO28、碳在氧气中不充分燃烧:2C +O点燃 2CO9、二氧化碳通过灼热碳层: C +CO高温 2CO10、一氧化碳在氧气中燃烧:2CO +O2 点燃 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 +H2OH2CO312、生石灰溶于水:CaO+ H2O Ca(OH)2二、分解反应15、实验室用双氧水制氧气:2H2O2MnO2 2H2O +O2↑16、加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 +O2↑MnO加热氯酸钾和二氧化锰混合物:2KClO322KCl+3O2↑17、水在直流电的作用下分解:2H2O 通电 2H2↑+O2↑18、碳酸不稳定分解:H2CO3 H2O +CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO高温CaO+ CO2↑三、置换反应(暑假咱们会重点学)定义:置换反应是单质与化合物反应生成另外的单质和化合物的化学反应,是化学中四大基本反应类型之一20、铁和硫酸铜溶液反应:Fe+ CuSO4 FeSO4 +Cu21、锌和稀硫酸反应(实验室制氢气):Zn+ H2SO4 == ZnSO4+H2↑22、镁和稀盐酸反应:Mg +2HCl MgCl2 +H2↑23、氢气还原氧化铜:H2 +CuO加热 Cu +H2O24、木炭还原氧化铜:C+ 2CuO 高温2Cu +CO2↑25、甲烷在空气中燃烧:CH4 +2O点燃 CO2+2H2O26、水蒸气通过灼热碳层:H2O +C 高温H2 +CO27、焦炭还原氧化铁:3C +2Fe2O高温4Fe +3CO2↑一价氢和钾钠银二价镁钙铜钡锌三铝四硅五氮磷另外:酸碱盐知识暑假和秋季会重点学习,不要着急哈~~~By文刀牛老师。

初中化学常见物质的化学式一、常见的单质:(一)金属单质:钾:K 钙:Ca 钠:Na 镁:Mg 铝:Al 锌:Zn 铁:Fe 锡:Sn 铅:Pb 铜:Cu 汞:Hg 银:Ag 铂:Pt 金:Au 钡:Ba 钨:W (二)非金属单质:碳:C 硫:S 磷:P硅:Si 碘:I2溴:Br2 氧气:O2氮气:N2氢气:H2氯气:Cl2(三)稀有气体单质:氦气:He 氖气:Ne 氩气:Ar 氪气:Kr 氙气:Xe二、常见的化合物:(一)氧化物:氧化钾:K2O 氧化钠:Na2O 氧化银:Ag2O 水:H2O氧化钙:CaO 氧化钡:BaO 氧化镁:MgO 氧化锌:ZnO 氧化铜;CuO 氧化铝:Al2O3二氧化锰:MnO2二氧化硅:SiO2五氧化二磷:P2O5一氧化碳:CO 二氧化碳:CO2一氧化氮:NO 二氧化氮:NO2二氧化硫:SO2三氧化硫:SO3氧化亚铁:FeO 氧化铁:Fe2O3四氧化三铁:Fe3O4(二)氯化物:氯化钾:KCl 氯化钠:NaCl 氯化银:AgCl 氯化氢;HCl氯化钙:CaCl2氯化钡:BaCl2氯化镁:MgCl2氯化锌:ZnCl2氯化铜:CuCl2 氯化铝:AlCl3氯化亚铁:FeCl2氯化铁:FeCl3(三)含原子团的化合物:硝酸:HNO3硫酸:H2SO4碳酸:H2CO3磷酸:H3PO4氢氧化钾:KOH 氢氧化钠:NaOH 氢氧化钙:Ca(OH)2氢氧化钡:Ba(OH)2氢氧化镁:Mg(OH)2氢氧化铜:Cu(OH)2氢氧化铝:Al(OH)3氢氧化亚铁:Fe(OH)2氢氧化铁:Fe(OH)3硝酸钾:KNO3硝酸钠:NaNO3硝酸钙:Ca(NO3)2硝酸钡:Ba(NO3)2硝酸镁:Mg(NO3)2硝酸铜:Cu(NO3)2硝酸铝:Al(NO3)3硝酸亚铁:Fe(NO3)2硝酸铁:Fe(NO3)3硫酸钾:K2SO4硫酸钠:Na2 SO4硫酸钙:Ca SO4硫酸钡:BaSO4硫酸镁:MgSO4硫酸铜:CuSO4硫酸铝:Al2 (SO4)3硫酸亚铁:FeSO4硫酸铁:Fe2 (SO4)3碳酸钾:K2CO3碳酸钠:Na2CO3碳酸钙:CaCO3碳酸钡:BaCO3碳酸镁:MgCO3碳酸铜:CuCO3氯化铵:NH4Cl 硝酸铵:NH4NO3硫酸铵:(NH4)2SO4碳酸铵:(NH4)2CO3碳酸氢铵:NH4HCO3(四)其他化合物:氯酸钾:KClO3高锰酸钾:KMnO4锰酸钾:K2MnO4过氧化氢:H2O2氨气:NH3初中常用的化学方程式 一、物质与氧气的反应:1、硫燃烧:S+O 2====SO 22、碳燃烧:C+O 2====CO 23、磷燃烧:4P+5O 2====2P 2O 54、镁燃烧:2Mg+O 2====2MgO5、铁丝燃烧:3Fe+2O 2====Fe 3O 46、铝箔燃烧:4Al+3O 2====2Al 2O 37、氢气燃烧:2H 2+O 2====2H 2O8、汞加热:2Hg+O 2====2HgO 二、生成氧气的反应:1、过氧化氢制氧气:2H 2O 2 ===== 2H 2O+O 2↑2、高锰酸钾制氧气 : 2KMnO 4====K 2MnO 4+MnO 2+O 2↑3、氯酸钾制氧气: 2KClO 3===== 2KCl+3O 2↑4、电解水:2H 2O===== 2H 2↑+O 2↑5、氧化汞受热分解:2HgO====2Hg+O 2↑三、氢气的性质与制法:1、锌粒与稀硫酸反应:Zn+H 2SO 4====ZnSO 4+H 2↑2、氢气还原氧化铜:H 2+CuO====Cu+H 2O点燃点燃 点燃点燃 点燃点燃点燃 点燃MnO 2 △ MnO 2△通电 △△。

中考化学方程式大全(初中常见化学式)(必考内容)班级: 姓名:注意:请各位同学妥善保管好,认真记忆!➢常见的化学式一、1、镁在空气中燃烧: 2Mg + O2点燃2MgO★2、铁在氧气中燃烧: 3Fe + 2O点燃Fe3O43、铜在空气中受热: 2Cu + O△2CuO4、铝在空气中燃烧: 4Al + 3O点燃2Al2O3★5、氢气中空气中燃烧: 2H2 + O2点燃2H2O★6、红磷在空气中燃烧(测定空气中氧气含量):4P + 5O2点燃2P2O57、硫粉在空气中燃烧: S + O2点燃SO28、碳在氧气中充分燃烧: C + O2点燃CO29、碳在氧气中不充分燃烧: 2C + O2点燃2CO10、一氧化碳在氧气中燃烧: 2CO + O2点燃2CO211.玻义耳研究空气的成分实验2HgO △2Hg+ O2 ↑★12.加热高锰酸钾: 2KMnO4△K2MnO4 + MnO2 + O2↑★13.氯酸钾与二氧化锰共热制取氧气2KClO3MnO2△2KCl+3O2↑★14.过氧化氢在二氧化锰作催化剂条件下分解反应:2H2O2 MnO2 2O+ O2 ↑二、自然界中的水:★15.电解水(探究水的组成实验): 2H2O 通电2H2↑+ O2 ↑16.生石灰溶于水: CaO + H2O = Ca(OH)217.二氧化碳可溶于水: H2O + CO2=H2CO3三、质量守恒定律:18.镁在空气中燃烧: 2Mg + O点燃2MgO★19.铁与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu★20.氢气还原氧化铜: H2 + CuO △Cu + H2O四、碳与碳的氧化物:21、碳在氧气中充分燃烧: C + O2点燃CO2★22.木炭还原氧化铜: C+ 2CuO 高温2Cu + CO2↑23. 焦炭还原氧化铁: 3C+ 2Fe2O3高温4Fe + 3CO2↑24.煤炉的底层: C + O2点燃CO225.煤炉的中层: CO2 + C 高温2CO26.煤炉的上部蓝色火焰的产生: 2CO + O2点燃2CO2★27.大理石与稀盐酸反应: CaCO3 + 2HCl = CaCl2 + H2O + CO2↑28.碳酸不稳定而分解: H2CO3 = H2O + CO2↑29.二氧化碳可溶于水: H2O + CO2=H2CO3★30.高温煅烧石灰石(工业制CO2):CaCO3高温CaO + CO2↑★31.石灰水与二氧化碳反应(检验二氧化碳):Ca(OH)2 + CO2 = CaCO3↓+ H2O ★32.一氧化碳还原氧化铜: CO+ CuO △Cu + CO2★33.一氧化碳的可燃性: 2CO + O2点燃2CO2★34.碳酸钠与稀盐酸(灭火器的原理): Na2CO3 + 2HCl =2NaCl +H2O +CO2↑五、燃料及其利用:★35.甲烷在空气中燃烧: CH4 + 2O2点燃CO2 + 2H2O★36.酒精在空气中燃烧: C2H5OH + 3O2点燃2CO2 + 3H2O★37. 氢气中空气中燃烧: 2H2 + O2点燃2六、金属38.镁在空气中燃烧: 2Mg + O2点燃2MgO39.铁在氧气中燃烧: 3Fe + 2O2点燃Fe3O440、铜在空气中受热: △2CuO41、铝在空气中形成氧化膜: 4Al + 3O2 2O3★42、锌与稀硫酸(实验室制取氢气)Zn + H2SO4 = ZnSO4 + H2↑★43、铁与稀硫酸Fe + H2SO4 = FeSO4 + H2↑44、镁与稀硫酸Mg + H2SO4 = MgSO4 + H2↑45、铝与稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑46、锌与稀盐酸Zn + 2HCl = ZnCl2 + H2↑47、铁与稀盐酸Fe + 2HCl =FeCl2 + H2↑48、镁与稀盐酸Mg+ 2HCl = MgCl2 + H2↑49.铝与稀盐酸2Al + 6HCl =2AlCl3 + 3 H2↑★50、铁与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu51、锌与硫酸铜溶液反应: Zn + CuSO4 =ZnSO4 + Cu52、铜与硝酸汞溶液反应: Cu + Hg(NO3)2= Cu(NO3)2 + Hg★53.金属铁的治炼原理: 3CO+ 2Fe2O3高温4Fe + 3CO2↑七、酸、碱、盐★54、氧化铁与稀盐酸反应: Fe2O3 + 6HCl =2FeCl3 + 3H2O★55、氧化铁与稀硫酸反应: Fe2O3 + 3H2SO4 =Fe2(SO4)3 + 3H2O56、氧化铜与稀盐酸反应: CuO + 2HCl =CuCl2 + H2O57、氧化铜与稀硫酸反应: CuO + H2SO4 =CuSO4 + H2O★58.盐酸与烧碱起反应: HCl + NaOH = NaCl +H2O★59、盐酸与氢氧化钙反应: 2HCl + Ca(OH)2 = CaCl2 + 2H2O60、氢氧化铝药物治疗胃酸过多: 3HCl + Al(OH)3 = AlCl3 + 3H2O61、硫酸与烧碱反应: H2SO4 + 2NaOH =Na2SO4 + 2H2O★62.大理石与稀盐酸反(实验室制取CO2 ):CaCO3 +2HCl =CaCl2+H2O+CO2↑★63.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑64.碳酸氢钠与稀盐酸反应: NaHCO3 + HCl= NaCl + H2O + CO2↑★65、硫酸与氯化钡溶液反应: H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl★66.苛性钠暴露在空气中变质: 2NaOH + CO2 = Na2CO3 + H2O67.苛性钠吸收二氧化硫气体: 2NaOH + SO2 =Na2SO3 + H2O68.苛性钠吸收三氧化硫气体: 2NaOH + SO3 = Na2SO4 + H2O★69.消石灰放在空气中变质: Ca(OH)2 + CO2 = CaCO3↓+ H2O70、消石灰吸收二氧化硫: Ca(OH)2 + SO2 = CaSO3↓+ H2O★71、铁与硫酸铜溶液(波尔多液不能用铁桶装): Fe + CuSO4 = FeSO4 + Cu★72.碳酸钠与稀盐酸(检验NaOH变质):Na2CO3+2HCl=2NaCl+H2O+CO2↑★73、碳酸氢钠与稀盐酸(小苏打治疗胃酸过多)NaHCO3+HCl=NaCl+H2O+CO2↑★74、氢氧化钙与碳酸钠(检验NaOH变质): Ca(OH)2+Na2CO3=CaCO3↓+ 2NaOH ★75.氯化钠与硝酸银(区别食盐与蒸馏水):NaCl + AgNO3 =AgCl↓+ NaNO3★76.硫酸钠与氯化钡: Na2SO4 + BaCl2 == BaSO4↓+ 2NaCl。
中学常见化学式、常见单质二、化合物1、氧化物2、其他化合物初中化学方程式汇总氧气的性质:(1)单质与氧气的反应:(化合反应) 5. 氢气中空气中燃烧:2H 2 +O 2点燃 2H 2O6. 红磷在空气中燃烧(研究空气组成的实验):7. 硫粉在空气中燃烧:S +O 2点燃 SO 28. 碳在氧气中充分燃烧:C +Q 点燃 CQ9. 碳在氧气中不充分燃烧:2C +Q 点燃 2CO (2) 化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+O 点燃 2CQ 11. 甲烷在空气中燃烧:CH +2O 2点燃 CQ +2H 2O 12. 酒精在空气中燃烧:C 2H 5OH +3O 点燃 2CQ +3H 2O (3) 氧气的来源: —13•玻义耳研究空气的成分实验 2HgO 加热Hg +O 2 T14. 加热高锰酸钾:2KMnO 加热K 2MnO+MnO +O 2T (实验室制氧气原理1) 15.过氧化氢在二氧化锰作催化剂条件下分解反应: H 2Q MnQ2HO+ Q T (实 验室制氧气原理2)1. 镁在空气中燃烧2. 铁在氧气中燃烧3. 铜在空气中受热4. 铝在空气中燃烧 2Mg+ O 点燃 2MgO 3Fe+ 2O 2 点燃 Fe a O 4 2Cu+ O 加热 2CuO 4AI +3O2■^燃 2AbQ 4P +5Q 点燃 2P 2O、自然界中的水:16. 水在直流电的作用下分解(研究水的组成实验):2HO通电2H2? +O T 17•生石灰溶于水英语六级作文:CaO +HO == Ca(OH)218. 二氧化碳可溶于水:H2O+C2==HCO三、质量守恒定律:19. 镁在空气中燃烧:2Mg+ O点燃2MgO20. 铁和硫酸铜溶液反应:Fe+ CuSO=== FeSQ+ Cu21 .氢气还原氧化铜:H +CuO加热Cu +H2O22. 镁还原氧化铜:Mg+ CuO加热u +MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2点燃CC224. 木炭还原氧化铜:C + 2CuO高温2Cu+ CQ T25. 焦炭还原氧化铁:3C + 2Fe2Q 高温4Fe + 3CO 2 T(2)煤炉中发生的三个反应:(几个化合反应)26. 煤炉的底层:C +Q点燃CQ27. 煤炉的中层:CO+ C~^温2CO28. 煤炉的上部蓝色火焰的产生:2CO +O点燃2CQ(3)二氧化碳的制法与性质:29. 大理石与稀盐酸反应(实验室制二氧化碳):CaCO+ 2HCl == CaCl 2+ H2O +CO T30. 碳酸不稳定而分解:HCO == H2O +CO T31. 二氧化碳可溶于水:H2O +CO== H2CO32. 高温煅烧石灰石(工业制二氧化碳):CaCO高温CaO+ CO T33. 石灰水与中学历史教学园地二氧化碳反应(鉴别二氧化碳):Ca(OH£ +CQ === CaCO J +H2O(4)一氧化碳的性质:34. 一氧化碳还原氧化铜:CO+ CuO加热Cu +CQ35. 一氧化碳的可燃性:2CO +O点燃2CO其它反应:36. 碳酸钠与稀盐酸反应(灭火器的原理):NaCO 2HCl == 2NaCI+ H 2O +CO T五、燃料及其利用:37. 甲烷在空气中燃烧:CH +2O2 魁CQ +2H2O38. 酒精在空气中燃烧:C2H5OH +3O2点燃2CO +3出039. 氢气中空气中燃烧:2H+ O2 魁2H2O六、金属(1)金属与氧气反应:40. 镁在空气中燃烧:2Mg+ O点燃2MgO41. 铁在氧气中燃烧:3Fe +2O2 沁Fe3。

初中常见化学式及化学方程式常见的化学式二、化合物初中化学方程式大全一、化合反应1、镁在空气中燃烧:2Mg+ O2点燃 2MgO2、铁在氧气中燃烧:3Fe +2O2点燃 Fe3O43、铝在空气中燃烧:4Al+ 3O2点燃 2Al2O34、氢气在空气中燃烧:2H2 +O2点燃 2H2O5、红磷在空气中燃烧:4P +5O2点燃 2P2O56、硫粉在空气中燃烧: S+ O2点燃 SO27、碳在氧气中充分燃烧:C +O2 点燃 CO28、碳在氧气中不充分燃烧:2C +O2点燃 2CO9、二氧化碳通过灼热碳层: C +CO2高温 2CO10、一氧化碳在氧气中燃烧:2CO +O2 点燃 2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 +H2O === H2CO312、生石灰溶于水:CaO+ H2O === Ca(OH)213、无水硫酸铜作干燥剂:CuSO4 +5H2O ==== CuSO4·5H2O14、钠在氯气中燃烧:2Na+ Cl点燃 2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O +O2↑16、加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 +O2↑17、水在直流电的作用下分解:2H2O 通电 2H2↑+O2↑18、碳酸化学物理学报不稳定而分解:H2CO3 === H2O +CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温 CaO+ CO2↑三、置换反应20、铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu21、锌和稀硫酸反应(实验室制氢气):Zn+ H2SO4 == ZnSO4+H2↑22、镁和稀盐酸反应:Mg +2HCl === MgCl2 +H2↑23、氢气还原氧化铜:H2 +CuO 加热 Cu +H2O24、木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑25、甲烷在空气中燃烧:CH4 +2O2 点燃 CO2+2H2O26、水蒸气通过灼热碳层:H2O +C 高温 H2 +CO27、焦炭还原氧化铁:3C +2Fe2O3高温 4Fe +3CO2↑其他28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+ CuSO4 == Cu(OH)2↓+ Na2SO429、甲烷在空气中燃烧:CH4 +2O2点燃 CO2 +2H2O30、酒精在空气中燃烧:C2H5OH+ 3O2点燃 2CO2 +3H2O31、一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO232、一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe+ 3CO233、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH+ CO2 ==== Na2CO3 +H2O35、石灰石(或小学音乐教案大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 +2HCl === CaCl2 +H2O +CO2↑36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3+ 2HCl === 2NaCl +H2O +CO2↑一.物质与氧气的反应:(1)单质与氧气的反应:1. 镁在空气中燃烧:2Mg+ O2点燃 2MgO2. 铁在氧气中燃烧:3Fe+ 2O2点燃 Fe3O43. 铜在空气中受热:2Cu+ O2加热 2CuO4. 铝在空气中燃烧:4Al +3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H2 +O2点燃 2H2O6. 红磷在空气中燃烧:4P+ 5O2点燃 2P2O57. 硫粉在空气中燃烧: S +O2 点燃 SO28. 碳在氧气中充分燃烧:C+ O2点燃 CO29. 碳在氧气中不充分燃烧:2C+ O2点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+ O2点燃 2CO211. 甲烷在空气中燃烧:CH4 +2O2点燃 CO2 2H2O12. 酒精在空气中燃烧:C2H5OH +3O2点燃 2CO2+3H2O二.几个分解反应:13. 水在直流电的作用下分新概念英语第一册解:2H2O 通电 2H2↑+ O2↑14. 加热碱式碳酸铜:Cu2(OH)2CO3加热 2CuO +H2O +CO2↑15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl+ 3O2↑16. 加热高锰酸钾:2KMnO4 加热 K2MnO4 +MnO2 +O2↑17. 碳酸不稳定而分解:H2CO3 === H2O +CO2↑18. 高温煅烧石灰石:CaCO3 高温 CaO +CO2↑三.几个氧化还原反应:19. 氢气还原氧化铜:H2+ CuO 加热 Cu+ H2O20. 木炭还原氧化铜:C+ 2CuO 高温 2Cu +CO2↑21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe+ 3CO2↑22. 焦炭还原四氧化三铁:2C +Fe3O4高温 3Fe+ 2CO2↑23. 一氧化碳还原氧化铜:CO +CuO 加热 Cu+ CO224. 一氧化碳还原氧化铁:3CO+ Fe2O3高温 2Fe +3CO225. 一氧化碳还原四氧化三铁:4CO +Fe3O4高温 3Fe+ 4CO2四.单质、氧化物、酸、碱、盐的相互关系(1)金属单质+酸 -------- 盐+氢气(置换反应)26. 锌和稀硫酸Zn+ H2SO4 = ZnSO4+ H2↑27. 铁和稀硫酸Fe +H2SO4 = FeSO4+ H2↑28. 镁和稀硫酸Mg +H2SO4 = MgSO4 +H2↑29. 铝和稀硫酸2Al+ 3H2SO4 = Al2(SO4)3 +3H2↑30. 锌和稀盐酸Zn +2HCl === ZnCl2+ H2↑31. 铁和稀盐酸Fe+ 2HCl === FeCl2+ H2↑32. 镁和语文教案格式稀盐酸Mg 2HCl === MgCl2+ H2↑33. 铝和稀盐酸2Al+ 6HCl == 2AlCl3 +3H2↑(2)金属单质+盐(溶液) ------- 另一种金属+另一种盐34. 铁和硫酸铜溶液反应:Fe+ CuSO4 === FeSO4+ Cu35. 锌和硫酸铜溶液反应:Zn+ CuSO4 === ZnSO4+ Cu36. 铜和硝酸汞溶液反应:Cu +Hg(NO3)2 === Cu(NO3)2 +Hg(3)碱性氧化物+酸 -------- 盐+水37. 氧化铁和稀盐酸反应:Fe2O3+ 6HCl === 2FeCl3+ 3H2O38. 氧化铁和稀硫酸反应:Fe2O3 +3H2SO4 === Fe2(SO4)3+ 3H2O39. 氧化铜和稀盐酸反应:CuO +2HCl ==== CuCl2 +H2O40. 氧化铜和稀硫酸反应:CuO +H2SO4 ==== CuSO4+ H2O41. 氧化镁和稀硫酸反应:MgO+ H2SO4 ==== MgSO4+ H2O42. 氧化钙和稀盐酸反应:CaO +2HCl ==== CaCl2 +H2O(4)酸性氧化物+碱 -------- 盐+水43.苛性钠暴露在空气中变质:2NaOH +CO2 ==== Na2CO3+H2O44.苛性钠吸收二氧化硫气体:2NaOH +SO2 ==== Na2SO3 +H2O45.苛性钠吸收三氧化硫气体:2NaOH+ SO3 ==== Na2SO4+ H2O46.消石灰放在空气中变质:Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O47. 消石灰吸收二氧化硫:Ca(OH)2 +SO2 ==== CaSO3↓+H2O(5)酸+碱 -------- 盐+水48.盐酸和烧碱起反应:HCl+ NaOH ==== NaCl+ H2O49. 盐酸和氢氧化钾反应:HCl+ KOH ==== KCl+H2O50.盐酸和氢氧化初中家长会课件铜反应:2HCl+ Cu(OH)2 ==== CuCl2 +2H2O51. 盐酸和氢氧化钙反应:2HCl+ Ca(OH)2 ==== CaCl2 +2H2O52. 盐酸和氢氧化铁反应:3HCl+ Fe(OH)3 ==== FeCl3 +3H2O53.氢氧化铝药物治疗胃酸过多:3HCl +Al(OH)3 ==== AlCl3 +3H2O54.硫酸和烧碱反应:H2SO4 +2NaOH ==== Na2SO4 +2H2O55.硫酸和氢氧化钾反应:H2SO4 +2KOH ==== K2SO4 +2H2O56.硫酸和氢氧化铜反应:H2SO4 +Cu(OH)2 ==== CuSO4 +2H2O57. 硫酸和氢氧化铁反应:3H2SO4 +2Fe(OH)3==== Fe2(SO4)3+ 6H2O58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O(6)酸+盐 -------- 另一种酸+另一种盐59.大理石与稀盐酸反应:CaCO3 +2HCl === CaCl2 H2O +CO2↑ 60.碳酸钠与稀盐酸反应: Na2CO3 +2HCl === 2NaCl +H2O+ CO2↑ 61.碳酸镁与稀盐酸反应: MgCO3 +2HCl === MgCl2 +H2O+CO2↑ 62.盐酸和硝酸银溶液反应:HCl+ AgNO3=== AgCl↓+ HNO363.硫酸和碳酸钠反应:Na2CO3 +H2SO4 === Na2SO4 +H2O +CO2↑64.硫酸和氯化钡溶液反应:H2S O4 +BaCl2 ==== BaSO4↓+ 2HCl (7)碱+盐 -------- 另一种碱+另一种盐65.氢氧化钠与硫酸铜:2NaOH CuSO4 ==== Cu(OH)2↓ Na2SO4 66.氢氧化钠与氯化铁:3NaOH FeCl3 ==== Fe(OH)3↓ 3NaCl 67.氢氧化钠与氯化镁:2NaOH MgCl2 ==== Mg(OH)2↓ 2NaCl68. 氢氧化钠与氯化铜:2NaOH CuCl2 ==== Cu(OH)2↓ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 Na2CO3 === CaCO3↓ 2NaOH(8)盐+盐 ----- 两种新盐70.氯化钠溶液和硝酸银溶液:NaCl +AgNO3==== AgCl↓+ NaNO3 71.硫酸钠和氯化钡:Na2SO4+ BaCl2 ==== BaSO4↓+ 2NaCl 五.其它反应:72.二氧化碳溶解于水:CO2+ H2O === H2CO373.生石灰溶于水:CaO+ H2O === Ca(OH)274.氧化钠溶于水:Na2O +H2O ==== 2NaOH75.三氧化硫溶于水:SO3 +H2O ==== H2SO476.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 5H2O77.无水硫酸铜作干燥剂:CuSO4+ 5H2O ==== CuSO4·5H2化学方程式反应现象应用2Mg+ O点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg +O点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+ O点燃或Δ2CuO 红色金属变为黑色固体4Al+ 3O点燃或Δ2Al2O3银白金属变为白色固体3Fe+ 2O点燃Fe3O4剧烈燃烧、火星四射、生成黑色固体、放热4Fe +3O高温2Fe2O3C+ O2点燃CO2剧烈燃烧、白光、放热、使石灰水变浑浊S +O2点燃SO2剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2 O2点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P +5O2点燃2P2O5剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+ CO2蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+ 5O2点燃2H2O +4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2、Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4 MnO2 +O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧论文气2HgOΔ2Hg+ O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+ O2↑ 水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO +H2O+ CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O+ CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+ H2SO4=ZnSO4 +H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe +H2SO4=FeSO4 +H2↑ 有大量气泡产生、金属颗粒逐渐溶解Mg +H2SO4 =MgSO4 +H2↑ 有大量气泡产生、金属颗粒逐渐溶解2Al+ 3H2SO4=Al2(SO4)3+ 3H2↑ 有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2Δ 2Fe +3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4 +4H2 Δ3Fe+ 4H2O 黑色逐渐变为银白色英语翻译、试管壁有液体冶炼金属、利用氢气的还原性2Na+ Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4 +2NaOH=Cu(OH)2↓+ Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C+O点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2CO+O点燃2CO2蓝色火焰煤气燃烧C+CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+ 3C 高温4Fe+ 3CO2↑ 冶炼金属Fe3O4 +2C高温3Fe+ 2CO2↑ 冶炼金属C+ CO2高温2COCO2+H2O = H2CO3碳酸使石蕊变红证明碳酸的酸性H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2 +CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3 +H2O+ CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+ H2O +CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+ H2O +CO2↑ 产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温 CaO +CO2↑ 工业制备二氧化碳和生石灰CaCO3 +2HCl=CaCl2+ H2O +CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢。
初中常见化合物化学式一、常见酸的化学式
1.无氧酸:氢氯酸HCl(盐酸)
2.含氧酸:硫酸H2SO4硝酸HNO3
碳酸H2CO3氯酸HClO3
亚硫酸H2SO3
3.有机酸:乙酸(醋酸)CH3COOH
二、常见碱的化学式
1.可溶性碱:氢氧化钾KOH
氢氧化钠NaOH
氢氧化钙Ca(OH)2
氢氧化钡Ba(OH)2
氢氧化铵(氨水)NH3·H2O
2.不溶性碱:氢氧化铜Cu(OH)2
氢氧化亚铁Fe(OH)2
氢氧化铁Fe(OH)3
氢氧化镁Mg(OH)2
氢氧化铝Al(OH)3
三、常见盐的化学式
1.硝酸盐:硝酸钾KNO3硝酸钠NaNO3
硝酸铵NH4NO3硝酸铜Cu(NO3)2
硝酸钡Ba(NO3)2硝酸铁Fe(NO3)3
硝酸铝Al(NO3)3硝酸银AgNO3
硝酸镁Mg(NO3)2硝酸钙Ca(NO3)2
硝酸锌Zn(NO3)2
2.硫酸盐:硫酸钠Na2SO4硫酸钾K2SO4
硫酸铵(NH4)2SO4硫酸铁Fe2(SO4)3
硫酸亚铁FeSO4硫酸铜CuSO4
硫酸铝Al2(SO4)3硫酸锌ZnSO4
硫酸镁MgSO4硫酸钙CaSO4
硫酸钡BaSO4
3.碳酸盐:碳酸钠Na2CO3碳酸钾K2CO3碳酸铵(NH4)2CO3碳酸铜CuCO3
碳酸钙CaCO3碳酸钡BaCO3
碳酸镁MgCO3碳酸锌ZnCO3
碳酸亚铁FeCO3
4.盐酸盐:氯化钠NaCl氯化钾KCl 氯化铵NH4Cl氯化钙CaCl2
氯化钡BaCl2氯化锌ZnCl2
氯化铝AlCl3氯化铜CuCl2
氯化铁FeCl3氯化亚铁FeCl2
氯化镁MgCl2氯化银AgCl
5.其他常见盐:高锰酸钾KMnO4
锰酸钾K2MnO4氯酸钾KClO3
碳酸氢钠NaHCO3碳酸氢铵NH4HCO3碱式碳酸铜Cu2(OH)2CO3
四、常见氧化物的化学式
1.金属氧化物:氧化铁Fe2O3
氧化亚铁FeO四氧化三铁Fe3O4
氧化铜CuO氧化亚铜Cu2O
氧化铝Al2O3氧化镁MgO
氧化锌ZnO氧化钙CaO
氧化钠Na2O
2.非金属氧化物:氧化氢(水)H2O
一氧化碳CO二氧化碳CO2
二氧化硫SO2三氧化硫SO3
一氧化氮NO二氧化氮NO2
五氧化二氮N2O5五氧化二磷P2O5 3.过氧化物:过氧化氢H2O2
过氧化钠Na2O2
过氧化钙CaO2
五、其他
甲烷CH4甲醇CH3OH
乙醇C2H5OH
有刺激性气味的气体:NH3、SO2、HCl
有毒的气体:CO
污染性气体:CO、SO2、NO2(空气中原有的成分都不是污染性气体)。