有机物结构特点
- 格式:doc
- 大小:1.16 MB
- 文档页数:15


★★★★★从大的方面讲,本章的知识可以从以下几个方面加以概括:1、有机物的结构特点;2、烃;3、几个重要的概念;4、几种重要的有机化学发应类型;5、烷烃的系统命名;6、石油和煤。
1、有机物的结构特点 有机物结构有何特点?有机物种类为什么繁多? 2、烃 什么叫烃?本章学过哪些烃?其通式是什么? (1)烃的分类 饱和链烃——烷烃C nH 2n+2 (n ≥1) 链烃 烯烃C n H 2n (n ≥2) 不饱和链烃—— 烃 炔烃C n H 2n -2 (n ≥2) 芳香烃(如苯及其同系物)C n H 2n -6 (n ≥6) (2)各类烃的结构特点和主要化学性质 结构特点 主要化学性质 烷烃 仅含C —C 键 与卤素等发生取代反应、热分解 烯烃 含C==C 键 与卤素等发生加成反应,与高锰酸钾发生氧化反应,聚合反应 炔烃 含C ≡C 键 与卤素等发生加成反应,与高锰酸钾发生氧化反应,聚合反应 苯 (芳香烃) 与卤素等发生加成反应,与氢气等发生加成反应 3、几个重要的概念 (1)同系物:结构相似,在分子组成上相差一个或若干个CH 2原子团的物质,互称为同系物; (2)同分异构现象:化合物具有相同的分子式,但具有不同的结构式的现象,叫做同分异构现象; (3)同分异构体:具有同分异构现象的化合物互称为同分异构体; 4、几种重要的有机化学反应类型 在本章所学各代表物的化学性质中涉及到哪些反应类型?其含义是什么? (1)氧化反应:包括两层含义①与氧气的燃烧②能否被酸性KMnO 4溶液氧化; (2)取代反应:有机物分子里的某些原子团或原子被其他原子或原子团所代替的反应叫取代反应。
如烷烃与卤素的反应、苯与液溴的反应、苯的硝化、磺化反应等均属取代反应; (3)加成反应:有机物分子里不饱和碳原子与其他原子或原子团直接结合生成新化合物的反应叫加成反应。
如乙烯与溴及其他卤素或氢气的反应、乙炔与卤素的反应等均属加成反应; (4)聚合反应:由相对分子质量小的化合物分子结合成相对分子质量大的高分子的反应叫做聚合反应。
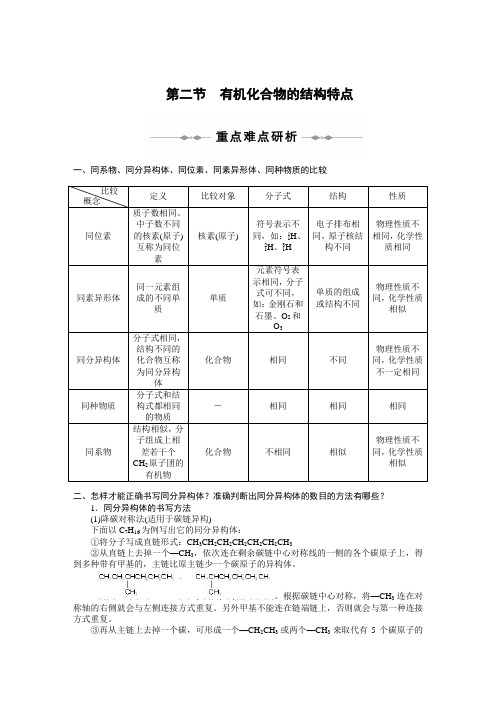
第二节有机化合物的结构特点一、同系物、同分异构体、同位素、同素异形体、同种物质的比较比较概念定义比较对象分子式结构性质同位素质子数相同、中子数不同的核素(原子)互称为同位素核素(原子)符号表示不同,如:11H、21H、31H电子排布相同,原子核结构不同物理性质不相同,化学性质相同同素异形体同一元素组成的不同单质单质元素符号表示相同,分子式可不同,如:金刚石和石墨、O2和O3单质的组成或结构不同物理性质不同,化学性质相似同分异构体分子式相同,结构不同的化合物互称为同分异构体化合物相同不同物理性质不同,化学性质不一定相同同种物质分子式和结构式都相同的物质-相同相同相同同系物结构相似,分子组成上相差若干个CH2原子团的有机物化合物不相同相似物理性质不同,化学性质相似二、怎样才能正确书写同分异构体?准确判断出同分异构体的数目的方法有哪些?1.同分异构体的书写方法(1)降碳对称法(适用于碳链异构)下面以C7H16为例写出它的同分异构体:①将分子写成直链形式:CH3CH2CH2CH2CH2CH2CH3②从直链上去掉一个—CH3,依次连在剩余碳链中心对称线的一侧的各个碳原子上,得到多种带有甲基的,主链比原主链少一个碳原子的异构体。
根据碳链中心对称,将—CH3连在对称轴的右侧就会与左侧连接方式重复。
另外甲基不能连在链端链上,否则就会与第一种连接方式重复。
③再从主链上去掉一个碳,可形成一个—CH2CH3或两个—CH3来取代有5个碳原子的主链上的氢。
当取代基为—CH2CH3时,由对称关系只能接在中间的碳原子上,即。
当取代基为两个甲基时,在主链上先定一个甲基,按照对、邻、间的位置依次移动另外一个甲基,注意不要重复。
(2)取代法(适用于醇、卤代烃异构)先碳链异构后位置异构如书写分子式为C5H12O的醇的同分异构体,如图(图中数字即为—OH接入后的位置,即这样的醇合计为8种):(3)插入法(适用于烯烃、炔烃、酯等)先根据给定的碳原子数,写出具有此碳原子数的烷烃的同分异构体的碳链骨架,再根据碳链的对称性,将官能团插入碳链中,最后用氢原子补足碳的四个价键。

精品文档有机物的分子结构特点和主要化学性质有机物种类繁多,变化复杂,应用面广。
在学习和掌握各类有机物化学性质时,要抓住有机物的结构特点,即决定有机物化学特性的原子或原子团——官能团。
学习时以烃类有机物为根底,以烃的衍生物为重点;通过各类有机物的重要代表物的组成、结构、性质、制法和主要用途的学习,到达掌握相关各类有机物的目的。
对于其中涉及的各有关反响要认识反响的意义,即每个反响对于反响物来说,它表示着反响物的性质;对于生成物来说,很可能成为生成物的制法。
也就是说,一个化学方程式它既是性质反响,又是制法的反响原理。
对于各个反响,应尽量从分子结构的角度,了解反响的历程,以便于掌握和运用。
现对各类有机物的分子结构特点和重要化学性质分别阐述如下:1.烷烃分子结构特点:C—C单键和C—H单键。
在室温时这两种键不活泼,不易发生化学反响,所以烷烃一般不和强酸、强碱、强氧化剂反响,但在一定条件下(光、热),C—H键的氢可以发生取代反响,C—C键可以断裂,继而发生裂化和氧化反响。
如:(1)取代反响R-CH3+X2 R-CH2X+HX(卤化)R-CH3+HO-NO2 -CH2NO2+H2O(硝化)裂化反响(在高温和缺氧条件下)(3)催化裂化C8H18 C4H10+C4H8C4H10 C2H6+C2H4(3)氧化反响①燃烧氧化.精品文档②催化氧化2CH3CH2CH2CH3+5O24CH3COOH+2H2.烯烃分子结构特点:分于中含有键。
烯烃分子内的碳碳双键中有一个键较弱,容易断开而发生化学反响,所以烯烃的化学性质较活泼,主要发生加成、氧化和加聚反响。
(1)氧化反响①燃烧氧化②催化氧化2CH2CH2+O22CH3-CHO③使高锰酸钾溶液褪色(2)加成反响①加H2、X2(X:Cl、Br、I)CH2CH2+H2CH3-CH3CH2CH2+Cl2→CH2Cl-CH2Cl②加H2O、HXCH2CH2+H-OH CH3-CH2OHCH2CH2+HCl C H3-CH2Cl(3)加聚反响.精品文档nCH2CH[CH-CH]n 2223.炔烃分子结构特点:分子内含有—C≡C—键炔烃分子内的碳碳三键中有一个较强的键和二个较弱的键,这二个较弱的键在化学反响中容易断开,因而炔烃的化学性质也是活泼的,能够发生和烯烃相似的反响即加成反响、加聚反响、氧化反响,能使酸性高锰酸钾溶液褪色,在空气中易燃烧,如:(1)氧化反响①燃烧氧化②使高锰酸钾溶液褪色(2)加成反响(H2、X2、H2O、HX)CH≡CH+HCl CH2==CHCl(3)加聚反响.精品文档4.二烯烃分子结构特点:分子内含有二个碳碳双键。

第二节有机化合物的结构特点一、有机化合物中碳原子的成键特点1、碳原子的成键特点(1)碳原子最外层有个价电子,能与其他原子形成个共价键。
(2)碳碳之间的结合方式:、、(3)多个碳原子间可形成长短不一的碳键和碳环,碳键和碳环也可以相互结合。
(4)原子种类和数目相同的分子,其原子可能具有多种不同的结合方式,形成具有不同结构的分子。
如:相同分子式的同分异构体。
2、甲烷的分子结构(1)不同表示方法化学式实验式电子式结构式结构简式球棍模型比例模型甲烷化学式:表示实验式:表示结构简式:表示如:乙烷:化学式:实验式:结构式:结构简式:(2)空间构型:正四面体构型4个C—H键是完全等同的,键长,键能,两个C—H键间的键角为。
二、有机物的同分异构现象1、同分异构现象和同分异构体(1)同分异构现象:化合物具有相同的,但不同,因而产生了性质上的差异,这种现象称为同分异构现象。
(2)同分异构体:具有的化合物互为同分异构体。
例:注意:互为同分异构体的化合物具有相同的分子量(相对分子质量);具有相同分子量的化合物互为同分异构体。
2、同分异构体的类别(1)碳链异构:不同而产生异构,如:(2)位置异构:不同引起异构,如:(3)官能团异构:不同引起异构,如:3、同分异构体的性质(1)链状烃同分异构体的熔沸点:支链越多,熔沸点越(2)化学性质,物理性质4、同分异构体的书写方法(注意有序性和等效性)碳链异构→官能团位置异构→官能团异构例1:写出C5H12的同分异构体。
(5种)例2:写出C7H14的同分异构体。
(9种)5、同位素、同素异形体、同系物和同分异构体的比较定义化学式或表示方法结构性质同位素同素异形体同系物同分异构体例3、下列物质中,互为同分异构体的是()A CH3CH2CH2B CH3CH2CHCH3C CH3CHCH2ClD CH3CH2CH2CH2Cl例4、进行一氯取代反应后,只能生成三种沸点不同的有机产物的烷烃是()A (CH3)2CHCH2CH2CH3B (CH3CH2)2CHCH3C (CH3)2CHCH(CH3)2D (CH3)3CCH2CH3例5、分子里碳原子数不超过10的烷烃,一卤代物只有一种的共有()A 2种B 3种C 4种D 5种例6、已知丙烷的二氯代物有4种同分异构体,则六氯代物异构体数目为()A 2种B 3种C 4种D 5种例7、分子式为C4H9Cl的有机物同分异构体的数目有()A 1种B 2种C 3种D 4种第二节有机化合物的结构特点练习题基础巩固1.下列说法中,正确的是( )A.任何有机物的分子中,碳原子的空间构型都是相同的B.任何烃类的分子中,碳原子的空间构型都是相同的C.烷烃分子中,所有碳原子的空间构型都相同,均为四面体型D.各族元素所形成的化合物中,以第ⅥA族元素为最多2.当碳原子与四个原子连接时,该碳原子为四面体构型;当碳原子只与三个原子连接时,该碳原子为平面构型,当碳原子只与两个原子连接时,该碳原子为直线型构型。
有机物的结构特征嘿,你知道吗?有一天我去朋友家做客,一进门就被他家厨房架子上的各种瓶瓶罐罐吸引住了。
朋友笑着说:“这里面可都是宝贝呢!”我好奇地凑过去看,发现有酱油、醋、料酒等等。
朋友开始给我介绍这些日常调料,可别小看它们,这里面可藏着有机物的大秘密呢。
朋友拿起一瓶酱油,“你看这酱油,颜色黑黝黝的,味道醇厚。
它里面就有很多有机物呢。
”我疑惑地问:“啥是有机物呀?”朋友笑了笑,“有机物呢,就是含碳的化合物。
不过可不是所有含碳的都是哦,像二氧化碳、一氧化碳这些就不是。
”我挠挠头,“这咋区分呢?”朋友晃了晃酱油瓶,“你看,这酱油能用来调味,能和其他东西发生反应,这就是有机物的特点之一。
”我们又拿起一瓶醋,朋友打开瓶盖,一股酸味扑鼻而来。
“这醋也是有机物,它的主要成分是醋酸。
有机物的结构可复杂了,就像一个神秘的迷宫。
”我想象着那个迷宫,“那这个迷宫有啥特别的呢?”朋友指了指醋瓶上的标签,“你看,这里面有各种成分的说明。
有机物的结构特征就是由不同的原子组成,这些原子就像小砖块一样,搭建起了各种各样的有机物。
”我看着那些瓶瓶罐罐,突然想到了一个问题,“那这些有机物是怎么来的呢?”朋友笑了起来,“这可就有很多途径啦。
有的是从大自然中提取的,就像蜂蜜,那可是蜜蜂们辛勤劳动的成果,里面有很多有机物呢。
还有的是通过人工合成的,比如一些药品。
”我不禁感叹:“这有机物还真是无处不在啊!”朋友又拿起一瓶料酒,“你看这料酒,在做菜的时候加一点,可以去腥提香。
这也是有机物的功劳呢。
有机物的结构决定了它们的性质和用途。
就像这料酒,里面的酒精就是一种有机物,它能和食物中的腥味物质发生反应,让我们的菜更加美味。
”我点了点头,“原来如此啊。
那有机物对我们的生活还有哪些重要的作用呢?”朋友想了想,“有机物的作用可大了去了。
我们穿的衣服,很多都是由有机物组成的,比如棉花、丝绸。
我们吃的食物,更是离不开有机物。
还有我们用的化妆品、药品,很多都是有机物呢。
第 1 页 共 15 页 第一章:认识有机化合物——考点二 有机物的结构特点、同系物、同分异构体
知识点一:有机化合物中碳原子的成键特点 1.碳元素位于第二周期ⅣA族,碳原子的最外层有4个电子,很难得到或失去电子,通常以共用电子对的形式与其她原子形成共价键,达到最外层8个电子的稳定结构。 2.由于碳原子的成键特点,在有机物分子中,碳原子总就是形成4个共价键,每个碳原子不仅能与氢原子或其她原子(如氧、氯、氮、硫等)形成4个共价键,而且碳原子之间可以形成单键(C—C)、双键(C=C)、三键(C≡C)。多个碳原子可以相互结合成长短不一的碳链,碳链也可以带有支链,还可以结合成碳环,碳链与碳环也可以相互结合,因此,含有原子种类相同,每种原子数目也相同的分子,其原子可能具有多种不同的结合方式,形成具有不同结构的分子。 要点解释:在有机物分子中,碳原子仅以单键与其她原子形成4个共价键,这样的碳原子称为饱与碳原子,当碳原子以双键或三键与其她原子成键时,这样的碳原子称为不饱与碳原子。 种类 实例 含义 应用范围 化学式 CH4、C2H2 (甲烷)(乙炔) 用元素符号表示物质分子组成的式子。可反映出一个分子中原子的种类与数目 多用于研究分子晶体
最简式 (实验式) C6H12O6的最简式为CH2O ①表示物质组成的各元素原子最简整数比的式子②由最简式可求最简式量 ①有共同组成的物质 ②离子化合物、原子晶体常用 它表示组成
电子式 用小黑点等记号代替电子,表示原子最外层电子成键情况的式子 多用于表示离子型、共价型 的物质
结构式 ①具有化学式所能表示的意义,能反映物质的结构②表示分子中原子的结合或排列顺序的式子,但不表示空间构型 ①多用于研究有机物的性质 ②能反映有机物的结构,有机 反应常用结构式表示
结构简式 (示性式) CH3—CH3 (乙烷) 结构式的简便写法,着重突出结构特点(官能团) 同“结构式”①
球棍模型 小球表示原子,短棍表示价键 用于表示分子的空间结构 (立体形状) 第 2 页 共 15 页 比例模型 用不同体积的小球表示不同原子的大小 用于表示分子中各原子的 相对大小与结合顺序
键线式:碳碳键用线段来体现。拐点或端点表示碳原子,碳原子上的氢原子不必标出,其她原子及其她原子上的氢原子都要指明。
例如:丙烯、正丙醇的键线式分别为。 要求:高考中,常出现必须掌握,会通过链线式写出熟悉的结构简式,也能通过结构简式写出链线式。 特别提示:(1)写结构简式时,同一碳原子上的相同原子或原子团可以合并,碳链上直接相邻且相同的原子团
亦可以合并,如有机物也可写成(CH3)3C(CH2)2CH3。 (2)有机物的结构简式只能表示有机物中各原子的连接方式.并不能反映有机物的真实结构。其实有机物
的碳链就是锯齿形而不就是直线形的。 要求:重点掌握各种形式的表达方式,特别就是最简式(实验式),结构简式 解题探究:题组一有机物的结构模型及表示法 4.如图所示就是四种常见有机物的比例模型示意图。下列说法正确的就是( )
A.甲能使酸性KMnO4溶液褪色 B.乙可与溴水发生取代反应使溴水褪色 C.丙中的碳碳键就是介于碳碳单键与碳碳双键之间的独特的键 D.丁在稀硫酸作用下可与乙酸发生取代反应 答案 C解析 甲代表CH4,乙代表乙烯,丙代表苯,丁代表乙醇。
知识点二:同系物 (1)定义:结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。如CH3CH3与CH4,CH2===CH2与CH2===CH—CH3。
(2)烷烃同系物:分子式都符合CnH2n+2(n≥1),如CH4、CH3CH3、互为同系物。 (3)同系物的化学性质相似,物理性质呈现一定的递变规律。 结构相似,分子量越大,熔沸点越高,分子式相同,支链越多,熔沸点越低。 题组二 同系物的判断与性质 由乙烯推测丙烯(CH2CHCH3)的结构或性质正确的就是( ) A.不能使酸性高锰酸钾溶液褪色 B.不能在空气中燃烧 第 3 页 共 15 页 C.能使溴水褪色 D.与HCl在一定条件下能加成只得到一种产物 答案 C
解析 丙烯与乙烯具有相同的官能团“”,具有与乙烯类似的化学性质,故C正确;丙烯与HCl加成时产物有两种,D不正确。 同系物的判断方法 “一差二同 ”:通式相同,官能团的种类数目相同;分子组成上至少相差一个CH2原子团。
如:①CH2===CH2与通式相同,官能团不同,二者不就是同系物。 ②CH3CH2CH2CH3与二者不相差一个或多个CH2,不就是同系物。 ③与的环数不同,且不相差n个CH2原子团,不就是同系物。 知识点三:有机化合物的同分异构现象(重点) 一.化合物具有相同的分子式,但具有不同的结构的现象叫同分异构现象,具有同分异构现象的化合物互为同分异构体。 二.两化合物互为同分异构体的必备条件有二: (1)两化合物的分子式应相同。 (2)两化合物的结构应不同(如碳链骨架不同、官能团的位置不同、官能团的种类不同等)。 三.中学阶段必须掌握的异构方式有三种,即碳链异构、位置异构与官能团异构。 常见同分异构现象及形成途径 异构方式 形成途径 示例 碳链异构 碳链骨架不同而产生的异构 CH3CH2CH2CH3与 位置异构 官能团位置不同而产生的异构 CH2=CHCH2CH3与CH3—CH=CH—CH3 官能团异构 官能团种类不同而产生的异构 CH3CH2CHO与 四.此外有机物还具有立体异构现象。常见的立体异构有顺反异构 当有机物分子中含有碳碳双键且每个双键碳原子所连的另外两个原子或基团不同时,就存在顺反异构现象。如2-丁烯存在顺反异构体。
CH3—CH—CH3 CH3 CH3—C—CH3 O 第 4 页 共 15 页 要求:只要求识别,有机的同分异构,高考一般不考书写,但选修三的考试有可能出现。 五、同分异构体的书写与数目的判断
书写同分异构体时,必须遵循“价键数守恒”原则,即在有机物分子中,碳原子的价键数为4,氢原子的价键数为1,氧原子的价键数为2,等等。 (一)同分异构体的书写规律(重点) (1) 烷烃的同分异构体的书写就是其她有机物的同分异构体书写的基础。 烷烃只存在碳链异构,书写时要注意全面而不重复,具体规则如下:
(2)具有官能团的有机物:一般按碳链异构→位置异构→官能团异构的顺序书写,同时遵循对称性、互补性、有序性原则,即可以无重复、无遗漏地写出所有的同分异构体来。 (3)芳香族化合物的同分异构体的书写及判断
b.若三个取代基中有2个相同,则有6种结构: 第 5 页 共 15 页 (4)“碎片拼装法”在苯环类同分异构体的书写中的应用(不讲) ①除苯环外,统计剩余基团的不饱与度、碳原子数与氧原子数。 ②结合题给限制条件,写出符合条件的官能团结构,即碎片。 ③结合不饱与度、碳原子数与氧原子数及已知碎片,判断出所有碎片。 ④结合等效氢等限制条件进行拼装。 (二) 同分异构体数目的判断方法 (1)记忆法。记住常见烃基同分异构体数目:(不记) ①丙基(—C3H7)有2种,则丙烷的一卤代物、丙醇均有2种,丁醛、丁酸有2种。 ②丁基(—C4H9)有4种,则丁烷的一卤代物、丁醇均有4种,戊醛、戊酸有4种。 ③戊基(—C5H11)有8种,则戊烷的一卤代物、戊醇均有8种。 (2)等效氢法(重点):判断有机物发生取代反应后,能形成几种同分异构体的规律,可通过分析有几种等效氢原子来得出结论,又称为对称法。 ①连接在同一碳原子上的氢原子为等效氢,如甲烷中只有一类氢原子。 ②连接在同一碳原子上的甲基(—CH3)氢为等效氢,如新戊烷[C(CH3)4]中只有一类氢原子。 ③处于对称位置的碳原子上的氢原子为等效氢,如苯分子为平面正六边形,为对称结构,分子中只有一类氢原子。 ④卤代烃同分异构体书写及数目巧确定,有几类不同的等效氢,其一取代产物就有几种。 具体步骤:例如:分子式为C5H11Cl的同分异构体(不考虑立体异构)数目的判断。 步骤1:写出C5H12可能的碳骨架,有三种
步骤2:根据“等效氢原子法”确定氯原子取代的位置,并标号 (3)基元法。丙基有2种结构,丁基有4种结构,由此可推断有机物的同分异构体的数目。例如,丁醇、戊酸、戊醛、一氯丁烷都分别有4种同分异构体。(不第 6 页 共 15 页 讲) 学后即练: 一、同分异构体的判断与种数计算 1.下列有关同分异构体数目的叙述中,正确的就是( ) A.戊烷有2种同分异构体 B.C8H10中只有3种属于芳香烃的同分异构体 C.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种 D.CH3CH2CH2CH3光照下与氯气反应,只生成1种一氯代烃
答案 C 解析 A项,戊烷有3种同分异构体;B项,有、、、4种同分异构体;C项,丙基的同分异构体有2种,所以取代苯环上的氢原子分别得到邻、间、对各3种同分异构体,共6种,正确;D项,光照条件下的取代反应,得到2种一氯代物。 2.有下列几种有机化合物的结构简式:
(1)属于同分异构体的就是____________________。 (2)属于同系物的就是________。 (3)官能团位置不同的同分异构体就是________。 (4)官能团类型不同的同分异构体就是________。 解析:本题考查了同系物、同分异构体的判断,以及同分异构体的不同类型:位置异构、官能团异构等的区分。