化学实验报告配置氯化钠溶液
- 格式:docx
- 大小:8.55 KB
- 文档页数:1

一定溶质质量分数的氯化钠溶液的配制实验报告班级:姓名:日期:年月日一、【实验目的】练习配制一定溶质质量分数的溶液。
加深对溶质的质量分数概念的理解二、【实验仪器与药品】托盘天平、烧杯、玻璃棒、钥匙、量筒、胶头滴管。
氯化钠、蒸馏水。
三、【实验步骤】1.配制质量分数为6%的氯化钠溶液。
(1)计算:配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:氯化钠_______g;水__________g。
(2)称量:用_________称量所需的氯化钠,放入____________中。
(3)量取:用_ __量取所需的水(水的密度可近似看做1g/cm3),倒入盛有氯化钠的__ _中。
(4)溶解:用__ ___搅拌,使氯化钠溶解。
(5)装瓶贴标签:2.配制质量分数为3%的氯化钠溶液。
用已配好的质量分数为6%的氯化钠溶液(密度约为cm3),配制50g质量分数为3%的氯化钠溶液。
(1)计算:配制50g质量分数为3%的氯化钠溶液所需质量分数为6%的氯化钠溶液和水分别为:6%的氯化钠溶液____________g(体积__________ml);水__________g。
(2)量取:用_____ ___量取所需的氯化钠溶液和水,倒入________中。
(3)混匀:用____________搅拌,使溶液混合均匀。
(4)装瓶贴标签:3.把配制好的上述俩种氯化钠的溶液分别装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品名称和溶液的溶质的质量分数),放到实验桌上。
【问题与交流】1.用托盘天平称量氯化钠是,有哪些注意事项?2.用量筒量取液体时,读数应注意什么?3.准确配制一定溶质质量分数的溶液,在实际应用中有什么意义?请举例说明。

氯化钠标准溶液配制氯化钠标准溶液是实验室常用的一种溶液,用于化学分析和生物化学实验中的标定和校准。
它的配制需要严格按照一定的比例和步骤进行,以确保其浓度和稳定性符合实验要求。
下面将介绍氯化钠标准溶液的配制方法。
首先,准备所需的材料和仪器,氯化钠固体、蒸馏水、容量瓶、天平、磁力搅拌器、移液器等。
确保所有仪器和容器都经过洁净和干燥处理,以避免外部杂质的污染。
其次,按照所需的浓度和体积,计算出氯化钠固体的质量。
通常情况下,可以根据溶液的摩尔浓度和容积来计算所需的氯化钠质量。
在计量时,应该使用精密天平进行称量,确保质量的准确性。
然后,将称量好的氯化钠固体溶解于一定体积的蒸馏水中。
在溶解过程中,可以使用磁力搅拌器来加快溶解速度,并确保溶液的均匀性。
同时,要注意控制溶解温度,避免因温度过高或过低而影响溶解度。
接着,将溶解好的氯化钠溶液转移至预先清洗干净的容量瓶中,并加入适量的蒸馏水至刻度线。
在加水的过程中,要轻轻摇晃容量瓶,使溶液充分混合,直至刻度线处。
最后,使用移液器或分液器,取出所需的氯化钠标准溶液进行实验使用。
在取用溶液时,要注意密封容量瓶,避免外部空气和杂质的污染。
通过以上步骤,我们就可以成功配制出所需浓度的氯化钠标准溶液。
在实验过程中,要注意溶液的保存和稳定性,避免受到光线和空气的影响。
同时,定期检查溶液的浓度和稳定性,确保其符合实验要求。
总之,氯化钠标准溶液的配制需要严格按照一定的比例和步骤进行,以确保其浓度和稳定性符合实验要求。
只有通过精确的配制和严格的管理,才能保证实验结果的准确性和可靠性。
希望以上介绍对大家有所帮助,谢谢!。

一、实训目的1. 掌握氯化钠标准溶液的配制方法;2. 熟悉标定氯化钠标准溶液的步骤;3. 培养实验操作技能,提高实验数据处理和分析能力;4. 了解氯化钠标准溶液在化学分析中的应用。
二、实训原理氯化钠标准溶液是一种常用的化学试剂,在化学分析中具有广泛的应用。
通过精确配制和标定氯化钠标准溶液,可以保证实验结果的准确性和可靠性。
本实训主要利用滴定分析法,通过标定硝酸银溶液的方法来测定氯化钠溶液的浓度。
三、实训仪器与试剂1. 仪器:电子天平、移液管、滴定管、锥形瓶、烧杯、玻璃棒、滤纸、滴定台、洗瓶、滴定管夹、酒精灯等。
2. 试剂:氯化钠基准试剂、硝酸银溶液、硝酸、氢氧化钠、酚酞指示剂等。
四、实训步骤1. 氯化钠标准溶液的配制(1)称取0.1000g氯化钠基准试剂,置于烧杯中。
(2)加入适量蒸馏水,溶解氯化钠。
(3)将溶液转移到1000mL容量瓶中,用蒸馏水稀释至刻度,摇匀。
2. 氯化钠标准溶液的标定(1)取一支干净的锥形瓶,加入20mL硝酸银溶液。
(2)用移液管取10.00mL氯化钠标准溶液,加入锥形瓶中。
(3)加入1~2滴酚酞指示剂,用硝酸银溶液滴定至粉红色,出现30秒内不褪色为止。
(4)记录消耗的硝酸银溶液体积,重复实验3次,计算平均值。
3. 数据处理根据滴定反应的化学方程式,计算氯化钠标准溶液的浓度:C(NaCl)= C(AgNO3)× V(AgNO3)× M(NaCl)/ V(NaCl)式中:C(NaCl)为氯化钠标准溶液的浓度,mol/L;C(AgNO3)为硝酸银溶液的浓度,mol/L;V(AgNO3)为消耗的硝酸银溶液体积,mL;V(NaCl)为氯化钠标准溶液的体积,mL;M(NaCl)为氯化钠的摩尔质量,58.442g/mol。
五、实训结果与分析1. 氯化钠标准溶液的配制通过称取0.1000g氯化钠基准试剂,配制成1000mL 0.1000mol/L的氯化钠标准溶液。
2. 氯化钠标准溶液的标定经过3次实验,消耗的硝酸银溶液体积分别为20.50mL、20.45mL、20.48mL,平均消耗体积为20.47mL。

溶液配制实验报告
实验目的:
1. 学习如何配制溶液;
2. 掌握稀溶液的配制方法。
实验原理:
在实验中,我们将配制一种指定浓度的溶液。
溶液配制的一般原则是按照所需浓度计算相应的质量或体积,并将固体或液体原料溶解于适量的溶剂中,最终得到所需浓度的溶液。
实验步骤:
1. 根据实验要求计算所需溶质的质量或体积和溶剂的质量或体积;
2. 准备好所需的溶质和溶剂;
3. 在一个干净的容器中,先加入适量的溶剂;
4. 将溶质逐渐加入容器中,并充分搅拌直至完全溶解,注意搅拌速度要适中;
5. 检查溶液的浓度是否符合要求,如有需要可以进行调整。
实验数据:(仅作为示例展示)
配制100 mL 0.1 mol/L 的 NaCl 溶液的计算:
1. 计算所需的溶质质量:NaCl 的相对分子质量为58.5 g/mol,摩尔质量为0.1 mol/L × 58.5 g/mol × 0.1 L = 0.585 g;
2. 准备0.585 g 的 NaCl 固体;
3. 在一个干净的容器中加入适量的水,溶解0.585 g 的 NaCl 固体,搅拌至完全溶解;
4. 检查溶液浓度是否符合要求。
实验结果:
所配制的100 mL 0.1 mol/L 的 NaCl 溶液经检测,浓度符合要求。
实验结论:
通过本次实验,我们成功地配制了所需浓度的NaCl溶液。
实
验过程中需要妥善计算和称量溶质与溶剂,以确保最终得到的溶液浓度符合要求。
此外,实验过程中搅拌的速度也需要适中,以促进溶质的溶解。

实验4:配制100mL1.00 mol/L 的NaCl 溶液班级: 姓名:【实验目的】1、练习配制一定物质的量浓度的溶液;2、加深对物质的量浓度概念的理解;3、练习容量瓶的使用方法【实验仪器药品】托盘天平、小烧杯、药匙、100ml 容量瓶、胶头滴管、玻璃棒、量筒【实验药品】NaCl 固体、蒸馏水中加蒸馏水至容量瓶刻然后使凹液面的最低点恰好与刻度1、 改用胶头滴管滴加,是为了防止加入液体过多; 2、 注意定容时眼睛应平视,不能俯视或仰视。
【交流与思考】1、容量瓶使用时应注意的事项:2、为什么要用蒸馏水来配置溶液而不能用自来水配置呢?3、为什么要洗涤玻璃棒和烧杯?如何洗涤?4、能否将溶解的NaCl溶液立即注入容量瓶中?为什么?5、为什么要将配好的溶液,从容量瓶里倒入试剂瓶?6、定容时不慎滴加液体超过刻度线,则该怎么做?7、下列实验操作会使所配制的溶液浓度偏高,偏低,还是不变?为什么?①把溶液向容量瓶中转移,有少量溶液溅出;( ) 原因:;②未洗涤烧杯和玻璃棒;( ) 原因:;③定容时加水超过了刻线;( )原因:;④定容时仰视观察液面;( )原因:;⑤定容时俯视观察液面;( )原因:;⑥将溶液转移到容量瓶之前,容量瓶中有少量蒸馏水;()原因:;⑦将配得的溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出;( )原因:;⑧定容时,俯视观察容量瓶刻度线;()原因:;鱼儿,在水中串上串下,吐着顽皮的泡泡;鸟儿从荷叶上空飞过,想亲吻荷花姑娘的芳泽。
四周的花儿,紫的,黄的,白的,红的,竞相开放。
大红花儿,张着大嘴,放声歌唱;灯笼花儿,随风摇坠,四处飘香;剑兰花儿,形态独特,毫不逊色。
它们与荷塘之景交相辉映,美不胜收此时,我的心情兴奋到极点,好久好久没有看过如此美的景色了。
若果我有一双会画画的手,我定把这如痴如醉的荷塘活色生香的描绘一番;若果我有一部高像素的相机,我定不放过每个花开的镜头;若果我是一个诗人,我定把这荷塘每片光鲜艳丽的色泽融入人生的诗篇。
一定溶质质量分数的氯化钠溶液的配制实验报告单实验名称:一定溶质质量分数的氯化钠溶液的配制一、实验目的:1.理解溶质的质量分数的概念;2.学习制备一定质量分数的氯化钠溶液的方法;3.掌握测量质量的准确方法。
二、实验原理:质量分数是溶液中溶质的质量与溶液总质量之比。
设氯化钠溶液的质量分数为x,则氯化钠的质量为x乘以溶液总质量。
质量分数的计算公式为:质量分数(x)=氯化钠质量/溶液总质量本实验采用蒸发法制备一定质量分数的氯化钠溶液,通过加热蒸发溶液中的水,使溶液浓缩,达到目标质量分数。
三、实验器材及试剂:1.氯化钠固体;2.蒸馏水;3.天平;4.烧杯;5.锥形瓶;6.镊子;7.加热器材;8.温度计。
四、实验步骤:1.准备工作:a.将所需器材清洗干净并晾干。
b.打开天平,将烧杯放在天平上,将天平调零。
c.使用镊子取一定质量的氯化钠固体,记录质量。
d.准备适量的蒸馏水。
2.配制溶液:a.将烧杯放在加热器上,将适量的蒸馏水倒入烧杯中。
b.将烧杯放在加热器上进行加热,同时搅拌溶液,直到观察到溶液开始沸腾。
c.一旦溶液开始沸腾,继续加热,直到溶液中的水蒸发至一定程度,使溶液浓缩。
3.测量质量:a.将烧杯从加热器上取下,放置到天平上,将天平调零。
b.将蒸发后的溶液慢慢倒入烧杯中,直到质量稳定。
c.记录溶液质量。
4.计算质量分数:a.使用质量分数公式计算氯化钠的质量分数。
b.记录计算结果。
五、实验数据记录:实验设置目标质量分数为0.2、实验过程中,取得的数据记录如下:质量分数x=氯化钠质量/溶液总质量=0.2质量分数x=0.2氯化钠质量=8g溶液总质量=40g六、实验结果与结论:通过本实验,成功地制备出了质量分数为0.2的氯化钠溶液。
七、实验讨论与思考:1.本实验使用的制备方法是蒸发法,理论上只有水分子被蒸发,而溶质的质量并不变化。
然而,实际操作中可能会有氯化钠固体溶解在水中,导致质量分数略高于理论值。
为了提高实验的准确性,可以在加热后加入少量蒸馏水,使溶液回溶,并进一步搅拌溶液以促进氯化钠的溶解。
配制NaCl溶液的实验报告实验名称:配制100ml 1mol/L的NaCl溶液实验目的:①学会配制溶液的操作技能和方法;②练习使用托盘天平、容量瓶等;③加深对物质的量浓度概念的理解;实验仪器和试剂:100ml容量瓶、药匙、托盘天平、滤纸、100ml烧杯、玻璃棒、胶头滴管、NaCl固体、蒸馏水实验步骤:①计算:需要称量NaCl的质量为5.8g;(原理m=C×V×M)②称量:根据计算结果,称量NaCl固体(注意:托盘天平两边垫滤纸)(托盘天平使用方法:①将托盘天平放在水平桌面上,用镊子将游码拨至标尺的左侧零位。
②接下来调节平衡螺母,使指针指到分度盘的中央刻度线。
③物体一定要放到托盘天平的左盘,放砝码时要从大到小,注意在取放砝码的过程当中要轻拿轻放。
④当砝码没有更小的可以加时,这时候拨动游码,使指针再次指到分度盘的中央刻度线即可。
⑤物体的质量分为两部分,例如:先是右盘砝码的质量,为40g,那么标尺上数值为2.8g,总共加起来应该是42.8g。
⑥做完实验,把砝码收回到盒子当中,取下物体,游码归至左侧零位处,整理好实验仪器。
)③溶解:向烧杯中加适量蒸馏水溶解④冷却待溶液冷却至室温⑤转移:将烧杯中的溶液转移到100ml容量瓶中(注意∶玻璃棒伸到刻度线以下)⑥洗涤用少量蒸馏水洗涤烧杯内壁和玻璃棒2-3次,洗涤液也注入容量瓶(注意:加蒸馏水的总量不要超过100ml)⑦摇动:轻轻摇动容量瓶,使溶液混合均匀(注意:注意幅度,不要将溶液摇到刻度线以上)⑧定容向容量瓶中注入蒸馏水至液面距离刻度线1-2cm 处,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;(注意:眼睛平视刻度线)⑨摇匀:盖好瓶塞,反复上下颠倒,摇匀(注意:摇匀后液面可能低于刻度线,此时不用再加蒸馏水)⑩装瓶贴标签:转入准备好的试剂瓶,并贴好标签妥善保存。
实验4:配制100mL1.00 mol/L 的NaCl 溶液班级: 姓名:【实验目的】1、练习配制一定物质的量浓度的溶液;2、加深对物质的量浓度概念的理解;3、练习容量瓶的使用方法【实验仪器药品】托盘天平、小烧杯、药匙、100ml 容量瓶、胶头滴管、玻璃棒、量筒【实验药品】NaCl 固体、蒸馏水中加蒸馏水至容量瓶刻然后使凹液面的最低点恰好与刻度1、 改用胶头滴管滴加,是为了防止加入液体过多; 2、 注意定容时眼睛应平视,不能俯视或仰视。
【交流与思考】1、容量瓶使用时应注意的事项:2、为什么要用蒸馏水来配置溶液而不能用自来水配置呢?3、为什么要洗涤玻璃棒和烧杯?如何洗涤?4、能否将溶解的NaCl溶液立即注入容量瓶中?为什么?5、为什么要将配好的溶液,从容量瓶里倒入试剂瓶?6、定容时不慎滴加液体超过刻度线,则该怎么做?7、下列实验操作会使所配制的溶液浓度偏高,偏低,还是不变?为什么?①把溶液向容量瓶中转移,有少量溶液溅出;( ) 原因:;②未洗涤烧杯和玻璃棒;( ) 原因:;③定容时加水超过了刻线;( )原因:;④定容时仰视观察液面;( )原因:;⑤定容时俯视观察液面;( )原因:;⑥将溶液转移到容量瓶之前,容量瓶中有少量蒸馏水;()原因:;⑦将配得的溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出;( )原因:;⑧定容时,俯视观察容量瓶刻度线;()原因:;鱼儿,在水中串上串下,吐着顽皮的泡泡;鸟儿从荷叶上空飞过,想亲吻荷花姑娘的芳泽。
四周的花儿,紫的,黄的,白的,红的,竞相开放。
大红花儿,张着大嘴,放声歌唱;灯笼花儿,随风摇坠,四处飘香;剑兰花儿,形态独特,毫不逊色。
它们与荷塘之景交相辉映,美不胜收此时,我的心情兴奋到极点,好久好久没有看过如此美的景色了。
若果我有一双会画画的手,我定把这如痴如醉的荷塘活色生香的描绘一番;若果我有一部高像素的相机,我定不放过每个花开的镜头;若果我是一个诗人,我定把这荷塘每片光鲜艳丽的色泽融入人生的诗篇。
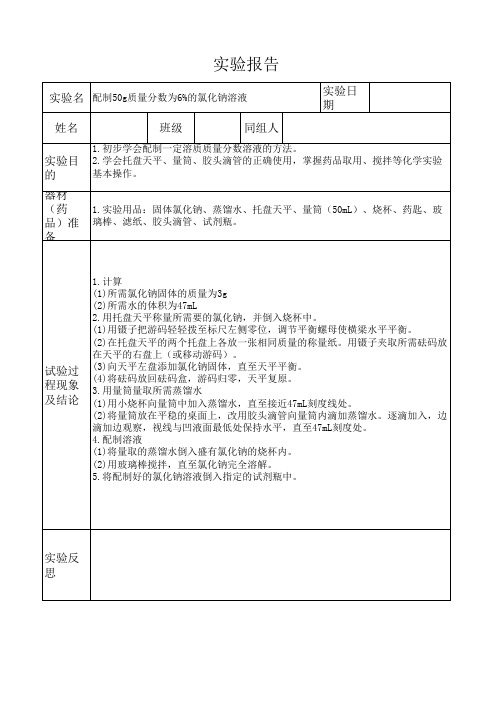
化学实验报告
【实验目的】
1、练习配制一定溶质质量分数或量浓度一定的溶液。
2、加深对溶质的质量分数以及量浓度概念的理解。
【实验器材】
托盘天平、烧杯、玻璃棒、药匙、量筒、胶头滴管。
氯化钠、浓盐酸溶液、蒸馏水、容量瓶、漏斗。
【实验步骤】
1、配置质量分数为6%的氯化钠溶液
(1)计算:配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:
NaCl:50g*6%=3g ;水:47g。
(2)称量:用托盘天平称取所需的氯化钠,放入烧杯中。
(3)量取:用量筒量取所需的水(水的密度可近似看作1g/cm3),倒入盛有氯化钠的烧杯中。
(4)溶解:用玻璃棒搅拌,使氯化钠溶解。
2、用已配制好的质量分数为6%的氯化钠溶液(密度约为1.04g/cm3),配制50g质量分数为3%的氯
化钠溶液。
(1)计算:所得溶液中,氯化钠的质量为50g*3%=1.5g,所以需要质量分数为6%的氯化钠溶液25g
(体积为26ml),蒸馏水25g(体积约为25ml)
(2)量取:用量筒量取所需的氯化钠溶液和水,倒入烧杯中。
(3)混匀:用玻璃棒搅拌,使溶液混合均匀。
将上述配制好的溶液分别转入试剂瓶内,并贴上标签,区分开来。
3、配制250ml,2mol/L的稀盐酸
(1)计算所需浓盐酸的体积
设所需浓盐酸的体积为V1,则
C1*V1=0.25L*2mol/L
12mol/L*V1=0.25L*2mol/L
解得该体积为41.7ml
(2)用量筒量取41.7ml的浓盐酸
(3)在烧杯中加入少量(大大少于250ml)的水和量取好的浓盐酸,用玻璃棒搅拌稀释。
(4)使用漏斗将烧杯内的溶液转移到容量瓶中。
(5)用水洗涤盛过盐酸的量筒和烧杯,并把洗涤液转移至容量瓶。
(6)定容:用胶头滴管继续加水,直至溶液凹液面达到250ml刻度。
(7)压紧容量瓶瓶盖将溶液摇匀。