2018年全国高考理综1卷化学试题部分答案与分析
- 格式:doc
- 大小:516.00 KB
- 文档页数:9


2018年全国高考理综(Ⅰ)卷
化学试题部分参考答案
一、选择题:每小题6分,在每小题给出的四个选项中,只有一选项就是符合题目要求的。
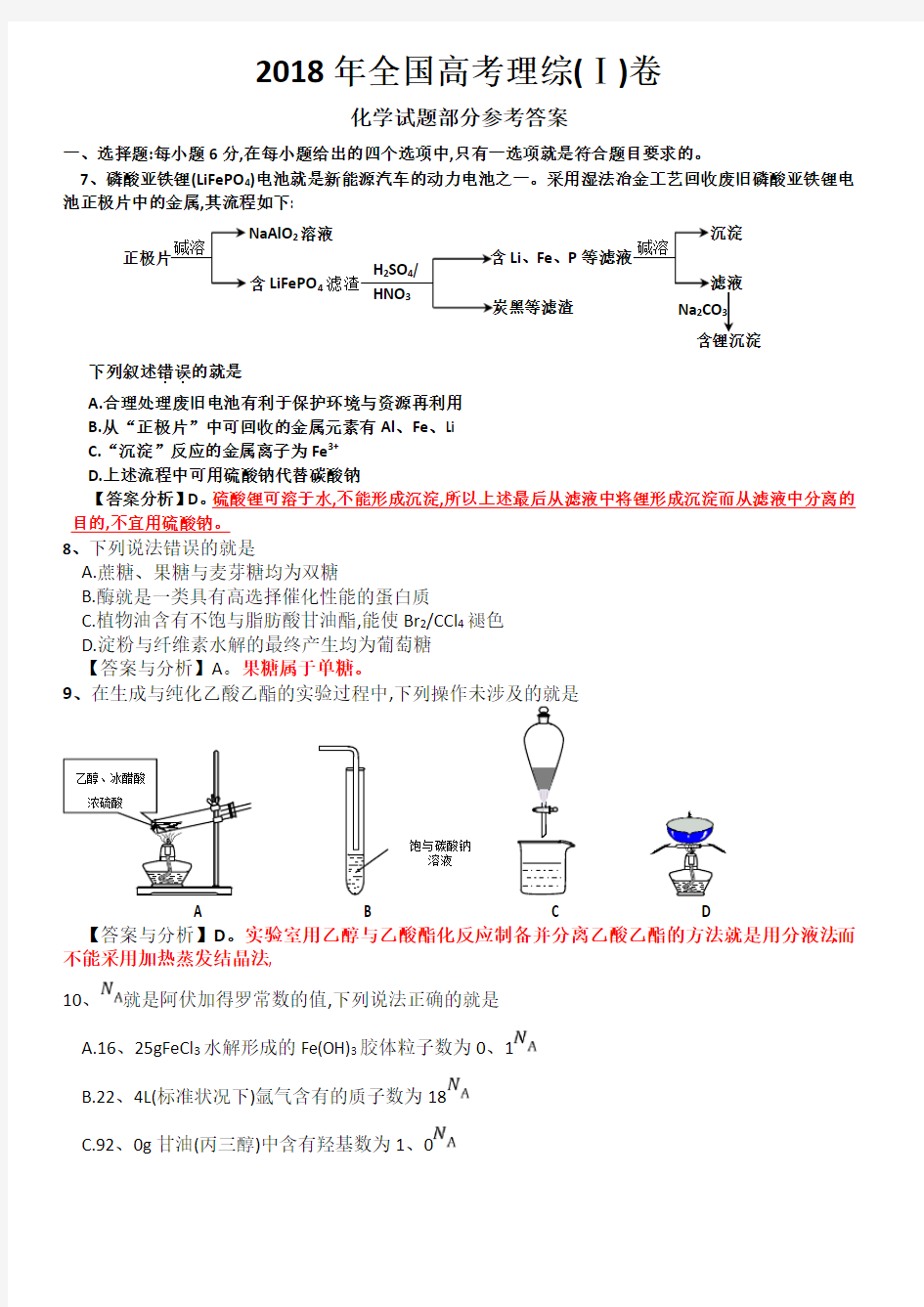
7、磷酸亚铁锂(LiFePO 4)电池就是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:
下列叙述错误..
的就是 A.合理处理废旧电池有利于保护环境与资源再利用 B.从“正极片”中可回收的金属元素有Al 、Fe 、Li C.“沉淀”反应的金属离子为Fe 3+ D.上述流程中可用硫酸钠代替碳酸钠
【答案分析】D 。硫酸锂可溶于水,不能形成沉淀,所以上述最后从滤液中将锂形成沉淀而从滤液中分离的目的,不宜用硫酸钠。 8、下列说法错误的就是
A.蔗糖、果糖与麦芽糖均为双糖
B.酶就是一类具有高选择催化性能的蛋白质
C.植物油含有不饱与脂肪酸甘油酯,能使Br 2/CCl 4褪色
D.淀粉与纤维素水解的最终产生均为葡萄糖 【答案与分析】A 。果糖属于单糖。
9、在生成与纯化乙酸乙酯的实验过程中,
A B C D
【答案与分析】D 。实验室用乙醇与乙酸酯化反应制备并分离乙酸乙酯的方法就是用分液法,而不能采用加热蒸发结晶法, 10、
就是阿伏加得罗常数的值,下列说法正确的就是
A.16、25gFeCl 3水解形成的Fe(OH)3胶体粒子数为0、1
B.22、4L(标准状况下)氩气含有的质子数为18
C.92、0g 甘油(丙三醇)中含有羟基数为1、0
饱与碳酸钠 溶液
乙醇、冰醋酸 浓硫酸
正极片
碱溶
2溶液 LiFePO 4滤渣
H 2SO 4/ HNO 3
含Li 、Fe 、P 炭黑等滤渣
碱溶
沉淀 滤液 Na 2CO 3 含锂沉淀
D.1、0molCH4与Cl2在光照下反应生成CH3Cl分子数为1、0
【答案与分析】B。盐类水解的程度就是很小的,A不对;隋性气体属于单原子分子,1mol的氩气在标准状况下所占的体积为22、4L,所含的电子数与质子数相等,均为18mol,B正确;1mol甘油(丙三醇)
中含有3的羟基,C错误;CH4与CL2在光照的条件下反应生成的产物中含有CH3Cl、CH2Cl2、CHCl3及CCl4,则生成物中含有的CH3Cl少于1mol,D不对。
11、环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷就是最简单的一种。下列
关于该化合物的说法错误的就是
A.与环戊烯互为同份异构体
B.二氯代物超过两种
C.所有碳原子均处于同一平面
D.生成1molC5H12至少需要2molH2
【答案与分析】C。螺[2,2]戊烷的分子式为C5H8,与环戊烯相同,它们互为同份异构体,A正
确;螺[2,2]戊烷(的二氯代物有3种,B正确;螺烷中共用的碳原子采用SP3杂化成键,根据价键互斥理论,螺[2,2]戊烷中的两个三角形平面互相垂直,共用的碳原子形成的四个价键不在同一平面上,C 观点不正确;由于3个碳原子形成三角形的键角为60°107、5°,形成的键张力容易使C—C断裂,
在一定条件下螺[2,2]戊烷能够与氢气发生类似不饱与烃的加成反应那样形成饱与直链烷烃,D正确。
12、主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之与为10,W 与Y同族,W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的就是
A.常温常压下X的单质为气态
B.Z的氢化物为离子化合物
C.Y与Z形成的化合物的水溶液呈碱性
D.W与Y具有相同的最高化合价
【答案与解释】B。能够腐蚀玻璃的二元化合物就是HF,由此推断,W、X、Y与Z分别就是F、Mg、Cl与K,Mg在常温常压下为固体,A错误;KH发生离子化合物,B正确;KCl属于强酸强碱盐,其水溶液呈中性,C观点不正确;F就是所有元素中电负性最大的非金属元素,在化合物中不能形成正价态,Cl的最高正化合价为“+7”,D不对。
13、最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2与H2S的高效去除。示意图如右图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)与石墨烯,石墨烯电极区发生反应为:①EDTA·Fe2+-e-=EDTA·Fe3+②2EDTA·Fe3++H2S=2H++S+2EDTA·Fe2+
4422
该装置工作时,下列叙述错误的就是
A.阴极的电极反应:CO2+2H++2e-=CO+H2O
B.协同转化总反应:CO2+H2S=CO+H2O+S
C.石墨烯上的电势比ZnO@石墨烯上的低
D.若Fe2+/Fe3+取代EDTA-Fe2+/EDTA-Fe3+,溶液需为酸性。
【答案与分析】C。由于石墨烯电极区发生反应为:①EDTA-Fe2+-e-=EDTA-Fe3+,即发生了氧化反应,因此石墨烯为阳极,而ZnO@石墨烯为阴极,发生还原反应,即CO2+2H++2e-=CO+H2O,A正确,则电池发生的反应为:
阳极:2EDTA-Fe2+-2e-=2EDTA-Fe3+………………………⑴
2EDTA-Fe3++H2S=2EDTA-Fe2++2H++S………………⑵
阴极:CO2+2H++2e-=CO+H2O…………………………………⑶
⑴+⑵+⑶得:协同转化反应总方程式:CO2+H2S=CO+H2O+S,A、B正确;阳极电势高于阴极电势,C不对;碱性条件下,Fe 2+与Fe 3+容易产生Fe(OH)2或Fe(OH)3沉淀,D正确。
26、(14分)
醋酸亚铬[(CH3COO)2Cr·2H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中,用作氧气吸收剂,一般制备方法就是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬,二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,
锌粒+氧化铬
回答下列问题:
⑴实验中所用蒸馏水均需要经煮沸后迅速冷却,目的就是,仪器a的名称就是
⑵将过量锌粒与氧化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。
①c中的溶液由绿色逐渐变为亮蓝色,该反应的离子方程式就是;