【苏教版】化学选修四:2.2.1《化学反应的方向》课时作业及答案
- 格式:doc
- 大小:202.50 KB
- 文档页数:4
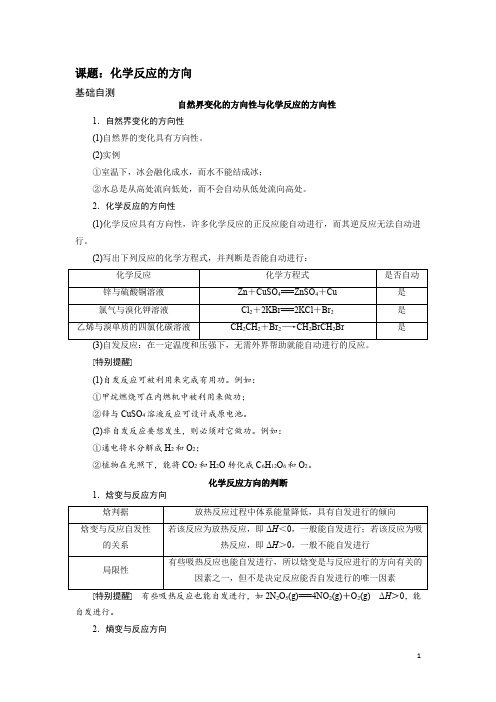
课题:化学反应的方向基础自测自然界变化的方向性与化学反应的方向性1.自然界变化的方向性(1)自然界的变化具有方向性。
(2)实例①室温下,冰会融化成水,而水不能结成冰;②水总是从高处流向低处,而不会自动从低处流向高处。
2.化学反应的方向性(1)化学反应具有方向性,许多化学反应的正反应能自动进行,而其逆反应无法自动进行。
(2)写出下列反应的化学方程式,并判断是否能自动进行:[特别提醒](1)自发反应可被利用来完成有用功。
例如:①甲烷燃烧可在内燃机中被利用来做功;②锌与CuSO4溶液反应可设计成原电池。
(2)非自发反应要想发生,则必须对它做功。
例如:①通电将水分解成H2和O2;②植物在光照下,能将CO2和H2O转化成C6H12O6和O2。
化学反应方向的判断1.焓变与反应方向2522自发进行。
2.熵变与反应方向(1)熵:科学家用来量度体系混乱程度的物理量,用S表示。
(2)熵变:ΔS=S(生成物)-S(反应物)(3)熵增原理:在与外界隔离的体系中,自发过程将导致体系的熵增大,即熵变大于零。
(4)熵判据:体系有自发地向熵增的方向转变的倾向,熵变是影响反应自发进行的一个因素,但不是唯一因素。
(5)熵变对化学反应方向的影响。
①熵增加的反应在一定条件下都可自发进行。
如2H2O2(aq)===2H2O(l)+O2(g)在常温下能自发进行。
②有些熵减小的反应也能自发进行。
如NH3(g)+HCl(g)===NH4Cl(s)。
3.焓变、熵变与反应方向(1)含义:体系能量降低和混乱度增大都有促使反应自发进行的倾向。
(2)反应方向的判断反应自发性的判断必须综合考虑反应的焓变和熵变。
在恒温、恒压时,①ΔH<0,ΔS>0,则反应一定能自发进行;②ΔH>0,ΔS<0,则反应一定不能自发进行;③ΔH<0,ΔS<0或ΔH>0,ΔS>0,反应可能自发进行,也可能不自发进行,与反应的温度有关。

课时分层作业(九) 化学反应的方向(建议用时:40分钟)[基础达标练]1.下列关于自发过程的说法中正确的是 ( )A.自发过程的逆过程在此条件下是非自发的B.自发变化一定能进行,非自发变化一定不能进行C.自发反应一定能进行彻底D.可以通过改变温度或加催化剂的办法使非自发反应转化为自发反应A[反应是否实际进行还要受速率影响,B项错误。
自发反应总是向ΔH-TΔS<0的方向进行,直至达到平衡状态,C项错误。
温度可以使ΔH和ΔS正负相同的不自发反应转化为自发反应,但催化剂不能,D项错误。
] 2.吸热反应一定是( )A.非自发的化学反应B.释放能量C.储存能量D.反应需要加热C[吸热反应也可能自发进行,A错误;吸热反应进行不一定需要加热,D错误。
]3.实验证明,多数能自发进行的反应都是放热反应。
对此说法的理解正确的是( )A.所有的放热反应都是自发进行的B.所有的自发反应都是放热的C.焓变是影响反应是否具有自发性的一种重要因素D.焓变是决定反应是否具有自发性的唯一判据C[焓变是判断反应能否自发进行的一种判据,但不是唯一判据;有些放热反应不是自发反应,有些自发反应是吸热的。
]4.在图1中A、B两容器里,分别收集着一种理想气体(二者不反应)。
若将中间活塞打开,两种气体分子立即都分布在两个容器中(如图2所示)。
这是一个不伴随能量变化的自发过程。
关于此过程的下列说法不正确的是( )图1 图2A.此过程是自发可逆的B.此过程从有序到无序,混乱度增大C.此过程为自发过程,而且没有热量的吸收或放出D.此过程是由混乱程度小的方向向混乱程度大的方向变化的过程,即熵增加的过程A[气体扩散过程中,混乱度增大,即ΔS>0,B项、D项正确;该变化过程自发进行,且没有能量变化,C 项正确;气体的扩散为自发过程,其逆过程不能自发进行,A项错误。
]5.下列对熵的理解不正确的是( )【导学号:73702112】A.同种物质气态时熵最大,固态时熵最小B.体系越有序,熵越小;越混乱,熵越大C.与外界隔离的体系,自发过程将导致体系的熵减小D.25 ℃、1.01×105 Pa时,2N2O5(g)===4NO2(g)+O2(g)是熵增的反应C[体系都有从有序自发转变为无序的倾向,此过程为熵增过程,故C错误。


化学反应的方向和限度___________________________________________________________________________ __________________________________________________________________________________ _______1.了解化学反应的方向与焓变与熵变之间的关系, 能利用化学反应的焓变和熵变判断化学反应的方向。
2.了解可逆反应的定义,理解化学平衡和化学平衡常数的定义并能进行简单计算。
1. 自发过程(1)含义在一定条件下, 不需要借助外力作用就能自动进行的过程。
(2)特点①体系趋向于从高能状态转变为低能状态(体系对外部做功或释放热量)。
②在密闭条件下, 体系有从有序转变为无序的倾向性(无序体系更加稳定)。
2. 自发反应在一定条件下无需外界帮助就能自发进行的反应称为自发反应。
3. 判断化学反应方向的依据(1)焓变与反应方向研究表明, 对于化学反应而言, 绝大多数放热反应都能自发进行, 且反应放出的热量越多, 体系能量降低得也越多, 反应越完全。
可见, 反应的焓变是制约化学反应能否自发进行的因素之一。
(2)熵变与反应方向①研究表明, 除了热效应外, 决定化学反应能否自发进行的另一个因素是体系的混乱度。
大多数自发反应有趋向于体系混乱度增大的倾向。
②熵和熵变的含义a. 熵的含义熵是衡量一个体系混乱度的物理量。
用符号S表示。
同一条件下, 不同物质有不同的熵值, 同一物质在不同状态下熵值也不同, 一般规律是S(g)>S(l)>S(s)。
b. 熵变的含义熵变是反应前后体系熵的变化, 用ΔS表示, 化学反应的ΔS越大, 越有利于反应自发进行。
(3)综合判断反应方向的依据①ΔH-TΔS<0, 反应能自发进行。
②ΔH-TΔS=0, 反应达到平衡状态。
③ΔH-TΔS>0, 反应不能自发进行。

课时分层作业(九) 化学反应的方向(建议用时:40分钟)[基础达标练]1.下列关于自发过程的说法中正确的是 ( )A.自发过程的逆过程在此条件下是非自发的B.自发变化一定能进行,非自发变化一定不能进行C.自发反应一定能进行彻底D.可以通过改变温度或加催化剂的办法使非自发反应转化为自发反应A[反应是否实际进行还要受速率影响,B项错误。
自发反应总是向ΔH-TΔS<0的方向进行,直至达到平衡状态,C项错误。
温度可以使ΔH和ΔS正负相同的不自发反应转化为自发反应,但催化剂不能,D项错误。
]2.吸热反应一定是( )A.非自发的化学反应B.释放能量C.储存能量D.反应需要加热C[吸热反应也可能自发进行,A错误;吸热反应进行不一定需要加热,D错误。
] 3.实验证明,多数能自发进行的反应都是放热反应。
对此说法的理解正确的是( ) A.所有的放热反应都是自发进行的B.所有的自发反应都是放热的C.焓变是影响反应是否具有自发性的一种重要因素D.焓变是决定反应是否具有自发性的唯一判据C[焓变是判断反应能否自发进行的一种判据,但不是唯一判据;有些放热反应不是自发反应,有些自发反应是吸热的。
]4.在图1中A、B两容器里,分别收集着一种理想气体(二者不反应)。
若将中间活塞打开,两种气体分子立即都分布在两个容器中(如图2所示)。
这是一个不伴随能量变化的自发过程。
关于此过程的下列说法不正确的是( )图1 图2A.此过程是自发可逆的B.此过程从有序到无序,混乱度增大C.此过程为自发过程,而且没有热量的吸收或放出D.此过程是由混乱程度小的方向向混乱程度大的方向变化的过程,即熵增加的过程A[气体扩散过程中,混乱度增大,即ΔS>0,B项、D项正确;该变化过程自发进行,且没有能量变化,C项正确;气体的扩散为自发过程,其逆过程不能自发进行,A项错误。
]5.下列对熵的理解不正确的是( )【导学号:73702112】A.同种物质气态时熵最大,固态时熵最小B.体系越有序,熵越小;越混乱,熵越大C.与外界隔离的体系,自发过程将导致体系的熵减小D.25 ℃、1.01×105 Pa时,2N2O5(g)===4NO2(g)+O2(g)是熵增的反应C[体系都有从有序自发转变为无序的倾向,此过程为熵增过程,故C错误。

化学反应的方向1.下列过程均为自发过程的是( )①铵盐的溶解 ②烧碱与盐酸反应 ③Zn 与稀H 2SO 4反应 ④氢气在氧气中燃烧 ⑤Mg 在空气中燃烧 ⑥铝热反应 ⑦墨水在水中的扩散 ⑧电解熔融的氯化钠A .①②③④B.⑤⑥⑦⑧ C .②④⑥⑧D.①②③④⑤⑥⑦2.金属锡的冶炼常用焦炭作还原剂:SnO 2+2C=====高温Sn +2CO↑,反应过程中能量的变化如右图所示。
下列有关该反应的ΔH 、ΔS 的说法正确的是( ) A .ΔH <0 ΔS <0 B .ΔH >0 ΔS <0 C .ΔH <0 ΔS >0 D .ΔH >0 ΔS >03.橡皮筋在拉伸和收缩状态时,结构如图。
25℃、101kPa 时,下列过程的焓变、熵变和自发性与橡皮筋从拉伸状态到收缩状态一致的是( )A .CaCO 3=====高温CaO +CO 2↑ B .NaOH 的溶解 C .2H 2+O 2=====点燃2H 2OD .Ba(OH)2·8H 2O +2NH 4Cl===BaCl 2+2NH 3↑+10H 2O4.往平底烧瓶中放入氢氧化钡晶体[Ba(OH)2·8H 2O]和固态氯化铵晶体,塞紧瓶塞。
在瓶底和木板间滴少量水,如图所示。
一会儿,就会发现瓶内固态物质变少并有液体产生,瓶壁变冷,小木板因水冻结而被烧瓶黏住,这时打开瓶塞,出来的气体有刺激性气味。
这是自发地发生了反应:Ba(OH)2·8H 2O +2NH 4Cl===BaCl 2+2NH 3+10H 2O 。
下列结论正确的是( )A .自发反应一定是放热反应B .自发反应一定是吸热反应C .有的吸热反应也能自发进行D .吸热反应不能自发进行5.下列反应在常温下均为非自发反应,在高温下仍为非自发反应的是( ) A .Ag 2O(s)===2Ag(s)+12O 2(g)B .Fe 2O 3(s)+32C(s)===2Fe(s)+32CO 2(g)C .N 2O 4(g)===2NO 2(g)D .CO(g)===C(s)+12O 2(g)6.反应CH 3OH(l)+NH 3(g)===CH 3NH 2(g)+H 2O(g)在某温度下自发向右进行,若反应的|ΔH |=17kJ·mol -1,|ΔH -TΔS |=17kJ·mol -1,则下列判断中正确的是( )A .ΔH >0,ΔH -T ΔS <0B .ΔH <0,ΔH -T ΔS >0C .ΔH >0,ΔH -T ΔS >0D .ΔH <0,ΔH -T ΔS <07.下列关于化学反应方向,说法正确的是( )A .反应3NO 2(g)+H 2O(l)===2HNO 3(aq)+NO(g)在一定条件下自发进行,说明该反应的ΔH >0B .反应2Na 2SO 3(s)+O 2(g)===2Na 2SO 4(s)能自发进行,则ΔH <0C .反应2Na 2O 2(s)+2CO 2(g)===2Na 2CO 3(s)+O 2(g)能自发进行,则该反应的ΔH >0D .一定温度下,反应2NaCl(s)===2Na(s)+Cl 2(g)的ΔH <0 8.已知在等温等压条件下,化学反应方向的判据为 ΔH -T ΔS <0 反应能自发进行ΔH -T ΔS =0 反应达到平衡状态 ΔH -T ΔS >0 反应不能自发进行设反应A===D +E ΔH -T ΔS =(-4500+11T ) J·mol -1,要防止反应发生,温度必须( )A .高于409KB .低于136KC .高于136K 而低于409KD .低于409K9.灰锡结构松散,不能用于制造器皿,而白锡结构坚固,可以制造器皿。
课时分层作业(九) 化学反应的方向(建议用时:40分钟)[基础达标练]1.下列关于自发过程的说法中正确的是 ( )A.自发过程的逆过程在此条件下是非自发的B.自发变化一定能进行,非自发变化一定不能进行C.自发反应一定能进行彻底D.可以通过改变温度或加催化剂的办法使非自发反应转化为自发反应A[反应是否实际进行还要受速率影响,B项错误。
自发反应总是向ΔH-TΔS<0的方向进行,直至达到平衡状态,C项错误。
温度可以使ΔH和ΔS正负相同的不自发反应转化为自发反应,但催化剂不能,D项错误。
]2.吸热反应一定是( )B.释放能量A.非自发的化学反应C.储存能量D.反应需要加热C[吸热反应也可能自发进行,A错误;吸热反应进行不一定需要加热,D错误。
] 3.实验证明,多数能自发进行的反应都是放热反应。
对此说法的理解正确的是( )A.所有的放热反应都是自发进行的B.所有的自发反应都是放热的C.焓变是影响反应是否具有自发性的一种重要因素D.焓变是决定反应是否具有自发性的唯一判据C[焓变是判断反应能否自发进行的一种判据,但不是唯一判据;有些放热反应不是自发反应,有些自发反应是吸热的。
] 4.在图1中A、B两容器里,分别收集着一种理想气体(二者不反应)。
若将中间活塞打开,两种气体分子立即都分布在两个容器中(如图2所示)。
这是一个不伴随能量变化的自发过程。
关于此过程的下列说法不正确的是( )图1 图2A.此过程是自发可逆的B.此过程从有序到无序,混乱度增大C.此过程为自发过程,而且没有热量的吸收或放出D.此过程是由混乱程度小的方向向混乱程度大的方向变化的过程,即熵增加的过程A[气体扩散过程中,混乱度增大,即ΔS>0,B项、D项正确;该变化过程自发进行,且没有能量变化,C项正确;气体的扩散为自发过程,其逆过程不能自发进行,A项错误。
]5.下列对熵的理解不正确的是( )【:73702112】A.同种物质气态时熵最大,固态时熵最小B.体系越有序,熵越小;越混乱,熵越大C.与外界隔离的体系,自发过程将导致体系的熵减小D.25 ℃、1.01×105 Pa时,2N2O5(g)===4NO2(g)+O2(g)是熵增的反应C[体系都有从有序自发转变为无序的倾向,此过程为熵增过程,故C错误。
y+、++、—Ⅰ Ⅱ 化学反应的方向及判据1.反应焓变与反应方向(1)多数能自发进行的化学反应是放热反应。
如氢氧化亚铁的水溶液在空气中被氧化为氢氧化铁的反应是自发的,其△H (298K )==-444.3kJ ·mol—1(2)部分吸热反应也能自发进行。
如NH 4HCO 3(s)+CH 3COOH(aq)==CH 3COONH 4(aq)+CO 2(g)+H 2O(l),其△H (298K )== +37.30kJ ·mol —1。
(3)有一些吸热反应在常温下不能自发进行,在较高温度下则能自发进行。
如碳酸钙的分解。
因此,反应焓变不是决定反应能否自发进行的唯一依据。
2.反应熵变与反应方向(1)熵:描述大量粒子混乱度的物理量,符号为S ,单位J ·mol —1·K —1,熵值越大,体系的混乱度越大。
(2)化学反应的熵变..(△S ):反应产物的总熵与反应物总熵之差。
(3)反应熵变与反应方向的关系①多数熵增加的反应在常温常压下均可自发进行。
产生气体的反应、气体物质的量增加的反应,熵变都是正值,为熵增加反应。
②有些熵增加的反应在常温下不能自发进行,但在较高温度下则可自发进行。
如碳酸钙的分解。
③个别熵减少的反应,在一定条件下也可自发进行。
如铝热反应的△S== —133.8 J ·mol—1·K —1,在点燃的条件下即可自发进行。
4.焓变和熵变对反应方向的共同影响——“四象限法”判断化学反应的方向。
在二维平面内建立坐标系,第Ⅰ象限的符号为“+、+”,第Ⅱ象限的符号为“+、—”,第Ⅲ象限的符号为“—、—”,第Ⅳ象限的符号为“—、+”。
借肋于数学坐标系四个象限的符号,联系焓变与熵变对反应方向的共同影响,可以从热力学的角度快速判断化学反应的方向。
在温度、压强一定的条件下,化学反应的方向的判据为: △H —T △S <0 反应能自发进行 △H —T △S==0反应达到平衡状态 △H —T △S >0反应不能自发进行反应放热和熵增加都有利于反应自发进行。
第四节化学反应进行的方向练习题一、选择题1.下列事实不能用勒夏特列原理解释的是()A.在硫化氢水溶液中加入碱有利于S2-的生成B.加入催化剂有利于氨的氧化反应C.高压有利于合成氨反应D.500℃左右比室温更利于合成氨反应2.有一处于平衡状态的反应:X(s)+3Y(g)2Z(g),ΔH<0。
为了使平衡向生成Z 的方向移动,应选择的条件是①高温②低温③高压④低压⑤加正催化剂⑥分离出ZA.①③⑤B.②③⑤C.②③⑥D.②④⑥3.下列说法正确的是()A.其他条件不变,增大某一反应物浓度,反应物的转化率一定都增大B.对于有气体参加的反应,其他条件不变增大压强,体积缩小,体系中各气体的浓度一定增大C.对于有气体参加的反应,改变压强使平衡向右移动,生成的气体的浓度一定增大D.增大反应物的浓度,平衡向右移动,生成物的体积分数一定增大和I2蒸气各0.5摩,发生反应H2+I22HI,4.在一定温度下,在一个密闭容器中加入H达到平衡时,生成HI 0.8摩,若其它条件不变,开始充入的H2为2摩,则达到平衡时生成的HI可能是下列中的()A 1.1摩B 0.87摩C 0.8摩D 0.5摩5.下图是可逆反应A+2B 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断()A.正反应是放热反应B.若A、B是气体,则D是液体或固体C.逆反应是放热反应.D.A、B、C、D均为气体6.在体积相同的A和B两个带活塞的玻璃容器中,如分别注入1/4容积颜色相同的NO2和Br2(气),然后将活塞同时向外拉到1/2处(快速),过一会儿可以看到()A.A中颜色比B中浅B.A中颜色比B中深C.A、B中颜色深浅一样D.A、B中颜色都比开始时深7.密闭容器中的平衡体系H2+I2(g) 2HI(g)+Q,欲使HI浓度增大,可采取的措施是()A.缩小体积B.升温C.降温D.加催化剂8.在密闭容器中有可逆反应:n A(g) +m B(g) p C(g)+Q处于平衡状态(又知n+m>P,Q<0),则下列说法正确的是①升高温度时,[B]/[C]的比值减小②降温时体系内混合气体平均相对分子质量减小③加入B,A的转化率变大④加入催化剂,气体的总物质的量不变⑤充入C,则A、B的物质的量增大( )A.③④B.①②⑤C.②③⑤D.全部9.甲萘醌(维生素K)有止血作用,它可通过2—甲基萘的氧化而制得,反应中常用乙酸作催化剂,该反应放热,可表示为:催化剂氧化剂2-甲基萘甲萘醌在某次合成反应中,用1.4g的2—甲基萘,才制得0.17g甲萘醌,已知该次合成反应的速率是快的,试判断导致其产率低的原因是( )CA.使用了过量的氧化剂B.没有用乙酸,而是使用了其它催化剂C.把反应混合物加热D.所生成的甲萘醌是沉淀物10.一定条件反应N2+3H 22NH3达平衡,当单独改变下述条件后有关叙述错误()A.加催化剂,v(正)和v (逆)都发生变化,且变化的倍数相等B.加压, v (正)和v (逆)都增大,且v (正)增加倍数大于v (逆)增加倍数C.降温, v (正)和v (逆)都减少,且v (正)减少倍数大于v (逆)减少倍数D.增加N2的浓度, v (正)和v (逆)都增大,且v (正)增加倍数大于v (逆)增加倍数11.常温下的定容容器中,建立如下平衡:3NO2+H2O NO+2HNO3,在其他条件不变时,若往容器中通入少量的氧气后、原体系将会发生的变化是()A.平衡向正反应方向移动B.NO的物质的量可能不变C.NO的物质的量一定会减少D.NO2增加的物质的量是通入O2的物质的量的2倍12.在密团容器中充入1molCO和1molH2O(气),在一定条件下达到平衡时生成了2/3mol CO2(反应为CO+H2O(g) CO2+H2),当其他条件不变,充入的水蒸气改变为2mol时,平衡时生成CO2的物质的量可能是( )A.0.5mol B.0.95mol C.1mol D.2/3mol13.可逆反应m A(g)+n B(g) p C(g)+q D(g),在密闭容器中反应达到平衡,改变某一条件后,正反应速率增大,则下列说法正确的是()A.A的转化率增大B.平衡向逆向移动C.平衡没有移动D.上述三种情况都有可能14.由可逆反应测绘出图象如下图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是A.反应物中一定有气体B.生成物中一定有气体C.正反应一定是放热反应D.正反应一定是吸热反应15.在地壳内,深度每增加1km ,压强大约增加25250~30300kPa ,在这样的压强下,对固体物质的平衡会发生较大的影响。
第二单元化学反应的方向和限度第一课时化学反应的方向1.下列反应一定能自发进行的是()A.放热反应B.熵增加的反应C.熵增加的吸热反应D.熵增加的放热反应2.有关化学反应的说法,正确的是()A.自发反应都是放热反应B.自发反应都是熵增大的反应C.自发反应一定能实现D.非自发反应在一定条件下也能实现3.实验证明,多数能自发进行的反应都是放热反应。
对此说法的理解的叙述中,正确的是()A.所有的放热反应都是自发进行的B.所有的自发反应都是放热的C.焓变是影响反应是否具有自发性的一种重要因素D.焓变是决定反应是否具有自发性的判据4.下列说法中正确的是()A.某反应低温条件下能自发进行,那么高温条件下也一定能自发进行B.某反应高温条件下不能自发进行,那么低温条件下也不能自发进行C.反应方向是由焓变和熵变共同决定的,与反应温度无关D.温度有可能对反应的方向起决定性的作用5.25 ℃时,KNO3在水中的饱和溶液物质的量浓度是6 mol·L-1,若将1 mol固体KNO3置于1 L水中,则KNO3变成盐溶液过程的ΔH-TΔS的取值为() A.小于0 B.等于0C.大于0 D.不能确定6.已知2CO(g)===2C(s)+O2(g)的ΔH为正值,ΔS为负值。
设ΔH和ΔS都不随温度而变,以下是对该反应的自发性的判断,其中正确的是()A.低温下是自发反应B.高温下是自发反应C.低温下是自发反应,高温下是非自发反应D .任何温度下都是非自发反应7.石墨、金刚石燃烧的热化学方程式分别为C(石墨)+O 2(g)===CO 2(g) ΔH =-393.51 kJ·mol -1C(金刚石)+O 2(g)===CO 2(g) ΔH =-395.41 kJ·mol -1关于金刚石和石墨的相互转化,下列说法正确的是( )A .石墨转化成金刚石是自发进行的过程B .金刚石转化成石墨是自发进行的过程C .金刚石比石墨更稳定D .金刚石比石墨能量低8.下列说法中正确的是( )A .能自发进行的反应一定能迅速发生反应B .非自发进行的反应一定不可能发生反应C .能自发进行的反应实际可能没有发生反应D .常温下,2H 2O=====通电2H 2↑+O 2↑,即常温下水的分解反应是自发反应9.汽车尾气(含烃类、CO 、NO 与SO 2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO 与CO 反应生成可参与大气生态循环的无毒气体,其反应原理是:2NO(g)+2CO(g)===N 2(g)+2CO 2(g),在298 K 、100 kPa 下ΔH =-113 kJ·mol -1,ΔS =-145 J·mol -1·K -1。
课时作业(八)
(30分钟 50分)
一、选择题(本题包括6小题,每小题5分,共30分)
1.(常州高二检测)关于反应3O2(g)====2O3(g) ΔH>0,下列说法正确的是( )
A.反应前后,熵不变
B.反应前后,分子总数不变
C.反应前后,生成物总能量与反应物总能量不变
D.反应前后,氧元素化合价不变
2.(双选)(潍坊高二检测)已知石墨、金刚石燃烧的热化学方程式分别为
C(石墨、s)+O2(g)====CO2(g)
ΔH1=-393.5 kJ·mol-1 ①
C(金刚石、s)+ O2(g)====CO2(g)
ΔH2=-395.4 kJ·mol-1 ②
关于石墨和金刚石的相互转化,下列说法正确的是 ( )
A.石墨转化成金刚石是自发进行的过程
B.金刚石转化成石墨是自发进行的过程
C.相同质量时,石墨比金刚石能量低
D.相同质量时,金刚石比石墨能量低
3.(济南高二检测)已知在等温等压条件下,化学反应方向的判据为ΔH-TΔS<0反应能正向自发进行;ΔH-TΔS=0反应达到平衡;ΔH-TΔS>0反应能逆向自发进行(其中ΔH为焓变,ΔS为熵变,T为热力学温标,单位为K)设反应A(s)====D(g)+E(g)(ΔH-TΔS) = (-4 500+11T) J·mol-1,要保证反应发生,温度必须( )
A.高于409 K
B.低于136 K
C.高于136 K而低于409 K
D.低于409 K
4.灰锡结构松散,不能用于制造器皿,而白锡结构坚固,可以制造器皿。
现把白锡制成的器皿放在0 ℃、100 kPa 的室内存放,它会不会变成灰锡而不能再继续使用(已知在0 ℃、100 kPa条件下白锡转化为灰锡反应的焓变和熵变分别为ΔH=-2.180 9 kJ·mol-1,ΔS=-6.6 J·mol-1·K-1,当ΔH-TΔS<0时能自发反应)( )
A.会变
B.不会变
C.不能确定
D.升高温度才会变
5.下列反应常温时能自发进行,既能用焓判据又能用熵判据解释的是( )
A.HCl+NH3====NH4Cl
B.2KClO3====2KCl+3O2↑
C.2Na2O2+2H2O====4NaOH+O2↑
D.Ba(OH)2·8H2O+2NH4Cl====BaCl2+2NH3↑+10H2O
6.对于化学反应能否自发进行,下列说法中错误的是( )
A.若ΔH<0,ΔS>0,任何温度下都能自发进行
B.若ΔH>0,ΔS<0,任何温度下都不能自发进行
C.若ΔH>0,ΔS>0,任何温度下都可自发进行
D.若ΔH<0,ΔS<0,低温时可自发进行
二、非选择题(本题包括2小题,共20分)
7. (8分)节能减排是指节约物质资源和能量资源,减少废弃物和环境有害物(包括三废和噪声等)排放。
(1)实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。
目前工业上有一种方法是用CO2来生产燃料甲醇。
一定条件下发生反应: CO2(g)+3H2(g)CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化:
关于该反应的下列说法中,正确的是_______(填字母)。
A.ΔH>0,ΔS>0
B.ΔH>0,ΔS<0
C.ΔH<0,ΔS<0
D.ΔH<0,ΔS>0
(2)将煤加工成水煤气可降低污染并能提高燃料的利用率。
将水蒸气通过红热的炭即产生水煤气,化学方程式为C(g)+H2O(g)====H2(g)+CO(g) ΔH=
+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1。
该反应在常温下能否自发进行?_______(填“能”或“不能”)。
8.(12分)在化学反应A(g)+B(g)2C(g)+D(g) ΔH=Q kJ·mol-1过程中的能量变化如图所示,回答下列问题。
(1)Q_____0(填“>”“<”或“=”)。
(2)熵变ΔS_____0(填“>”“<”或“=”)。
(3)该反应______自发进行(填“能”或“不能”)。
答案解析
1.【解析】选D。
该反应是气体物质的量减小的吸热反应,故A、B、C项不正确;O2和O3均为单质,反应中化合价不变,D项正确。
2.【思路点拨】解答本题时要注意以下两点:
(1)运用盖斯定律写出金刚石和石墨转化的热化学方程式。
(2)根据焓变与熵变进行判断反应的自发性。
【解析】选B、C。
由②-①可得:C(金刚石,s)====C(石墨,s) ΔH3=-1.9 kJ·mol-1,由此热化学方程式可看出,金刚石变成石墨要放出能量,符合焓判据,存在反应自发进行的可能性。
故答案选B、C。
3.【解析】选D 。
反应发生必须满足ΔH-TΔS<0,所以(-4 500+11T) J·mol-1<0,即得T<409 K。
4.【解析】选A。
在等温、等压条件下,自发反应总是向着ΔH-TΔS<0的方向进行,直至达到平衡状态。
因此,在0 ℃、100 kPa条件下,白锡会不会变为灰锡的问题就转化为求算反应:白锡转化为灰锡的ΔH-TΔS值的问题。
ΔH-
TΔS=-2 180.9 J·mol-1-273 K×(-6.6 J·mol-1·K-1)=-379.1 J·mol-1<0,因此在该条件下白锡会变为灰锡。
【误区警示】在计算时,若不注意焓变和熵变二者单位的统一,就容易出错。
5.【解析】选C。
A项,不能从熵判据上进行解释;B、D项,因它们都是吸热反应,都不能从能量判据上进行解释;C项符合。
6.【思路点拨】解答本题的依据是:
【解析】选C。
根据ΔH-TΔS<0时,反应正向自发进行,可知:若ΔH<0,
ΔS>0时,ΔH-TΔS恒小于0,所以“任何温度下都能自发进行”正确;若
ΔH>0,ΔS<0时,由于ΔS<0,使得-TΔS成为正值,使ΔH-TΔS恒大于0,故“任何温度下都不能自发进行”正确;若ΔH>0,ΔS>0时,只有 |TΔS︱>ΔH时,ΔH-TΔS<0,即T为高温时即可,C错误;若ΔH<0,ΔS <0时,由ΔS<0而使-TΔS成为正值,所以只有在低温时,|TΔS|<|ΔH|,使得
ΔH-TΔS<0,故“低温时可自发进行”正确。
7.【解析】(1)根据反应过程中能量变化的情况可知反应物的总能量高于生成物的总能量,反应放热,ΔH<0;该反应发生后气体的物质的量减小,ΔS<0。
(2)根据ΔH-TΔS=+131.3 kJ·mol-1-298 K×0.133 7 kJ·mol-1·K-1≈
91.46 kJ·mol-1>0,所以反应在常温下不能自发进行。
答案:(1)C (2)不能
8.【解析】据图像可知,该反应是放热反应,故Q<0。
据反应特点可知,该反应是熵增大的反应;据此可知该反应能自发进行。
答案:(1)< (2)> (3)能。