小鼠胚胎干细胞培养实验具体步骤及方法
- 格式:docx
- 大小:18.27 KB
- 文档页数:7

iPS细胞制备技术随着对iPS细胞重编程机制研究的不断深入,iPS细胞的制备体系不断完善,目前iPS细胞的制备方法多种多样,但以Yamanaka的“四因子”诱导体系较为经典,本书在此简要阐述此制备方法。
一、小鼠iPS细胞制备【实验步骤】1.建立小鼠胎儿成纤维细胞系(1)脱颈处死13.5天孕鼠,分离出子宫并用PBS浸洗。
(2)用手术镊将胚胎从胎盘和周围膜系组织分离开,去除头、性腺和内脏组织。
(3)将胚胎转移至一个新100mm皿进行PBS清洗,剪刀剪碎组织,放于含有0.1%胰酶/0.1mmol/L EDTA溶液的50ml离心管,于37℃消化20分钟,重新加酶,再次消化。
(4)加入等体积FP溶液(含10%FBS,50U&50mg/ml青霉素和链霉素的DMEM)中止消化,吹打数次以帮助组织破碎。
(5)室温(20~25℃)放置5分钟以沉降大块组织,取上悬液体于离心管进行离心,1200r/min×5min,弃上悬液并用新鲜液体重悬。
(6)计数细胞,并调节细胞浓度至1×106/ml。
一般约1×107细胞/胚胎,1×107细胞/100mm皿于37℃,5%CO2培养24小时。
(7)次日,PBS清洗去除未贴壁细胞,待细胞铺满皿底,换掉FP液,用PBS清洗一次,1ml 0.05%胰酶/0.53mmol/L EDTA消化5分钟,加入9ml FP液并吹打成细胞悬液,传代按1∶4进行(用于iPS 诱导的MEFs代次最好选用3代以内)。
2.饲养层细胞准备(1)复苏 SNL 细胞1)由液氮罐中取出SNL冻存管,迅速放入37℃水浴锅中,并晃动冻存管直到融化。
2)乙醇擦拭冻存管盖及冻存管壁,将管内冻存悬液转移入预先准备的SNL液体中,800r/min×5min,弃去上液。
3)重新加入10ml SNL液体重悬细胞,转入明胶铺被的100mm皿中,于37℃,5%CO2培养至细胞80%~90%汇合。

实验一小鼠骨髓间充质干细胞的分离培养一、目的要求1.掌握小鼠骨髓间充质干细胞的分离培养方法。
2.了解小鼠骨髓间充质干细胞的鉴定方法。
3.了解小鼠骨髓间充质干细胞定向分化和鉴定方法。
二、材料与设备1.动物:SD大鼠。
2.主要试剂:胎牛血清(FBS),DMEM--LG培养基,PBS,抗体(NSE和GFAP)。
3.主要器材与仪器:手术剪,手术镊,眼科剪,眼科镊,培养瓶,培养皿,称量瓶,刻度离心管,吹打管,注射器,倒置相差显微镜,CO2培养箱三、实验步骤1.小鼠骨髓间充质干细胞(bone marrow stromal stem cells,BMSC)的分离培养:⑴小鼠BMSC的分离和原代培养:①以颈髓离断法处死小鼠。
在无菌条件下取出小鼠股骨,除去骨表面附着的组织,用PBS 清洗干净。
②用剪刀去除股骨两端,暴露骨髓腔。
无菌条件下用5ml注射器抽取PBS约3-4ml将小鼠股骨内的骨髓冲出,收集骨髓冲洗液,将收获的全部骨髓用注射器反复抽吸,以打散组织成为细胞悬液。
③收集细胞悬液约7ml并将其转入15毫升离心管中,1500r/min离心5min,弃上清液及脂肪层。
④在细胞沉淀中加入5-6ml含10%胎牛血清的DMEM一LG培养基,倒置显微镜下观察,37℃、5%CO2 培养箱中培养。
2. 带学生在电脑上观看以往的小鼠间充质干细胞免疫荧光图片。
实验二大鼠神经干细胞的分离培养一、目的要求1.掌握大鼠胚胎神经干细胞的分离培养方法。
2.了解大鼠胚胎神经干细胞的鉴定方法。
3.了解大鼠胚胎神经干细胞定向分化和鉴定方法。
二、材料与设备1.动物:孕龄约15天的Wistar或SD孕鼠2.试剂:条件培养基(DMEM/F12+20ng/mlbFGF+20ng/mlEGF+20μl/mlB27),D-Hank’s液(NaCl 8g, KCL0.4g,Na2HPO4.12H2O 0.1g, KH2PO4 0.06g, NaHCO3 0.35g, 加水1000ml溶解,调PH 值为7.2-7.4,高压灭菌后,4℃储存备用),0.25%胰蛋白酶(D-Hank’s液配制,过滤灭菌,-20℃储存),抗体(巢蛋白、NSE、GFAP)。

转基因小鼠制备实验方法1.计划设计:首先确定研究目的和研究对象基因的功能。
根据目的,选择适合的转基因策略。
2.构建转基因载体:根据研究对象基因的序列,设计合成含目标基因的转基因载体。
一般可选择质粒、病毒载体或者合成RNA/DNA方式构建转基因载体。
3.构建胚胎干细胞(ES)或受精卵DNA库:通过开展反转录聚合酶链反应(RT-PCR)方式,从小鼠胚胎组织中制备出RNA,然后利用逆转录酶将RNA转化成cDNA;之后,利用特定引物扩增目标基因的cDNA片段,将其克隆到适当的表达载体中,最终构建ES细胞库或者受精卵DNA库。
4.转染、筛选和克隆:将所构建的转基因载体导入到ES细胞或者受精卵中,使其整合到其基因组中。
然后,采用药物筛选、DNA分子标记、PCR和Southern blot等方法对转染后的细胞进行筛选和鉴定,获得含有目标基因的ES细胞克隆或者转基因小鼠胚胎。
5.基因敲除或添加:6.培养和培育:将获得的转基因ES细胞或者受精卵注入到养殖母鼠子宫中进行妊娠,然后等待幼鼠出生。
根据需要,可将转基因小鼠进行进一步培养、繁殖和鉴定。
为了进行转基因小鼠的后代繁殖,需要对转基因小鼠进行基因型鉴定和表型分析。
7.基因鉴定和表型分析:通过PCR、Southern blot、Western blot、RT-PCR或者其他的基因鉴定技术,对转基因小鼠的基因型进行鉴定。
同时,可以通过行为学、生理学和病理学等方法对转基因小鼠进行表型分析。
8.数据分析与结果解读:对表型数据进行统计分析,绘制图表或者进行统计学分析。
根据实验设计和方法,对实验结果进行解读,并得出相关结论。
总结起来,转基因小鼠制备是一个复杂而严谨的实验过程。
通过设计转基因载体、构建DNA库、转染和克隆、培养和培育小鼠以及基因鉴定和表型分析,可以成功制备目标基因转基因小鼠,并用于研究其功能、调控机制以及在疾病中的作用。

第1篇一、实验背景随着生物技术的飞速发展,转基因技术在医学、农业等领域发挥着越来越重要的作用。
小鼠作为生物医学研究中常用的实验动物,其基因编辑技术的应用为疾病模型构建、药物筛选和基因功能研究提供了有力工具。
本实验旨在通过基因编辑技术构建转基因小鼠模型,研究特定基因在小鼠体内的表达和功能。
二、实验材料1. 实验动物:C57BL/6小鼠,雄性,8周龄。
2. 基因构建材料:目的基因(GFP基因)、启动子(CMV启动子)、荧光素酶报告基因(Luc基因)、pEGFP-C1质粒载体、pGL3-Basic质粒载体。
3. 实验试剂:限制性内切酶、DNA连接酶、T4 DNA连接酶、DNA聚合酶、PCR引物、Trizol试剂、RNA提取试剂盒、反转录试剂盒、荧光定量PCR试剂盒、细胞培养试剂等。
4. 仪器设备:PCR仪、凝胶成像系统、实时荧光定量PCR仪、细胞培养箱、显微镜等。
三、实验方法1. 目的基因构建:将GFP基因和Luc基因分别插入到pEGFP-C1和pGL3-Basic质粒载体中,构建重组质粒。
2. 重组质粒转染:将构建好的重组质粒通过脂质体转染法转染C57BL/6小鼠胚胎干细胞(ES细胞)。
3. 转基因小鼠胚胎细胞筛选:通过GFP荧光筛选,得到阳性细胞克隆。
4. 胚胎细胞传代培养:将阳性细胞克隆进行传代培养,筛选出稳定表达的细胞系。
5. 胚胎细胞冻存:将稳定表达的细胞系进行冻存,以备后续实验使用。
6. 胚胎移植:将冻存后的胚胎细胞进行移植,获得转基因小鼠。
7. 转基因小鼠表型鉴定:通过GFP荧光显微镜观察转基因小鼠体内GFP表达情况,并通过实时荧光定量PCR检测GFP基因在转基因小鼠体内的表达水平。
四、实验结果1. 重组质粒构建:成功构建了含有GFP基因和Luc基因的重组质粒。
2. 转基因小鼠胚胎细胞筛选:通过GFP荧光筛选,得到阳性细胞克隆。
3. 胚胎细胞传代培养:成功传代培养出稳定表达的细胞系。
4. 胚胎移植:成功获得转基因小鼠。

实验名称:基因检测小鼠模型建立及功能研究实验目的:1. 建立基因敲除小鼠模型,验证目标基因的功能;2. 探究目标基因在特定生理或病理过程中的作用;3. 为后续相关疾病的研究和治疗提供实验动物模型。
实验时间:2023年3月1日-2023年6月30日实验地点:XX大学动物实验中心实验材料:1. 实验小鼠:C57BL/6小鼠;2. 基因敲除质粒:含有目标基因的敲除质粒;3. 酶切试剂:DNA酶、T4连接酶等;4. 载体细胞:小鼠胚胎干细胞;5. 细胞培养试剂:DMEM培养基、胎牛血清等;6. 实验仪器:PCR仪、凝胶成像系统、显微镜等。
实验方法:1. 基因敲除质粒构建(1)根据目标基因序列设计特异性引物,进行PCR扩增;(2)将扩增得到的DNA片段与载体连接,构建基因敲除质粒;(3)将构建好的质粒进行测序,确保序列正确。
2. 基因敲除小鼠模型建立(1)将基因敲除质粒转染小鼠胚胎干细胞;(2)将转染成功的细胞进行分裂培养,筛选出基因敲除细胞;(3)将基因敲除细胞进行核移植,获得基因敲除小鼠。
3. 功能验证(1)对基因敲除小鼠进行表型分析,观察其生长发育、生理功能等;(2)对基因敲除小鼠进行病理模型建立,观察其病理特征;(3)对基因敲除小鼠进行分子生物学检测,分析目标基因表达水平及蛋白功能。
实验结果:1. 基因敲除质粒构建成功,测序结果显示序列正确。
2. 基因敲除小鼠模型建立成功,经过表型分析,基因敲除小鼠在生长发育、生理功能等方面与野生型小鼠无显著差异。
3. 在病理模型建立过程中,基因敲除小鼠表现出与野生型小鼠相似的病理特征。
4. 分子生物学检测结果显示,基因敲除小鼠目标基因表达水平降低,蛋白功能受到影响。
实验结论:1. 成功构建了基因敲除小鼠模型,为后续相关疾病的研究和治疗提供了实验动物模型;2. 验证了目标基因在特定生理或病理过程中的作用,为进一步研究该基因的功能奠定了基础;3. 本实验结果为相关疾病的发病机制研究提供了参考,有助于寻找新的治疗靶点。

基因敲除小鼠研究方案基因敲除小鼠研究方案一、研究目标:通过基因敲除小鼠研究,探究目标基因在小鼠发育、生长、免疫系统等方面的功能和调控机制。
二、实验设计:1. 基因敲除小鼠模型的构建:选择合适的基因敲除技术,如CRISPR/Cas9系统,通过设计合适的sgRNA(single guide RNA)序列,引导Cas9核酸酶定点切割目标基因的DNA序列。
进而引发DNA修复机制,导致目标基因的插入、缺失或突变。
将CRISPR/Cas9系统构建为可表达载体,转染入小鼠胚胎干细胞中,克隆筛选敲除成功的细胞系。
2. 小鼠胚胎干细胞培养及注射:将敲除成功的小鼠胚胎干细胞注射到早期胚胎中,制备敲除小鼠模型。
养育敲除成功的小鼠。
3. 小鼠品系和样本采集:选择合适的小鼠品系,如C57BL/6小鼠品系。
在小鼠发育、生长、免疫等关键时期,如出生后不同天数、特定时间点等,采集合适的器官或细胞样本。
4. 小鼠表型分析:对敲除小鼠与野生型小鼠进行比较,通过外观、体重、行为、生理指标等方面的观察和实验测定,分析目标基因在小鼠生长发育等方面的影响。
5. 组织学和免疫组化分析:采集目标器官样本,进行组织学和免疫组化实验。
通过病理学检测、免疫组织化学染色等方法,观察目标基因在组织结构和免疫功能调控方面的作用机制。
6. 分子生物学实验分析:采集样本进行基因表达、蛋白质表达水平和分子机制等方面的实验分析,如实时定量PCR、Western blot等方法,研究目标基因对其他基因和信号通路的影响。
7. 数据分析:对实验获得的生物学数据进行统计学和生物信息学分析,建立基因敲除小鼠模型的相关数据库,以及通过差异分析、基因功能注释等方法,进一步探究目标基因的功能和相关调控网络。
三、预期结果:通过上述研究方案,可以获得目标基因敲除小鼠模型,并通过多个方面的分析来研究该基因对小鼠生长发育、组织结构、免疫系统等方面的功能和调控机制。
预期结果包括但不限于:敲除小鼠的表型差异和诱导的特异性疾病模型;目标基因调控的重要信号通路;基因与其他相关基因间的调控网络等。

小鼠胚胎神经干细胞的分离及贴壁培养方法杨骐昌;宋晓峰;韩平【摘要】Objective To develop a modified method of adherent culturing NSCs to replace the traditional suspension culturing method.Methods Neural stem cells(NSCs)were isolated from brain of fetal mouse at 15.5-day fetal age.In culture bottle which had been pre-coated with poly-L-ornithine hydrochloride/fibronectin(PO/FN),the cells were adherently cultured and passaged.The cell morphology was observed under inverted microscope.NSCs and their differentiated cells were identified by immunofluorescence.Results NSCs obtained in this study were successfully adherently cultured and expressed specific markers.Conclusion NSCs are successfully adherently cultured in this study.As compared with the traditional suspension culturing method,adherent culturing is simpler and has lower wastage of passage.It is easy to observe cell morphology and differentiation by this method.It is also helpful to culturing and storage of NSCs.%目的探索一种改进的贴壁培养神经干细胞的方法.方法从胚胎期为15.5d 的胎鼠大脑皮层中提取神经干细胞,在PO/FN(Poly-L-ornithine hydrochloride/Fibronectin)包被处理后的培养瓶中进行贴壁培养并传代,在倒置显微镜下观察神经干细胞的细胞形态,并通过免疫荧光法鉴定神经干细胞及其子代细胞进行分化操作之后的情况.结果原代神经干细胞细胞形态清晰,免疫荧光标记物明显.结论相对于传统神经球悬浮培养法该法处理简便,传代损耗低,容易观察到细胞形态和分化阶段,更有助于神经干细胞的培养和存储.【期刊名称】《华中科技大学学报(医学版)》【年(卷),期】2017(046)003【总页数】6页(P312-316,340)【关键词】神经干细胞;贴壁培养;包被处理;免疫荧光;悬浮培养【作者】杨骐昌;宋晓峰;韩平【作者单位】南京航空航天大学生物医学工程系,南京211100;南京航空航天大学生物医学工程系,南京211100;南京医科大学第一附属医院产科,南京210005【正文语种】中文【中图分类】R329神经系统是人体内起主导作用的功能调节系统,在神经系统的发育期间,神经干细胞(neural stem cells,NSCs)会向其他脑部区域迁移,并分化为特异性细胞[1],提供了大量脑组织所需的细胞,其增殖与分化对神经发育起到至关重要的作用[2]。

小鼠造血干细胞制备引言:造血干细胞是一类具有自我更新能力和分化潜能的细胞,可以不断产生各种血液细胞,包括红细胞、白细胞和血小板。
研究小鼠造血干细胞制备的方法对于深入了解造血过程、治疗血液系统疾病以及开发新型治疗方法具有重要意义。
一、小鼠造血干细胞的来源小鼠造血干细胞可以从多个来源获得,包括骨髓、外周血和胚胎等。
其中,骨髓是最常用的来源之一,因为在骨髓中富含大量造血干细胞。
此外,小鼠外周血中也存在一定数量的造血干细胞,可以通过采集外周血得到。
另外,小鼠胚胎的早期阶段也含有造血干细胞,可以通过体外培养的方法获得。
二、小鼠造血干细胞的分离与富集为了获得高纯度的小鼠造血干细胞,需要对细胞进行分离和富集。
常用的方法包括密度梯度离心、免疫磁珠分离和流式细胞术等。
密度梯度离心是一种通过调整细胞悬液的密度差异来分离细胞的方法,可以根据细胞的大小和密度将造血干细胞与其他细胞分离开来。
免疫磁珠分离是利用特定抗体与细胞表面标记物的结合来选择性富集造血干细胞的方法,可以通过磁珠的吸附和洗脱实现对目标细胞的富集。
流式细胞术结合特定抗体和荧光染料的使用,可以通过单个细胞的流动和荧光信号来鉴定和富集造血干细胞。
三、小鼠造血干细胞的培养和扩增获得小鼠造血干细胞后,需要进行培养和扩增,以满足后续实验的需要。
常用的培养基包括DMEM/F12、RPMI 1640和Iscove's Modified Dulbecco's Medium等,其中添加适量的生长因子和细胞因子可以促进造血干细胞的增殖和分化。
在培养过程中,需要注意细胞的密度和培养时间,避免细胞过度分化或过度增殖。
四、小鼠造血干细胞的分化和功能研究小鼠造血干细胞可以通过不同的诱导因子和培养条件进行定向分化,得到不同类型的血液细胞。
例如,添加EPO和SCF等因子可以促进红细胞的分化,添加GM-CSF和G-CSF等因子可以促进粒细胞的分化。
通过研究小鼠造血干细胞的分化和功能,可以深入了解造血过程的调控机制以及与血液系统疾病的关联。

转基因小鼠制备实验方法1、选取7~8周龄雌性小鼠,阴道口封闭,作为供体,下午3:00左右,每只小鼠腹腔注射PMSG(10 IU)。
2、 47~48小时后,每只小鼠腹腔注射HCG(0.8 IU),并与正常公鼠合笼;另取数只适龄母鼠(2月龄以上)作为受体,阴道口潮红,与结扎公鼠合笼。
3、第二天上午9:00前观察供体、受体,有精栓者拿出备用。
受体笼拿出作好隔离措施。
4、10:30左右,断颈处死供体,手术取出整个输卵管,放入透明质酸酶~0.3mg/M2液中。
显微镜下,用镊子撕开输卵管壶腹部,受精卵随同颗粒细胞即一同流出。
5、仔细观察放在透明质酸酶M2液中的受精卵,当受精卵周围的颗粒细胞脱离时,将受精卵吸出,放入M2液中洗涤,最后放在M16液中放入5% CO2,37C0培养箱培养。
6、在显微镜下观察,挑选细胞饱满,透明带清晰,雄原核清晰可见的受精卵待用。
7、安装持卵针和注射针,使其末端平行于载物台,在凹玻片的中央滴入一滴M2液,覆盖石蜡油,移入待注射的受精卵。
DNA在注射针中的气泡应在先前全部弹走。
8、在高倍镜下,将注射针轻触持卵管,使DNA缓慢流出并控制其流量;反复吹吸受精卵,使其处于最佳位置,将注射针刺入受精卵的雄原核,直至看到原核膨大即退出。
将注射过的和未注射过的受精卵上下分开放置,不致于混搅,注射完毕后,放入5% CO2,37C0培养箱培养。
9、将受体麻醉,注射计量为1%戊巴比妥钠0.01ml/g,腹腔注射。
手术取出卵巢连接输卵管,用脂肪镊固定,在显微镜下找到输卵管开口。
吸取注射后经培养成活的受精卵,吸取方法是先吸一段较长的M2,吸一个气泡,然后吸取受精卵,尽量紧密排列,再吸一段液体,吸一个气泡,再吸一段液体,共四段液体三个气泡。
除较长的那段液体,其余的液体大致1cm 左右,气泡0.2cm左右。
将移植管口插入输卵管口,轻轻将移植管内的液体吹入,看到输卵管壶腹部膨大并清晰地看到三个气泡,即移植成功。

基因编辑小鼠模型构建方法基因编辑小鼠模型是一种通过基因编辑技术改变小鼠基因组的方法,以研究基因在生物体发育、生理和疾病过程中的功能和机制。
下面是关于基因编辑小鼠模型构建方法的十条详细描述:1. 胚胎干细胞(ES细胞)导入方法:将经过基因编辑的ES细胞注射到小鼠早期胚胎中,使其发育成含有编辑基因的小鼠体。
2. 胚胎干细胞(ES细胞)体外培养方法:将小鼠胚胎中的干细胞分离出来,进行基因编辑后体外培养并转移到小鼠胚胎中,培育出基因编辑小鼠。
3. 基因敲除方法:使用CRISPR/Cas9等基因编辑工具,设计合适的寡核苷酸序列并导入小鼠胚胎,通过切割和删除目标基因,实现基因敲除。
4. 基因突变方法:通过CRISPR/Cas9等基因编辑工具,直接在小鼠基因中引入点突变或插入突变,使其产生突变株。
5. 转基因方法:将外源基因导入小鼠胚胎细胞,并使其嵌入细胞基因组,从而使小鼠表达外源基因。
6. 基因表达调控方法:通过CRISPR/Cas9等基因编辑工具,设计合适的寡核苷酸序列并导入小鼠胚胎细胞,以实现对基因的过表达或下调。
7. 基因标记方法:使用CRISPR/Cas9等基因编辑工具,在小鼠基因中插入标记基因,如荧光蛋白,以便对基因表达进行可视化和追踪。
8. 基因互补方法:通过CRISPR/Cas9等基因编辑工具,将外源基因导入小鼠胚胎细胞,使其与已有基因相互补充或修复,从而恢复基因功能。
9. 基因组工程方法:通过CRISPR/Cas9等基因编辑工具,在小鼠基因组中引入大片段DNA,如全基因组范围的基因敲除、替换或插入。
10. 利用转基因碰撞方法:将两个具有特定基因敲除或表达的小鼠品系交配,使它们的后代同时具有两个基因的敲除或表达,从而模拟一种基因缺失或改变的状态。
这些方法都是对基因编辑小鼠模型构建过程中常用的技术手段,能够有效地改变小鼠基因组,从而研究基因功能和机制。
但是在实际应用过程中需要注意合理选择方法,并根据具体的研究目的进行优化和改进。
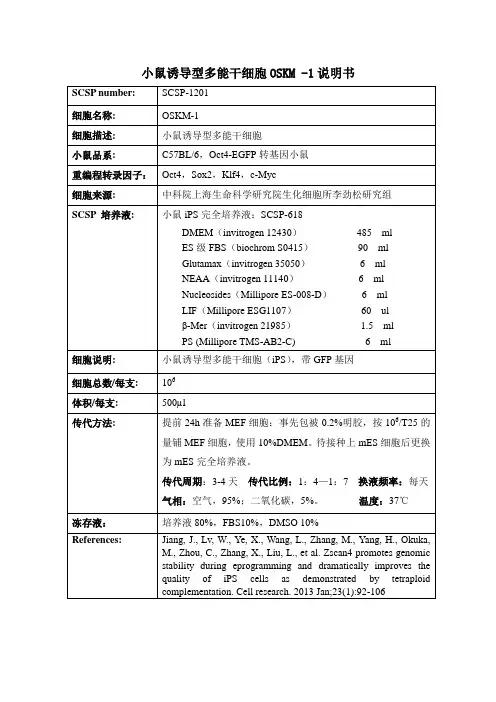
小鼠诱导型多能干细胞OSKM -1说明书SCSP number: SCSP-1201细胞名称: OSKM-1细胞描述: 小鼠诱导型多能干细胞小鼠品系: C57BL/6,Oct4-EGFP转基因小鼠重编程转录因子:Oct4,Sox2,Klf4,c-Myc细胞来源: 中科院上海生命科学研究院生化细胞所李劲松研究组SCSP 培养液: 小鼠iPS完全培养液:SCSP-618DMEM(invitrogen 12430)485 mlES级FBS(biochrom S0415)90 mlGlutamax(invitrogen 35050) 6 mlNEAA(invitrogen 11140) 6 mlNucleosides(Millipore ES-008-D) 6 mlLIF(Millipore ESG1107)60 ulβ-Mer(invitrogen 21985) 1.5 mlPS (Millipore TMS-AB2-C) 6 ml细胞说明: 小鼠诱导型多能干细胞(iPS),带GFP基因细胞总数/每支: 106体积/每支: 500µl传代方法:提前24h准备MEF细胞:事先包被0.2%明胶,按106/T25的量铺MEF细胞,使用10%DMEM。
待接种上mES细胞后更换为mES完全培养液。
传代周期:3-4天传代比例:1:4—1:7 换液频率:每天气相:空气,95%;二氧化碳,5%。
温度:37℃冻存液:培养液80%,FBS10%,DMSO 10%References: Jiang, J., Lv, W., Ye, X., Wang, L., Zhang, M., Yang, H., Okuka, M., Zhou, C., Zhang, X., Liu, L., et al. Zscan4 promotes genomicstability during eprogramming and dramatically improves thequality of iPS cells as demonstrated by tetraploidcomplementation. Cell research. 2013 Jan;23(1):92-106。
小鼠基因敲除的基本步骤小鼠基因敲除听起来可能有点复杂,但别担心,我来给你简单明了地讲讲这个过程,顺便还想聊聊小鼠这个家伙的可爱之处。
首先,咱们得知道,基因敲除就是把某个特定基因给“关掉”,这样就能研究这个基因对小鼠的影响,简而言之,就是给科学家们提供了一扇观察基因如何工作的窗子。
1. 准备工作1.1 选择目标基因在一切开始之前,科学家得先决定要敲除哪个基因。
这个就像选口味一样,你可以选择巧克力、香草,还是草莓?每个基因都有自己的“性格”,而你要的就是找到那个特别的、让你心动的。
为了决定哪个基因最重要,科学家们通常会做一些文献调研,看看过去的研究成果,找出哪些基因和疾病、行为等方面有关系。
1.2 制备小鼠胚胎干细胞一旦选定了目标基因,接下来就要制备小鼠胚胎干细胞。
这些细胞就像是小鼠未来的“小宇宙”,能够发展成任何细胞。
科学家们会取小鼠的胚胎,经过一系列的处理,把这些细胞培养出来。
想象一下,就像是种花一样,浇水、施肥,让它们茁壮成长。
不过,咱们这次不是为了观赏,而是为了科学实验!2. 基因编辑2.1 设计靶向载体这一步就有点像是制作一张地图,科学家要设计一个靶向载体,把这个载体引导到目标基因的位置。
这个载体就像是一个快递包裹,里面装着“关掉”目标基因的指令。
科学家们利用一些分子生物学的技术,把这个载体制作好,准备在小鼠胚胎干细胞里实施“任务”。
2.2 转染小鼠胚胎干细胞有了载体,接下来就是把它送进小鼠的胚胎干细胞里。
这一步可得小心翼翼,像是把珍贵的陶瓷小心翼翼地放进柜子里。
科学家们会用一些化学试剂,或者电穿孔的方法,把载体导入细胞内。
这时,载体就会开始和目标基因“打招呼”,并实施敲除的计划。
3. 产生转基因小鼠3.1 筛选成功的细胞完成转染后,科学家需要筛选出那些成功“敲掉”基因的细胞。
这个过程有点像考试,只有通过了才能进入下一轮。
科学家会用一些特定的标记物来检测这些细胞,看看有没有成功的小伙伴。
如果找到了,哇,那可是大大的喜讯!3.2 复制小鼠最后一步是把这些成功的细胞注入到小鼠胚胎里,然后再将这些胚胎植入到代孕母鼠的体内。
基因敲除小鼠的实验流程
基因敲除是一种常用的功能基因研究方法,通过使特定基因失去功能,从而研究该基因在生物体发育、生理功能、疾病机理等方面的作用。
在此,我将详细介绍基因敲除小鼠的实验流程。
1.设计敲除基因的策略:
2.构建敲除载体:
根据设计好的敲除策略,研究者需要构建敲除载体。
敲除载体一般包
括两个主要部分:敲除目标基因的DNA序列和荧光蛋白报告基因的DNA序列。
为了实现高效的基因敲除,敲除目标基因的DNA序列应当与目标细胞
染色体上的同源序列高度相似。
荧光蛋白报告基因的DNA序列可以用来监
测基因敲除的效果。
研究者可以使用聚合酶链式反应(PCR)等技术来合成
敲除载体的DNA序列。
3.DNA传递和胚胎干细胞培养:
4.敲除载体导入胚胎干细胞并筛选:
将构建好的敲除载体导入胚胎干细胞,可以使用电穿孔、转染等方法
将外源DNA转入胚胎干细胞。
导入后,筛选出带有敲除载体的胚胎干细胞。
研究者可以利用荧光蛋白报告基因来筛选出携带敲除基因的胚胎干细胞。
5.胚胎干细胞的胚胎注射和小鼠的获取:
将携带了敲除载体的胚胎干细胞通过微注射的方式注入小鼠早期胚胎
的内腔。
这些胚胎随后继续发育,最终产生带有敲除基因的小鼠。
6.培养和分析经过敲除的小鼠:
获得敲除基因的小鼠之后,研究者可以将其培养至成年,然后对其进行各种生理、行为等方面的分析。
通过与野生型小鼠进行比较,可以了解基因敲除对小鼠的影响和功能。
小鼠胚胎干细胞培养实验具体步骤及方法
胚胎干细胞在体内外可以分化为各种类型的细胞。
我们的体外分化方法有利于神经前体细胞通过在最少量的培养基内选择(第3步),在有bFGF存在的情况下扩增(第4步)并最终分化在第5步。
细胞全程培养在37℃,5%CO2,100%湿度条件下。
一般体外诱导向神经细胞方向分化,也可以采用低浓度的RA进行诱导。
具体步骤
一、ES培养基
在LIF存在的条件下维持细胞培养。
二、EB培养基
使用细菌培养皿去除LIF后胚状体的形成需要4天。
1. 分散纯化细胞(参见上面的细胞传代部分)。
2. 纯化2小时后将细胞转入含有ES培养基的50 ml Falcon管中,计数细胞取适量体积放入15 ml管中离心3分钟。
3. 用2mlEB培养基重悬细胞,吹打至少10次制成单细胞悬液
4. 一个15 cm的细菌培养皿接种4~5x106个细胞(1个完全融合的组织培养皿通常足以接种4个同样规格的细菌培养皿)。
5. 2天后更换培养基,将胚状体转入锥形管中放置3~5分钟使细胞沉降。
弃去上清,将细胞重悬于新鲜培养基并接种在新的细菌培养皿中。
6. 用EB培养基培养的第4天将细胞转入没有包被的组织培养皿中(这即是细胞的移植步骤)。
1个组织培养皿之中放置1个细菌培养皿,在进行第3步之前一天将胚状体黏附在同样规格的培养板上。
7. 形成胚状体需要4天时间。
在EB培养基中再培养1天使胚状体粘附在组织培养皿的表面。
这一天被认为是第2步和第3步的分界。
三、ITSFn培养基
在最少量培养基中选择神经前体细胞
1. 胚状体接种在组织培养皿一天后将培养基换成ITSFn培养基。
2. 并非所有胚状体在这一时期都已经发生粘附,因此在移除培养基时要小心谨慎以使大部分胚状体留在培养皿内。
3. 保持细胞在ITSFn中培养大约10天,根据需要更换培养基--大约每隔一天。
4. 观察细胞形态,神经样细胞大约出现在第4到第7天。
当神经样细胞能够被鉴别时,转入到第4步。
步骤的转换应该在神经前体细胞出现第一个清晰的标志几天以后,通常是在第3步的第6到第10天。
四、N3培养基+bFGF
通过将神经前体细胞培养在含有10ng/ml bFGF的培养基中进行扩增。
1. PBS洗涤,加入1-2 ml 胰酶。
2. 37℃孵育5分钟。
3. 用4mlEB培养基终止胰酶活*,将细胞转入锥形管中放置3~5分钟移出细胞团,将上清移入一新的离心管离心。
4. 将细胞重悬于含有bFGF的N3培养基。
5. 将细胞接种在包被多聚-L-鸟氨酸/纤维连接蛋白的盖玻片上(最好将盖玻片放于24孔培养板或6孔培养板,6孔培养板中每孔放置5个盖玻片如果是塑料的放置4个,以使最
大可能的获得样品数量)。
24孔板接种3.5x105/孔或6孔板1.7x106 /孔。
6. 2天后更换培养基。
五、N3培养基
通过撤除bFGF使神经前体细胞分化。
1. 细胞被接种在盖玻片上4天后将培养基换成不含bFGF的N3培养基。
2. 根据需要换液(大约每隔一天)。
3. 分化10~15天后固定细胞。
4. 移除培养基。
5. PBS洗涤,加入4%福尔马林,室温放置30分钟,PBS洗涤2次储存于PBS。
6. 长期储存使用含0.01%叠氮化纳的PBS。
六、移植细胞的准备
细胞在胚状体形成4天以后被移植(相应于体外分化过程中的第2步末细胞被转种到组织培养板)。
正如在前文体外分化中所描述的在移植之前4天开始形成胚状体。
通常再需要一天时间以便将胚状体移植入一10 cm的培养皿。
1. 将胚状体转移至一15 ml 圆锥形管中放置3~5分钟使胚状体沉降下来。
细胞被离心3分钟会更好。
放置使之沉降将会去除更多的单个细胞(包括死细胞)而这些细胞可以被离心下来。
2. 去除上清将胚状体重悬于无钙镁离子的1xPBS中。
2. 离心3分钟。
3. 去除上清加入1x胰酶(10 cm的培养皿加1 ml)。
4. 37℃水浴5分钟。
5. 加入5 mlEB培养基小心吹打约10次。
6. 小心处理细胞很重要,进行细胞传代分散细胞时不可剧烈吹打。
7. 离心2分钟。
9. 用光滑的巴斯德吸管小心吹打5次。
10. 离心2次。
11. 吸出上清将细胞重悬于100 ul EB培养基。
七、烟酸己可碱标记ES细胞进行移植
1. 准备一10 ug/ml的烟酸已可碱染液(双苯酰亚胺,在冷冻室118)。
2. 加入1 mg(你能称到的最小量)到5 ml EB培养基(制成200 ug/ml)。
3. 将溶液稀释成10 ug/ml (100 ul 200 ug/ml 溶液和1.9 ml EB培养基)。
4. 如前所述将细胞重悬于2 ml烟酸已可碱染液而不是EB培养基中制备ES细胞悬液。
5. 将悬液置于室温(或冰上)30分钟。
6. 离心2分钟。
8. 重复一次。
9. 离心2分钟。
10. 吸出上清将细胞重悬于100 ul EB培养基并置于冰上。
注意
1.需要采用高纯度的水进行培养细胞。
2. 必须要在无菌的环境下操作实验。
经验
1. 在没有添加LIF的条件下,培养在饲养层上的ES细胞克隆形成率和AKP染色阳性度显著高于无饲养层培养的ES细胞。
2. 在LIF添加量达到l000IU/ml时,外源LIF与饲养层产生的基质型LIF在维持未分化状态作用中存在有主从关系。
3. 当没有外源LIF或量不足时,饲养层产生的分化抑制作用才会在分化抑制中发挥主要作用。