李狄-电化学原理-第四章-电极过程概述
- 格式:ppt
- 大小:432.50 KB
- 文档页数:25





电化学原理思考题答案-北航李荻版(总4页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--2.为什么不能测出电极的绝对电位我们平常所用的电极电位是怎么得到的答:电极电位是两类导体界面所形成的相间电位,相间电位中的内电位是无法直接测量的,故无法直接测出电极的绝对电位,我们平常所用的电极电位都是相对电极电位。
不对,虽然有电位差,但是没有电流通过,所以不能转化为电能。
17、描述腐蚀原电池的特点所在。
①阴、阳极区肉眼可分或不可分,或交替发生;②体系不稳定? 稳定,腐蚀过程是自发反应;③只要介质中存在氧化剂 (去极化剂),能获得电子使金属氧化,腐蚀就可发生;④腐蚀的二次产物对腐蚀影响很大;⑤电化学腐蚀离不开金属/电解质界面电迁移,电子由低电位金属或地区传荷到电位高的金属或地区,再转移给氧化剂;⑥腐蚀电池包括阴极、阳极、电解质溶液和电路四部分,缺一不可;⑦阴极、阳极反应相对独立,但又必须耦合,形成腐蚀电池;⑧ia=ic ,无净电荷积累;⑨腐蚀电池不对外作功,只导致金属腐蚀破坏的短路原电池。
原电池和电解池装置原电池电解池电镀铜精炼铜形成条件镀层金属作阳极,镀件作阴极,电镀粗铜金属作阳极,精铜作阴极,CuSO4溶液作除电子转移步骤之外,其他电极过程的单元步骤能否用电流密度来表示它们的速度为什么因为J=zFvr对于我们所讨论的某一反应来说,zF为常数,故J与vr成正比。
这就是说,在电化学中总是习惯于用电流密度来表示反应速度。
由于在稳态下接续进行的各步骤速度都一样,所以在讨论液相传质等步骤时,也可用电流密度来表示它们的反应速度。
因此,在电化学中实际上已经将电流密度变成反应速度的同义语了。
己知电极反应在25℃时的反应速度为 A/cm2。
根据各单元步骤活化能计算出电子转移步骤速度为 X 10-2mol/m2s,扩散步骤速度为 mol/m2s。
试判断该温度下的控制步骤。
若这一控制步骤的活化能降低了12kJ/mol,会不会出现新的控制步骤?[解〕因为电极反应速度可用电流密度表示,即J=nFv,所以对电子转移步骤,其反应速度可表示为j电子=nFv电子。

电极过程简明教程
《电极过程简明教程》
电极过程是一种将电能转换成化学能的方法,是电化学反应的基础。
它是一种重要的能源转换技术,用于制造电池、燃料电池、电解槽等。
下面介绍一下电极过程的基本原理和步骤。
原理:电极过程通过电化学反应将电能转换成化学能,其中电解质在电极表面发生氧化还原反应,从而将电能转换成化学能。
步骤:
1.准备电极:首先准备好电极,电极可以是金属电极或非金属电极,根据不同的电极材料,选择合适的电解质。
2.准备电解质:将电解质加入电极中,以便发生电化学反应。
3.连接电源:将电极连接到电源,使电流流过电极,从而发生电化学反应。
4.观察反应:观察电极表面的反应,以确定电极过程的进行情况。
以上就是电极过程的基本原理和步骤,它是一种重要的能源转换技术,可以用于制造电池、燃料电池、电解槽等。

电化学原理第四版李荻课件电化学原理是研究电荷在电解质溶液中移动和电化学反应的科学。
本文将详细介绍电化学原理第四版李荻课件的内容和特点。
1. 引言电化学原理是追溯到18世纪的一门研究电化学现象的学科。
通过电化学原理的学习,我们可以深入了解电解质溶液中的电荷运动规律以及电化学反应的机理。
2. 基础概念电化学原理第四版李荻课件首先介绍了一些基础概念,包括电流、电荷、电势差等。
这些基础概念对于理解电化学原理的后续内容至关重要。
3. 电解质溶液的离子电导性本节介绍了电解质溶液中离子电导性的相关理论和实验方法。
电解质溶液中的离子在电场的作用下会发生迁移,并导致电流的流动。
通过测量电导率可以了解电解质溶液的离子浓度和活度系数等信息。
4. 电极反应与电极电势本节重点探讨了电极反应与电极电势的关系。
电极反应是电化学反应的基础,通过对不同电极反应的理解,可以揭示电化学反应的动力学过程。
而电极电势则是用来描述电极反应的热力学属性。
5. 电化学动力学电化学动力学研究了电化学反应的速率与反应条件之间的关系。
本节主要介绍了电化学动力学的基本原理和数学表达式,包括电荷传递系数、极化现象等内容。
6. 脉冲伏安法脉冲伏安法是一种常用的电化学测量技术,可以用于研究电化学反应的动力学和热力学过程。
本节详细介绍了脉冲伏安法的原理、仪器设计和实验步骤等内容。
7. 电化学计量电化学计量是利用电化学方法测量溶液中化学物质含量的技术。
本节主要介绍了电化学计量的原理、电化学分析方法的分类以及常用的电化学测量技术。
8. 电化学电源与电解池电化学电源和电解池是电化学实验的核心设备。
本节着重介绍了电化学电源和电解池的结构和工作原理,以及常见的电化学电源和电解池的种类和特点。
9. 应用与展望电化学原理在许多领域都有广泛的应用,如能源存储、电镀、电池等。
本节将展示一些电化学原理的应用案例,并对未来的发展进行展望。
总结:通过对电化学原理第四版李荻课件的介绍,我们深入了解了电化学原理的基本概念和相关理论。


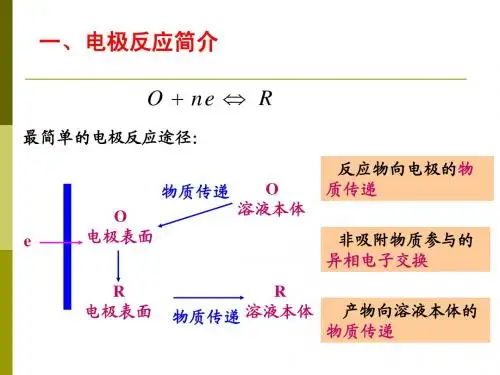
第4章 浓度极化(Concentration Polarization )(液相传质过程动力学 mass transfer process )电化学极化控制时,认为传质无限快,得失电子是慢步骤。
R e O O s −−→−+−−→←-电化学传质 (s -- surface )其中sO 是表面的反应粒子。
传质过程无限快,则在反应进行中。
反应粒子不断被消耗,但s o C 表面浓度不会下降,因为消耗多少,就能补充多少,因此总有0os o C C =。
当传质不快时,传质会成为慢步骤,即:R O O es −−→←−−→−-+传质这时,电化学步骤很快(0i 大,a k i i ≈)。
处于准平衡状态。
而传质速度慢,在反应中就会出现表面反应物浓度)(0o s o C C <↓的现象,[开始前,0o s o C C =,0R s R C C =]或产物↑s R C 。
sC 的改变将导致ϕ的变化(根据Nernst 方程),即出现浓度极化。
实际反应中,电化学极化和浓度极化还常常是同时存在的,交迭在一起,即出现混合控制的现象。
注意:前面讨论过,由于1ψ效应的存在,电极表面d 处的浓度0*oo C C ≠,而是符合玻尔兹曼分布[)exp(10*RT F z i i i C C ψ-=]。
这里的*oC 与s o C 并不是一个概念(虽然都未加区分地叫“表面浓度”)。
讨论1ψ效应时,未考虑传质的影响,*o C 与so C 不等是1ψ的存在引起的。
而若有0os o C C ≠,则是指传质速度慢引起的。
后面将说明*o C 、s o C 所在的具体位置并不相同(距电极的距离不同)。
反应物和产物在溶液中是如何传递的呢?4.1 液相传质过程的基本概念4.1.1 传质的三种方式:1、 对流:(强制或自发产生的电解质的流动)反应物(产物)随液体一起流动,这种传质方式即为对流。
这种方式的特点是:反应粒子与溶液整体间无相对运动。
对流的产生有两种情况: (1)、自然对流(自发产生):①反应进行中,溶液内部会出现局部的浓度与温度的变化(浓度大,密度大;温度高,密度小),从而引起各部分密度的差别。