对甲氧基苯胺
- 格式:pdf
- 大小:231.88 KB
- 文档页数:3

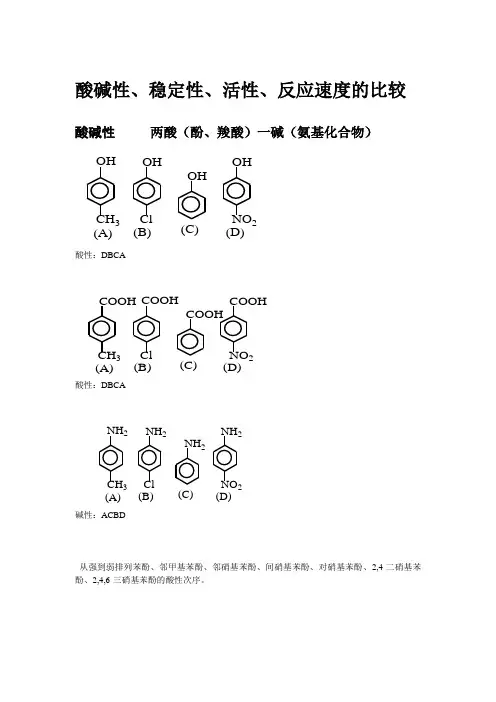
酸碱性、稳定性、活性、反应速度的比较 酸碱性 两酸(酚、羧酸)一碱(氨基化合物)酸性:DBCA酸性:DBCA碱性:ACBD从强到弱排列苯酚、邻甲基苯酚、邻硝基苯酚、间硝基苯酚、对硝基苯酚、2,4-二硝基苯酚、2,4,6-三硝基苯酚的酸性次序。
OH CH 3Cl NO 2OH OH OH (A)(B)(C)(D)CH 3Cl NO 2(A)(B)(C)(D)COOH COOH COOH COOH CH 3Cl NO 2(A)(B)(C)(D)NH 2NH 2NH 2NH 2胺与氨相似,由于氮原子上有一对未共用电子对,容易接受质子形成铵离子,因而呈碱性。
胺的碱性强弱可用pKb值表示。
PKb值愈小,其碱性愈强。
不同胺的碱性强弱的一般规律为:脂肪胺(仲>伯>叔)>氨>芳香胺(苯胺>二苯胺>三苯胺)当芳胺的苯环上连有给电基时,可使其碱性增强,而连有吸电基时,则使其碱性减弱。
例如,下列芳胺的碱性强弱顺序为:对甲苯胺>苯胺>对氯苯胺>对硝基苯胺较下列化合物在水溶液中的碱性强弱,按碱性从大到小的顺序排列:氨、CH3NH2、(C6H5)3N、(CH3)3N、(CH3)2NH、苯胺、对硝基苯胺、对甲氧基苯胺、活性、反应速度的比较:1、醇的活性次序:烯丙型、苄基型>叔醇>仲醇>伯醇烯丙型、苄基型、叔醇、仲醇为SN1反应。
2、羰基的反应活性按下列羰基化合物其加成反应的活性由强至弱的次序排列。
A、ClCH2CHOB、CH3CHOC、CH2=CHCHOD、CH3CH2CHO答:ABDC3羧酸衍生物的相对反应活性亲核取代反应酰氯> 酸酐> 酯> 酰胺。

各章练习题1.名词解释:(1)有机化学:研究有机化合物的结构、性能和合成方法的一门科学。
(2)有机化合物:碳的化合物。
(3)官能团:在有机化合物分子中能体现一类化合物性质的原子或基团。
(4)共价键的键长、键角、键能: 键长:成键两原子核间距离。
键角:两个共价键在空间的夹角。
键能:以共价键结合的双原子分子裂解成原子时所吸收的能量。
2.写出氯甲烷分子中碳氯键的异裂和均裂的化学反应式。
H 3CCH 3 + Cl CH 3 + ClClH 3CCl1.解释名词:(1)同系列:具有相同分子通式和结构特征的一系列化合物。
(2)构造异构:分子式相同,分子中原子间相互连接顺序和方式不同而产生的不同化合物。
(3)构象异构:由单键的旋转而产生的异构体。
2.写出含有7个碳烷烃的同分异构体的结构并用系统命名法命名。
CH 3CH 2CH 2CH 2CH 2CH 2CH 3CH 3CH 2CH 2CH 2CHCH 3CH 3CH 3CH 2CH 2CHCH 2CH 3CH 3庚烷 2-甲基己烷 3-甲基己烷CH 3CHCH 2CHCH 3CH 3CH 3CH 3CHCHCH 2CH 3CH 3CH 3CH 3CCH 2CH 2CH 3CH 3CH 32,4-二甲基戊烷 2,3-二甲基戊烷 2,2-二甲基戊烷CH 3CH 2CHCH 2CH 3CH 2CH 3CH 3CH 2CCH 2CH 3CH 3CH 3CH 3CHCCH 3CH 3CH 3CH 33,3-二甲基戊烷 2,2,3-三甲基丁烷 3-乙基戊烷第三章 烯烃和炔烃1.写出单烯烃C 5H 8的所有同分异构体,并用系统命名法命名。
CH 2=CHCH 2CH 2CH 3CH 3CH=CHCH 2CH 31-戊烯 2-戊烯CH 2=CCH 2CH 3CH 3CH 2=CHCHCH 3CH 3CH 3CH=CCH 3CH 32-甲基-1-丁烯 3-甲基-1-丁烯 2-甲基-2-丁烯2.完成下列反应(1)CH 3CH 2C=CH 2 + HBrCH 3CH 3CH 2CCH 3BrCH 3(2)CH 3CH=CCH 2CH 334,HCH 3COOH + O=CCH 2CH 33(3)CH 3CH=CHCH 3 + H 2PtCH 3CH 2CH 2CH 3(4)CH 3CH 2C CH + AgNO 3(NH 3)CH 3CH 2C CAg + NH 4NO 3 + NH 3(5)CH 3C CH + HCl CH 3C=CH 2ClClCH 3CCH 33、用简单的化学方法鉴别戊烷、1-戊烯、1-戊炔。

催化合成对甲氧基肉桂酸甲酯张立攀;郭青照;王永【摘要】采用对甲氧基苯胺为原料,将其制成重氮盐,然后在催化剂和表面活性剂的作用下和丙烯酸甲酯反应,合成了对甲氧基肉桂酸甲酯;通过熔点测定、质谱和气相色谱分析等手段对产物进行了结构表征和含量分析,并研究得到最佳工艺条件。
%Methyl p-methoxy cinnamate was synthesized with p-Anisidine and Methyl acrylate,under the action of catalyst and surfactant. The structure was confirmed by melt point and MS with the content being analyzed by GC , and the optimum technological condition was determined.【期刊名称】《河南科学》【年(卷),期】2016(034)009【总页数】3页(P1437-1439)【关键词】对甲氧基苯胺;对甲氧基肉桂酸甲酯;合成【作者】张立攀;郭青照;王永【作者单位】河南省商业科学研究所有限责任公司,郑州 450002;河南省商业科学研究所有限责任公司,郑州 450002;河南省商业科学研究所有限责任公司,郑州 450002【正文语种】中文【中图分类】O626.32近年来,因氟利昂等气体的随意排放,大气臭氧层日趋稀薄,到达地面的紫外线强度日益增加,紫外线在短时间内就会使皮肤产生急性损伤如红斑、水泡等,还可深达真皮层,导致皮肤晒黑、老化甚至癌变[1].对甲氧基肉桂酸甲酯对紫外线具有良好吸收作用,是一种优良的防晒剂,易生物降解,具有环保上的相容性[2-4].目前合成对甲氧基肉桂酸甲酯主要有以对甲氧基苯甲醛为原料的Perkin[5-8]和Knoevenagel法[9-14],以对甲氧基卤苯为原料的Heck偶联反应法[15],以对甲氧基苯乙烯为原料经加成、酯化法[16].其中,Perkin和Knoevenagel法存在反应温度较高、使用催化剂碱性较强、产率偏低等缺点;Heck偶联法能耗多、原料难得且价格高.本文以对甲氧基苯胺和丙烯酸甲酯为主要原料,采用混合催化剂,用重氮化反应合成对甲氧基肉桂酸甲酯,具有反应时间短、产率高、后处理更简便等优点,合成路线如下:1.1 试剂与仪器对甲氧基苯胺(青州市奥星化工有限公司);冰醋酸、氧化铜、氧化铁、氧化锌(国药集团化学试剂有限公司);硫酸(天津市瑞金特化学品有限公司);其余试剂为市售分析纯.WRS-2微机熔点仪(上海申光仪器仪表有限公司);GC-17A/QP-5000型GC-MS仪(日本岛津公司).1.2 实验方法取1 mol(123 g)对甲氧基苯胺与质量分数75%的硫酸溶液(553 g)混匀,控制温度不超过50℃(30~50℃),滴加质量分数25%的氟硼酸钠溶液(含56 g 氟硼酸钠);滴毕,加入1.2 mol(103 g)丙烯酸甲酯和0.8 g十二烷基三甲基溴化铵,搅拌均匀;滴加质量分数21%的亚硝酸钠溶液(含75.8 g亚硝酸钠),60 min滴完,在开始滴加亚硝酸钠溶液10 min后加入催化剂(氧化铜5.5 g、氧化铁8.9 g、氧化锌8.5 g),滴加过程控制内温为30~45℃,滴毕,维持温度继续反应40 min;升高温度至60℃,反应1.5 h后结束反应.反应结束后加入反应液等体积的水稀释,加入乙酸乙酯萃取,有机相经水洗、浓缩、干燥后得到对甲氧基肉桂酸甲酯189.6 g,收率98.6%.产物用乙醇重结晶后得到纯品,重结晶回收率95%.2.1 产物熔点分析产物熔点86.9~88.2℃,文献值87~88℃,符合文献值[2].2.2 产物含量分析经气相色谱归一法测定,产物中对甲氧基肉桂酸甲酯的质量分数为99.3%,气象色谱如图1所示.2.3 质谱分析产物的分子质量为192.图2中可找到对应产物分子离子峰为192;离子峰162为产物分子失去甲氧基后的碎片峰CH3OPHCH=CHCO,因此可以确证产物结构. 2.4 反应物用量比主要反应物为对甲氧基苯胺和丙烯酸甲酯,由于丙烯酸甲酯成本较低,且剩余物容易在后处理中除去,所以选择丙烯酸甲酯过量.经过研究,两者最佳物质的量比为1∶1.2.2.5 氟硼酸钠的影响与对甲氧基苯胺同时加入氟硼酸钠,有利于形成重氮四氟硼酸盐,可以稳定化中间物,使反应温度更加适宜,提高可操作性和反应产率.2.6 催化剂实验所用的催化剂为3种金属氧化物氧化铜、氧化铁以及氧化锌混合而成,当三者的质量比为55∶89∶85时,催化效果最好;催化剂应选择与亚硝酸钠溶液开始滴加后加入.2.7 表面活性剂丙烯酸甲酯与重氮盐处于两相中,与丙烯酸甲酯一起加入适量的十二烷基三甲基溴化铵,能够促使反应的快速进行,减少副反应,提高产率.【相关文献】[1]王娜,王新宇,陆洪光.中波紫外线诱导HaCaT细胞凋亡的研究[J].中国皮肤性病学杂志,2007,21(11):651-653.[2]邢彦美,刘仕伟,于世涛,等.甲氧基肉桂酸甲酯的合成[J].青岛科技大学学报:自然科学版,2010,31(2):141-143.[3]张红,区国勇.防晒剂对甲氧基肉桂酸酯类的合成进展[J].香料香精化妆品,2001(3):18-22.[4]田孟超,付承臣,李爱梅.反应性紫外线吸收剂的合成与应用[J].河南科学,2010,28(12):1533-1535.[5]王永,张立攀,郭良起,等.氧化法合成2,2′-联吡啶-4,4′-二甲醛[J].河南科学,2011,29(12):1433-1435.[6]李晓湘,唐冬秀.冠醚相转移催化合成肉桂酸[J].宁夏化工,2007(3):2-4.[7]王永,伍季,张立攀,等.2-苯硫基-5-丙酰基苯乙酸甲酯的合成研究[J].河南科学,2011,29(2):910-912.[8]金秋,杨国玉,潘振良,等.一种新型手性催化剂的合成及其催化的不对称羟醛缩合反应[J].河南科学,2009,27(8):921-923.[9]陈红飙,林原斌,彭智勇,等.对三氟甲基肉桂酸的合成[J].合成化学,2006,14(3):314-316.[10]薛亮.头孢类抗生素及中间体发展浅析[J].精细化工原料及中间体,2007(3):27-29. [11]曾庆友,曾明荣.对甲氧基肉桂酸甲酯的一锅式绿色合成[J].合成化学,2007,15(5):663-664.[12]张立攀,郭良起,谭静,等.2,2′-(2,2′-联吡啶-4,4′-二次甲基)二丙二腈的合成及其表征[J].河南科学,2014,32(4):496-499.[13]张红,伍苡沁,余昆松.无溶剂微波辐射对甲氧基肉桂酸的合成[J].日用化学品科学,2004,27(12):15-17.[14]金继曙,都述虎.莪术抗真菌主要有效成分对甲氧基桂皮酸乙酯的合成[J].天然产物研究与开发,1994,6(1):40-41.[15] Jason T,Rodrigo R,Carlos D,et al.Facile synthesis of symmetrical 3,3-diarylacrylates by a Heck-Matsuda reaction:an expedient route to biologically active indanones[J].Tetrahedron Letters,2011,52(30):3861-3864.[16] Mohammad A,Wayne S,Robert R,et al.Preparation of cinnamate esters from sty renes[J].J Org Chem,1997(62):1550-1552.。

2009年第29卷有机化学V ol. 29, 2009第4期, 643~647 Chinese Journal of Organic Chemistry No. 4, 643~647* E-mail: zhaoying42@Received March 23, 2008; revised August 20, 2008; accepted November 25, 2008.湖南省科技厅科研基金(No. 2007FJ4156)资助项目.644有 机 化 学 V ol. 29, 2009在芳香胺的邻位、对位和间位取代苯中, 对位取代苯胺易与丙烯腈发生加成反应生成相应的N -氰乙基对位取代苯胺(简称单氰乙基物, 以下同). 但是, 生成的单氰乙基物要继续进行氰乙基化生成N ,N -二氰乙基对位取代苯胺(简称双氰乙基物, 以下同)则因空间阻碍而较难, 需要催化效率更强的催化剂, 但有关这方面的报道很少, 仅见Braunholtz 等[4,11]以HOAc-CuCl 催化体系合成N ,N -二氰乙基对氯苯胺, 收率为20%, Gimbert 等[12]以Bu 3P 催化合成N ,N -二氰乙基对硝基苯胺, 收率为71%, 本课题组[13~16]曾在合成N ,N -二氰乙基苯胺研究中发现AlCl 3对该类加成反应具有非常高的催化活性. 本研究继续采用无水AlCl 3催化一系列对位取代苯胺与丙烯腈发生加成反应合成相应的单氰乙基物和双氰乙基物, 并对合成的5种新的双氰乙基物进行物性和结构表征. 对位取代苯胺与丙烯腈加成反应方程式如Eq. 1.1 结果与讨论1.1 单氰乙基化反应相对于邻位取代苯胺、间位取代苯胺的单氰乙基化反应(单氰乙基化反应是指氨基上的一个氢与丙烯腈加成生成相应的单氰乙基物), 对位取代苯胺是一个没有空间阻碍的加成反应. 在无水AlCl 3催化下, 当AlCl 3加入较多, 丙烯腈过量较多, 反应温度较高, 反应时间较长的条件下, 易产生双氰乙基产物, 因此, 控制好这些反应条件尤为重要. 表1是我们优化的对位取代苯胺进行单氰乙基化反应的实验结果. 序号1~4为具有供电子基团的烷基、烷氧基等取代基, 单氰乙基化反应较易进行, 所以无水AlCl 3的使用量较少(2%, 质量比, 以下同), 反应温度较低(50~60 ℃), 其中甲氧基、乙氧基等烷氧基比甲基、乙基等烷基供电性更强, 反应时间要短, 反应温度要低. 氯原子诱导效应大于其供电子共轭效应, 使苯环上电子云密度降低, 所以, 对氯苯胺的反应活性比对甲基苯胺、对乙基苯胺要弱, 无水AlCl 3的使用量相对要多(10%), 反应时间相对要长(4 h), 反应温度相对要高(65~70 ℃). 序号6~7为具有吸电子基团的硝基、磺酸基, 较带烷基、烷氧基等供电子基团芳香胺的单氰乙基化反应要难得多, 即使无水AlCl 3的使用量更多, 反应时间更长, 反应温度更高, 也难以获得高收率单氰乙基产物. 其中N -氰乙基对硝基苯胺的收率仅21% (NMR 计算收率), 对氨基苯磺酸没有发生氰乙基化反应(分离产物的IR 表明无CN 基的吸收峰). 为降低双氰乙基产物的产生, 提高单氰乙基反应的选择性, 我们尝试采用加入一定量NaOAc 作助催化剂来降低AlCl 3的催化活性. 序号1~4与序号8~11的对比实验表明, 在反应时间延长后, 对甲基苯胺、对甲氧基苯胺、对乙基苯胺、对乙氧基苯胺和相应的双氰乙基产物的含量均降低, 单氰乙基产物的含量和收率均明显升高. NaOAc 之所以具有提高单氰乙基反应选择性的效果, 这可能是醋酸根上的氧原子与AlCl 3上Al 原子结合抑制了AlCl 3瞬时间强的催化活性, 避免了因剧烈催化作用而产生N ,N-二氰乙基对取代苯胺. 这与AlCl 3和许多有机碱性物组成的离子液来调节酸性的原理可能是一样的[17].表1 对位取代苯胺的单氰乙基化反应Table 1 Monocyanoethylation reaction of p -substituted anilines a产物含量b /% 序号 芳香胺 催化剂 催化剂/% 时间/h 温度/℃单氰双氰收率c /%1 p -CH 3C 6H 4NH 2 AlCl 3 2.0 4 55~60 92.5 2.5 89 2 p -C 2H 5C 6H 4NH 2 AlCl 3 2.0 4 55~60 91.7 3.0 88 3 p -CH 3OC 6H 4NH 2 AlCl 3 2.0 3 50~55 92.1 3.5 89 4 p -C 2H 5OC 6H 4NH 2 AlCl 3 2.0 3 50~55 92.0 2.8 88 5 p -ClC 6H 4NH 2 AlCl 3 10.04 65~70 93.5 0.7 906 p -NO 2C 6H 4NH 2 AlCl 3 20.0 12 80~85 — — 21d7 p -SO 3HC 6H 4NH 2 AlCl 3 20.0 12 80~85—— 08 p -CH 3C 6H 4NH 2 AlCl 3/NaOAc 4.0/2.0e 8 55~60 97.6 0.3 94 9 p -C 2H 5C 6H 4NH 2 AlCl 3/NaOAc 4.0/2.0 8 55~60 96.7 0.5 93 10 p -CH 3OC 6H 4NH 2 AlCl 3/NaOAc 4.0/2.0 8 55~60 97.5 0.4 94 11p -C 2H 5OC 6H 4NH 2 AlCl 3/NaOAc 4.0/2.0 855~60 97.1 0.4 93a对位取代苯胺用量为0.60 mol, 丙烯腈为0.66 mol, 芳胺为固体的加乙腈20 mL 作溶剂; b 系反应终点用高压液相色谱检测的含量; c 分离收率; d NMR 计算收率; e 4.0/2.0是指AlCl 3/NaOAc 的质量比.No. 4 赵莹等:AlCl3催化对位取代苯胺与丙烯腈加成反应的研究645可见, 无水AlCl3是催化对位取代苯胺与丙烯腈单氰乙基加成反应的一种高效催化剂, 控制丙烯腈和AlCl3的用量、反应时间和反应温度, 可以获得高选择性、高收率的单氰乙基加成产物; 而加入一定量的NaOAc作助催化剂, 则有利于提高单氰乙基反应的选择性和单氰乙基产物的收率.1.2 双氰乙基化反应对位取代苯胺单氰乙基化反应后, 再与丙烯腈进行氰乙基化形成双氰乙基物时存在空间阻碍, 使加成反应难于进行, 有关芳香胺的双氰乙基加成反应(双氰乙基化反应是指氨基上的两个氢与丙烯腈加成生成相应的双氰乙基物)报道很少. 我们采用加入较多的无水AlCl3、较多的丙烯腈、提高反应温度和延长反应时间较好地解决了这个问题. 表2是优化的对位取代苯胺进行双氰乙基化反应的实验结果. 与单氰乙基化反应一样, 烷基、烷氧基等具有强供电子基团的芳胺双氰乙基化反应较易进行; 而氯原子的诱导效应大于供电子共轭效应, 使苯环上电子云密度降低, 无水AlCl3的使用量相对要多, 反应时间相对要长, 反应温度相对要高. 序号1~4与序号6~9的实验结果对比表明, 由AlCl3-ZnCl2构成的催化体系比只用AlCl3催化具有更好的催化效率. 这是因为在AlCl3中加入另一Lewis酸可以构成超强酸催化剂, 如AlCl3-CuCl2, AlCl3-CuSO4催化体系就是固体超强酸催化剂[18]. 我们采用了AlCl3-Cu(AcO)2•3H2O, AlCl3-CuCl2, AlCl3-CuSO4, AlCl3-FeCl3, AlCl3-ZnCl2等五种二元催化体系研究该类反应, 发现AlCl3-ZnCl2催化体系具有更高的催化效率. 其原因是这两个催化剂均能溶于丙烯腈, 从而构成AlCl3-ZnCl2液体超强酸催化剂, 提高了催化剂的催化效率, 使双氰乙基产物收率提高.可见, 无水AlCl3是催化对位取代苯胺与丙烯腈双氰乙基加成反应的一种高效催化剂, 在丙烯腈过量较多, AlCl3的用量增加、反应温度提高的情况下, 可以获得高收率的双氰乙基加成产物; 而加入ZnCl2后构成的AlCl3-ZnCl2液体超强酸催化剂, 可使反应的收率更高.2 实验部分2.1 试剂与仪器对甲基苯胺, 对甲氧基苯胺, 对乙基苯胺, 对乙氧基苯胺, 对氯苯胺, 对硝基苯胺, 对氨基苯磺酸, 丙烯腈, AlCl3, HCl, NaAcO, ZnCl2, Na2CO3均为化学纯.北京瑞利UV 1100紫外可见分光光度计, 日本岛津LC-10AT液相色谱仪; 美国Agilent 1100 Series LC/MDS液-质联用仪; 美国Avatar-330红外光谱仪; 美国EA2400-II元素分析仪; 德国布兰克核磁共振仪(400 MHz), 北京光学仪器厂WCT-2C微机差热分析仪.液相色谱仪测试条件为: V(MeOH)∶V(H2O)=65~90∶35~10, 流速: 1~1.5 mL/min.2.2 N-氰乙基对位取代苯胺合成的典型过程在带有搅拌器、温度计和回流冷凝管的250 mL三口烧瓶中, 加入乙腈20 mL, 丙烯腈35.0 g (约0.66 mol), 无水AlCl3 1.28 g (0.0096 mol), 对甲基苯胺64.2 g (约0.60 mol), 加热至50 ℃反应4 h, 取样, 用高压液相色谱仪检测, 单氰乙基产物纯度92.5%. 然后减压蒸馏回收丙烯腈, 将瓶内物料升温至70 ℃, 倒入70 ℃水中, 加入10%稀盐酸, 搅拌, 冷却到室温, 抽滤, 再加入70 ℃水, 5% Na2CO3水溶液, 升温至70 ℃, 搅拌, 冷到室温, 过滤, 用蒸馏水洗涤至中性, 干燥, 得N-氰乙基对甲基苯胺. 经m.p., UV, IR, NMR, MS, EA分析得到确认, 并与文献基本一致[8,10].2.3 N,N-二氰乙基对位取代苯胺合成的典型过程在带有搅拌器、温度计、回流冷凝管的250 mL三口表2 对位取代苯胺的双氰乙基化反应aTable 2 Dicyanoethylation reaction of p-substituted anilines产物含量/%序号芳胺催化剂催化剂/% 丙烯腈b时间/h温度/℃单氰双氰收率/%1 p-CH3C6H4NH2 AlCl3 201∶3 16 80~85 2.6 95.9 912 p-C2H5C6H4NH2 AlCl3 201∶3 16 80~85 3.8 94.7 893 p-CH3OC6H4NH2 AlCl3 201∶4 16 75~80 3.2 95.4 904 p-C2H5OC6H4NH2 AlCl3 201∶4 16 80~85 5.1 93.5 885 p-ClC6H4NH2 AlCl3 401∶6c 16 80~85 3.1 96.5 896 p-CH3C6H4NH2 AlCl3/ZnCl2 20/10d1∶3 10 80~85 0.8 98.4 957 p-CH3OC6H4NH2 AlCl3/ZnCl2 20/10 1∶4 10 75~80 0.3 98.9 968 p-C2H5C6H4NH2 AlCl3/ZnCl2 20/10 1∶4 10 80~85 0.4 98.3 959 p-C2H5OC6H4NH2 AlCl3/ZnCl2 20/10 1∶4 10 75~80 0.4 98.5 95a对位取代苯胺用量为0.30 mol; b芳香胺与丙烯腈的物质的量比; c由于产物熔点高, 需要过量的丙烯腈作溶剂; d20/10是指AlCl3/ZnCl2的质量比.646有机化学V ol. 29, 2009烧瓶中, 加入47.7 g (约0.90 mol)的丙烯腈、6.4 g AlCl3 (0.048 mol), 保温在70 ℃使催化剂完全溶解, 得一透明液体, 再分批加入对位甲基苯胺32.1 g (约0.30 mol), 加热至80~85 ℃左右回流反应16 h, 用高压液相色谱仪检测, 双氰乙基产物纯度为95.9%. 然后减压蒸馏回收丙烯腈, 将瓶内物料升温至70~80 ℃, 倒入70~80 ℃水的烧杯中, 加入10%稀盐酸, 搅拌, 冷却到室温, 抽滤, 再加入80 ℃水, 5% Na2CO3水溶液, 升温至80 ,℃搅拌, 冷到室温, 过滤, 用蒸馏水洗涤至中性, 干燥, 得N,N-二氰乙基对甲基苯胺. 该N,N-二氰乙基化物的结构分析数据见前.2.4 物性及结构表征在本研究中, 我们获得了6种N-氰乙基对位取代苯胺和5种N,N-二氰乙基对位取代苯胺, 其中N-氰乙基对位取代苯胺已有相关文献对其物性及结构进行了表征[8,10]. 本文只对5种N,N-二氰乙基对位取代苯胺的物性及结构进行表征.N,N-二氰乙基对甲基苯胺: 灰白色固体(用乙醇重结晶后为白色针状晶体), m.p. 91~92 ℃(毛细管法), 经微机差热分析仪分析m.p. 89~92 ; b.p. 3℃14~330 ;℃UV-vis (EtOH) λmax: 211, 254, 300 nm; 1H NMR (CDCl3, 400 MHz) δ: 2.29 (s, 3H, CH3), 2.61 (t, J=6.60 Hz, 4H, CH2), 3.73 (t, J=6.64 Hz, 4H, CH2), 6.85 (d, J=8.28 Hz, 2H, C6H4), 7.13 (d, J=8.24 Hz, 2H, C6H4); IR (KBr) ν: 3023, 3013, 2962, 2915, 2856, 2245 (CN), 1619, 1522, 1478, 1459, 1409, 1359, 1324, 1179, 804, 766 cm-1; MS m/z (%): 213, 159. Anal. calcd for C13H15N3: C 73.21, H 7.09, N 19.70; found C 72.87, H 7.16, N 19.82.N,N-二氰乙基对乙基苯胺: 浅灰色或浅黄色固体, m.p. 79~81 ℃(毛细管法, 未校正, 以下同), 经微机差热分析仪分析m.p. 77~80 ℃, b.p. 293~304 ℃; UV-vis (EtOH) λmax: 212, 256, 297 nm; 1H NMR (CDCl3, 400 MHz) δ: 1.19~1.23 (m, J=7.80 Hz, 3H, CH3), 2.57~2.61 (m, J=6.52 Hz, 6H, CH2), 3.73 (t, J=6.64 Hz, 4H, CH2), 6.89 (d, J=7.76 Hz, 2H, C6H4). 7.14 (d, J=8.24 Hz, 2H, C6H4); IR (KBr) ν: 3074, 3019, 2960, 2910, 2927, 2866, 2246 (CN), 1615, 1570, 1520, 1460, 1356, 1312, 1238, 1175, 1130, 1021, 1002, 807 cm-1; MS m/z (%): 227, 173. Anal. calcd for C14H17N3: C 73.96, H 7.54, N 18.49; foundC 74.03, H 7.57, N 18.40.N,N-二氰乙基对甲氧基苯胺: 浅灰色固体或白色针状晶体, m.p. 102~103 ℃(毛细管法), 经微机差热分析仪分析m.p. 97~101 ℃; b.p. 307~325 ℃; UV-vis (EtOH) λmax: 210, 252, 311 nm; 1H NMR (CDCl3, 400 MHz) δ: 2.52 (t,J=6.72 Hz, 4H, CH2), 3.59 (t,J=6.72 Hz, 4H, CH2), 3.78 (s, 3H, CH3), 6.87 (m, J=6.72 Hz, 4H, C6H4); IR (KBr) ν: 3043, 3006, 2952, 2934, 2903, 2831, 2247 (CN), 1616, 1575, 1516, 1459, 1413, 1371, 1359, 1245, 1208, 1177, 1035, 814 cm-1; MS m/z (%): 229, 214, 175, 160. Anal. calcd for C13H15N3O: C 68.11, H 6.63, N 18.22, O 7.04; found C 68.17, H 6.63, N 18.17, O 7.03.N,N-二氰乙基对乙氧基苯胺: 浅灰色固体, m.p. 47~48 ℃(毛细管法), 经微机差热分析仪分析m.p. 45~47 ℃; b.p. 302~316 ℃; UV-vis (EtOH) λmax: 206, 250, 310 nm; 1H NMR (CDCl3,4 00 MHz) δ: 1.41 (t, J=6.80 Hz, 3H, CH3), 2.53 (t, J=6.68 Hz, 4H, CH2), 3.59 (t, J=6.68 Hz, 4H, CH2), 3.99 (q, J=6.92 Hz, 2H, CH2), 6.87 (q, J=8.88 Hz, 4H, C6H4). IR (KBr) ν: 3057, 2981, 2934, 2899, 2866, 2244 (CN), 1521, 1475, 1371, 1259, 1053, 975, 810, 790, 705 cm-1; MS m/z (%): 243, 213, 198, 169. Anal. calcd for C14H17N3O: C 69.10, H 7.05, N 17.27, O 6.58; found C 69.16, H 7.04 , N 17.15, O 6.65.N,N-二氰乙基对氯苯胺: 浅黄色或灰褐色固体. m.p. 92~93 ℃(毛细管法), 经微机差热分析仪分析m.p. 90~93 ℃; b.p. 323~340 ℃; UV-vis (EtOH) λmax: 212.5, 256, 301 nm; 1H NMR (CDCl3, 400 MHz) δ: 2.63 (m, J=6.52 Hz, 4H, CH2), 3.77 (t, J=6.56 Hz, 4H, CH2), 6.65 (d, J=8.84 Hz, 2H, C6H4), 7.27 (d, J=8.80 Hz, 2H, C6H4); IR (KBr) ν: 3054, 2971, 2957, 2915, 2250 (CN), 1597, 1570, 1503, 1459, 1422, 1397, 1373, 1290, 1227, 1204, 1174, 815, 785, 638 cm-1; MS m/z (%): 233, 198, 179, 144. Anal. calcd for C12H12N3Cl: C 61.93, H 5.21, N 18.06, Cl 14.80; found C 61.88, H 5.19, N 17.99, Cl 14.94.3 结论AlCl3在催化对位取代苯胺与丙烯腈加成反应中是一种高效催化剂. 当合成N-氰乙基对位取代苯胺时, 为防止产生双氰乙基产物, 应考虑AlCl3和丙烯腈的用量、反应温度、反应时间等因素, 具有供电子取代基团与具有吸电子取代基团的反应相比, AlCl3的用量要少, 反应温度要低, 反应时间要短些. 此外, 为抑制AlCl3强的催化活性, 同时加入NaOAc等Lewis碱是一种有效的手段, 这将有利于提高单氰乙基反应的选择性, 获得高含量、高收率的单氰乙基产物. 当合成N,N-二氰乙基对位取代苯胺时, AlCl3的用量要多, 反应温度要高, 反应时间要长, 而且加入的丙烯腈要超过化学计量. AlCl3和丙烯腈的用量、反应温度、反应时间的选择同样与对位取代基团性质有关, 具有吸电子取代基团的芳胺要求AlCl3用量多、反应温度高、反应时间长. 此外, 为提高No. 4 赵莹等:AlCl3催化对位取代苯胺与丙烯腈加成反应的研究647AlCl3的催化活性, 缩短反应时间, 加入Lewis酸ZnCl2组成的液体超强酸催化体系是一种有效的手段, 它有利于获得高含量、高收率的双氰乙基产物.References1 Yao, M.-Z.; Chen, L.-B.; Wang, J.-Y. Synthesis Principle onFine Chemicals, China Oil and Chemistry Press, Beijing, 1992, pp. 281~282 (in Chinese).(姚蒙正, 陈侣柏, 王家儒, 精细化工产品合成原理, 中国石化出版社, 北京, 1992, pp. 281~282.)2 Whitmore, F. C.; Mosher, H. S.; Adams, R. R.; Taylor, R.B.; Chapin, E.C.; Weise, C. L.; Yanko, W. J. Am. Chem.Soc. 1944, 66. 725.3 Scully, D. F. US3743668, 1973 [Chem. Abstr. 1973, 78,58104].4 Braunholtz, J. T.; Mann, F. G. J. Chem. Soc, 1953, 1817.5 Peterli, H. J.; Switzerland, B.-L. US3231601, 1966 [Chem.Abstr. 1972, 60, 2980].6 Amore, K. M.; Leadbeater, N. E.; Kristen.; Miller, T. A.;Schmink, J. R. Tetrahedron Lett. 2006, 47, 8583.7 Ross, J. M.; Farm, C.; Del, W. US3496213, 1970[Chem.Abstr. 1972, 72, 90105].8 Zhong, W.-H.; Zhang, Y.-M. Chin. J. Org.Chem. 2000, 20,747 (in Chinese).(钟为慧, 张永敏, 有机化学, 2000, 20, 749.)9 Smith, P. A. S.; Yu, T. Y. J. Am. Chem. Soc. 1952, 74,1096.10 Heininger, S. A. J. Org. Chem. 1957, 22, 1213.11 Braunholtz, J. T.; Mann, F. G. J. Chem. Soc. 1954, 651.12 Gimbert, C.; Moreno-Manas, M.; Perez, E.; Vallribera, A.Tetrahedron2007, 63, 8305.13 Zhao, Y. Fine Chem. Ind. 2001, 31, 29 (in Chinese).(赵莹, 精细化工中间体, 2001, 31, 29.)14 Zhao, Y. Chem. Eng. 2001, 83, 13 (in Chinese).(赵莹, 化学工程师, 2001, 83, 13.)15 Zhao, Y. CN 1342645, 2003 [Chem. Abstr. 2003, 138,368528g].16 Zhao, Y.; Tan, X.-Y.; Yang, Z.; Li, J.-J. Chin. J. Org. Chem.2005, 25, 1469 (in Chinese).(赵莹, 谭晓燕, 杨志, 李姣娟, 有机化学, 2005, 25, 1469.)17 Sun, X.-W.; Zhao, S.-Q. Acta Chim. Sinica2008, 66, 471(in Chinese).(孙学文, 赵锁奇, 化学学报, 2008, 66, 471.)18 Jiang, W.-W. Fine. Chem. 1997, 14, 46 (in Chinese).(蒋文伟, 精细化工, 1997, 14, 46.)(Y0803213 Zhao, X.; Zheng, G.)。


摘要摘要食人鱼洗液(Piranha Solution)一般是将浓硫酸(95%-98%)与浓过氧化氢溶液(30%)按照体积比3:1(也有其他比例)混合的洗液。
由于它自身的强氧化性,该洗液经常用于去除载体上的有机残留物。
在去除大多数的有机物质同时,食人鱼洗液往往在载体表面实行羟基化,使得载体表面上极其亲水。
H2SO4 + H2O2 →H3O+ + HSO4− + O。
作为强酸和强氧化剂的食人鱼洗液,危险性较大。
在使用食人鱼洗液之前,需要使用更为稳妥的方式对载体进行清洗,如使用浓硫酸等。
食人鱼洗液具有爆炸性,在溶液配置的时候也会放出大量的热。
当过氧化氢浓度超过50%时,溶液配制过程中便会发生爆炸,因而一般使用30%过氧化氢进行配制。
洗液若与有机溶剂接触时亦会发生爆炸。
向洗液中放置有有机物残留的载体时切忌一定要缓慢放置。
存放食人鱼洗液也不可使用密封容器,以防爆炸。
用毕的食人鱼洗液不能随意堆放,应当用大量水稀释后集中存放。
食人鱼溶液常用来清洗玻片,也称SPM技术。
论文介绍了Piranha的组成,优点,安全性以及净化玻片的实验过程和原理。
净化玻片后,就是对它的表面改性,论文介绍了硅烷偶联剂的种类,组成和偶联机理以及它的具体应用,记录了实验的过程,从实验中探究了硅烷偶联剂在偶联过程中适宜的加热温度和加热时间,以及偶联剂的最佳用量。
芳香族伯胺和亚硝酸作用(在强酸介质下)生成重氮盐的反应标为重氮化(一般在低温下进行,伯胺和酸的mol比是:1:2.5),芳伯胺常称重氮组分,亚硝酸为重氮化剂,因为亚硝酸不稳定,通常使用亚硝酸钠和盐酸或硫酸使反应时生成的亚硝酸立即与芳伯胺反应,避免亚硝酸的分解,重氮化反应后生成重氮盐。
关键词:Piranha溶液羟基化亲水性硅烷偶联剂偶联机理疏水性AbstractAbstractpiranha solution ( Piranha Solution ) is generally concentrated sulfuric acid (95%-98% ) and hydrogen peroxide solution (30%) according to the volume ratio of 3:1( there are other proportion mixed lotion ). Due to its strong oxidizing, the eluent is often used to remove the carrier of organic residues. In the removal of most of the organic material at the same time, piranha solution is often on the surface of the carrier to implement hydroxylation, makes the carrier surface extremely hydrophilic. H2SO4 + H2O2 →H3O+ + HSO4−+ O。

荧光素的全合成祝曙英;吴奇;林成刚;陈书艳;史海健【摘要】设计了一条新的萤火虫荧光素(6)的全合成路线.以对甲氧基苯胺为起始原料,经酰胺化、硫代、水解、铁氰化钾氧化等反应构筑苯并噻唑环得到6-甲氧基苯并噻唑-2-甲酸(2).首次采用一锅法对2进行酰氯-酰胺化后,经脱水制得关键中间体2-氰基-6-甲氧基-苯并噻唑(4);4经脱甲基、与D-半胱氨酸盐酸水合物反应合成了6,总收率20%,100%ee.其结构经UV,1H NMR,FT-IR和MS表征.【期刊名称】《合成化学》【年(卷),期】2010(018)005【总页数】3页(P633-635)【关键词】萤火虫荧光素;2-氰基-6-羟基苯并噻唑;全合成【作者】祝曙英;吴奇;林成刚;陈书艳;史海健【作者单位】南京工业大学,化学化工学院,江苏,南京,210009;南京工业大学,化学化工学院,江苏,南京,210009;南京工业大学,化学化工学院,江苏,南京,210009;南京工业大学,化学化工学院,江苏,南京,210009;南京工业大学,化学化工学院,江苏,南京,210009【正文语种】中文【中图分类】O626.25生物体发光[1]俗称有生命的光,是化学发光反应中的一种特殊类型,是一种非常高能效的发光体系。
萤火虫荧光素(6)存在于萤火虫的发光细胞中,由于其对ATP(三磷酸腺甙)十分敏感,可用于ATP的含量检测[2,3]。
天然的6产量极小,无法满足日益增长的需求,通过化学方法合成6显得尤为必要。
在已知的四种合成6的方法中,Seto合成路线[4]由于原料氨甲酰硫代羰基硫代乙酸必须随用随制备,且总收率较低(6.5%),限制了其应用;White改进路线[5](21%)和Yoshiaki路线[6](34%)总收率相对较高,但合成中用到KCN或CuCN,毒性较大;White早期路线[7,8]起始原料简单易得,但路线较长,总产率仅5.8%。
本文设计了一条更为简短的合成6的新路线。

Feb.2015精细与专用化学品第23卷第2期Fine and Specialty Chemicals 2015年2月 收稿日期:2015-01-04 作者简介:邬春雷(1981-),男,主要从事精细化学品的合成研究。
技术进展奥美拉唑中间体2-巯基-5-甲氧基-1 H-苯并咪唑的工艺改进邬春雷1,刘克垒1,马东来2(1.雷翁化工科技(上海)有限公司,上海201906;2.河北中医学院药学院,河北石家庄050200)摘 要:介绍了经改进的奥美拉唑中间体2-巯基-5-甲氧基-1 H-苯并咪唑的合成工艺。
以对甲氧基苯胺为原料,经胺基保护、硝化、水解得到4-甲氧基-2-硝基苯胺,再经Pd/C催化下还原后,直接与CS2缩合成环反应制得奥美拉唑重要中间体2-巯基-5-甲氧基-1 H-苯并咪唑。
对实验过程中的硝化反应和催化还原反应的条件进行了探讨。
该方法具有反应条件温和、操作简便、环境污染小的特点,适合工业化生产。
关键词:奥美拉唑;2-巯基-5-甲氧基-1 H-苯并咪唑;催化加氢;合成Improvement on synthetic technology of 2-mercapto-5-methoxy-1 H-benzimidazoleWU Chun-lei1,LIU Ke-lei1,MA Dong-lai2(1.Raven Chem Science(Shanghai)Co.,Ltd.,Shanghai 201906,China;2.College of Pharmacy,Hebei College of Chinese Medicine,Shijiazhuang 050200,China)Abstract:The synthetic process of 2-mercapto-5-methoxy-1 H-benzimidazole which is the intermediate of Ome-prazole was introduced.4-methoxy-2-nitrophenyl amine was obtained using p-anisidine as the raw material by pro-tecting of amino-group,nitrifying,hydrolysizing acylamide,and than with catalytic hydrogenation and cyclizating,to synthesize 2-mercapto-5-methoxy-1 H-benzimidazole in the end.The synthesis method is improved,has a morehigh yield and can be used for industry.Key words:omeprazole;2-mercapto-5-methoxy-1 H-benzimidazole;catalytic hydrogenation;synthesis 奥美拉唑(Omeprazole),化学名为5-甲氧基-2-{〔(4-甲氧基-3,5-二甲基-2-吡啶基)甲基〕亚磺酰基}-1 H-苯并咪唑,是第一个上市的质子泵抑制剂。

阿哌沙班的合成张涛;孔令金;丁珊珊;刘新泳【摘要】Objective To synthesize of apixaban. Methods Apixaban was synthesized from p - anisidine by substitu-tion,cycloaddition,reduction and amination. Results Apixaban was synthesized with inexpensive and readily available cat-alyst and the total yield of the target compound was 10% . Conclusion The process was suitable for industrial production.%目的:合成阿哌沙班。
方法以对甲氧基苯胺为原料经胺基取代、环加成、催化以及胺化得到产品阿哌沙班。
结果用廉价原料合成了阿哌沙班,总收率10%。
结论该工艺适合工业化生产。
【期刊名称】《药学研究》【年(卷),期】2014(000)009【总页数】2页(P550-551)【关键词】阿哌沙班;合成;抗凝血【作者】张涛;孔令金;丁珊珊;刘新泳【作者单位】山东齐都药业有限公司,山东省脑神经质糖类药物重点实验室,山东临淄 255400; 山东大学药学院,山东济南 250012;山东齐都药业有限公司,山东省脑神经质糖类药物重点实验室,山东临淄 255400;山东齐都药业有限公司,山东省脑神经质糖类药物重点实验室,山东临淄 255400;山东大学药学院,山东济南 250012【正文语种】中文【中图分类】TQ460.31阿哌沙班(Apixaban)是一种口服的选择性活化Ⅹ因子抑制剂,由辉瑞与百时美施贵宝联合开发,2012年12月FDA批准了该药在美国上市。
笔者参考相关文献[1~8],以对甲氧基苯胺为原料经胺基取代得到(2Z)-氯[(4-甲氧基苯基)亚肼基]乙酸乙酯,经过环加成得到中间体6-(4-碘苯基)-1-(4甲氧基苯基)-7-氧代-4,5,6,7-四氢-1H吡唑并[3,4-c]吡啶-3-乙酸乙酯,再经过催化得到1-(4-甲氧基苯基)-7-氧代-6-[4-(2-氧代哌啶-1-基)苯基]-4,5,6,7-四氢-1H-吡唑并[3,4-c]吡啶-3-乙酸乙酯,最后经过胺化得到产品阿哌沙班,该法原料易得,反应条件温和,易于工业化生产,合成路线如图1。
习题解答第1章绪论1.价键理论和分子轨道理论都是关于分子如何构成的理论。
价键理论主要关注于σ键和π键的形成,通过研究受成键情况影响的轨道形状描述分子的形状。
分子轨道理论研究电子在整个分子中的运动状况,用成键轨道、非键轨道和反键轨道来描述分子的形成。
2.u=78/12+1=6, C6H 63.均裂,发生游离基型反应,异裂,发生离子型反应。
第2章烷烃1.(1)3-甲基戊烷(2)3-甲基-3-乙基己烷2.3.(1)CH3C CH2CH3CH3CH32,2- 二甲基丁烷(2)CH2CH3C2H5C CH CH3CH3CH32, 3- 二甲基3-乙基戊烷(3)CH CHCH3CH3CH2CHCH3CH3(CH3)3C2,2,3,5,6-五甲基庚烷4.(1)CH3CCH3CH3CH3(2)CH2CH2CH3CH3CH2(3)CH2CHCH3CH3CH3(4)CH3CCH3CH3CH35. (1)第3章烯烃与红外光谱1.答:(1)1-己烯(2)2-己烯(3)己烯(4) 2-甲基-1-戊烯(5) 3-甲基-1-戊烯(6)4-甲基-1-戊烯(7) 2-甲基-2-戊烯(8) 3-甲基-2-戊烯(9)4-甲基-2-戊烯CH3CHC=CH2CH33CH3CCH=CH2CH3CH3CH3C=CCH33CH3CH3CH2C=CH2CH2CH3(10) 2,3-二甲基-1-丁烯(11)3,3-二甲基-1-丁烯 (12) 2,3-二甲基-2-丁烯 (13) 2-乙基-1-丁烯其中(2)、(3)、(8)、(9)有顺反异构。
2.答:(1)(2) (3) (4)(5) (6) (7)3.答:无顺反异构4.答:5.答:1)ClI 2)500ClClOH℃3)OH4) or 5)Br 第4章炔烃与共轭双烯1.答:(1)2,2,5-三甲基-3-己炔(2)1,3-己二烯-5-炔(3)5-庚烯-1,3-二炔(4)(5)H(6)2. 答: (1)HHNH Na/乙醚Na H322T.M(2)(3) HH 2CuCl /NH Cl Br22(4)2HHNaHCH CH Br2HCl3.答: (1) (2)(3)和(4) 有,但不是只有它。
多糖含量测定的几种不同方法比较系别:信息学院专业:生物工程学号:姓名:指导教师:指导教师职称: 讲师多糖含量测定的几种不同方法比较摘要:本文综述了多糖含量测定的几种常用方法,主要有苯酚-硫酸法、3, 5-二硝基水杨酸法(简称DNS法)、蒽酮-硫酸法、色谱法、红外光谱定量分析多糖法等。
并对这些方法的优缺点进行了分析和比较。
这些方法可为多糖含量测定提供一定的参考,并为多糖含量测定的更深入研究提供一定的理论基础。
关键词:多糖;含量;测定;方法A review of different methodsto the determination of polysaccharidesAbstract: Paper reviewed some different methods to the determination of polysaccharides, in it phenol-vitriol method, 3, 5-two nitro salicylic acid (DNS) method, anthrone-vitriol method, chromatography, infrared spectrum quantitative analysis and etc had been dealed with. And the advantages and disadvantages of these methods are analyzed and compared. It provided some related information and based theories to the determination of polysaccharides content.Key words:polysaccharides; content; determination; methods目录中文摘要 (I)英文摘要 (II)1前言 (1)2化学法测定多糖含量 (1)2.1苯酚-硫酸法 (1)2.2 3, 5-二硝基水杨酸法(简称DNS法) (2)2.3蒽酮-硫酸法 (2)3色谱法测定多糖含量的研究 (3)3.1气相色谱法(GC) (3)3.2 液相色谱法(HPLC) (3)3.3薄层色谱法(TLC) (4)4其他方法 (4)4.1红外光谱定量分析多糖法 (4)4.2生物传感器法 (5)5结论 (5)6展望 (6)参考文献 (6)致谢 (9)1前言多糖(polysaccharides,PS)是由10个以上的单糖聚合而成的生物高分子[1]。
19种苯胺类化合物苯胺类化合物是一类含有苯胺基的有机化合物,它们具有各种不同的结构和性质。
以下是一些常见的苯胺类化合物:1. 苯胺(Aniline),最简单的苯胺类化合物,是一种无色至黄色液体,常用于染料和橡胶生产。
2. 二甲苯胺(Dimethylaniline),含有两个甲基基团的苯胺衍生物,常用作有机合成中间体。
3. 三甲苯胺(Trimethylaniline),含有三个甲基基团的苯胺衍生物,具有多种工业用途,如染料和颜料的生产。
4. 甲基苯胺(Methylaniline),含有一个甲基基团的苯胺衍生物,常用作染料和农药的合成原料。
5. 乙基苯胺(Ethylaniline),含有一个乙基基团的苯胺衍生物,常用于有机合成和染料工业。
6. 正丙基苯胺(n-Propylaniline),含有一个正丙基基团的苯胺衍生物,在染料和颜料工业中有应用。
7. 异丙基苯胺(Isopropylaniline),含有一个异丙基基团的苯胺衍生物,常用于染料和橡胶生产。
8. 正丁基苯胺(n-Butylaniline),含有一个正丁基基团的苯胺衍生物,在有机合成和染料工业中有一定用途。
9. 异丁基苯胺(Isobutylaniline),含有一个异丁基基团的苯胺衍生物,具有一定的工业应用价值。
10. 氯苯胺(Chloroaniline),苯胺的氯取代衍生物,常见的有邻氯苯胺、间氯苯胺和对氯苯胺。
11. 溴苯胺(Bromoaniline),苯胺的溴取代衍生物,常见的有邻溴苯胺、间溴苯胺和对溴苯胺。
12. 硝基苯胺(Nitroaniline),苯胺的硝基取代衍生物,常见的有邻硝基苯胺、间硝基苯胺和对硝基苯胺。
13. 甲基氨基苯(Methoxyaniline),苯胺的甲氧基取代衍生物,常见的有邻甲氧基苯胺、间甲氧基苯胺和对甲氧基苯胺。
14. 乙基氨基苯(Ethoxyaniline),苯胺的乙氧基取代衍生物,在染料和颜料工业中有应用。
对甲氧基苯胺化学品安全技
术说明书
第一部分:化学品名称化学品中文名称:对甲氧基苯胺 化学品英文名称:p-methoxyaniline 中文名称2:对茴香胺 英文名称2:p-anisidine 技术说明书编码:1218CAS No.:
104-94-9 分子式:
C 7H 9NO 分子量:123.16第二部分:成分/组成信息
有害物成分含量CAS No.第三部分:危险性概述健康危害:吸入、摄入或经皮肤吸收对身体有害。
对皮肤有刺激作用。
其蒸气或气溶胶对眼睛、粘膜、呼吸道有刺激作用。
进入体内导致形成高铁血红蛋白而引起紫绀。
慢性影响:可引起呼吸系统、皮肤的过敏反应。
燃爆危险:本品可燃,有毒,具刺激性,具致敏性第四部分:急救措施皮肤接触:脱去污染的衣着,用大量流动清水冲洗眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。
就医。
吸入:迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
如呼吸停止,立即进行人工呼吸。
就医。
食入:饮足量温水,催吐。
洗胃,导泄。
就医第五部分:消防措施危险特性:遇明火、高热可燃。
与强氧化剂接触可发生化学反应。
受高热分解放出有毒的气体。
有害燃烧产物:一氧化碳、二氧化碳、氧化氮。
灭火方法:消防人员须佩戴防毒面具、穿全身消防服,在上风向灭火。
灭火剂:雾状水、泡沫、干粉、二氧化碳、砂土。
第六部分:泄漏应急处理应急处理:隔离泄漏污染区,限制出入。
切断火源。
建议应急处理人员戴防尘面具(全面罩),穿防毒服。
用洁净的铲子收集于干燥、洁净、有盖的容器中,转移至安全场所。
若大量泄漏,收集回收或运至废物处理场所处置。
第七部分:操作处置与储存
有害物成分 含量 CAS No.:
对甲氧基苯胺 104-94-9
操作注意事项:密闭操作,提供充分的局部排风。
操作人员必须经过专门培训,严格遵守操作规程。
建议操作人员佩戴自吸过滤式防尘口罩,戴化学安全防护眼镜,穿防毒物渗透工作服,戴橡胶手套。
远离火种、热源,工作场所严禁吸烟。
使用防爆型的通风系统和设备。
避免与氧化剂、酸类接触。
搬运时要轻装轻卸,防止包装及容器损坏。
配备相应品种和数量的消防器材及泄漏应急处理设备。
倒空的容器可能残留有害物。
储存注意事项:储存于阴凉、通风的库房。
远离火种、热源。
保持容器密封。
应与氧化剂、酸类等分开存放,切忌混储。
配备相应品种和数量的消防器材。
储区应备有合适的材料收容泄漏物。
第八部分:接触控制/个体防护中国M AC (m g /m3):未制定标准前苏联M AC (m g /m3):未制定标准TLVT N:OSHA 0.5m g /m3[皮]; AC GI H 0.1ppm ,0.5m g /m3[皮]TLVW N:未制定标准工程控制:严加密闭,提供充分的局部排风。
提供安全淋浴和洗眼设备。
呼吸系统防护:空气中粉尘浓度超标时,必须佩戴自吸过滤式防尘口罩。
紧急事态抢救或撤离时,应该佩戴空气呼吸器。
眼睛防护:戴化学安全防护眼镜。
身体防护:穿防毒物渗透工作服。
手防护:戴橡胶手套。
其他防护:工作现场禁止吸烟、进食和饮水。
及时换洗工作服。
工作前后不饮酒,用温水洗澡。
实行就业前和定期的体检。
第九部分:理化特性主要成分:纯品外观与性状:熔融状的固体。
熔点(℃):57.2沸点(℃):242相对密度(水=1): 1.09相对蒸气密度(空气=1):无资料饱和蒸气压(kP a ):1.73)燃烧热(kJ /mol ):无资料临界温度(℃):无资料临界压力(MP a ):无资料辛醇/水分配系数的对数值:无资料闪点(℃):无资料引燃温度(℃):515爆炸上限%(V /V):无资料爆炸下限%(V /V):无资料溶解性:微溶于水,溶于乙醇、乙醚、丙酮、苯等多数有机溶剂。
主要用途:
主要用于制取冰染染料,也作为医药中间体。
第十部分:稳定性和反应活性禁配物:强氧化剂、强酸、酸酐、酰基氯。
避免接触的条件:光照。
第十一部分:毒理学资料LD50:1400 m g /kg(大鼠经口);3200m g /kg(大鼠经皮)L C 50:无资料第十二部分:生态学资料第十三部分:废弃处置废弃物性质废弃处置方法:用焚烧法处置。
焚烧炉排出的氮氧化物通过洗涤器除去。
第十四部分:运输信息危险货物编号:61784 U N编号:2431包装方法:小开口钢桶;螺纹口玻璃瓶、铁盖压口玻璃瓶、塑料瓶或金属桶(罐)外普通木箱;螺纹口玻璃瓶、塑料瓶或镀锡薄钢板桶(罐)外满底板花格箱、纤维板箱或胶合板箱。
运输注意事项:运输前应先检查包装容器是否完整、密封,运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。
严禁与酸类、氧化剂、食品及食品添加剂混运。
运输途中应防曝晒、雨淋,防高温。
第十五部分:法规信息法规信息:化学危险物品安全管理条例 (1987年2月17日国务院发布),化学危险物品安全管理条例实施细则 (化劳发[1992] 677号),工作场所安全使用化学品规定([1996]劳部发423号)等法规,针对化学危险品的安全使用、生产、储存、运输、装卸等方面均作了相应规定;常用危险化学品的分类及标志 (G B 13690-92)将该物质划为第6.1 类毒害品。
急性毒性:
这部分暂无资料。