离子方程 式
H++OHH2O
H++OHH2O
H++OHH2O
H++OHH2O
两种方程式 的异同
4 个反应的化学方 程式不同,但其离 子方程式却相同
结论:强酸与强碱发生中和反应的实质是,强酸电离出的H+与强 碱电离出的OH-结合生成H2O。
知识铺垫
新知预习
自主测试
课前篇自主预习
②离子方程式的意义
离子方程式不仅可以表示某个具体的化学反应,还可以表示同一 类型的离子反应。
课前篇自主预习
1.复分解反应是指两种化合物互相交换成分,生成另外两种化合 物的反应。其发生的条件为生成沉淀、放出气体或生成水。
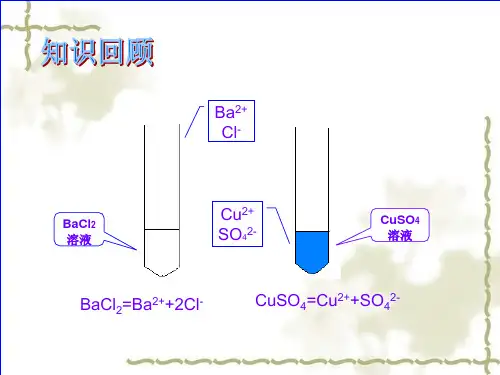
2.写出a.H2SO4、b.NaOH、c.BaCl2在水溶液中的电离方程式:
a.H2SO4 b.NaOH
2H++SO42-; Na++OH-;
c.BaCl2 Ba2++2Cl-。
(1)a和b两溶液混合后发生反应的化学方程式为
H2SO4+2NaOH=Na2SO4+2H2O; (2)a和c两溶液混合后发生反应的化学方程式为
H2SO4+BaCl2=2HCl+BaSO4↓; (3)b和c两溶液混合不能(填“能”或“不能”)发生复分解反应,原因
是二者混合无气体、沉淀或水生成。
课前篇自主预习
(6)错误,HCO3- 为弱酸酸式酸根离子,不能拆成 H+和 CO32-。 (7)错误,Fe与盐酸反应生成Fe2+。
课前篇自主预习
知识铺垫
新知预习
自主测试
2.下列离子方程式书写正确的是( ) A.盐酸与碳酸钡反应: CO32-+2H+ CO2↑+H2O B.硫酸铜溶液中滴加氢氧化钠溶液:



![《离子反应》PPT教学课件[优秀课件]](https://uimg.taocdn.com/fa4e595fda38376baf1faec7.webp)