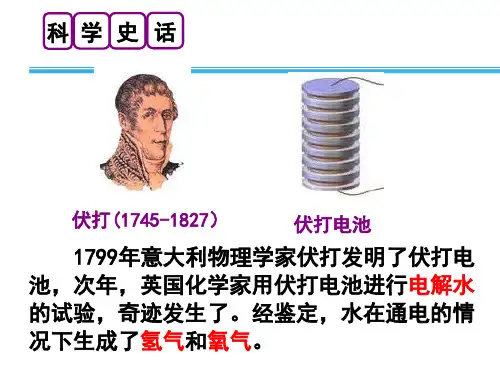
e- 外加直流 e-
电源
失去e-
与电源正极相连 发生氧化反应
阳极
移
向
阴离子
得到 e-
阴极
移 向
电解质 溶液 阳离子
与电源负极相连 发生还原反应
电解原理示意图
3.电解池的工作原理
①电极。 阳极:与电源 正极 相连, 失去 阴极:与电源 负极 相连, 得到
电子,发生 氧化 电子,发生 还原
反应。 反应。
二、教学过程
1.电解、电解池
(1)电解:使电流通过电解质溶液(或熔融的电解质)而在阴、 阳两极引发氧化还原反应的过程。
(2)电解池:是把电能转化为化学能的装置。
2.构成条件
(1)有外接直流电源 (2)有与电源正负极相连的两个电极 (3)电解质溶液或熔融电解质 (4)形成闭合回路
3.电解池的工作原理
(2)总反应(化学方程式):2H2O 2H2↑+O2↑
例3:根据右图书写用惰性电极电解硫酸铜的电极反应和 总反应方程式。(a、b为惰性电极)
(1)电极反应
阳极:(OH-(水) >SO42- ) 4OH--4e-=== 2H2O + O2↑(氧化反应); 2H2O-4e- === O2↑+ 4H+ 放氧生酸
例1:试分析用惰性电极电解CuCl2溶液时的电极反应和总反应。
阴极:[H+(水)>Mg2+>Na+>K+]
1电8解.池生工活作中原处S理处2及-存其在>应化I用学-,>下B列r说-法>不正C确l-的是>(OH) -(碱、水)>最高价含氧酸根离子(CO32- 、 NO3-、 SO42-)
下列有关说法不正确的是
②电子和离子的移动方向。 电子:从电源 负极 流出后,流向电解池的 阴极 ;