溶液质量分数的计算
- 格式:ppt
- 大小:246.00 KB
- 文档页数:7

溶液质量分数的符号
溶液质量分数,也被称为质量百分比浓度,常用希腊字母ω(小写的)来表示。
不过,由于ω与英文字母w相似,通常在非规范环境下,人们也会用w来表示。
该符号的定义是:ω(溶液)=m(溶质)/[m(溶剂)+m(溶质)]×100%= m(溶质)/m(溶液)×100%。
其中,m(溶质)表示溶质的质量,m(溶剂)表示溶剂的质量,m(溶液)表示溶液的质量。
此外,质量分数还可以用于描述化合物中各原子相对原子质量(需乘系数)与总式量的比值,即某元素在某物质中所占比例。
例如,对于物质Fe2O3(氧化铁),Fe的质量分数为:562/160100%=70%。
以上信息仅供参考,如有需要,建议您查阅相关文献或咨询相关专业技术人员。

有关溶液中溶质质量分数的计算姓名一、计算类型:1、关于溶质质量分数概念的计算。
2、溶液质量、体积、溶质质量间的换算。
3、溶液稀释(或浓缩)、混合的计算.4、化学方程式与溶质质量分数的综合计算.二、主要内容:1、理解溶质质量分数的数学表达式:溶质质量溶质质量溶质质量分数=== —--——×100 %=== —————————×100%溶液质量溶质质量+溶剂质量溶质质量=== -———-—---—×100%溶液体积×溶液密度溶液稀释或浓缩:溶液中溶质质量保持不变。
(稀释: 用水稀释; 浓缩:蒸发溶剂)⑴、M浓× P浓% ======== M稀× P稀%⑵、V浓þ浓P浓% ======== V稀þ稀P稀%其中: M-溶液质量 V—溶液体积þ—溶液密度P%—-溶液中溶质质量分数⑶、稀释时加水或浓缩时蒸去水的质量(ΔM水)为稀溶液与浓溶液的质量之差。
即:ΔM水 === M稀— M浓2、同种溶质、不同质量分数的溶液混合时,量间的关系为:M浓× P浓% + M稀× P稀% ==== ( M浓 + M稀)×P混%4、化学反应后生成物溶液中溶质质量分数的计算.反应后生成物溶液中溶质质量溶质质量分数=== —-————————————×100%生成物溶液质量反应后生成物溶液中溶质质量=== —-—-——-————————--————--——×100%反应前各物质质量总和- 生成气体质量- 生成沉淀质量所得溶液的质量=反应前溶液的质量+反应掉的固体或气体质量- 生成气体或生成沉淀质量第一类型:练习、①、有食盐溶液100克,其中水96克,求食盐溶液中食盐的质量分数?②、 200克氯化钠溶液中含氯化钠10克,求溶液中氯化钠的质量分数?③计算在80克质量分数为15%的NaNO3溶液里含有NaNO3多少克。

溶液的质量分数公式1. 溶液质量分数公式。
- 溶质质量分数=(溶质质量)/(溶液质量)×100%- 其中,溶液质量 = 溶质质量+溶剂质量。
- 例如,将10g氯化钠(溶质)溶解在90g水中(溶剂),则溶液质量为10g + 90g=100g,溶质质量分数=(10g)/(100g)×100% = 10%。
2. 相关计算类型。
- 已知溶质和溶剂质量求溶质质量分数。
- 按照上述公式直接计算即可。
如25g硝酸钾溶解在125g水中,溶质质量分数=(25g)/(25g + 125g)×100%=(25g)/(150g)×100%=(1)/(6)×100%≈16.7%。
- 已知溶液质量和溶质质量分数求溶质质量。
- 溶质质量=溶液质量×溶质质量分数。
例如,有200g溶质质量分数为15%的蔗糖溶液,其中蔗糖(溶质)质量为200g×15% = 30g。
- 已知溶质质量和溶质质量分数求溶液质量。
- 溶液质量=(溶质质量)/(溶质质量分数)。
有5g氢氧化钠,要配制溶质质量分数为10%的氢氧化钠溶液,则溶液质量为(5g)/(10%)=50g。
- 溶液稀释问题。
- 稀释前后溶质质量不变。
设浓溶液质量为m_1,溶质质量分数为w_1,稀释后溶液质量为m_2,溶质质量分数为w_2,则m_1× w_1=m_2× w_2。
例如,将100g溶质质量分数为98%的浓硫酸稀释成溶质质量分数为20%的稀硫酸,设稀释后溶液质量为x,则100g×98%=x×20%,解得x = 490g,需要加入水的质量为490g - 100g = 390g。

溶液物质的量分数,密度,质量分数之间的关系
溶液物质的量分数、密度和质量分数之间的关系可以用以下公式表示:
物质的量分数(X)= 物质的质量(m)/ 溶液的总质量(mixture)
物质的量分数(X)= 物质的摩尔质量(M)×物质的摩尔数(n)/ 溶液的总摩尔质量(Mixture)
密度(ρ)= 溶液的总质量(mixture)/ 溶液的体积(V)
物质的质量分数(w)= 物质的质量(m)/ 溶液的总质量(mixture)
由上述公式可以得出以下关系:
物质的质量分数(w)= 物质的量分数(X) ×物质的摩尔质量(M)/ 溶液的总摩尔质量(Mixture)
物质的质量分数(w)= 密度(ρ)/ 物质的摩尔质量(M)×溶液的总摩尔质量(Mixture)
物质的质量分数(w)= 密度(ρ)/ 溶液的体积(V)。

溶液的浓度和颗粒数浓度的计算步骤1.溶液的定义:溶液是由溶剂和溶质组成的均匀透明的混合物。
其中,溶剂是溶解度较大的物质,溶质是溶解度较小的物质。
2.溶液的浓度:溶液的浓度表示单位体积或单位质量的溶液中溶质的含量。
常用的浓度表示方法有质量分数、摩尔浓度等。
3.质量分数的计算:质量分数是指单位质量的溶液中溶质的质量与溶液总质量之比。
计算公式为:质量分数(%)=(溶质的质量 / 溶液的总质量)× 100%4.摩尔浓度的计算:摩尔浓度是指单位体积的溶液中溶质的物质的量(摩尔数)。
计算公式为:摩尔浓度(mol/L)= 溶质的物质的量(mol)/ 溶液的体积(L)5.颗粒数浓度的计算:颗粒数浓度是指单位体积的溶液中溶质颗粒的数目。
计算公式为:颗粒数浓度(个/L)= 溶质颗粒的数目 / 溶液的体积(L)6.溶液的配制:配制溶液时,首先称量一定质量的溶剂,然后将溶质加入溶剂中,搅拌均匀,直至溶质完全溶解。
7.溶液的稀释:稀释溶液时,可以向溶液中加入适量的溶剂,使溶液的体积增加,从而降低溶液的浓度。
8.溶液的浓度换算:在不同浓度单位之间进行换算时,可以根据相应的换算公式进行计算。
例如,从质量分数换算到摩尔浓度,需要先将质量分数转换为物质的量浓度,再进行换算。
9.溶液的浓度测量:可以使用不同的方法测量溶液的浓度,如滴定法、光谱法、质谱法等。
10.溶液的浓度应用:溶液的浓度在化学实验、医药、食品等领域有广泛的应用,如配制药物、检测物质含量等。
以上是关于溶液的浓度和颗粒数浓度的计算步骤的知识点介绍。
习题及方法:1.习题:某溶液的质量为100g,其中溶质的质量为5g,求该溶液的质量分数。
解题方法:根据质量分数的计算公式,代入数据进行计算。
质量分数(%)=(溶质的质量 / 溶液的总质量)× 100%=(5g / 100g)× 100%答案:该溶液的质量分数为5%。
2.习题:某溶液的体积为500mL,其中溶质的物质的量为0.2mol,求该溶液的摩尔浓度。

有关溶液中溶质质量分数的计算溶液是由溶质和溶剂组成的混合物。
溶质是指能溶解于溶剂中的物质,而溶剂是指能够溶解其他物质的物质。
溶液中溶质的质量分数是指溶液中溶质的质量与溶液总质量之比。
计算溶液中溶质的质量分数可以通过下面的公式来实现:质量分数(%)=(溶质的质量÷溶液的质量)×100%举例来说,如果我们有100g的溶液,其中包含30g的溶质,那么溶质的质量分数可以通过下面的计算来得到:质量分数(%)=(30g÷100g)×100%=30%这意味着该溶液中溶质的质量占总质量的30%。
通过这种计算,我们可以了解到溶液中溶质的含量。
此外,还有一种常用的计算溶液中溶质质量分数的方法:已知溶质的质量与溶剂的质量比,我们可以根据溶质与溶剂的总质量,计算出溶液中溶质的质量分数。
假设我们有一个溶液,其中溶质和溶剂的质量比为1:4,溶液的总质量为200g。
我们可以通过下面的步骤来计算出溶质的质量分数:首先,我们需要确定溶质和溶剂的质量。
根据质量比1:4,我们可以得出溶质的质量为:溶质质量=(溶液总质量÷(溶质质量比+1))×溶质质量比=(200g÷(1+4))×1=40g溶剂的质量为溶液的总质量减去溶质的质量:溶剂质量=溶液总质量-溶质质量=200g-40g=160g接下来,我们可以计算溶质的质量分数:质量分数(%)=(溶质的质量÷溶液的质量)×100%=(40g÷200g)×100%=20%这意味着该溶液中溶质的质量占总质量的20%。
溶质的质量分数可以帮助我们了解溶液中溶质的含量。
在化学实验和工业生产中,常常需要调整溶液的溶质含量,而溶质的质量分数可以作为一个重要的参考。
需要指出的是,溶质的质量分数仅仅是描述了溶质在溶液中的含量,对于溶质与溶剂之间的相互作用没有直接的关系。
为了更全面地了解溶液的性质,还需要考虑其他因素,如溶液的浓度、溶液的pH值等。

怎样计算溶液的质量分数?怎样计算溶液的质量分数?溶液中溶质的质量分数是溶质质量与溶液质量之比。
为了帮助同学们攻克这一难题,小编整理了一些计算溶液的质量分数的方法,希望对同学们学习有帮助。
1溶液的质量分数计算方式①化学方程式下相对应的物质质量不能直接写溶液质量,而要写参加化学反应的溶质实际质量。
②若已知溶液的体积或求溶液的体积,要用m=ρV这个公式进行换算。
③单位要统一。
④若溶质全部溶于水,且不与水发生化学反应,直接利用上述计算公式进行计算。
⑤若溶质虽不与水反应,但没有全部溶解,则溶质质量只计算溶解部分,未溶解部分不能参与计算。
⑥若溶质溶于水时与水发生了化学反应,则溶液中的溶质就为反应后的生成物了。
溶液的质量分数计算公式溶液质量=m(反应)-m↓-m↑,此法较为简单,其m(反应)代表反应物(或溶液)质量总和,m↓表示不溶固体及生成沉淀的质量,m↑表示生成气体的质量。
饱和溶液的质量分数(C) =S/(100+S)*100%S=M质/M剂*100g溶质质量分数=(溶质的质量/溶液的质量) ×100%1计算溶液的质量分数注意事项 1.溶质的质量分数只表示溶质质量与溶液质量之比,并不代表具体的溶液质量和溶质质量。
2.溶质的质量分数一般用百分数表示。
3.溶质的质量分数计算式中溶质质量与溶液质量的单位必须统一。
4.计算式中溶质质量是指被溶解的那部分溶质的质量,没有被溶解的那部分溶质质量不能计算在内。
5.饱和溶液、不饱和溶液与溶质的质量分数的关系6.溶质的质量分数和饱和不饱和无直接关系,但在饱和溶液中,溶质的质量分数=溶解度/(溶解度+100g)。
浓溶液中溶质的质量分数大,但不一定。

理化检验浓度计算公式简算在理化检验中,浓度的计算是非常重要的。
浓度是指单位体积或单位质量内所含物质的量,通常用质量分数、体积分数、摩尔浓度等来表示。
在实验室中,我们经常需要根据实验结果计算出物质的浓度,以便进行后续的分析和判断。
下面我们将介绍一些常见的浓度计算公式,并给出简单的计算示例。
1. 质量分数。
质量分数是指溶液中溶质的质量与溶液总质量之比。
其计算公式为:质量分数 = 溶质质量 / 溶液总质量× 100%。
例如,有一瓶质量分数为5%的盐水溶液,其中溶质的质量为10g,溶液的总质量为200g,则可以通过以下公式计算出盐水的浓度:质量分数 = 10g / 200g × 100% = 5%。
2. 体积分数。
体积分数是指溶液中溶质的体积与溶液总体积之比。
其计算公式为:体积分数 = 溶质体积 / 溶液总体积× 100%。
例如,有一瓶体积分数为10%的酒精溶液,其中溶质的体积为50ml,溶液的总体积为500ml,则可以通过以下公式计算出酒精的浓度:体积分数 = 50ml / 500ml × 100% = 10%。
3. 摩尔浓度。
摩尔浓度是指溶液中溶质的摩尔数与溶液总体积之比。
其计算公式为:摩尔浓度 = 溶质的摩尔数 / 溶液的体积。
例如,有一瓶摩尔浓度为0.1mol/L的盐酸溶液,其中溶质的摩尔数为0.05mol,溶液的体积为500ml,则可以通过以下公式计算出盐酸的浓度:摩尔浓度 = 0.05mol / 0.5L = 0.1mol/L。
4. 溶解度。
溶解度是指在一定温度下,单位体积溶剂中最多可溶解的溶质的量。
其计算公式为:溶解度 = 溶质的质量 / 溶剂的体积。
例如,有一种在25℃下的氯化钠溶解度为360g/L的溶液,则可以通过以下公式计算出氯化钠的浓度:溶解度 = 360g / 1L = 360g/L。
通过以上的浓度计算公式和示例,我们可以看到,在理化检验中,浓度的计算并不复杂,只需要根据实际情况选择合适的计算公式,然后将已知的数据代入公式中进行计算即可。

化学质量分数的计算公式
其中,溶质质量是溶质的质量,溶液总质量是溶质和溶剂的总质量。
1.确定溶液的总质量:
溶液的总质量等于溶质的质量加上溶剂的质量。
溶质的质量可以称量得到,而溶剂的质量可以通过溶液的体积和密度来计算。
2.确定溶质的质量:
溶质的质量可以通过称量得到。
如果溶液中的溶质是固体,可以将溶质称入容器中,再加入适量的溶剂溶解;如果溶液中的溶质是液体,可以通过体积计算溶质的质量。
3.计算化学质量分数:
将溶质质量除以溶液总质量,并乘以100%即可得到化学质量分数。
保留两位小数可以使结果更精确。
例如,假设有100g的溶液中含有30g的溶质
w=(30g/100g)×100%=30%
需要注意的是,化学质量分数是一种相对数值,不同溶质或溶剂的化学质量分数不能直接进行比较。
在比较化学质量分数时,需要比较相同溶液中不同组分的化学质量分数,或者比较相同组分在不同溶液中的化学质量分数。
此外,还有一种类似的计算方式叫做摩尔分数,它是溶质的摩尔数与溶液中所有组分摩尔数之和的比值,计算公式为:
摩尔分数(x)=(溶质摩尔数/溶液中所有组分的摩尔数之和)
摩尔分数的计算方式与化学质量分数的计算方式类似,只是将质量换为摩尔数。
两种分数在计算上的区别主要在于溶液中组分的表达方式的不同。

溶液质量分数公式
1 溶液质量分数公式
溶液质量分数是指将溶液中的溶液分子的质量与溶液中所有物质的质量之比所得到的百分比,也叫作摩尔质量百分比。
溶液质量分数公式为:
溶液质量分数 (M)= 溶液分子质量 / 溶液中所有物质质量* 100 %
溶液质量分数公式能更好地计算和表示溶液浓度,在化学和其他学科中得以广泛应用,使更加准确的化学反应计算变得容易。
2 应用
1. 工业应用:溶液质量分数公式是工业生产中比较浓度的重要参数,常用于配制、分析中的样品配制,也经常用于解决浓度常不一致的问题,能精准地计算出制剂的最佳配比,从而避免浓度过大或过小而造成的损失。
2. 医学应用:溶液质量分数公式在医学领域很受欢迎,例如,用于计算静脉输液诊断,可以帮助医生确定给药的最佳浓度。
比如在制定某种药物的治疗剂量的时候,溶液质量分数公式可以用来计算出病人体内需要的治疗效果基本一致的剂量,而不受到浓度的影响。
3. 教学应用:溶液质量分数公式也广泛应用于学术研究。
学术报
告中使用溶液质量分数公式,可以更精确地研究不同物质及其可能用途,也能有利于说明反应实验以及来自物质的变化、物质的性质等等。
3 结论
溶液质量分数公式是一种简单实用的计算工具,化学和其他学科
的项目均有其广泛的应用,用它可以更容易地表示和计算溶液浓度,
从而为工业生产,医学治疗,教学研究等提供方便。
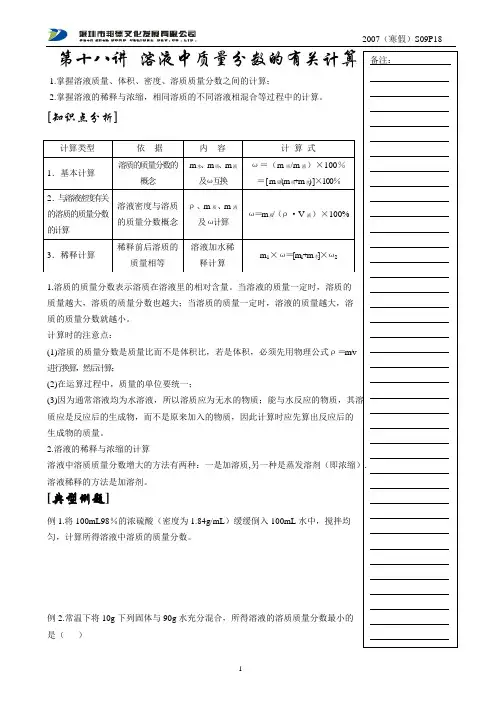
第十八讲 溶液中质量分数的有关计算1.掌握溶液质量、体积、密度、溶质质量分数之间的计算;2.掌握溶液的稀释与浓缩,相同溶质的不同溶液相混合等过程中的计算。
[知识点分析]1.溶质的质量分数表示溶质在溶液里的相对含量。
当溶液的质量一定时,溶质的质量越大,溶质的质量分数也越大;当溶质的质量一定时,溶液的质量越大,溶 质的质量分数就越小。
计算时的注意点:(1)溶质的质量分数是质量比而不是体积比,若是体积,必须先用物理公式ρ=m/v 进行换算,然后计算;(2)在运算过程中,质量的单位要统一;(3)质应是反应后的生成物,而不是原来加入的物质,因此计算时应先算出反应后的 生成物的质量。
2.溶液的稀释与浓缩的计算溶液中溶质质量分数增大的方法有两种:一是加溶质,溶液稀释的方法是加溶剂。
[典型例题]例1.将100mL98%的浓硫酸(密度为1.84g/mL )缓缓倒入100mL 水中,搅拌均 匀,计算所得溶液中溶质的质量分数。
例2.常温下将10g 下列固体与90g 水充分混合,所得溶液的溶质质量分数最小的 是( ) A.胆矾B.氧化钙C.氧化钠D.硝酸钾例3.一定量溶质质量分数为8%的食盐水蒸发掉50g 则原溶液中溶质的质量为例4. 在农业科研上,有时用10%~20%的氯化钠溶液来选种。
现需要30kg16%的氯 化钠溶液。
(1)若用氯化钠固体和水配制上述溶液,需要氯化钠的质量是 kg 水的质量是 kg (2)若用25%的氯化钠溶液和水配制上述溶液,需要 25%的氯化钠溶液的质量是 kg例5. 医疗上常用的生理盐水是质量分数为0.9%(密度约为13g cm /)的氯化钠 溶液。
500mL 的这种生理盐水中含氯化钠_______g ,水_________g 。
若以每分钟 50滴(20滴约为1mL )的速率给病人静脉输液500mL ,约需______分钟输完. 例6. 日常生活中我们要科学地节约用水。
现有一件刚用洗涤剂洗过的衣服, “拧干”后湿衣服上残留的溶液为100g ,其中含洗涤剂的质量分数为1%,则湿衣服上残留的洗涤剂的质量为____________g 。
溶液质量分数计算公式
1什么是溶液质量分数
溶液质量分数是一种反映某一时刻溶液中溶质和溶剂的重量比的概念,也可以称之为溶质比或溶质百分率,简称摩尔比,符号用φ表示。
它是描述某些物质的组成的重要指标,在具体计算中,它表示溶质在溶液中的量,并以相对单位进行计算。
2溶液质量分数的计算方法
溶液质量分数的计算方法可以根据具体需求分为两种不同的算法,分别是用体积计算和用质量计算。
用体积计算:溶液质量分数按体积计算时,用φ表示,则φ=V (溶质)/V(溶液)×100%,其中,V(溶质)和V(溶液)分别是溶质的体积和溶液的体积。
用质量计算:溶液质量分数按质量计算时,用φ表示,则φ=m (溶质)/m(溶液)×100%,其中,m(溶质)和m(溶液)分别是溶质的质量和溶液的质量。
3溶液质量分数的应用场景
溶液质量分数最具有实际意义的应用,来自于维护汽油配置技术,因为汽油在不经混合机和液体流体力学加处理的情况下,容易降低单质质量,而使汽油性质不满足机动车发动机要求。
此外,溶液质量分数的应用还得有所拓展,它可以用于分析无机溶液中的各种物质的相对含量,也可以用于生物医药和食品行业的一些科研,测定一定质量比的微量物质含量及混合物成分以及确定难以直接测定的混合体中各种物质的百分含量。
4总结
溶液质量分数是表示某一时刻溶液中溶质和溶剂的重量比的指标,并以相对单位进行计算,它的计算方法可以根据具体需求分为两种,分别是用体积计算和用质量计算,此外,溶液质量分数的应用还得有所拓展,它可以应用于多种领域,有助于我们更有效的分析化学方程式,并将理论实例化。
溶液质量分数计算公式溶液质量分数计算公式是一种重要的计算方法,可以让我们快速准确地评估溶液的浓度以及要求的质量分数。
简而言之,它可以帮助我们量化溶质和溶剂在液体中的比例,并将其表示为一个百分比(W / W)。
首先,从物理学的角度来看,溶液是由溶质和多种溶剂组成的浓度混合物,它的质量成分由其中的物质的质量组成。
换句话说,要了解溶液的质量分数,必须计算其中溶质的质量与总质量之比。
溶液成分的质量分数的计算通常采用以下公式:溶质质量分数(W / W)=溶质质量(m)/总质量(m)以上是溶液质量分数计算的统一公式,其中m表示质量,W表示体积。
在实际应用中,可以使用统一的单位以便于计算和比较,例如每千克溶液中,溶质质量分数=溶质的质量(千克)/总质量(千克)由于计算溶液的质量分数时需要考虑实际应用需要,因此不同的溶液类型有着不同类型的质量分数计算公式。
例如,当溶液中含有多种溶质时,可以使用混合质量分数计算公式。
具体如下:混合质量分数(W / W)=(溶质1质量(M1)+溶质2质量(M2)…)/总质量(M)计算混合质量分数时,可以在各个溶质中加权平均,而不是将所有溶质的质量累加在一起,然后除以总质量。
此外,如果溶液中混合了大量的有机溶剂,例如溶剂油,也可以使用体积分数计算公式来计算溶质质量分数。
与汽油成分混合质量分数计算公式相比,溶液质量分数计算公式更加复杂,考虑到不同溶质以及可能存在的有机溶剂,必须进行相关的加权计算。
因此,正确的计算溶质的质量分数必须考虑到每一个溶质和溶剂的特性、重量、容积等等,进行精确的加权计算。
只有经过充分的研究和计算,才能够确定正确的溶液和混合质量分数。
溶液质量分数计算公式是一种重要的化学计算方法,在化学领域中拥有重要意义,可以用来评估溶液的浓度,进而找出化学溶液在工业生产中的应用。
例如,以氢氧化钠为溶质的溶液,通常需要将溶质的质量分数计算为十分之六,以保证它的性能。
此外,溶液质量分数计算公式还有助于我们研究不同溶液的结晶度和溶质分数,以及溶质在溶剂中的动力学性质。
溶液质量分数的计算方法
溶液质量分数是化学里一个超有趣的概念呢。
咱先来说说啥是溶液质量分数哈。
溶液质量分数就是溶质质量和溶液质量的比值,再乘以100%,就得到这个百分数啦。
比如说,你有一杯糖水,糖就是溶质,水是溶剂,糖和水混在一起就是溶液。
如果糖有10克,水有90克,那溶液质量就是10 + 90 = 100克。
这时候糖的质量分数就是(10÷100)×100% = 10%。
那怎么计算溶质质量呢?有时候题目会直接告诉你溶质质量是多少,那可就太好啦。
但有时候不会这么直接哦。
如果知道溶液的体积和溶质的物质的量浓度,那就可以用公式n = cV(n是溶质的物质的量,c是物质的量浓度,V是溶液体积)算出溶质的物质的量,再根据溶质的摩尔质量M,用m = nM算出溶质质量。
就像玩解谜游戏一样。
溶剂质量也很重要哦。
要是知道溶液质量和溶质质量,溶剂质量就可以用溶液质量减去溶质质量得到。
还有一种情况呢,就是溶液发生了反应,然后让你求反应后溶液的质量分数。
这时候就得先搞清楚反应后溶质是啥,有多少。
比如说氢氧化钠和盐酸反应,生成了氯化钠和水,那反应后溶质就是氯化钠啦。
要通过化学方程式算出氯化钠的质量,再算出反应后溶液的总质量,最后算出质量分数。
溶液质量分数的计算其实就像是在做一个探索小任务。
只要把溶质、溶剂、溶液这几个小角色的关系搞清楚,就像知道故事里每个角色的特点一样,那计算起来就不会觉得难啦。
多做几道题,就会越来越熟练,就像玩游戏升级一样,会越来越厉害的哟。
溶液溶质质量分数的计算
原理:溶质质量分数=溶质质量/溶液质量×100%
例题:36g食盐溶解在100g水中,求溶液的溶质质量分数?
练习(1)室温下硝酸钾的溶解度为60g,现有35g硝酸钾加入50g水中充分搅拌后,求所得溶液溶质质量分数。
例题:有25g蔗糖将其加入75g水中使其完全溶解,并均分为四等份,
求:1、溶液溶质质量分数
2、取四等份中的一份,向其中加入5g蔗糖使其完全溶解,求所得溶液的溶质质量分数
3、取第二份加入5g水,求所得溶液的溶质质量分数
4、取第三份蒸发5g水时无晶体析出,求所得溶液的溶质质量分数
溶液稀释问题
例题:需要50%的稀硫酸1000g需要98%的浓硫酸多少g?
(分析:溶液稀释过程中只是溶剂的质量在变化,而溶质保持不变,所以在溶液中存在稀溶液中溶质质量=浓溶液中溶质质量的关系,而溶质质量=溶液质量×溶质质量分数,所以本题的解决就水到渠成了)
练习:若要配制1000ml(密度为1.2g/ml)20%稀硫酸,需要多少体积的(密度1.84g/ml)98%浓硫酸,需要加水体积为多少?
练习:(1)有108克(不纯,且杂志不溶于水)碳酸钠,现与200克未知质量分数的稀盐酸完全反应,反应后称得剩余物质质量为264g.。
求:1、生成二氧化碳质量
2、碳酸钠纯度
3、稀盐酸质量分数
4、最终所得溶液质量分数
(2) 将一块铁片加入200g硫酸铜溶液中,至硫酸铜完全反应后取出铁片,称得铁片质量增加0.8g
求:1、硫酸铜溶液的溶质质量分数
2、反应后所得溶液溶质质量分数。
使溶液溶质质量分数的方法溶液的质量分数是指溶液中溶质的质量与整个溶液质量的比值。
计算溶液质量分数的方法主要有两种:质量分数的定义法和质量分数的计算法。
一、质量分数的定义法:质量分数的定义法是指通过溶质质量与溶液总质量的比值得出质量分数。
其计算公式为:质量分数= 溶质质量/ 溶液总质量。
二、质量分数的计算法:质量分数的计算法是通过溶液中溶质的质量与单位体积溶液的质量之比来计算的。
其计算过程如下:1. 首先确定溶解质的质量和溶剂的质量。
溶解质是指将溶质溶解在溶剂中所得到的溶液。
溶质的质量是指溶液中溶质所含的质量,可以通过称量的方法测定。
溶剂的质量是指未溶质溶解前的溶剂质量。
2. 计算溶液的总质量。
溶液的总质量是指溶液中溶剂和溶质两者的质量之和。
总质量= 溶剂质量+ 溶质质量。
3. 计算单位体积溶液的质量。
单位体积溶液的质量是指单位体积溶液所含的质量。
单位体积溶液的质量可以通过将溶液的总质量除以溶液的体积得到。
4. 计算溶质的质量分数。
质量分数= 溶质质量/ (单位体积溶液的质量×溶剂体积)。
通过上述计算方法,可以得到溶液中溶质的质量分数。
质量分数的计算法主要适用于质量分数的计算和溶液中溶质浓度的计算。
它不仅可以用来计算溶液中溶质的质量分数,还可以用来计算溶液中其他物质的质量分数。
此外,质量分数的计算法还可以用来计算溶解度和物质的质量百分比等问题。
总结起来,溶液质量分数的计算有两种方法:质量分数的定义法和质量分数的计算法。
其中,质量分数的定义法是通过溶质质量和溶液总质量的比值计算得出的;质量分数的计算法是通过溶质质量与单位体积溶液的质量之比计算得出的。
这两种方法在实际应用中都具有重要的作用,可以用来计算溶液中溶质的质量分数及其他相关的浓度和百分比问题。
溶液质量分数计算例题分析
【例题分析】例1:已知60 ℃时,硝酸钾的溶解度为110克,问:
(1)将50克硝酸钾加入60克水中,经充分搅拌后所得溶液中溶质的质量分数= 。
解:C%=(50/50+60)≈45.5%
(2)将60克硝酸钾加入50克水中,经充分搅拌后所得溶液中溶质的质量分数。
常见错误:解:C%=(60/60+50)×100%=54.5%
分析:浓度只有在物质溶解度范围内才有可变的意义,当一定温度下达到饱和溶液时浓度已达到最大值,因此保持不变。
(2)中硝酸钾不能完全溶解。
应根据60 ℃时溶解度计算出50克水最多能溶解55克硝酸钾。
求解一:
C%=(55/55+50)×100%=52.4%
求解二:(利用溶解度计算)
C%=(S/100+S)×100%=(110/110+100)×100%=52.4%
例2:向质量分数为20%的氯化钠溶液中,再加入3克氯化钠和12克水,所得溶液中溶质的质量分数是()
A.25% B.20.5% C.20% D.无法求解
常见错误:一般认为20%的氯化钠溶液质量未知,不易求出混合后溶质和溶液的总质量,故此题无解,选D。
分析:抛开20%的氯化钠溶液,先求出3克氯化钠溶于12克水中所得溶液的溶质质量分数=(3/12+3)×100%=20%。
相同质量分数的同一溶液混合其溶质质量分数仍然不变。
故正确答案为:C
1∕1。