抑菌效果的检测方法
- 格式:doc
- 大小:17.50 KB
- 文档页数:3
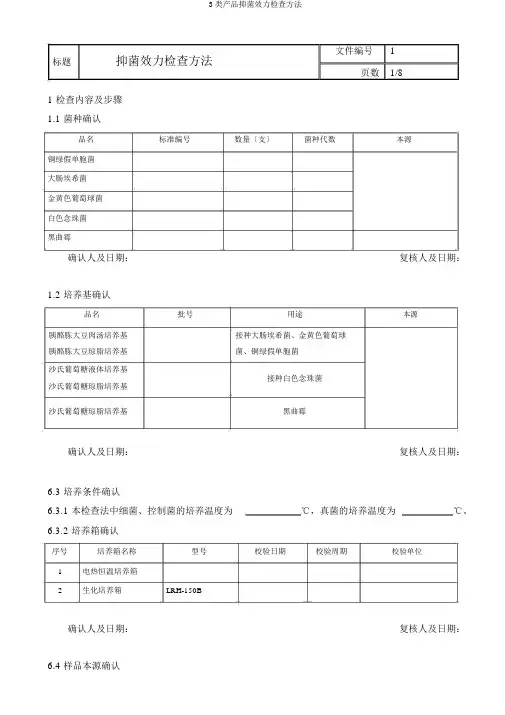
1检查内容及步骤1.1 菌种确认品名标准编号数量〔支〕菌种代数本源铜绿假单胞菌大肠埃希菌金黄色葡萄球菌白色念珠菌黑曲霉确认人及日期:复核人及日期:1.2 培养基确认品名批号用途本源胰酪胨大豆肉汤培养基接种大肠埃希菌、金黄色葡萄球胰酪胨大豆琼脂培养基菌、铜绿假单胞菌沙氏葡萄糖液体培养基接种白色念珠菌沙氏葡萄糖琼脂培养基沙氏葡萄糖琼脂培养基黑曲霉确认人及日期:复核人及日期:6.3 培养条件确认6.3.1 本检查法中细菌、控制菌的培养温度为℃,真菌的培养温度为℃。
6.3.2 培养箱确认序号培养箱名称型号校验日期校验周期校验单位1电热恒温培养箱2生化培养箱LRH-150B确认人及日期:复核人及日期:6.4 样品本源确认品名批号数量本源备注蛋白琥珀酸铁口服溶液确认人及日期:复核人及日期:6.5 操作环境确认为确认人及日期:的洁净地域以内,局部〔操作台〕为级并单向流空气。
复核人及日期:7培养基的适用性检查7.1 抑菌剂效力测定用培养基应进行培养基的适用性检查,包括成品培养基、由脱水培养基或按处方配制的培养基均应检查。
7.2 菌种试验所用的菌株传代次数不得高出 5 代〔从菌种珍藏中心获得的冷冻无聊菌种为第0代〕,并采用合适的菌种珍藏技术进行保存,以保证试验菌株的生物学特色。
铜绿假单胞菌〔 Pseudomonas aeruginosa〕〔 CMCC(B)10 104〕大肠埃希菌〔 Escherichia coli〕〔 CMCC(B) 44 102〕金黄色葡萄球菌〔Staphylococcus aureus〕〔 CMCC(B)26 003〕白色念珠菌〔Candida albicans〕〔CMCC(F) 98 001〕黑曲霉〔Aspergillus niger 〕〔CMCC(F) 98 003〕7.3 菌液制备7.3.1 接种大肠埃希菌、金黄色葡萄球菌、铜绿假单胞菌的新鲜培养物至胰酪胨大豆肉汤培养基中,30~35℃培养 18~ 24 小时;接种白色念珠菌的新鲜培养物至沙氏葡萄糖液体培养基中,20~25℃培养24~48 小时。

抗菌药物最小抑菌浓度的测定之相礼和热创作一、概念:最小抑菌浓度(minimum inhibitory concentration, MIC):在特定环境下孵育24小时,可抑制某种微生物出现分明增长的最低药物浓度即最小抑菌浓度,用于定量测定体外抗菌活性.二、实验目的:经过采取常量浓缩法, 检测几种抗菌药物对----菌株的最小抑菌浓度( MIC) , 对临床诊断用药有引导作用.三、仪器和试剂:MH液体培育基无菌试管分光光度计MH琼脂微量加样器蒸馏水吸头0.1mol磷酸缓冲液接种环(PH6.0)无菌生理盐水无菌平板无菌针筒抗菌药物金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌四、检验方法:液体浓缩法、琼脂浓缩法、E实验(E test)液体浓缩法操纵步调:1..抗菌药物原液制备抗菌药物储存液浓度不该低于1000μg/ml(如1280μg/ml)或10倍于最高测定浓度.溶解度低的抗菌药物可稍低于上述浓度.所需抗菌药物溶液量或粉剂量可公式进行计算.例如:需配制100 ml 浓度为1280μg/ml 的抗生素储存液,所用抗生素为粉剂,其药物的无效能为750μg/mg.用分析天平精确称取抗生素粉剂的量为182.6 mg.根据公式计算所需浓缩剂用量为:(182.6 mg ×750μg/ml )/1280μg/ml=107.0ml ,然后将182.6 mg 抗生素粉剂溶解于107.0ml 浓缩剂中.制备抗菌药物储存液所用的溶剂和浓缩剂见表 1.配制好的抗菌药物储存液应储存于-20℃环境,并留意抗菌药物的保管限期.表1 浓缩法中经常运用的抗菌药物容积浓缩法2.药敏实验用抗菌药物浓度范围根据NCCLS抗菌药物敏感性实验操纵尺度,药物浓度范围应包含耐药、中介和敏感分界点值,特殊状况例外.3.培育基NCCLS引荐运用Mueller-Hinton(MH)肉汤,pH7.2~7.4.需氧菌及兼性厌氧菌在此培育基中生长良好.在测试葡萄球菌对苯唑西林的敏感性时,应在肉汤中加入2%(W/V)氯化钠,按制造厂家的要求配制必要量的MH肉汤.嗜血杆菌属菌运用HTM肉汤,肺炎链球菌和别的链球菌运用含2%~5%溶解马血的MH肉汤.4.接种物的制备有2种方法配制接种物,一是细菌生长方法,用接种环挑取形状类似待检菌落3-5个,接种于4-5ml 的水解酪蛋白(MH)肉汤中,35℃孵育2-6h.增菌后的对数生长期菌液用生理盐水或MH肉汤校正浓度至0.5麦氏比浊尺度,约含1~2×108CFU/ml.二是直接菌落悬液配制法,对某些苛养菌,如流感嗜血杆菌、淋病奈瑟菌和链球菌及甲氧西林耐药的葡萄球菌等菌株,引荐直接取培育18~24h的菌落调配成0.5麦氏比浊尺度的菌悬液.用MH肉汤将上述菌悬液进行1∶100浓缩后备用.留意应在15分钟内接种完配制好的接种物,并取一份接种物在非选择性琼脂平板上传代培育,以检查接种物纯度.5.浓缩抗菌药物的制备及菌液接种取无菌试管(13×100mm)13支,排成一排,除第1管加入1.6mlMH肉汤外,别的每管加入MH肉汤1ml,在第1管加入抗菌药物原液(如1280μμg/ml.然后在每管内加入上述制备好的接种物各1ml,使每管最终菌液浓度约为5×μg/ml.另外设对照3支,别为肉汤对照、质控菌对照和待测菌生长对照.6.孵育将接种好的浓缩管塞好塞子,置35℃平凡空气孵箱中孵育16~20h;嗜血杆菌和链球菌在平凡空气孵箱中孵育20~24h;对可能的耐甲氧西林葡萄球菌和耐万古霉素肠球菌应持续孵育满24h.7.结果判别与解释在读取和陈述所测试菌株的MIC前,应检查生长对看管的细菌生长状况能否良好,同时还应检查接种物的传代培育状况以确定其能否净化,质控菌株的MIC值能否处于质控范围.以肉眼观察,药物最低浓度管无细菌生长者,即为受试菌的MIC.甲氧苄胺嘧啶或磺胺药物的肉汤浓缩法尽头判别,与阳性生长对看管比较抑制80%细菌生长管药物浓度为受试菌MIC.【MIC参考范围】表2浓缩法质控尺度菌株MIC预期值范围(ug/ml)经常运用抗菌药物浓缩和配制方法药物溶媒配制方法青霉素一次氨苄西林一次氨苄西林氟氯西林一次氨苄西林舒巴坦一次阿莫西林氟氯西林一次阿莫西林舒巴坦一次阿莫西林克拉维酸一次奈夫西林一次阿洛西林二次,每g先用10ml注射用水溶解美洛西林一次美洛西林舒巴坦二次,先用过量注射用水或生理盐水溶解羧苄西林一次替卡西林克拉维酸二次,先用10ml注射用水溶解哌拉西林无一次哌拉西林他唑巴坦5%G.S,NS 一次哌拉西林舒巴坦5%G.S,NS 一次苯唑西林一次头孢唑啉二次,先用注射用水溶解五水头孢唑啉二次,先用注射用水溶解头孢硫脒一次头孢噻吩二次.先4g用20ml注射用水溶解头孢呋辛无一次头孢美唑一次头孢替安一次头孢替唑一次头孢尼西一次头孢西丁一次头孢孟多一次头孢他定一次头孢曲松头孢哌酮一次,终浓度为5-25mg/ml头孢哌酮舒巴坦二次,1g—水溶后总量4ml,再用同一溶媒溶解.头孢哌酮他唑巴坦二次.先用注射用水、N.S 5-10ml溶解拉氧头孢一次头孢米诺一次头孢唑肟一次头孢地嗪一次头孢甲肟一次头孢匹胺一次头孢吡肟一次头孢匹罗一次亚胺培南西司他汀一次美罗培南二次,可先用适宜液体配制氨曲南二次,1g先用至多3ml注射用水溶解,终浓度不超出2%阿奇霉素二次.先用注射用水浓缩成0.1mg/ml,再浓缩成终浓度为1-2mg/ml依替米星一次多西环素克林霉素无一次万古霉素二次.先用10ml注射用水溶解,再加入至多200ml溶液中.滴注>1小时.往甲万古霉素二次.先用注射用水溶解,再用至多200ml液体慢滴.替考拉宁二次.先用注射用水溶解,双手滚动小瓶至药粉全部溶解.假如出现泡沫,静置15分钟.培氟沙星一次氟罗沙星一次洛美沙星二次,先用5ml注射用水溶解左氧氟沙星一次加替沙星一次,终浓度为2mg/ml依诺沙星一次帕珠沙星一次利福霉素一次氟康唑无一次两性霉素B 5%G.S(用NS有沉淀)二次.5ml注射用水溶解25mg药物,终浓度<0.1mg/ml,避光慢滴6h以上阿昔洛韦二次.每0.1g用10ml注射用水溶解成50g/l.再用大瓶浓缩成至多100ml.终浓度不超出7g/l.慢滴.留意水化更昔洛韦先用N.S或注射用水溶解,再用大瓶浓缩成100ml.浓度不超出10mg/ml,一次最大量6mg/kg聚安洛韦一次膦甲酸钠无一次.留意水化(2.5L/d),可得当用利尿剂,慢滴阿糖腺苷无一次.日剂量<10mg/kg病毒唑一次.1mg/ml,慢滴磷霉素先用注射用水溶解.慢滴1-2小时.总结:1. N.S溶解:青霉素、氨苄西林类、阿莫西林类、奈夫西林、头孢硫脒、帕珠沙星(阿青安怕牛来)2. G.S溶解:培氟沙星、氟罗沙星、曲伐沙星、依诺沙星、两性霉素B/利福霉素(两粒)3. 需二次配制的:青霉素类:阿洛西林、美洛西林舒巴坦、替卡西林克拉维酸(阿美卡拉);头孢类:唑啉、噻吩、曲松、哌酮舒巴坦(他唑巴坦);两粒霉素B、磷霉素、多西环素、阿奇霉素、洛美沙星(20多哈罗)、万古霉素、往甲万古霉素、替考拉宁;阿昔洛韦、更昔洛韦、氨曲南、美罗培南。

抗菌测试检测标准
抗菌测试是评价物质抑制或杀灭细菌或其他微生物能力的方法。
下面是常见的抗菌测试方法和相关的标准:
1. 纸片扩散法(Disk diffusion method):根据CLSI(Clinical and Laboratory Standards Institute)标准进行抗菌活性测试。
该
标准包括了对不同细菌株和药物的测试方法和结果解读标准。
2. 最小抑菌浓度法(Minimum Inhibitory Concentration, MIC):根据CLSI或欧洲常用测试方法(EUCAST,European Committee on Antimicrobial Susceptibility Testing)进行细菌的
药敏性测试。
该测试可以确定药物对细菌的最低有效抑制浓度。
3. K-B法(Kirby-Bauer method):也是一种常用的纸片扩散法,测定细菌对抗生素的药敏感性。
除了上述各种抗菌测试方法外,还有许多其他的标准和指南可供参考,例如:
- 美国药典(USP,United States Pharmacopeia)中的相关方法
规范。
- 欧洲抗菌药物开发委员会(EUCAST)的药敏性测试指南。
- 中国药典(ChP,Chinese Pharmacopoeia)中的抗菌药物相关标准。
这些标准和指南提供了在实验室中进行抗菌测试的具体步骤和结果的解释。
根据不同的应用领域和目的,选择合适的标准进行抗菌测试非常重要。

检测某个样品的抑菌活性时间观察1.把实验室用的普通滤纸用打孔器打成0.5cm直径的圆片,装在试管中密封灭菌(121度,20分钟)。
2.将已经培养好的菌制成一定浓度的悬浮液,取1ml该菌悬液至灭过菌的(121度,20分钟)培养皿中,倒入适量(约4毫米厚吧)已灭菌的培养基(温度约45度,用手摸瓶壁不感觉烫手即可),轻轻转动培养皿,使培养基与菌液混匀,静置凝成平板。
3.将用于试验的农药配制成几个所需的浓度,用无菌镊子夹起一片滤纸放入药液中浸透,夹出时在容器边缘停靠片刻,滤掉多余的药液,把滤纸片放在平板中凝好的培养基的中心,用镊子稍用力按一下,使之与培养基充分紧贴。
4.按上述方法,每个浓度做3个重复,以灭菌水浸湿的滤纸片做空白对照。
5.在适当温度下培养一定时间后观察,用直尺或游标卡尺测量抑菌圈的大小,计算抑菌率就OK了!细菌素抗菌活性的检测采用牛津杯法。
双碟的制备:取直径90mm的培养皿,注入灭菌的营养琼脂(1.5%)15mL,水平放置使之凝固,作为底层,取指示菌培养基(浓度为0.8%,冷却至50℃)与指示菌菌液适量混匀,取6ml。
铺在底层培养基上,水平放置使之凝固,作为菌层。
用无菌镊子夹取已灭菌的牛津杯,打开皿盖,放在培养基上。
在牛津杯中加满相同量的抗菌液(300uL),每个样品3个重复。
将加完样的培养皿小心放入37℃恒温箱内,培养18h后(其中以真菌做指示菌的培养时间为30℃、3d)取出测量抑菌圈直径。
琼脂扩散法:先将指示菌固体培养基融化,冷却后倒平板。
待平板凝固后,均匀放入牛津杯。
再将指示菌半固体培养基融化,冷却至45~50℃,把指示菌液先稀释至10°后,吸取50uL接入指示菌半固体培养基中,倒平板。
待平板凝固后将牛津杯拔出,在孔中加入50uL 发酵液。
30℃培养24h,观察有无抑菌圈产生。

最小抑菌浓度(MIC)及抑菌率的测定提纯蛋白质后,需要测定其最小抑菌浓度(MIC),有文献提到根据MIC测得的结果计算抑菌率:抑菌率(%)= (阳性对照OD值—试验OD值) / (阳性对照OD值—阴性对照OD值)X100样品的MIC与同性质药物和一些常用药物的MIC进行比较才有意义,不能单纯通过自己样品的结果就判断出高低,并且不能只用一种细菌。
要考虑用不同种类的细菌进行实验,还要做质控。
根据抑菌率大小可以判断是否具有抑菌能力。
可参考以下药敏介绍:诸多药敏试验方法中,肉汤稀释法是标准方法,琼脂稀释法也可认为属于标准方法。
其他任何方法必须与标准方法比较,才能确定可靠性。
其他方法之间相互比较没有太大价值。
比较须平行测定耐药菌株和敏感菌株。
耐药菌株,被评价方法与标准方法的误差称极重要误差,不得大于3%;敏感菌株,被评价方法的误差称重要误差,不大于7%。
不同的药敏试验方法,针对不同药物,可靠性不一样。
如测MRSA须高盐条件,有的试剂盒中不加盐,结果不准确,但这不影响肠球菌的测定结果。
所以,评价一种方法,应该是有针对性地验证一种细菌对一种药物测定结果的可靠性。
质量控制及其校准作用1、纸片法药敏试验用敏感菌株做质量控制。
此外,ATCC25923,ATCC25922,ATCC27853三个菌株还具备校准作用,此点往往被忽视。
在NCCLS有关文件中,质量控制一节的第一部分就是讲方法的校准。
由于培养基和操作的原因,国内大部分实验室的药敏试验没有经过校准,试验的准确度差异很大。
校准过程中,须注意用适合的参考菌株校准相应菌类的药敏试验。
如葡萄球菌药敏试验用ATCC25923校准;肠杆菌药敏试验用ATCC25922校准。
2、筛选法药敏试验必须用耐药菌株做质量控制,最好是低水平耐药菌株。
MRS筛选试验以ATCC43300控制。
万古霉素筛选试验,以ATCC51299控制。
3、稀释法药敏试验对质量控制要求较高,特别是微量稀释法,必须做质量控制,否则会出现较大误差。


牛津杯法定量检测大蒜抑菌作用实验一、实验目的1.了解大蒜对微生物中大肠杆菌的抑菌作用2.学习不同抑菌效价检测方法的原理和差异3.掌握牛津杯法的抑菌试验二、实验原理抑菌试验是指在体外测定样品的抑菌或杀菌能力。
在药品、功能食品、保健品和化妆品等行业中,所用中药材提取物、天然活性物质(如多糖类、黄酮类和精油类等)和抗生素类等物质的抑菌性能是一个重要指标。
抑菌试验常用的方法有抑菌圈法、菌落计数法、最小抑菌浓度法和比浊法等。
牛津杯法属于抑菌圈法的一种,其原理是利用待测药物在琼脂平板中扩散使其周围的细菌生长受到限制而形成透明圈——抑菌圈,根据抑菌圈大小判定待测药物抑菌效价。
它既可用于定性试验,也可用于定量分析,并且操作便捷、成本低廉、结果准确可靠,在多个领域被广泛使用。
大蒜是百合科葱属植物,具有医食同源性,既是调味品也是天然的药剂。
大蒜具有较高的营养价值,含有丰富的氨基酸、肽类、蛋白质、糖类、脂肪、无机盐、维生素以及蒜油。
同时它还具有抗菌抑菌、抗癌防癌、营养保健、降血压、抗击各种病毒侵袭、提高机体免疫力等功能。
大蒜被誉为“天然广谱抗生素”,对多种致病菌如大肠杆菌、金黄色葡萄球菌和致病性肠道细菌都有较强的抑制或杀灭作用,其抑菌的活性成分主要是含硫化合物等挥发性物质和大蒜素等。
本实验以大蒜作为待测样品、以大肠杆菌(Escherichia coli)作为指示菌,通过牛津杯法定量检测大蒜粗提物对大肠杆菌的抑制作用,让学生在掌握牛津杯法抑菌实验的同时,观察到大蒜粗提液的抗菌杀菌效果,从而增加对生活中食用大蒜对人体的抗感染和保健作用的了解。
三、实验方法1.试验菌种大肠杆菌(Escherichia coli)2.培养基与试剂1)LB液体培养基:胰蛋白胨10 g (1%);酵母提取物5 g (0.5%);氯化钠10g (1%);蒸馏水1000 mL;pH值7.0~7.2。
2)LB半固体培养基(含1%琼脂): 胰蛋白胨10 g (1%);酵母提取物5 g(0.5%);氯化钠10 g (1%);琼脂10 g (1%);蒸馏水1000 mL;pH值7.0~7.2。

几种测定抗菌药物最低抑菌浓度(MIC)方法1.1.常量肉汤稀释法1.1.1.抗菌药物贮存液制备抗菌药物贮存液浓度不应低于1000μg/ml(如1280μg/ml)或10倍于最高测定浓度。
溶解度低的抗菌药物可稍低于上述浓度。
抗菌药物直接购自厂商或相关机构。
所需抗菌药物溶液量或粉剂量可公式进行计算。
例如:需配制100 ml浓度为1280μg/ml的抗生素贮存液,所用抗生素为粉剂,其药物的有效力为750μg/mg。
用分析天平精确称取抗生素粉剂的量为182.6 mg。
根据公式计算所需稀释剂用量为:(182.6 mg×750μg/ml)/1280μg/ml=107.0ml,然后将182.6 mg抗生素粉剂溶解于107.0ml稀释剂中。
制备抗菌药物贮存液所用的溶剂和稀释剂见表5。
配制好的抗菌药物贮存液应贮存于-60℃以下环境,保存期不超过6个月。
1.1.2.药敏试验用抗菌药物浓度范围根据NCCLS抗菌药物敏感性试验操作标准,药物浓度范围应包含耐药、中介和敏感分界点值,特殊情况例外。
1.1.3. 培养基NCCLS推荐使用Mueller-Hinton(MH)肉汤,pH7.2~7.4。
需氧菌及兼性厌氧菌在此培养基中生长良好。
在测试葡萄球菌对苯唑西林的敏感性时,应在肉汤中加入2%(W/V)氯化钠,按制造厂家的要求配制需要量的MH肉汤。
嗜血杆菌属菌使用HTM 肉汤,肺炎链球菌和其它链球菌使用含2%~5%溶解马血的MH肉汤。
1.1.4.接种物的制备有2种方法配制接种物,一是细菌生长方法,用接种环挑取形态相似待检菌落3-5个,接种于4-5ml的水解酪蛋白(MH)肉汤中,35℃孵育2-6h。
增菌后的对数生长期菌液用生理盐水或MH肉汤校正浓度至0.5麦氏比浊标准,约含1~2×108CFU/ml。
二是直接菌落悬液配制法,对某些苛养菌,如流感嗜血杆菌、淋病奈瑟菌和链球菌及甲氧西林耐药的葡萄球菌等菌株,推荐直接取培养18~24h的菌落调配成0.5麦氏比浊标准的菌悬液。

2.1.8 抗(抑)菌试验2.1.8.1 目的测定抗(抑)菌产品对细菌和真菌的抗(抑)菌作用。
常使用的方法有抑菌环试验、最小抑制浓度测定试验、滞留抑菌效果测定试验、洗衣粉抗菌效果测定试验、振荡烧瓶试验、浸渍试验与奎因试验,可视情况选用。
2.1.8.2 抑菌环试验2.1.8.2.1 原理利用抑菌剂不断溶解经琼脂扩散形成不同浓度梯度,以显示其抑菌作用。
试验通过抑菌环大小以判断其是否具有抑菌能力。
本试验适用于抑菌剂与溶出性抗(抑)菌产品的鉴定。
2.1.8.2.2 试验器材(1)金黄色葡萄球菌(ATCC 6538)、大肠杆菌(8099)、白色念珠菌(A TCC 10231) 菌悬液(见2.1.1.2)及根据抑菌剂特定用途所用的其他菌悬液。
(2)抑菌剂载体(5 mm 直径园形新华一号定性滤纸片,经压力蒸汽灭菌处理后,置120℃烤干2h,保存备用)。
(3)活菌培养计数所需器材(见2.1.1.3)。
(4)微量移液器(5μl~50μl,可调式)。
(5)游标卡尺。
(6)营养琼脂培养基、胰蛋白胨大豆琼脂培养基与沙堡琼脂培养基2.1.8.2.3 操作程序(1)抑菌片的制备:对液体抑菌剂,取无菌并干燥的滤纸片。
每片滴加实际使用浓度抑菌剂溶液20μl,然后将滤纸片平放于清洁的无菌平皿内,开盖置温箱(37℃) 中烤干,或置室温下自然干燥后备用。
溶出性抗(抑)菌产品,可直接制成直径为5mm,厚不超过4mm圆片(块),每4 片(块) 一组。
(2)阴性对照样片的制备:取无菌干燥滤纸片,每片滴加无菌蒸馏水20μl,干燥后备用。
溶出性抗(抑)菌产品的阴性对照样本,应取同种材质不含抑菌成份的样品,制成与试验组大小相同的样片(块)。
(3)试验菌的接种:用无菌棉拭子蘸取浓度为5×105cfu/ml~5×106cfu/ml 试验菌悬液,在营养琼脂培养基平板表面均匀涂抹3次。
每涂抹1次,平板应转动60°,最后将棉拭子绕平板边缘涂抹一周。

20244两种方法测试抗菌肽与抗生素的联合抑菌效果赵晶晶1李晓凤2刘保国2杭柏林2*(1洛宁县动物疫病预防控制中心,河南洛宁471700;2河南科技学院动物科技学院,河南新乡453003)摘要为了解抗菌肽泰立停与抗生素的联合抑菌作用,本研究通过倍比稀释法和纸片法测试了泰立停和抗生素在单用和联用时对大肠杆菌和沙门菌的抑菌活性。
结果表明:抗菌肽泰立停和抗生素安普霉素、恩诺沙星、多西环素在单用时对大肠杆菌和沙门菌均有不同程度的抑菌活性,在联合使用时,倍比稀释法观察到泰立停与恩诺沙星联合可以提高对大肠杆菌CVCC1568的抑菌活性;纸片法观察到仅泰立停与多西环素以8∶2的比例进行联合时对大肠杆菌AE1具有联合抑菌作用,同时观察到泰立停与某些抗生素联合时,抑菌效果与该抗生素单用的效果相当。
说明抗菌肽泰立停与某种抗生素联合可针对某种菌的某些菌株有很好的抑菌活性,同时可以降低抗生素的使用剂量。
这将减少抗生素在临床中的应用,进而避免或减少耐药菌的形成,维护人与动物的健康,保护生态环境。
关键词抗菌肽;泰立停;抗生素;联合抑菌作用中图分类号S859.79+6文献标识码A文章编号1007-5739(2024)04-0139-04DOI:10.3969/j.issn.1007-5739.2024.04.035开放科学(资源服务)标识码(OSID):Two Methods for Testing Combined Antibacterial Effects of Antimicrobial Peptideand AntibioticsZHAO Jingjing1LI Xiaofeng2LIU Baoguo2HANG Bolin2*(1Prevention and Control Center for Animal Disease in Luoning County,Luoning Henan471700;2College of Animal Science and Veterinary Medicine,Henan Institute of Science and Technology,Xinxiang Henan453003) Abstract In order to understand the combined antimicrobial activity of antimicrobial peptide Tailiting and anti-biotics,the antibacterial activity of Tailiting and antibiotics against Escherichia coli and salmonella was tested by double dilution method and paper slice method when Tailiting or antibiotic was used alone,or Tailiting combined with anti-biotic.The results showed that single use of Tailiting or antibiotic(apramycin,enrofloxacin and doxycycline)had different antimicrobial activity against E.coli and salmonella.The combination of Tailiting and enrofloxacin could increase the antimicrobial activity against E.coli CVCC1568by double dilution method.Only the combination of Tailiting and doxycycline at the ratio of8∶2had the combined antimicrobial effect on E.coli AE1.The combined antimicrobial effect of Tailiting and some antibiotics was similar to that of antibiotic alone.The results indicated that the combination of antimicrobial peptide Tailiting and some antibiotics had good antibacterial activity against some strains of certain bacteria and could reduce the dosage of antibiotics.This would reduce the application of antibiotics in clinic,and could avoid or reduce the formation of drug-resistant bacteria,maintain the health of human and animals and protect the ecological environment.Keywords antimicrobial peptide;Tailiting;antibiotic;combined antibacterial activity基金项目河南省科技攻关项目(222102110411);河南科技学院高层次人才启动项目(2014020);河南省三区人才项目(105020222016/011)。

抗菌性能检测一般知识
目前,整理织物抑菌效果测试方法一般有以下几种:
1.AATCC 9O-1982法晕出法
2.AATCC lOO-1981法汲尽培养法
3.CTM 0923法摇晃烧瓶法(美国道康宁公司的试验方法)
具体试验操作如下:
1.晕出法:在培养基上,接种上细菌培养液之后,将整理织物小块复盖在培养基上,而后在一定条件下使细菌繁殖一定时间,检查织物复盖部位是否有"菌落"生长,也检查织物周围渗出无菌区城的大小尺寸。
复盖区无菌落,抑菌效果属于优良,晕出圈越大,表明整理剂从织物上渗出量越多。
2.汲尽培养法;吸一毫升细菌培养液,滴在一小块整理织物上,使溶液正好被织物全部吸收,放置一定时何后,用培养液将织物上的细菌液洗落(稀释),摇匀,取样置于培养基上,在一定条件下,使细菌繁殖一定时间,检查培养基上“菌落”数,与空白样品对比。
3.摇晃烧瓶法,在盛有稀释液的有塞三角烧瓶中,投入样品(纺织品),而后移入细菌液,在一定条件下,摇晃一小时,取出一毫升试验液,置于固体培养基上,在一定条件下使细菌繁殖一定时间,检查菌落数与空白样品比较,计算抑菌率。
以上三种方法,对于非渗出性的整理剂来讲以摇晃烧瓶法较为准确。
在抑菌率测试中,很可能发生误差,主要原因有;
(1)菌株的活力和纯度不易一敦,因此既要求钝种,还安求选育培养至繁殖速度呈对数增长后的稳定期问取样。
(2)织物上可能有复盖物或离子屏蔽化合物,因此,测试前应将整理织物洗净。
(3)自培养液中吸取菌液时,细菌仍处在新陈代谢过程中,因此,对照样品之间的取样时间越接近越好。
实验七杀菌剂生物活性测定方法——抑菌圈法摘要:本实验主要研究了七杀菌剂的生物活性测定方法,抑菌圈法。
该方法通过在琼脂平板上播种细菌,再在平板上施加一定浓度的七杀菌剂,观察并测量周围的抑菌圈直径,从而评估七杀菌剂对细菌的抑制作用。
实验结果表明,抑菌圈直径与七杀菌剂浓度呈正相关关系,且抑菌圈直径越大,表示七杀菌剂的抑菌效果越好。
通过该方法可以快速、简便地评估七杀菌剂的生物活性,为进一步研究其抗菌机制和优化配方提供了参考。
关键词:七杀菌剂;抑菌圈法;生物活性;抑菌圈直径一、引言七杀菌剂是一类特殊作用机制的植物杀菌剂,具有广谱杀菌、低滴效、低残留、不发生抗性等优点,被广泛应用于农业防病生产中。
评估七杀菌剂的生物活性是研究抗病机理、筛选优良品种和优化配方的重要手段。
目前,常用的七杀菌剂生物活性测定方法包括最小抑菌浓度法、抑菌圈法和微量滴定法等。
本实验采用抑菌圈法对七杀菌剂的生物活性进行测定,该方法简单易行、时间短,能够客观直观地评估抗菌剂的抑菌效果,被广泛应用于杀菌剂的筛选和评估中。
二、材料与方法2.1实验材料-七杀菌剂:根据实验需要选择合适的七杀菌剂;-革兰氏染色培养基:包括琼脂和所需培养成分;-细菌:根据实验需要选择合适的细菌菌种;- 培养皿:直径90 mm的培养皿;-无菌棉花:消毒后用于吸水;-直尺:用于测量抑菌圈的直径。
2.2实验步骤步骤一:制备琼脂平板1)按照革兰氏染色培养基的配方将琼脂和所需培养成分溶解在适量的蒸馏水中;2)加热溶液,使其均匀溶解;3)微量加热,使溶液达到沸腾状态;4)关火,冷却至50-60°C左右;5)待溶液冷却至室温,但还能滴落时,加入适量的细菌菌液;6)快速均匀摇晃培养皿,使菌液均匀分布;7)等待琼脂凝固,形成琼脂平板。
步骤二:制备七杀菌剂根据使用七杀菌剂的需要,按照使用说明书中的配方调配适量的七杀菌剂浓度。
步骤三:进行抑菌实验1)在琼脂平板表面平均涂布一层细菌菌液;2)在涂布完成后,使用消毒的锥形杯钻按规定距离在琼脂平板上扎孔;3)将七杀菌剂溶液滴入孔内,注意控制滴入的量和浓度;4)将培养皿倾斜,使溶液均匀涂布在琼脂平板上;5)撤去孔内的溶液,用无菌棉花吸干孔内的溶液;6)将培养皿倒置放置于恰当的环境中进行培养;7)培养一定时间后,观察并测量抑菌圈的直径。
药敏试验纸片法的抑菌范围解释药敏试验纸片法是一种常用的药敏试验方法,其主要用于检测细菌对不同抗生素的敏感性,是抗生素治疗的指南之一。
在进行这种试验时,需要根据不同的抗生素种类,为细菌培养基上接种不同的试验纸片,观察它们对细菌的抑菌作用。
那么,这种试验纸片的抑菌范围是怎样解释的呢?抑菌范围的定义抑菌范围指试验纸片的抗生素浓度对细菌生长所产生的影响。
可以通过抑制菌落的数量或直接观察菌落形态来确定抗生素的抑菌效果。
通常,抑菌范围被定义为一组不同浓度抗生素所能抑制的最小和最大菌落直径之间的区间。
抑菌范围的解释抑菌范围的解释是基于对试验纸片抗生素浓度的了解。
对于不同种类的细菌和抗生素,需要根据其最佳浓度范围来确定试验纸片的浓度范围。
一般来说,试验纸片的抗生素浓度在最小抑菌浓度(MIC)以下,细菌可以在培养基上生长。
而在MIC以上,抗生素的浓度越高,细菌对抗药性越强,抑菌效果也越明显。
因此,抑菌范围是该试验纸片所能达到的最大和最小抗生素浓度之间的区间。
抑菌范围的影响因素抑菌范围不但受试验纸片抗生素浓度的影响,还受到以下因素的影响:1.细菌类型:不同种类的细菌对抗生素具有不同的敏感性和耐受性。
因此,在使用试验纸片时,需要根据不同细菌类型来确定正确的抗生素浓度范围。
2.抗生素类型:不同种类的抗生素在不同浓度下对细菌的抑菌效果也是不同的。
因此,需要选择对应的抗生素种类和浓度,来使试验纸片的抑菌效果最佳。
3.使用时间:如果试验纸片放置时间过长,抗生素的浓度可能会降低,影响试验结果。
因此,及时使用试验纸片是十分重要的。
4.库存条件:试验纸片需要在干燥、阴凉的环境中存放,以保证其抗生素浓度稳定,降低试验误差。
药敏试验纸片法是一种简单且可靠的抗生素敏感性检测方法。
抑菌范围是该试验纸片所能达到的最大和最小抗生素浓度之间的区间,其受到细菌类型、抗生素类型、使用时间和库存条件等因素的影响。
在使用试验纸片进行药敏试验时,需要充分考虑这些因素,来保证试验结果的准确性和可靠性。
抑菌效果的检测方法:将抗生素菌株进行平板划线分离,长
出单菌落后,在421房间的超净工作台上找到直径7mm的
打孔器(只有一个,请大家不要拿到其它地方去!),用该打孔器在单菌落上打取菌落块,若菌落块卡在打孔器内,请用接种针挑出来,将菌落块以菌落面向上的方式放置在已经涂
布有金黄色葡萄球菌或大肠杆菌的平板上,培养48小时后测量抑菌圈的直径。
发帖者:徐耀波317生命科学学院
发布至:微生物学实验31700235fzkc200545401001
微生物学实验安排及自主实验要求
发帖位置: Tuesday, March 25, 2014
微生物学实验安排及自主实验要求
第6周:1.口腔微生物的染色观察与显微镜油镜的使用;
第7周:2.培养基的制备;3.高压蒸汽灭菌;
第8周:4.土壤中微生物的分离;
第9周:5.微生物菌落的观察;6. 微生物的分离纯化与菌种保存
第10周:7.细菌的革兰氏染色;8.放线菌装片的制作及观察;
第11周:9.酵母菌装片的制作及观察;10.霉菌装片的制作及观察;
第12周:11.酸奶的制作
第13周:12.水中大肠菌群的检测;
第12-14周:自主实验——抗生素产生菌的分离纯化及抗菌活性测定;
第15周:实验考核(无菌操作、制片、染色、油镜观察);
各组提交自主实验项目总结报告,要求按照正式发表的科研论文进行写作;自主实验总结汇报。
要求:1.以一个班为单位,3~4人一组(即每张桌子上的同学分成两个自主实验小组
2.禁止选择以青霉为筛选目标的实验方案,各组自己查阅相
关资料然后设计实验方案主要包括样品的采集、所用的培养基配方、分离方法、鉴定的方法、活性测定的方法等方面;
各组长在第9周上实验课时将纸质实验方案提交给指导教师(实验方案请标明:2012级*班*组+组长姓名+联系电话+组员姓名)
发帖者:徐耀波317生命科学学院
发布至:微生物学实验31700235fzkc200545401001
自主实验预期目标及活性检测建议
发帖位置: Tuesday, March 25, 2014
抗生素产生菌的分离与抗菌活性检测
1. 分离纯化获得1株以上具有明显抑制测试菌生长作用的
产抗生素菌株,测试菌建议选用:金黄色葡萄球菌或大肠杆菌,只要对任何一种测试菌有比较明显的抑菌圈就可以了。
2. 对上述菌株进行初步鉴定,包括菌体形态、大小、菌落形
态等、以及一些本实验室可以完成的生理生化反应,在此基础上对上述菌株鉴定到属名。
3. 条件允许的情况下,选取一株菌进行液体摇床发酵培养(250ml三角瓶内装50ml液体培养基,统一采用28℃,150r/min),测试其发酵液的抑菌活性,测试时请向徐老师借牛津杯6个,分别加入发酵液上清液100μl、200μl,培养48小时后,测量抑菌直径,各组间以抑菌圈直径大小比较产抗生素活性的大小。
注意:尽可能多留一些图片资料,如抑菌圈、菌体形态、菌落形态等的图片,拍照时请注意在拍照物上留下清晰的标记
如“ 12级?班?组***”,实验过程中要留下详尽的原始实验记录。