实验三超氧化物歧化酶(SOD)的提取及活性测定
- 格式:ppt
- 大小:109.50 KB
- 文档页数:12
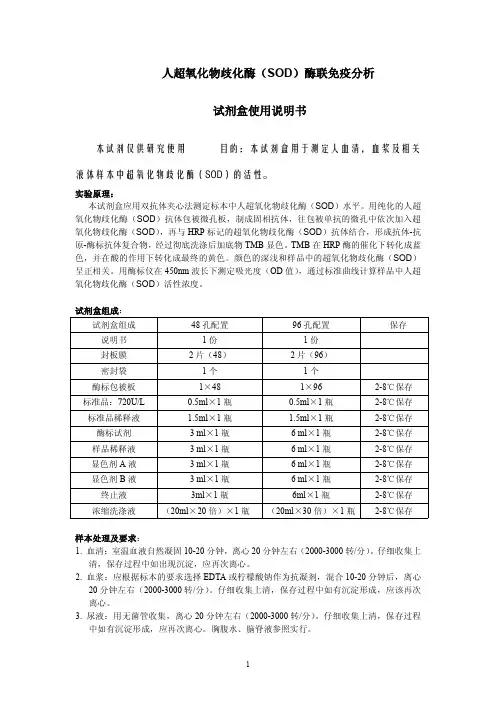
人超氧化物歧化酶(SOD)酶联免疫分析试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定人血清,血浆及相关液体样本中超氧化物歧化酶(SOD)的活性。
实验原理:本试剂盒应用双抗体夹心法测定标本中人超氧化物歧化酶(SOD)水平。
用纯化的人超氧化物歧化酶(SOD)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入超氧化物歧化酶(SOD),再与HRP标记的超氧化物歧化酶(SOD)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的超氧化物歧化酶(SOD)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人超氧化物歧化酶(SOD)活性浓度。
试剂盒组成:试剂盒组成48孔配置96孔配置保存说明书1份1份封板膜2片(48)2片(96)密封袋1个1个酶标包被板1×481×962-8℃保存标准品:720U/L0.5ml×1瓶0.5ml×1瓶2-8℃保存标准品稀释液 1.5ml×1瓶 1.5ml×1瓶2-8℃保存酶标试剂3ml×1瓶6ml×1瓶2-8℃保存样品稀释液3ml×1瓶6ml×1瓶2-8℃保存显色剂A液3ml×1瓶6ml×1瓶2-8℃保存显色剂B液3ml×1瓶6ml×1瓶2-8℃保存终止液3ml×1瓶6ml×1瓶2-8℃保存浓缩洗涤液(20ml×20倍)×1瓶(20ml×30倍)×1瓶2-8℃保存样本处理及要求:1.血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2.血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心20分钟左右(2000-3000转/分)。

SOD活性测定:SOD的测定方法很多,常见的有化学法,免疫法等电点聚焦法等,化学法测定的原理主要是利用有些化合物如邻苯三酚,在自氧化过程中会产生有色中间物降超氧游离基(O2)这样就可以利用SOD分例(O2)。
阻止中间物的积累而测定其酶活性。
1、试剂及仪器(1)邻苯三酚分析纯,用10mmol/LECL配成50mmol/L溶液。
(2)UV-754紫外分光光度计。
2、测定方法:(1)邻苯三酚自氧化速度的测定。
在25度、45ml`50mmol/L、PH值8.3、K2HPO4-KH2PO4缓冲液中加入10mmol/L的邻苯三酚,迅速摇匀,倒入光径1cm的比色杯内,在325mm波长下每隔30秒测A值一次,要求自氧化速度控制在0.0700d/mm 左右。
(2)SOD或粗酶抽提液活性测定:测定方法同测邻苯三酚自氧化速度,在加入邻苯三酚前加入待测SOD样液,测得数据按以下公式计算酶活性。
0.0700-A325mm/min----------------------------------------*100%度0.70样液稀释倍数样液稀释倍数酶活性(u/m1)=------------*反应液总体积*----------------50%样液体积3、蛋白浓度(mg/ml)和蛋白的计算:SOD或粗酶抽提液,经280mm紫外比色测定后,查牛轿清白蛋的标准曲线,由此算出每ml含ug蛋白的量。
蛋白浓度=ug蛋白/ml*样液稀释倍数*10负3次方=mg蛋白/ml总蛋白=mg蛋白/ml*原液总体积=mg蛋白。
4、比活(u/mg蛋白)的计算:单位活力(u/ml) 总活力比活=-----------------------=-----------------=u/mg蛋白蛋白的浓度(mg蛋白/ml) 总蛋白超氧化物歧化酶的活性测定超氧化物岐化酶(Superoxide dismutase,简称 SOD)广泛存在于生物体内的含Cu、Zn、Mn、Fe的金属类酶。

食叶草提取SOD探索北京军信泉盛环境科学技术研究院农业课题组食叶草提取SOD:SOD也叫超氧化物歧化酶,是一种源于生命体的活性物质,是一种含有金属元素的活性蛋白酶。
能消除生物体在新陈代谢过程中产生的有害物质。
对人体不断地补充 SOD具有抗衰老的特殊效果。
SOD是一种广泛存于动物、植物和微生物的生物酶,国外药用SOD系从血中提取,国内SOD已开发的品种已超过20种,证明我国对SOD的研究和应用已进入新时期。
用食叶草提取 SOD来源丰富,成本低,提取和纯化较方便SOD的应用技术:SOD是中国卫生部批准的具有延缓衰老功能的物质之一。
可抑制心脑血管疾病、抗衰老作用、自身免疫性疾病、肺气肿、辐射病及辐射防护、老年性白内障等。
食叶草SOD提取及测定:一、实验目的1、掌握食叶草细胞SOD提取和活力测定方法。
2、熟悉有关生化技术的基本原理和基本操作。
二、实验原理:食叶草和悬浮培养的食叶草细胞中含有丰富的SOD,通过组织或细胞破碎后,可用PH为7.8的磷酸缓冲液提取出。
由于SOD不溶于丙酮,可用丙酮将其沉淀析出。
三、实验步骤:1、细胞组织破碎:称取5克食叶草,置于研砵中研磨。
2、SOD提取:破碎后的组织中加入2~3倍体积的0.05mol/L磷酸缓冲液(PH 值=7.8),继续研磨20min,使SOD充分溶解到缓冲液中在5000rpm下离心15min,取上清液。
3、除去杂蛋白:上清液加入0.25体积的氯仿-乙醇混合液搅拌15min,5000r/min离心15min,得到的上清液为粗酶液。
4、SOD分离:粗酶液中加入等体积的冷丙酮,搅拌15min,5000r/min离心15min,得到SOD沉淀。
5、测SOD酶的活性①取约0.2gSOD测酶活,剩下的放入真空干燥机内干燥。
②取10ml缓冲液溶解,取2只离心管离心,取上清液,编号为 0,1,2。
③在3个离心管中分别家人200ul酶液。
④在0号管加400ulTCA,1、2号管分别加200u底物,从加入时开始计时,放入37℃水浴箱中10min。

丙⼆醛MDA、总抗氧化能⼒、超氧化物歧化酶(SOD)的测定丙⼆醛MDA、总抗氧化能⼒、超氧化物歧化酶(SOD)的测定丙⼆醛MDA测定测试所需仪器设备:可见光分光光度计,可调到95℃左右的恒温⽔浴箱(或者铝锅内放⼏个去掉盖⼦的易拉罐,将罐壁及底部穿数⼗个孔,以便⽔的进⼊,⽤来代替⽔浴箱)。
离⼼机。
100T试剂盒组成与配制:试剂⼀:液体20mL*1瓶,室温保存.(天冷时会凝固,每次测试前适当⽔浴加温以加速溶解,直⾄透明⽅可应⽤)。
试剂⼆:液体12mL*1瓶,⽤时每瓶加340mL双蒸⽔混匀,4℃冷藏。
试剂三:粉剂*1⽀,4℃冷藏。
1.按规范操作⽅法来配制MDA3号试剂:将1⽀100T的MDA3号粉剂倒⼊烧杯内加90℃~100℃的热蒸馏⽔64mL,充分溶解(溶解过程中可适当加热)。
冷却后加冰醋酸60mL混匀。
2.再将上述配好的MDA3号试剂⽤50%冰醋酸按2:1进⾏稀释,⽤多少配多少。
例如您需要⽤微量法测MDA需要试剂三为15mL,则可以取上述按规范操作法配好的试剂三10mL加冰醋酸5mL,混匀即可。
配好的试剂避光4℃冰箱冷藏(冰醋酸⾃备)注:因蒸馏⽔热胀冷缩,加热过程要蒸发,本应加60mL现多加4mL,冷却后在60mL。
50%冰醋酸的配制是50mL双蒸⽔加50mL冰醋酸混合⽽成的。
冰醋酸⼜名⼄酸,⼀般的医药公司、化剂公司均有售,要购AR级分析纯级的⼄酸较好,⼄酸含量为99%以上。
⽤时将粉剂加⼊到90℃~100℃的热双蒸⽔60mL中,(在溶解过程中可适当加热),充分溶解后⽤双蒸⽔补⾜⾄60mL再加冰醋酸60mL,混匀,配好的试剂避光冷藏。
冰醋酸⾃备。
标准品:10nmoL/mL四⼄氧基丙烷5mL*1瓶,4℃冷藏。
测试盒冷藏⾄少可保存⼀年。
操作步骤:混匀(摇动⼏下试管架)旋涡混匀器混匀,试管⼝⽤保鲜薄膜扎紧,⽤针头刺⼀⼩孔,95℃⽔浴(或⽤锅开盖煮沸40分钟),取出后流⽔冷却,然后3500~4000转/分,离⼼10分钟,取上清***,532nm处,1cm光径,蒸馏⽔调零,测各管吸光度值。

氮蓝四唑(NBT)法测定超氧物歧化酶(SOD)活力一、原理超氧物歧化酶(superoxidedismutase , SOD)普遍存在于动、植物体内,是一种清除超氧阴离子自由基的酶。
本实验依据超氧物歧化酶抑制氮蓝四唑(NBT)在光下的还原作用来确定酶活性大小。
在有氧化物质存在下,核黄素可被光还原,被还原的核黄素在有氧条件下极易再氧化而产生02,可将氮蓝四唑还原为蓝色的甲腙,后者在560nm处有最大吸收。
而SOD可清除02,从而抑制了甲腙的形成。
于是光还原反应后,反应液蓝色愈深,说明酶活性愈低,反之酶活性愈高。
据此可以计算出酶活性大小。
二、材料、仪器设备及试剂(一)材料;水稻或小麦叶片(二)仪器设备: 1.高速台式离心机; 2.分光光度计; 3.微量进样器; 4.荧光灯(反应试管处照度为4000Lx); 5.试管或指形管数支。
(三)试剂:1. 0.05mol/L 磷酸缓冲液(pH7.8);2. 130mmol/L 甲硫氨酸(Met )溶液:称1.9399gMet 用磷酸缓冲液定容至100ml(现用现配);3.750卩mol/L氮蓝四唑溶液:称取0.06133gNBT用磷酸缓冲液定容至100ml,(避光保存);4. 100卩mol/L EDTA- Na2溶液:称取0.03721gEDTA— Na2用磷酸缓冲液定容至1000ml ;5. 20卩mol/L核黄素溶液:称取0.0753g核黄素用蒸馏水定容至1000ml(避光保存)。
三、实验步骤1. 酶液提取取一定部位的植物叶片(视需要定,去叶脉)0.5g于预冷的研钵中,1ml预冷的磷酸缓冲液在冰浴上研磨成浆,加缓冲液使终体积为5ml。
取1.5〜2ml于1000rpm下离心20min,上清液即为SOD粗提液。
2. 显色反应取5ml指形管(要求透明度好)4支,2支为测定管,另2支为对照管,按下列加入各溶液:试剂(酶)用量(ml)终浓度(比色时)0.05mol/L磷酸缓冲液 1.5130mmol/L Met溶液0.313mmol/L 750 卩mol/L NBT 溶液0.375 卩mol/L 100 卩mol/L EDTA—Na2 液0.310 卩mol/L 20 卩mol/L核黄素0.320卩mol/L酶液0.052支对照管以缓冲液代替酶液蒸馏水0.25总体积3.0 混匀后将1支对照管置暗处,其它各管于4000LX日光下反应20min (要求各管受光情况一致,温度高时间缩短,低时延长)。

超氧化物歧化酶(SOD)提取液简介:超氧化物岐化酶(Superoxide Dismutase, SOD)是含金属辅基的酶,能催化超氧化物阴离子发生岐化作用,生成过氧化氢(H 2O 2)和氧气(O 2),是生物体内一种重要的抗氧化酶。
由于超氧自由基是不稳定的的自由基,寿命极短,SOD 活性一般用间接方法测定,并利用各种呈色反应来测定SOD 活力,其中显色剂有NBT(四氮唑蓝)、WST-1、WST-8等。
Leagene 超氧化物歧化酶(SOD)提取液主要用于裂解组织样本、细胞样本,提取样品中的过氧化物酶。
该试剂仅用于科研领域,不宜用于临床诊断或其他用途。
组成:自备材料:1、 蒸馏水2、 离心管或试管3、 匀浆器或研钵4、 低温离心机操作步骤(仅供参考):1、植物组织样品:取正常或逆境下的新鲜植物组织,清洗干净,擦干,切碎,迅速称取,按植物组织:超氧化物歧化酶(SOD)提取液=的比例,加入预冷的超氧化物歧化酶(SOD)提取液,冰浴情况下充分捣碎或研磨,用超氧化物歧化酶(SOD)提取液冲洗研钵或匀浆器,合并冲洗液至该离心管,补加超氧化物歧化酶(SOD)提取液至10ml ,离心10min ,取上清液(SOD 粗提液)用于酶活性的测定。
2、动物组织样品:动物用含有20U/ml Heparin 的生理盐水(0.9% NaCl containing 20U/ml Heparin)灌流清除血液后获取组织样品。
按照每100mg 组织加入500μl SOD 检测缓冲液的比例,用玻璃匀浆器在4℃或冰浴匀浆,离心10min ,取上清液(SOD 粗提液)用于酶活性的测定。
3、血浆或含红细胞的样品:从待测样品中分理出的血清或血浆不应有溶血,如果含有应去除红细胞后检测,如超过检测范围,用超氧化物歧化酶(SOD)提取液稀释后检测。
血清去除红细胞的简易方法如下:用抗凝管收集血液,颠倒混匀,取至少500μl 全血,4℃ 3000g 编号 名称 CS0395 Storage 超氧化物歧化酶(SOD)提取液 500ml RT 使用说明书 1份离心5min,转移上清至另一新的1ml离心管中,适量生理盐水稀释后待测。

摘要:通过对绿豆种子的研磨破碎获得SOD粗酶,经过硫酸铵分级分离、透析除盐和浓缩等过程,除去粗酶液中的杂质及干扰蛋白,采用葡聚糖(Sephadex G-100)凝胶层析得到纯化的SOD酶。
跟踪提纯过程活性的分布,并评价提取过程各步骤的效率。
实验结果证实随着不断的分离提纯,总活力以及总蛋白不断减小,比活力不断上升,最终得到的结果为总纯化倍数为0.68,活性得率为5.24%。
一、前言:超氧化物歧化酶简称SOD,是一种新型酶制剂,属金属酶。
分布很广,几乎从哺乳动物到细菌,以及植物中均存在。
在微生物中主存于需氧菌。
SOD是催化超氧阴离子(O2-)歧化反应的酶类,能通过歧化反应清除生物细胞中的超氧自由基(O2.-),生成H2O2和O2.H2O2由过氧化氢酶(CAT)催化生成H2O 和O2,从而减少自由基对有机体的毒害。
它的存在与生物体内的解毒作用有关,也发现与机体的衰老、肿瘤及免疫性疾病等有关。
自1968 年发现SOD 后,立刻引起科学界的高度重视,近40 年来这方面的研究进展非常迅速,它的应用领域日益拓宽,SOD 也有了产品.国外从牛红细胞中制得的超氧化物歧化酶,其商品名为Orgotein.不少人研究Orgotein的药理性质,证明它无毒,无抗原性,能抗发炎、抗超氧离子、抗病毒感染。
二十世纪80 年代后期,我国关于SOD 的研究及应用也形成了热点,如今已在化妆品添加剂、饮料及医药方面显示了特殊效果。
SOD作为治因而受到医药界的关注。
目前中国国内已进入临床试验阶段。
本实验以绿豆为原料提取SOD,通过各步的分离提纯,应测得酶总活力逐渐减小,比活逐渐升高.通过本实验掌握物质分离纯化的实验设计过程,以及硫酸铵分离、透析除盐、浓缩和葡聚糖凝胶层析等物质分离技术。
二、实验材料与方法:<一>材料:绿豆种子,市售新鲜绿豆种子浸泡蒸馏水24小时备用.<二>试剂:葡聚糖(sephadexG-100), NaCl(AP), 磷酸氢二钠(AP), 磷酸二氢钠(AP), 三羟甲基氨基甲烷(Tris), 盐酸(浓盐酸),硫酸铵(AP), PEG6000 ,考马斯亮蓝G250 , 磷酸,乙醇(95%),牛血清蛋白BSA , 连苯三酚(焦性没食子酸), EDTA(钠盐) , 超氧化物歧化酶(sigma公司)。

动物血中超氧化物歧化酶(superoxide dismutase,SOD)的提取[原理]l969年,McCord和Fridovich第一次从牛血中提纯到超氧化物岐化酶。
自然界中SOD分布极广,其含量随生物体的不同而不同,即使同一种生物的不同组织或同一组织的不同部位,其SOD的种类和含量也有很大差别。
迄今为止人们已从细菌,真菌、原生动物。
藻类、昆虫、鱼类、植物和动物等各种生物体内分离得到SOD。
为拓宽提取SOD的原料,筛选或基因过程开发产SOD量较高的菌株。
目前,研究开发最多的资源还是从动物血液、动物组织中制备提纯SOD。
从动物血液材料中制备Cu Zn-SOD纯化工艺分为三个主要步骤:(1)原材料的预处理;(2)粗酶液的制备;(3)离子交换柱层析精制。
国内多采用Mccord和 Fridovich法,其主要工艺过程为:第一步,乙醇-氯仿除去血红蛋白;第二步,有机溶剂和硫酸铵分级沉淀;第三步,离子交换柱层析精制。
[试剂和器材]1、试剂(1)3.8%(质量分数)柠檬酸三钠(2)0.9%(质量分数)氯化钠(3)95%(体积分数)乙醇(4)氯仿(5)丙酮(6)pH7.6、 2.5mmol/L K2HPO4-KH2PO4缓冲液(7)DEAE-Sephadex A-502、器材(1)猪血(2)恒温水浴(3)离心机(4)布氏漏斗、抽滤瓶(5)烧杯、量筒、搅棒(6)透析袋[方法和步骤]1、从猪血中提取SOD(1)分离血球取新鲜猪血,加入到3.8%柠檬酸三钠抗凝液中,新鲜猪血与抗凝液的比例为3:1,轻轻搅拌均匀,4 000r/min离心20min,收集红血球。
(2)除血红蛋白红血球用3倍体积生理盐水洗涤,4 000r/min离心20min,重复三次,然后向洗净的红血球加入1~1.1倍体积去离子水,搅拌溶血30min,再向溶血液中分别缓慢加入0.25倍体积的预冷95%乙醇和0.15倍体积的预冷氯仿,剧烈搅拌15min左右,静置1h,然后 4 000r/min离心20min除去变性血红蛋白沉淀,取清液,过滤,收集滤液(记录体积,测酶活性和蛋白浓度)。

SOD活力测定(NBT还原法)植物叶片在衰老过程中发生一系列生理生化变化,如核酸和蛋白质含量下降、叶绿素降解、光合作用降低及内源激素平衡失调等。
这些指标在一定程度上反映衰老过程的变化。
近来大量研究表明,植物在逆境胁迫或衰老过程中,细胞内自由基代谢平衡被破坏而有利于自由基的产生。
过剩自由基的毒害之一是引发或加剧膜脂过氧化作用,造成细胞膜系统的损伤,严重时会导致植物细胞死亡。
自由基是具有未配对价电子的原子或原子团。
生物体内产生的自由基主要有超氧自由基(O2-)、羟自由基(OH.)、过氧自由基(ROD)、烷氧自由基(RO)等。
植物细胞膜有酶促和非酶促两类过氧化物防御系统,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)和抗坏血酸过氧化物酶(ASA-POD)等是酶促防御系统的重要保护酶。
抗坏血酸(VC)、VE和还原型谷胱甘肽(GSH)等是非酶促防御系统中的重要抗氧化剂。
SOD、CAT等活性氧清除剂的含量水平和O2-、H2O2、OH. 和O2等活性氧的含量水平可作为植物衰老的生理生化指标。
超氧自由基(O2.-)是生物细胞某些生理生化反应常见的中间产物。
自由基是本身带有不成对价电子的分子、原子、原子团或离子,化学性质非常活泼,是活性氧的一种。
如果细胞中缺乏清除自由基的酶时,机体就会受到各种损伤。
超氧化物歧化酶(Superoxide Dismutase),简称SOD,能通过歧化反应清除生物细胞中的超氧自由基(O2.-),生成H2O2和O2。
H2O2由过氧化氢酶(CAT)催化生成H2O和O2,从而减少自由基对有机体的毒害。
一、原理超氧物歧化酶(superoxidedismutase,SOD)普遍存在于动、植物体内,是一种清除超氧阴离子自由基的酶。
本实验依据超氧物歧化酶抑制氮蓝四唑(NBT)在光下的还原作用来确定酶活性大小。
在有氧化物质存在下,核黄素可被光还原,被还原的核黄素在有氧条件下极易再氧化而产生O2-,可将氮蓝四唑还原为蓝色的甲腙,后者在560nm处有最大吸收。

植物组织中SOD活性MDA含量的测定方法超氧化物歧化酶(superoxide dismutase,SOD)活性和丙二醛(malondialdehyde,MDA)含量是评价植物细胞的氧化应激程度和损伤程度的重要指标。
下面将介绍常用的测定植物组织中SOD活性和MDA含量的方法。
一、SOD活性测定方法:1. 混合植物组织提取液:将适量的植物组织(如叶片、根部等)加入冰冻磨碎器中,加入适量的冰冷提取液(Tris-HCl缓冲液,pH 7.8或其他适宜缓冲液),按比例加入少量酒石酸、酚酸、DTT等,然后将混合物离心10分钟。
2.处理提取物:将上述所得的植物组织提取液加入活性溶液,如NBT、PIP等,混匀后放置在37°C水浴中反应一定时间。
3. 停止反应:将反应液加入组织破壁液(甘油、NaCl、Tween-20等混合物),混匀后放置一段时间,离心10-15分钟。
4.测定光密度:取上清液用比色计测定光密度(OD)值,以反映SOD的活性,活性越高,OD值越低。
二、MDA含量测定方法:1.组织提取:将适量的植物组织加入冰冷提取液(如磷酸盐缓冲液,pH7.4),用冷磨具磨碎并移至离心管中,离心5分钟收集上清液。
2.加入TBA液:取上清液与TBA液(三硝基苞球菌素溶液)按比例混合,混匀后在水浴中加热(100°C,10分钟),然后迅速冷却至室温。
3.离心沉淀:将样品离心10分钟,取上清液。
4.测定光密度:分别取上清液测定OD值,OD值越高,MDA含量越高。
三、优化与改进:1.提取液的选择:根据不同植物组织的特点选择合适的提取液,以提高SOD活性和MDA含量的测定效果。
2.比色反应的时间和温度的调整:根据植物组织中SOD活性的变化调整反应时间和温度,以保证测定结果的准确性。
3.重复测量:为了提高实验结果的可靠性,可以重复测量同一样本,并取平均值作为最终结果。
4.与对照的比较:将测定样本与对照组进行比较,以评估SOD活性和MDA含量的变化,进一步分析植物组织的氧化应激程度和损伤程度。
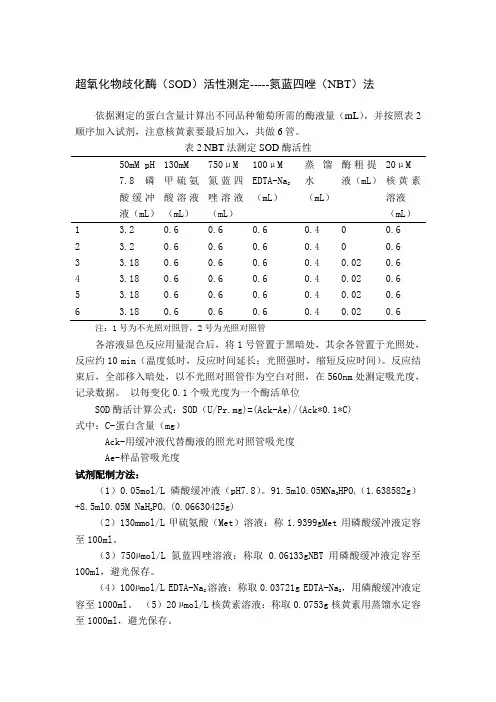
超氧化物歧化酶(SOD)活性测定-----氮蓝四唑(NBT)法依据测定的蛋白含量计算出不同品种葡萄所需的酶液量(mL),并按照表2顺序加入试剂,注意核黄素要最后加入,共做6管。
表2 NBT法测定SOD酶活性50mM pH 7.8磷酸缓冲液(mL)130mM甲硫氨酸溶液(mL)750μM氮蓝四唑溶液(mL)100μMEDTA-Na2(mL)蒸馏水(mL)酶粗提液(mL)20μM核黄素溶液(mL)1 3.2 0.6 0.6 0.6 0.4 0 0.62 3.2 0.6 0.6 0.6 0.4 0 0.63 3.18 0.6 0.6 0.6 0.4 0.02 0.64 3.18 0.6 0.6 0.6 0.4 0.02 0.65 3.18 0.6 0.6 0.6 0.4 0.02 0.66 3.18 0.6 0.6 0.6 0.4 0.02 0.6注:1号为不光照对照管,2号为光照对照管各溶液显色反应用量混合后,将1号管置于黑暗处,其余各管置于光照处,反应约10 min(温度低时,反应时间延长;光照强时,缩短反应时间)。
反应结束后,全部移入暗处,以不光照对照管作为空白对照,在560nm处测定吸光度,记录数据。
以每变化0.1个吸光度为一个酶活单位SOD酶活计算公式:SOD(U/Pr.mg)=(Ack-Ae)/(Ack*0.1*C)式中:C-蛋白含量(mg)Ack-用缓冲液代替酶液的照光对照管吸光度Ae-样品管吸光度试剂配制方法:(1)0.05mol/L磷酸缓冲液(pH7.8)。
91.5ml0.05MNa2HPO4(1.638582g)+8.5ml0.05M NaH2PO4(0.06630425g)(2)130mmol/L甲硫氨酸(Met)溶液:称1.9399gMet用磷酸缓冲液定容至100ml。
(3)750µmol/L氮蓝四唑溶液:称取0.06133gNBT用磷酸缓冲液定容至100ml,避光保存。
NBT法测定SOD活力1.原理超氧化物岐化酶(superoxide dismutase,SOD)普遍存在于动、植物体内,是一种清除超氧阴离子自由基(O2.-)的酶,它催化下列反应:2 O2.- + 2H+→H2O2 + O2反应产物H2O2可由过氧化氢酶进一步分解或被过氧化物酶利用。
实验中依据超氧化物歧化酶抑制氮蓝四唑(NBT)在光下的还原作用来确定酶活性大小。
在有氧化物质存在下,核黄素可被光还原,被还原的核黄素在有氧条件下极易再氧化而产生O2.-,O2.-可将氮蓝四唑还原为蓝色的甲腙,后者在560nm处有最大吸收。
而SOD可清除O2.-,从而抑制了甲腙的形成。
于是光还原反应后,反应液蓝色愈深,说明酶活性愈低,反之酶活性愈高。
据此可计算出酶活性大小。
2.试剂50mM,PH7.8磷酸缓冲液(57.1875mL A + 5.3125mL B定容至250mL)130mM甲硫氨酸,0.1940g →10mL,磷酸缓冲液配制750µM NBT,0.0061g →10mL,磷酸缓冲液配制100µM EDTA-Na2,0.0037g →100mL,磷酸缓冲液配制20µM 核黄素,0.00753g →100mL,蒸馏水配制,避光保存附录:不同pH 磷酸缓冲液的配制母液:A:0.2M Na2HPO4溶液:Na2HPO4.12H2O 71.64g用蒸馏水溶至1LB:0.2M NaH2PO4溶液:NaH2PO4.2H2O 15.60g用蒸馏水溶至500mL100mM磷酸缓冲液配法:x(mL)A + y(mL)B稀释至200 mL3.实验步骤(1)酶液粗提称取一定量的实验材料于预冷的研钵中,加入适量磷酸缓冲液,冰浴充分研磨后定容(1mL/0.1g)。
取1.5mL匀浆于4℃,10000rpm离心15min,上清液即为酶粗提液。
(POD,CAT,MDA,可溶性蛋白等的测定均按此方法提取)(2)反应液配制取透明度好的指形管或离心管,按下表依次加入各溶液:试剂(酶液)用量/µL 终浓度/比色时50mM磷酸缓冲液600130mM Met 120 13 mM750µM NBT 120 75µM 100µM EDTA-Na2120 10µM20µM 核黄素120 2.0µM酶液20 对照以缓冲液代替酶液蒸馏水100总体积1200混匀后将1只对照管放在暗处,其它各样品于4000lx日光下反应20min(各管受光必须一致,温度高则缩短时间,低则延长)。
实验五SOD 活性的测定一、实验目的学习并掌握氮蓝四唑(NBT)法测定植物体内超氧化物歧化酶(SOD)活性的基本原理和操作方法。
二、实验原理超氧物歧化酶(superoxidedismutase SOD)普遍存在于动、植物体内,是一种清除超氧阴离子自由基的酶。
测定SOD 活性的方法很多,简便且常用的是NBT (氮蓝四唑)光还原法。
该方法的原理是超氧化物歧化酶抑制氮蓝四唑(NBT )在光下的还原作用来确定酶活性大小。
当反应体系中有可被氧化的物质存在时,核黄素可被光还原,被还原的核黄素在有氧条件下极易再氧化而产生氧气,氧气被单电子还原产生氧自由基,氧自由基则可将氮蓝四唑还原为蓝色的化合物,后者在560nm 处有最大吸收。
而SOD 可清除氧自由基,当反应体系中有SOD 存在时可抑制NBT 的还原,于是光还原反应后,反应液蓝色愈深,说明酶活性愈低,反之酶活性愈高。
因此可通过测定A560 来计算SOD 的活性,以抑制NBT 光还原反应50%所需的酶量为一个酶活性单位。
三、实验材料、试剂与仪器1. 实验材料:小白菜叶片。
2. 实验试剂:(1)0.05mol/L 磷酸缓冲液(pH7.8);(2)130mmol/L甲硫氨酸(Met)溶液:称1.9399gMet用磷酸缓冲液定容至100ml;(3)750卩mol/L氮蓝四唑(NBT)溶液:称取0.06133gNBT用磷酸缓冲液定容至100ml,避光保存;(4)100 卩mol/LEDTA-Na2 溶液:称取0.03721g EDTA-Na2 用磷酸缓冲液定容至1000ml;(5)20卩mol/L核黄素溶液:100卩mol/L核黄素溶液稀释5倍即实验所需的20卩mol/L核黄素溶液;(6)SOD提取介质:50mmol/L磷酸缓冲液(pH7.8)内含1%的聚乙烯吡咯烷酮(PVP)、3. 实验仪器:高速台式离心机,可见分光光度计,光照培养箱,专用试管,研钵等。
四、实验步骤1 、粗酶液提取将小白菜叶片放置在冰箱中冷处理3min,用作胁迫对照。
SOD活性测定:SOD的测定方法很多,常见的有化学法,免疫法等电点聚焦法等,化学法测定的原理主要是利用有些化合物如邻苯三酚,在自氧化过程中会产生有色中间物降超氧游离基(O2)这样就可以利用SOD分例(O2)。
阻止中间物的积累而测定其酶活性。
1、试剂及仪器(1)邻苯三酚分析纯,用10mmol/LECL配成50mmol/L溶液。
(2)UV-754紫外分光光度计。
2、测定方法:(1)邻苯三酚自氧化速度的测定。
在25度、45ml`50mmol/L、PH值、K2HPO4-KH2PO4缓冲液中加入10mmol/L的邻苯三酚,迅速摇匀,倒入光径1cm的比色杯内,在325mm波长下每隔30秒测A值一次,要求自氧化速度控制在mm 左右。
(2)SOD或粗酶抽提液活性测定:测定方法同测邻苯三酚自氧化速度,在加入邻苯三酚前加入待测SOD样液,测得数据按以下公式计算酶活性。
-A325mm/min----------------------------------------*100%度样液稀释倍数样液稀释倍数酶活性(u/m1)=------------*反应液总体积*----------------50%样液体积3、蛋白浓度(mg/ml)和蛋白的计算:SOD或粗酶抽提液,经280mm紫外比色测定后,查牛轿清白蛋的标准曲线,由此算出每ml含ug蛋白的量。
蛋白浓度=ug蛋白/ml*样液稀释倍数*10负3次方=mg蛋白/ml总蛋白=mg蛋白/ml*原液总体积=mg蛋白。
4、比活(u/mg蛋白)的计算:单位活力(u/ml) 总活力比活=-----------------------=-----------------=u/mg蛋白蛋白的浓度(mg蛋白/ml) 总蛋白超氧化物歧化酶的活性测定超氧化物岐化酶(Superoxide dismutase,简称 SOD)广泛存在于生物体内的含Cu、Zn、Mn、Fe的金属类酶。
它作为生物体内重要的自由基清除剂,可以清除体内多余的超氧阴离子,在防御生物体氧化损伤方面起着重要作用。
一、实验目的1. 了解大蒜中SOD的提取方法及其酶活力测定原理。
2. 掌握大蒜中SOD的提取与分离实验步骤。
3. 分析大蒜中SOD的提取效果及酶活力。
二、实验原理超氧化物歧化酶(SOD)是一种具有抗氧化、抗衰老、抗辐射和消炎作用的药用酶。
它可催化超氧负离子进行歧化反应,从而降低细胞内的氧自由基浓度,保护细胞免受氧化损伤。
大蒜中含有丰富的SOD,本实验旨在通过提取和分离大蒜中的SOD,研究其酶活力,为后续研究提供实验数据。
三、实验材料与仪器1. 实验材料:新鲜大蒜、0.05mol/L磷酸缓冲液(pH7.8)、无水乙醇、氯仿、硫酸铵等。
2. 实验仪器:电子天平、高速冷冻离心机、超声波破碎仪、分光光度计、恒温培养箱等。
四、实验步骤1. 大蒜SOD的提取(1)称取150g新鲜大蒜蒜瓣,研磨2倍体积的0.05mol/L磷酸缓冲液(pH7.8),继续研磨至浆状。
(2)静置20min,使SOD充分溶解到缓冲液中。
(3)4℃下以8000r/min离心10min,取上清液。
2. 除杂蛋白(1)取上清液,加入硫酸铵至饱和,静置2h。
(2)4℃下以8000r/min离心10min,收集沉淀。
(3)用0.05mol/L磷酸缓冲液(pH7.8)溶解沉淀,透析过夜。
3. SOD的纯化(1)将透析后的溶液用氯仿-甲醇(体积比2:1)沉淀蛋白质,静置2h。
(2)4℃下以8000r/min离心10min,收集沉淀。
(3)用0.05mol/L磷酸缓冲液(pH7.8)溶解沉淀,透析过夜。
4. SOD酶活力测定(1)取一定量的SOD样品,加入0.05mol/L磷酸缓冲液(pH7.8)稀释至适当浓度。
(2)取0.1ml稀释后的SOD样品,加入0.1ml0.1mol/L邻苯三酚溶液,37℃下反应5min。
(3)立即加入0.1ml0.02mol/LHCl终止反应。
(4)在波长320nm下测定吸光度。
(5)计算酶活力。
五、实验结果与分析1. 大蒜SOD的提取效果根据实验结果,本实验成功提取了大蒜中的SOD,提取率约为0.5%。
大蒜中超氧化物歧化酶的提取及其酶活力测定一、实验目的:⒈掌握SOD酶的提取、分离、检测一般步骤。
⒉了解酶在提取过程中的两个参数:回收率、纯化倍数。
⒊掌握离心机的使用。
二、实验原理:邻苯三酚在碱性条件下可迅速自氧化,释放出O2-,生成带色的中间产物,在420nm有最大吸收峰。
邻苯三酚自氧化产生的中间产物在40s-3min这段时间,生成物与时间有较好的线性关系。
颜色深→SOD逐渐增多→颜色浅,即酶活力越大,颜色越浅。
三、实验材料及试剂:大蒜、磷酸缓冲液(PH7.8, 0.05mol/l)、氯仿—乙醇混合液、冷丙酮、邻苯三酚(焦性没食子酸)、浓盐酸四、操作步骤:1、SOD提取:称取5g大蒜蒜瓣,加入石英砂研磨破碎细胞,加入15ml的PH7.8 0.05mol/L的磷酸缓冲液,研磨搅拌20分钟,使SOD充分溶解,6000rpm 离心,弃去沉淀,得上清液。
(留出1ml备用,准确量取剩余上清液体积,记录)2、除杂蛋白:提取液加入1/4体积的氯仿-乙醇混合液搅拌10分钟,6000rpm 离心15min去沉淀,得粗酶液。
(取1ml粗酶液备用,精确测量剩余粗酶液体积)3、SOD酶的沉淀分离:剩余的粗酶液中加入等体积的冷丙酮,搅拌15min,6000rpm 离心15min,得到SOD酶沉淀。
将沉淀每管先加2ml磷酸缓冲液,溶解后在加3ml 混匀。
6000rpm离心15min,取上清得到SOD酶液。
取1ml备用,其余量取体积。
4、粗酶液活性测定(邻苯三酚法)提取液、粗酶液、酶液中SOD活力检测,具体步骤如下。
加入邻苯三酚后迅速混匀,准确计时4min,加一滴浓盐酸停止反应,420nm测吸光值.5、溶液中可溶性蛋白含量测定:分别从1ml 备用的提取液、粗酶液、酶液各取0.3ml按以下倍数稀释,260nm/280nm测定吸光值,按公式计算蛋白质浓度.提取液稀释:50 ×粗酶液稀释:20 ×酶液稀释:10 ×蛋白质浓度(mg/ml)=(1.45A280 –0.74A260) ×稀释倍数6、计算:酶活力单位U/ml=2(OD1-OD2)×5/0.1(1ml反应液中,每分钟抑制邻苯三酚自氧化速率达到80%时的酶量)总活力U=活力单位×总体积比活力U/mg=活力单位/蛋白质浓度纯化倍数=粗酶液(酶液)比活力/提取液比活力回收率=粗酶液(酶液)总活力/提取液总活力五、实验数据记录及结果计算:1、提取液、粗酶液、酶液体积记录(除去留下的1ml)2、420nm吸光值测定:3、稀释后的SOD提取液280nm\260nm吸光值:4、按公式计算蛋白质浓度:稀释提取液中蛋白质浓度:(1.45×0.055-0.74×0.082)×50=0.9535mg/ml 稀释粗酶液中蛋白质浓度:(1.45×0.098-0.74×0.144)×20=0.7108mg/ml 稀释酶液中蛋白质浓度:(1.45×0.030-0.74×0.040)×10=4.054mg/ml5、酶活力单位、总活力、比活力计算:6、粗酶液:纯化倍数=粗酶液比活力/提取液比活力=35.9595/15.1023=2.3811回收率=粗酶液总活力/提取液总活力=25.56/14.4×100%=177.5%酶液:纯化倍数=酶液比活力/提取液比活力=5.6167/15.1023=0.3719回收率=酶液总活力/提取液总活力=22.77/14.4×100%=158.1%。