错误折叠的蛋白质共26页文档
- 格式:ppt
- 大小:3.15 MB
- 文档页数:26

错误折叠与蛋白质构象病生物物理系 2005级硕士研究生刘莹摘要:许多疾病的发生是由蛋白质错误折叠引起的,这类疾病被称为蛋白质错误折叠病。
蛋白质突变、泛素-蛋白酶和自噬功能的失常与蛋白质错误折叠的发生,异常蓄积和聚集有关。
本文综述了蛋白质错误折叠和聚集的机制和部分蛋白质构象病产生的机理。
关键词:蛋白质错误折叠;分子伴侣;泛素-蛋白酶系统;溶酶体途径;Prion;蛋白质是生物体的组成成分之一,在物质代谢、机体防御、血液凝固、肌肉收缩、细胞信息传递、个体生长发育、组织修复等方面均有不可替代的重要作用。
具有完整一级结构的多肽或蛋白质,只有当其折叠形成正确的三维空间结构才可能具有正常的生物学功能。
一旦蛋白质形成了错误的空间结构,将丧失其生物学功能,还会引起相关疾病,迄今已发现20 多种蛋白质的错误折叠与疾病相关,神经退行性疾病如阿尔茨海默病’s disease , AD) , 帕金森病(Parkinson’s disease , PD) ,亨廷顿舞蹈病(Huntington’sdisease ,HD) ,朊蛋白病(prion disease) ,家族性肌萎缩侧索硬化症(familial amyotrophic lateral sclerosis ,ALS) 等均与错误折叠的蛋白质聚合和沉积有关。
一蛋白质折叠与降解的机制蛋白质的一级结构是其特定空间结构的基础,此外,肽链还需经过与翻译同时进行的和翻译完成后的化学加工,如形成二硫键,完成糖基化、羟基化、磷酸化等化学修饰。
这些化学修饰以及蛋白质亚基的非共价键聚合、蛋白质的靶向输送等均与肽链的折叠密切相关。
在细胞内大多数天然蛋白质能自发形成比较稳定的天然结构, 或被配体和代谢因子所稳定。
但约10 %~20 %新合成的多肽链需要分子伴侣的帮助才能正确折叠。
此外,约有20 %新合成的多肽链不能形成正确的三维结构而被蛋白酶降解,包括由于错误转录和翻译形成的不完全蛋白质,翻译后受到化学损伤或其他因素引起的失活、去折叠或折叠错误的蛋白质。

Protein Folding and Misfolding 蛋白质的折叠和错误折叠蛋白质是生命体中最为重要的分子之一,它们扮演着多种生物过程中至关重要的角色。
在细胞内和细胞外,蛋白质通过复杂的折叠结构,在生物的生长、发育、调节、代谢、运动、感知和免疫等方面发挥着极其重要的作用。
蛋白质的折叠状态与其功能密切相关,而且蛋白质的结构和功能之间有着非常微妙的平衡关系。
正常的蛋白质折叠是生命体正常运转的必要条件,而错误的折叠则会导致蛋白质的结构和功能异常,引发许多疾病。
蛋白质折叠的过程十分复杂。
当蛋白质由氨基酸序列被合成出来后,它们并不是成熟的状态,而是被称为“未折叠状态”。
为了形成正确的折叠结构,需要耗费大量的时间和能量。
蛋白质折叠涉及到许多机制,如互作用力、氢键、范德华力、静电相互作用和疏水性等因素。
虽然这些机制不能完全解释蛋白质的折叠过程,但它们提供了关于疏水作用和分子间相互作用的表象。
在正常情况下,蛋白质在其自然环境中可以顺利完成折叠,达到稳定、规整、功能性的状态。
但是,一旦它们的折叠过程中受到干扰,就可能会发生错误折叠。
在错误折叠中,蛋白质失去其规则的空间结构,形成异常的三维结构。
异常结构通常称为“蛋白聚集体”,常见的聚集体包括“淀粉样斑块”(amyloid plaques)和“纤维瘤样聚集物”(fibrillar aggregation)。
这些聚集体对生物体产生一定的毒性,与其相关的疾病有亚旁垂体腺瘤、老年痴呆症、帕金森综合症、肌萎缩性侧索硬化症、奥尔茨海默病、糖尿病等。
蛋白质错误折叠的成因以及如何预防和治疗异常折叠是一个重要的研究方向。
目前的研究成果表明,许多环境因素和遗传因素都可以造成蛋白质折叠的异常,包括氧化应激、药物毒性、重金属中毒、普鲁托蛋白异常、卟啉代谢障碍等。
人们通过改变相对环境中的物理和化学参数以及药物设计等方式尝试降低蛋白质错误折叠的风险。
例如,使用透过疏水分子和亲水分子相互作用而更加稳定的小分子和复合物来代替蛋白质、预测折叠稳定性、制备抑制蛋白质聚集的药物等。

蛋白质折叠和错误折叠在神经退行性疾病中的作用在疾病的研究中,蛋白质折叠是一项重要的研究方向。
蛋白质折叠没有完成,将会导致蛋白质的失去功能。
而错误的蛋白质折叠则会导致蛋白质形成想形态,甚至毒性物质,引起身体疾病。
在神经退行性疾病中,蛋白质错误折叠的作用更是无可替代的。
神经退行性疾病是一类随着年龄增长而逐渐出现的、逐渐进展、不能治愈的神经系统疾病。
例如,阿尔兹海默病,亨廷顿病等。
这些疾病会导致神经细胞的变性,可能伴随认知能力的下降、运动能力的退化等病情。
研究表明,在这些疾病的发展过程中,蛋白质错误折叠起到至关重要的作用。
阿尔兹海默病是一种老年性痴呆症,是由反式淀粉质蛋白质在大脑中广泛积累所致。
这种蛋白质在正常情况下是由神经元产生和分解的。
然而,当这种蛋白质折叠错误时,它们会在大脑中累积,形成阿尔兹海默病中的“神经元堆积”,导致神经元死亡。
这种蛋白质错误折叠的过程不仅会影响神经元,还会影响与大脑认知相关区域的支持细胞,从而影响个体的认知能力。
另一个例子是亨廷顿病。
这是一种遗传性疾病,由一种称为展缩性多面体蛋白(HTT)的蛋白质的错误折叠导致。
HTT蛋白是一种完全正常的蛋白,在正常信号传递和对神经细胞的支持中发挥作用。
然而,当HTT错误折叠时,它们会形成毒性物质,称为“展缩体”,这些物质会对神经元产生破坏,导致运动障碍和认知障碍等症状。
过去几十年,对这些神经退行性疾病的研究表明,蛋白质错误折叠在这些疾病中发挥了至关重要的作用。
因此,研究人员还在探索如何影响蛋白质折叠。
一些研究团队正在研究将正常的蛋白质注入病人,以减轻神经退行性疾病的症状。
虽然这项技术还很初级,但它已经表明,蛋白质折叠和错误折叠在治疗神经退行性疾病方面具有巨大的治疗潜力。
总结起来,蛋白质错误折叠在神经退行性疾病中扮演了至关重要的角色。
人们正在努力研究如何通过控制蛋白质折叠来预防或治疗这些疾病。
随着这方面研究的进展,我们相信,将能够提供更多的治疗方案,从而帮助人们更好地应对神经退行性疾病。
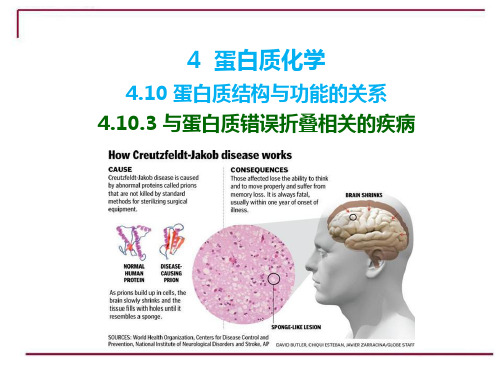

蛋白质错误折叠及其相关疾病作者:孙月菊包宪霞刘蕾来源:《中国科技纵横》2013年第23期【摘要】蛋白质在生物体中发挥着十分重要的功能,从催化化学反应到抵御外来侵略都是蛋白质作用的结果,蛋白质折叠是生命活动的最基本过程,近年来发现蛋白质折叠异常也可导致疾病,对其致病机理人们也提出了许多假说,这些假设正在进一步的完善当中。
本文介绍了细胞内保证蛋白质折叠的控制、与蛋白质错误折叠有关的一些疾病及蛋白质错误折叠可能的致病机理。
【关键词】蛋白质错误折叠疾病致病机理细胞是生命体的基本单位,蛋白质是细胞的支柱。
为了保证细胞的正常生活及功能,生物体已经发展出一套完整的体系来帮助新合成的蛋白正确折叠:1 蛋白质的折叠控制细胞从以下三个层次进行调控防止错误蛋白质的产生,即复制、翻译及翻译后等环节。
1.1 复制环节DNA的复制因其复制机制的复杂性而具有高度的精确性和准确性,DNA可能被内源或外源的因素损伤,但是机体可以通过碱基删除和核苷删除过程分别对由内源和外源因素引起的DNA损伤进行修复,从而保证了模板的正确性。
1.2 翻译环节翻译过程非常复杂,需要200种以上的生物大分子,包括核糖体、mRNA、tRNA、氨酰tRNA合成酶和各种可溶性的蛋白质因子,它是中心法则中的核心步骤。
因为翻译过程的复杂调控其出错率很低,实验结果也证实了这一点,氨基酸导入的错误率仅为万分之一。
1.3 翻译后环节翻译后产生的新生多肽链如何进行正确折叠?多余的多肽链又如何清除?发生错误的多肽链如何处理,重新折叠还是直接清除?细胞通过两种方式应对这种情况。
(1)分子伴侣。
分子伴侣是一类相互之间有关系的蛋白,它们的功能是帮助不能自发折叠的蛋白质在体内进行正确的非共价的组装,并且不是组装完成的结构在发挥其正常的生物功能时的组成部分。
包括:Hsp60(GroEL)家族、Hsp60(DnaK)家族、Hsp60(Hsp100)家族等,它们都具有ATP依赖性,可以与大量的非天然蛋白质作用,帮助蛋白质折叠、装配和调整。

蛋白质折叠解释蛋白质折叠的过程和重要性以及与疾病相关的折叠错误蛋白质是生物体内最为重要的大分子,其在维持生命活动中起着至关重要的作用。
蛋白质分子的功能与其形状密切相关,而蛋白质的形状由其折叠过程决定。
本文将探讨蛋白质折叠的过程和重要性,以及与疾病相关的折叠错误。
一、蛋白质折叠的过程蛋白质的折叠是指将一条由氨基酸组成的线性多肽链通过非共价键的作用转变为其稳定的三维空间结构的过程。
折叠能够将蛋白质的氨基酸残基有序排列,使得蛋白质分子具有特定的功能。
蛋白质折叠通常经历四个层次的结构:一级结构、二级结构、三级结构和四级结构。
一级结构是指蛋白质链上的氨基酸残基的线性排列顺序。
二级结构是指由氢键形成的规则重复单元,如α螺旋和β折叠。
三级结构是指整个多肽链的三维构象,由各个二级结构通过疏水效应、电荷作用、范德华力等相互作用构成。
四级结构是指含有多个多肽链的蛋白质分子的空间排列方式,如同源二聚体或是四聚体。
二、蛋白质折叠的重要性蛋白质的折叠过程对于其在细胞内的功能发挥具有关键影响。
正常的蛋白质折叠能够使其达到近乎最佳的功能状态,从而保证细胞的正常运作。
正确折叠的蛋白质可以作为酶催化化学反应、参与细胞信号传递、成为细胞骨架的组成部分,甚至参与基因表达调控等重要功能。
蛋白质折叠还能够影响蛋白质的稳定性和长寿性。
正确折叠的蛋白质更稳定,更不容易被降解,从而能够更长时间地发挥其功能。
而错误折叠的蛋白质可能会失去正常功能,并且容易形成聚集物,进一步引发细胞损伤甚至导致疾病的发生。
三、与疾病相关的折叠错误蛋白质折叠错误是导致许多疾病的重要原因之一。
折叠错误可能导致蛋白质失去正常功能,或形成有毒的蛋白质聚集物,从而影响细胞的正常运作。
许多神经系统疾病,如阿尔茨海默病、帕金森病和亨廷顿舞蹈病,都与蛋白质折叠错误有关。
在这些疾病中,某些蛋白质的折叠发生错误,导致它们无法正常运作并聚集在细胞内,从而造成神经细胞的死亡和功能损害。
此外,某些蛋白质折叠错误还与癌症、感染性疾病和自身免疫疾病等疾病的发生和发展密切相关。
蛋白质折叠问题的解析和解决方案蛋白质是生物体内最基本的分子构建单位,它们在细胞内发挥着各种重要的功能。
然而,在细胞内合成之后,蛋白质并不处于最终稳定的三维结构状态,而是需要通过折叠过程才能达到其功能活性。
蛋白质折叠问题一直以来都是生物化学和生物物理学研究的重要课题之一。
本文将介绍蛋白质折叠问题的背景和意义,并针对该问题提出一些解析和解决方案。
蛋白质折叠是指线性上的氨基酸序列如何在水相溶液中自发地折叠成稳定的三维结构。
这一过程涉及到各种非共价相互作用,包括氢键、疏水相互作用、电荷相互作用等。
蛋白质折叠的过程极其复杂,涉及到庞大的构象空间搜索和多维能量面的优化,因此其机理一直以来都备受研究者关注。
了解蛋白质折叠问题的机理对于理解蛋白质的生物功能和疾病的发生机制具有重要意义。
蛋白质的结构决定其功能,而许多生物过程、代谢反应以及信号传导等都依赖于特定蛋白质的正确折叠。
一旦蛋白质折叠发生错误,就可能导致功能失调和疾病的发生,如变性性疾病、癌症、神经退行性疾病等。
那么如何解析和解决蛋白质折叠问题呢?首先,在解析蛋白质折叠问题方面,科学家们通过实验和计算手段,努力尝试揭示蛋白质折叠的机制和规律。
实验手段主要包括X射线晶体学、核磁共振、质谱等,通过解析蛋白质的三维结构来推断其折叠过程。
计算手段则是利用数学模型和分子模拟等方法,模拟蛋白质折叠的具体过程,探究折叠中的能量变化和稳定构象。
这些研究工作为深入理解蛋白质折叠问题提供了重要的实验和理论基础。
其次,解决蛋白质折叠问题的方法包括实验和计算两大方面。
在实验方面,科学家们通过引入特定物质或者改变环境条件,如温度、压力、pH值等,来研究蛋白质折叠和变性的行为。
同时,利用蛋白质工程技术,设计和合成蛋白质模型,探索其折叠过程和结构-功能关系。
在计算方面,利用计算模型和算法,对蛋白质折叠中的能量变化和构象进行模拟和优化,以预测蛋白质的稳定结构和折叠动力学。
除了实验和计算方法,还有一些新兴的解决方案正在被科学家们尝试和研究。
蛋白质的折叠与修复蛋白质是细胞中最重要的分子之一,它们承担着多种生物学功能。
但是,蛋白质的功能取决于它们的三维结构,当蛋白质结构发生错误时,可能会导致疾病或者细胞死亡。
因此,蛋白质的折叠和修复是非常重要的过程,本文将探讨蛋白质的折叠和修复过程。
蛋白质的折叠蛋白质折叠是指线性氨基酸序列被折叠成一个三维结构。
这个过程是非常快速、高度有序和协同的。
在细胞中,蛋白质的折叠通常是由一组辅助蛋白质(chaperones)协同完成的。
这些辅助蛋白质通常具有结构特异性,能够正确地识别和与待折叠的蛋白质进行相互作用,以帮助蛋白质正确地折叠。
这个过程是非常复杂的,需要蛋白质内部相互配合。
一般而言,蛋白质折叠时会经过四个阶段。
第一个阶段是氨基酸的线性序列经过一系列非常快速的无序“降低能量”运动,把它们引向更具有稳定性的构象。
第二个阶段是局部稳定结构的形成,这涉及到蛋白质局部的氢键、带电氨基酸偶极矩、氨基酸侧链的静电相互作用和范德华力等。
第三个阶段是全局的稳定性结构的形成,这需要全局构象中带动局部结构的发展,使其达到稳定的状态。
最后,第四个阶段是全局结构的细致调整,调整蛋白质最终的三维结构,以使其达到最优的稳定性。
蛋白质的修复蛋白质折叠错误是非常常见的现象。
一些蛋白质可能粘在一起形成蛋白质凝聚体(protein aggregate)。
这些凝聚体可能会堵塞细胞内的通路,消耗能量并破坏正常细胞功能,甚至可能引起细胞死亡。
因此,细胞必须修复这些被错误折叠的蛋白质,而细胞内有多种修复机制来修复这些蛋白质。
最常见的修复机制是由泛素连接到被误折叠蛋白的氨基酸上,以标记错误蛋白,并被废弃体质论移除。
这种泛素标记的过程被称为泛素化(ubiquitination)。
泛素标记可以由多种泛素连接酶完成,最终是由被废弃体质论途径轻易地碾碎,并进行降解。
另一种重要的修复机制是自噬。
自噬是细胞通过自大的膜结构,在其中包裹错误蛋白并传递到细胞质中,以揭示其中的氨基酸。
细胞内蛋白质折叠与修复机制细胞内蛋白质折叠与修复机制是细胞中一个重要的过程,确保蛋白质在细胞内正确折叠并保持正常功能。
细胞内蛋白质折叠和修复机制包括分子伴侣参与的折叠、修复酶的协助以及蛋白质降解等过程。
本文将从折叠错误原因、细胞内担任折叠任务的蛋白伴侣、蛋白质修复酶的重要性以及异常折叠蛋白质的降解等方面展开阐述。
一、折叠错误的原因蛋白质的折叠错误可能由于多种原因引起,包括温度的变化、氧化应激、含有突变基因的遗传物质以及环境压力等。
这些原因会导致蛋白质折叠时形成不正常的连接或者结构,进而影响蛋白质的功能。
折叠错误的蛋白质如果不能得到及时修复,则可能会积聚在细胞内,形成蛋白质聚集体和凝胶样结构,最终引发细胞功能障碍甚至细胞死亡。
二、分子伴侣参与的折叠在细胞内,折叠错误的蛋白质会被分子伴侣识别并进行折叠或者修复。
分子伴侣是细胞中参与蛋白质折叠和修复的重要因素,包括分子伴侣热休克蛋白(HSP)以及其他担任折叠任务的蛋白质。
热休克蛋白通过与折叠错误的蛋白质结合,并提供正确的折叠环境,促进蛋白质的正确折叠。
同时,它们还能够帮助细胞中的其他蛋白质的运输和定位,对维持细胞内环境的稳定性具有重要作用。
三、蛋白质修复酶的协助除了分子伴侣之外,细胞内还有专门的酶类参与蛋白质折叠和修复过程。
这些酶类常被统称为蛋白质修复酶。
蛋白质修复酶能够催化蛋白质折叠过程中形成的错误连接的断裂和重构,从而修复折叠错误的蛋白质。
其中,蛋氧硫辅酶还可以还原受氧化损伤的蛋白质。
蛋白质修复酶的协助对于维持细胞的正常生物学功能至关重要。
四、异常折叠蛋白质的降解在细胞内,如果蛋白质发生严重的折叠错误,无法通过分子伴侣和修复酶进行修复,细胞会通过自噬和泛素-蛋白酶体系统等机制对其进行降解。
自噬是细胞通过包裹异常蛋白质并将其输送至溶酶体进行降解的过程。
泛素-蛋白酶体系统则通过泛素标记异常蛋白质,并将其送往蛋白酶体进行降解。
这些降解机制确保了细胞内异常蛋白质的清除,维护了细胞内环境的稳定性。