浓硫酸和稀硫酸的鉴别方法
- 格式:doc
- 大小:21.00 KB
- 文档页数:1

浓硫酸的特性易错点精析一、浓硫酸的特性:①吸水性:浓H2SO4能吸附物质中含有的水分。
因而浓H2SO4可作干燥剂,干燥一些不与之反应的气体,通常用于洗气装置。
但是需要注意的是浓H2SO4不能干燥碱性气体NH3、还原性气体H2S、HBr、HI 等。
②脱水性:浓H2SO4将有机物里的氢、氧原子按水的比例脱去生成水的性质。
如蔗糖、木屑、纸屑、棉麻织物等,浓硫酸能使它们脱水而碳化。
③强氧化性:常温下,Fe、Al遇浓H2SO4会发生钝化现象。
但热的浓硫酸能氧化大多数金属(除金、铂外)、非金属单质及一些还原性化合物。
在这些氧化还原反应中,浓硫酸的还原产物一般是SO2。
④难挥发性(高沸点):可用于制取低沸点酸,如制取氯化氢气体等。
二、浓硫酸、稀硫酸的性质比较:浓硫酸稀硫酸酸性弱(主要以分子状态存在,不能用于制取氢气)强(可以用来与活泼金属反应制取氢气)氧化性强氧化性(硫元素被还原,可以与不活泼金属如弱氧化性(氢元素被还原,只能与金属活Cu 和非金属如 C 发生氧化还原反应)动性顺序中排在氢前面的金属反应)钝化现象有,常温下使铁、铝等发生钝化现象无吸水性有无脱水性有无三、浓硫酸的特性易错点1、注意吸水性和脱水性的区别;2、利用浓硫酸的吸水性干燥气体时需要考虑其酸性和强氧化性;3、利用浓硫酸的难挥发性制取低沸点酸时需要考虑其强氧化性;4、常温下,Fe、Al 遇浓H2SO4会发生钝化现象并不是没有发生反应;5、浓H2SO4在加热条件下与金属反应反映其氧化性的同时反映出其酸性;6、注意浓H2SO4弱的酸性和稀硫酸弱的氧化性。
1四、解题规律与方法1、明确浓硫酸各种特性的本质以及体现出这些特性的场景;2、区分浓硫酸与稀硫酸的性质。
五、纠错练习1.下列关于浓硫酸的说法错误的是()A.浓硫酸有许多重要的性质,在与含有水分的蔗糖作用过程中不显示酸性的性质B.实验室用浓硫酸来制取氯化氢显示了浓硫酸的难挥发性或高沸点C.在一定体积 18mol/L 的浓硫酸中加入过量铜片并加热,被还原的硫酸为 0.9mol,则硫酸的实际体积不为100mLD.常温下,冷的浓硫酸可以用铁或铝的容器贮存,是因为常温下铁或铝与浓硫酸不发生反应2.下列反应既利用了浓硫酸的强氧化性,又利用了浓硫酸的酸性的是()A.碳与浓硫酸加热B.浓硫酸与氯化钠固体加热C.浓硫酸中加入铜片加热D.蔗糖与浓硫酸混合后炭化发黑3.下列气体中,不能用浓硫酸作干燥剂的是()(1)HCl(2)HI(3)Cl2(4)H2(5)H2S(6)SO2A.(2)(4)(5)(6)B.(1)(2)(5)C.(2)(5)D.(1)(2)(4)(5)4.下列反应中,浓H2SO4表现出脱水性的是()A.Fe2O3+3H2SO4→Fe2(SO4)3+3H2OB.NaNO3(固)+H2SO4(浓)→NaHSO4+HNO3↑C.H2S+H2SO4(浓)→S+SO2↑ +2H2OD.C12H22O11−−−→浓硫酸12C+11H2O5.将如下卤化物跟浓H2SO4放在烧瓶中共热,可以得到纯净卤化氢气体的是()A.NaF B.NaCl C.NaBr D.NaI26.在下图的实验中,过一段时间,对看到的现象叙述错误的是()A.苹果会干瘪B.胆矾晶体表面出现“白班”C.小试管内有晶体析出D.pH 试纸变红7.将浓硫酸在下列反应中的性质用编号填在横线上。



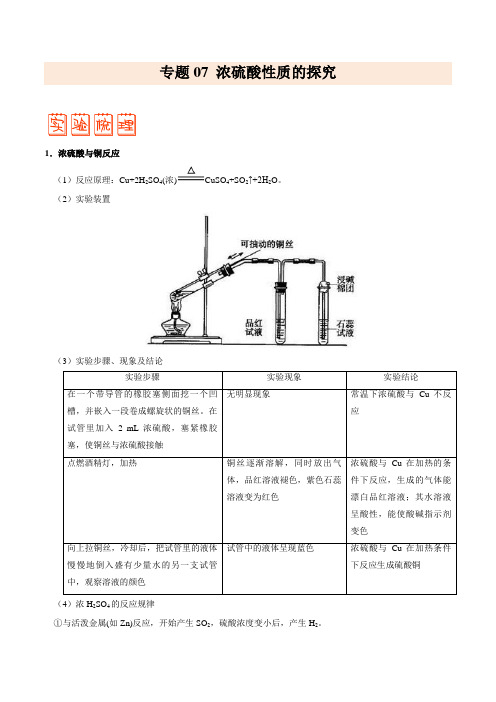
专题07 浓硫酸性质的探究1.浓硫酸与铜反应(1)反应原理:Cu+2H 2SO4(浓)CuSO4+SO2↑+2H2O。
(2)实验装置(3)实验步骤、现象及结论实验步骤实验现象实验结论在一个带导管的橡胶塞侧面挖一个凹槽,并嵌入一段卷成螺旋状的铜丝。
在试管里加入 2 mL浓硫酸,塞紧橡胶塞,使铜丝与浓硫酸接触无明显现象常温下浓硫酸与Cu不反应点燃酒精灯,加热铜丝逐渐溶解,同时放出气体,品红溶液褪色,紫色石蕊溶液变为红色浓硫酸与Cu在加热的条件下反应,生成的气体能漂白品红溶液;其水溶液呈酸性,能使酸碱指示剂变色向上拉铜丝,冷却后,把试管里的液体慢慢地倒入盛有少量水的另一支试管中,观察溶液的颜色试管中的液体呈现蓝色浓硫酸与Cu在加热条件下反应生成硫酸铜(4)浓H2SO4的反应规律①与活泼金属(如Zn)反应,开始产生SO2,硫酸浓度变小后,产生H2。
②与不活泼金属(如Cu)反应,开始产生SO2(加热),浓度变小后,稀硫酸不再与不活泼金属反应。
③浓硫酸在与金属的反应中既表现氧化性又表现酸性。
浓硫酸在与非金属的反应中只表现氧化性。
2.鉴别浓硫酸和稀硫酸的方法方法操作结论一分别滴到火柴梗上变黑者为浓硫酸二分别加入到盛水的试管中放热者为浓硫酸三加到CuSO4·5H2O晶体中晶体变白色的为浓硫酸四分别加入铝箔常温下反应的是稀硫酸,不反应的是浓硫酸五滴加到浓盐酸中产生白雾的是浓硫酸六加入铜片并加热溶液变蓝,产生刺激性气味气体的是浓硫酸,不反应的是稀硫酸七用玻璃棒蘸取液体粘稠状的为浓硫酸八称量相同体积的酸质量大的是浓硫酸3.浓硫酸的脱水性(1)定义:指浓硫酸能将有机物中的氢、氧原子按2∶1的比例脱去的性质。
(2)实验操作示意图:(3)实验现象及分析蔗糖变黑,体积膨胀,变成疏松多孔的海绵状的炭,并放出有刺激性气味的气体。
蔗糖的分子式为C12H22O11,在浓硫酸作用下脱去水分子:C12H22O1112C+11H2O,在该实验下,浓硫酸既体现脱水性又体现氧化性。

第2课时硫酸课前自主预习一、硫酸的制备1.古代制法加热胆矾(CuSO4·5H2O)或绿矾(FeSO4·7H2O)制取硫酸。
2.现代工业制法——接触法二、硫酸的性质1.稀硫酸的化学性质具有酸的通性,溶于水完全电离:H2SO4===2H++SO错误!。
2.浓硫酸的特性(1)吸水性浓硫酸能够吸收气体、液体中的水分子及固体中的结晶水,故常用作干燥剂。
(2)脱水性浓硫酸能按水的组成比脱去纸、棉布、木条等有机物中的氢、氧元素。
向蔗糖中加入浓硫酸时,观察到的现象有:①蔗糖变黑;②蔗糖体积膨胀,变成疏松多孔的海绵状的炭;③放出有刺激性气味的气体。
(3)强氧化性①与金属的反应:除金、铂以外的绝大多数金属都能与浓硫酸作用。
常温下,Fe、Al遇浓硫酸发生钝化.与铜反应的实验探究②与非金属的反应浓硫酸与木炭的反应:2H2SO4(浓)+C错误!CO2↑+2SO2↑+2H2O。
3.硫酸的用途(1)重要的化工原料,实验室必备的重要试剂。
(2)工业上可用于制化肥、农药、炸药、染料、盐类等。
(3)用于精炼石油、金属加工前的酸洗及制取各种挥发性酸,作干燥剂等.三、硫酸盐课堂互动探究硫酸的制备工业上接触法制硫酸的主要设备及生产流程如下图:根据上图回答下列问题:(1)填写下列各进口或出口物质的名称:A含硫矿石(如FeS2);B炉渣;C二氧化硫、氧气;D尾气(SO2、O2)。
(2)接触法制硫酸分为三个阶段,填写下表:浓硫酸与稀硫酸1.浓硫酸与稀硫酸的比较2.浓硫酸与稀硫酸的鉴别方法(1)取少量蒸馏水,向其中加入少量试样,能够放出大量热的为浓硫酸,反之为稀硫酸。
(2)观察状态:为黏稠状液体的是浓硫酸,而黏稠度较小的是稀硫酸.(3)取体积相等的两液体,用手掂掂,质量较大的是浓硫酸。
(4)取少量试样,向其中加入铁片,若能够产生大量气泡的则为稀硫酸:Fe+H2SO4===FeSO4+H2↑;若无明显现象(钝化),则为浓硫酸。
浓硫酸稀硫酸浓度界限浓硫酸和稀硫酸是我们生活中常见的化学物质,它们在许多领域都有着广泛的应用。
然而,在使用这两种酸之前,我们需要了解它们的浓度界限,以确保安全使用并避免潜在的危险。
浓硫酸和稀硫酸是硫酸的两种不同浓度的形式。
浓硫酸指的是硫酸溶液中硫酸的浓度较高,通常为98%以上。
而稀硫酸则是指硫酸溶液中硫酸的浓度较低,通常在1%到10%之间。
首先,我们需要注意的是,标题与正文内容应该一致。
本文将主要讨论浓硫酸和稀硫酸的浓度界限,而不会偏离这一主题。
其次,作为一篇纯粹的文章,我们需要避免在正文中添加任何网址链接或其他形式的广告信息。
这样可以确保读者能够专注于正文内容,而不会受到不必要的干扰。
第三,我们需要遵守版权法律,确保文章内容不会侵犯他人的版权。
因此,在撰写文章时,我们应该避免使用他人的文字、图片或其他媒体素材,以免引发侵权争议。
在文章标题、简介和正文中,我们还应该注意不使用包含不适宜展示的敏感词或其他不良信息。
这样可以确保文章对读者的阅读体验没有负面影响,并且能够传递积极的信息。
最后,文章正文应该具有清晰的思路和流畅的表达。
我们需要确保文章的逻辑结构合理,段落之间的过渡自然流畅。
此外,文章中不应出现缺失语句、丢失序号或段落不完整等问题,以免给读者带来困惑或阅读障碍。
总结一下,一篇关于浓硫酸和稀硫酸浓度界限的文章应该以清晰的思路和流畅的表达为基础。
标题不得与正文内容不符,正文中不得包含广告信息或侵犯版权的内容,也要避免使用敏感词或其他不良信息。
此外,正文应该完整且连贯,不得出现缺失语句或段落不完整的情况。
通过遵循这些原则,我们可以撰写出一篇符合要求的文章。
姓名,年级:时间:第2课时硫酸一、稀硫酸——具有酸的通性1.与指示剂作用:能使紫色石蕊试液变红。
2.与活泼金属反应,生成盐和氢气,Fe+H2SO4===FeSO4+H2↑。
3.与碱性氧化物反应,生成盐和水;CuO+H2SO4===CuSO4+H2O。
4.与碱反应,生成盐和水;2NaOH+H2SO4===Na2SO4+2H2O.5.与某些盐反应:H2SO4+Na2CO3===Na2SO4+H2O+CO2↑。
二、浓硫酸的性质浓H2SO4是无色黏稠油状液体,难挥发,能以任意比与水混溶,常用的98%的浓H2SO4的密度为1.84 g·cm-3,物质的量浓度为18.4 mol·L-1。
三、浓硫酸的化学性质1.浓硫酸是二元强酸,具有酸的通性。
2.浓硫酸的特性。
(1)脱水性浓硫酸能把有机物中的H、O元素按原子个数比21脱去,留下黑色炭。
例如,浓硫酸能使蔗糖炭化.(2)吸水性浓硫酸能够吸收游离态的水或结晶水,可用做干燥剂。
(3)强氧化性①与Cu反应化学方程式为Cu+2H2SO4(浓)错误!CuSO4+SO2↑+2H2O。
②与铁、铝反应常温下,浓硫酸可以使铁、铝钝化,即铁、铝表面被浓硫酸氧化为致密的氧化物薄膜,阻止了酸与内层金属的进一步反应,所以可以用铁、铝制容器来盛装浓硫酸.③与非金属反应化学方程式为C+2H2SO4(浓)错误! CO2↑+2SO2↑+2H2O。
铜与浓硫酸反应:Cu+2H2SO4(浓)错误!CuSO4+SO2↑+2H2O(浓硫酸作用:氧化性、酸性);火热木炭与浓硫酸反应:C+2H2SO4(浓)错误!CO2↑+2SO2↑+2H2O(浓硫酸作用:氧化性);溴化氢被浓硫酸氧化:2HBr+H2SO4(浓)===SO2↑+Br2+2H2O(浓硫酸作用:氧化性);硫化氢被浓硫酸氧化:H2S+H2SO4(浓)===S↓+SO2↑+2H2O(浓硫酸作用:氧化性)。
在以上反应中,浓硫酸一般被还原为SO2。
(浓)硫酸•硫酸:硫酸的分子式:H2SO4;结构式:,H2SO4中硫元素为+6价,处于最0 高价,具有氧化性,但只有浓H2SO4表现出强氧化性,而稀硫酸、硫酸盐巾的硫元素通常不表现氧化性。
•硫酸的物理性质和化学性质:1.硫酸的物理性质纯硫酸是无色、黏稠的油状液体,密度大,沸点高,是一种难挥发的强酸,易溶于水,能以任意比与水互溶.浓硫酸溶于水时放出大量的热。
常见浓硫酸的质量分数为98.3%,其密度为1.84g·cm-3,沸点为338℃,物质的量浓度为18.4mol·L-1.H2SO4的浓度越大,密度越大,若将30%的H2SO4溶液与10%的H2SO4溶液等体积混合,所得溶液的质量分数大于20%。
2.稀硫酸的化学性质稀硫酸具有酸的通性。
(1)与指示剂作用:能使紫色石蕊试液变红。
(2)与碱发生中和反应(3)与碱性氧化物或碱性气体反应(4)与活泼金属发生置换反应(5)与某些盐溶液反应4.浓硫酸的特性(1)吸水性将一瓶浓硫酸敞口放置在空气中,其质量将增加,密度将减小,浓度降低,体积变大。
这是因为浓硫酸具有吸水性,实验室里常利用浓硫酸作干燥剂。
浓硫酸不仅可以吸收空气中的水,还可吸收混在气体中的水蒸气、混在固体中的湿存水、结晶水合物中的部分结晶水。
浓H2SO4中的H2SO4分子可强烈地吸收游离的水分子形成一系列的硫酸水合物:。
这些水合物很稳定,所以浓H2SO4可作某些不与其反应的气体、固体的干燥剂,同时不能暴露在空气中。
能够用浓H2SO4干燥的气体有、等酸性或中性气体,而具有还原性的气体和碱性气体NH3则不能用浓H2SO4干燥。
另外在酯化反应中,如中,浓H2SO4作催化剂和吸水剂。
(2)脱水性指浓H2SO4将有机物里的氧、氧元素按原子个数比2:1脱去生成水的性质。
浓H2SO4从有机物中脱下来的是氢、氧元素的原子,不是水,脱下来的氢、氧元素的原子按2:1的比例结合成H2O;对于分子中所含氢、氧原子个数比为2:l的有机物(如蔗糖、纤维素等),浓H2SO4可使其炭化变黑,如:(3)强氧化性常温下,Fe、Al遇浓H2SO4会发生钝化。
浓硫酸和稀硫酸的鉴别方法
(1)密度法:浓硫酸密度比稀硫酸大的多,可以测试这两支试管相同体积液体的重量,重量的是浓硫酸,重量小的是稀硫酸。
(或用密度计进行测试)
(2)黏度法:浓硫酸是黏稠的液体,而稀硫酸是接近水的黏度,所以将两支试管拿起来摇动几下,观察,流动性差的是浓硫酸,流动性好的是稀硫酸。
(3)稀释法:浓硫酸溶与水时放出大量的热,故可用稀释法进行鉴别。
在小烧杯中加入10mL水,再慢慢沿烧杯壁加入某种硫酸,放出热量大的是浓硫酸,热量变化很小的是稀硫酸。
(4)露置法:浓硫酸具有吸水性,而稀硫酸无此特性。
分别称取等量的两种硫酸,露置在空气中一段时间后再称量,质量明显增加的是浓硫酸,另一种是稀硫酸。
(5)吸水法:在两支试管中各加入少量胆矾,再分别加入几滴硫酸,晶体溶解且溶液变蓝的是稀硫酸,若蓝色晶体变白,则加入的酸是浓硫酸。
(6)钝化法:取已去氧化膜的两块铁片或铝片,分别放入盛有两种硫酸的试管中。
无明显现象的是浓硫酸,有气泡产生的是稀硫酸。
(7)氧化法:浓硫酸具有强氧化性,而稀硫酸的氧化性弱。
分别取两支试管,加入铜片后再分别加入两种硫酸,加热,能产生刺激性气味的是浓硫酸,另一种是稀硫酸。
(8)脱水法:分别用玻璃棒蘸取两种酸,涂在纸上过一段时间后,若纸上出现黑色痕迹,则涂的是浓硫酸。
(9)生雾法:在两支试管中各加少量浓盐酸,再分别加入少量的两种硫酸,若有大量白雾生成,则加入的是浓硫酸。
(10)导电法:取两种酸少许于两只小烧杯中,分别做导电性实验,若小灯泡发光且亮,则烧杯中所盛的是稀硫酸。