高三化学一轮复习 第一章 章末整合提升 精品课件 鲁科版必修1
- 格式:ppt
- 大小:910.50 KB
- 文档页数:18


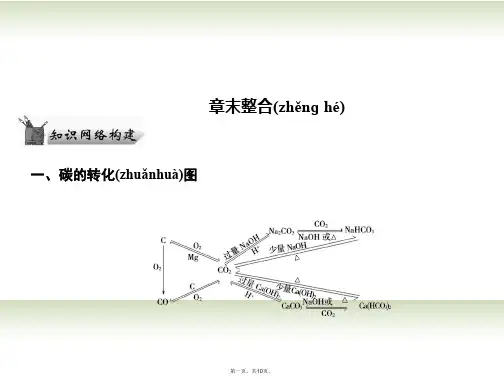

2020高三化学一轮复习第一章第1节钠及其化合物知识综合验收鲁科版必修11.(2020·汕头模拟)金属钠不仅能跟氧气、水等无机物反应,还能跟酒精、醋酸等有机物反应。
要研究金属钠跟酒精反应的性质以及它与水反应的异同点,下列研究方法中没有用到的是A.实验法B.观察法C.分类法D.比较法答案 C2.将一小块金属钠久置于空气中,有下列现象:①生成白色粉末;②变暗;③生成白色固体;④发生潮解变为液体,这些现象的先后顺序是A.①②③④B.④③②①C.②③④①D.①③④②答案 C3.在一定条件下,将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL 浓度为0.50 mol·L-1的HCl溶液中和,则该生成物的成分是A.Na2O B.Na2O2C.Na2O和Na2O2D.Na2O2和NaO2解析Na与O2反应的产物可能是Na2O或Na2O2或Na2O和Na2O2的混合物。
无论哪一种情况,与盐酸反应后都生成NaCl,即n(Na+)=0.08 L×0.50 mol·L-1=0.04 mol。
假设生成物全部为Na2O,其质量为0.04 mol×12×62 g·mol-1=1.24 g,实际是1.5 g,不符合;假设全部为Na2O2,其质量为0.04 mol×12×78 g·mol-1=1.56 g,也不符合。
故生成物为Na2O和Na2O2的混合物。
答案 C4.(2020·河南师大附中月考)把NaHCO3和NaOH的混合物放在密闭容器中加热,下列关于混合物加热前后消耗盐酸的物质的量的判断正确的是A.加热前消耗得多B.加热后消耗得多C.加热前后一样多D.当NaOH适量时才会一样多解析不加热时,1 mol NaHCO3和1 mol NaOH与盐酸反应均消耗1 mol盐酸;加热时,依题意可得关系式2NaHCO3~Na2CO3~2HCl,进而可得NaHCO3~HCl;又由关系式2NaOH~Na2CO3~2HCl可得NaOH~HCl。

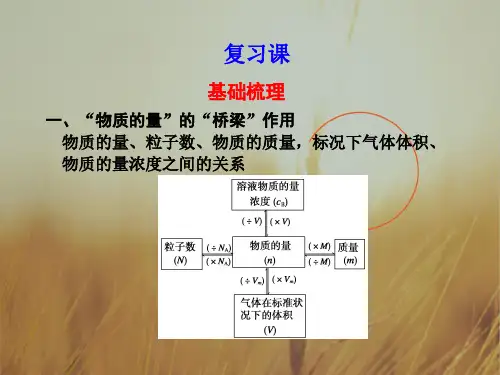




高三化学一轮复习第一章第3节物质的量气体摩尔体积知识综合验收鲁科版必修1 1.(2009·北师附中模拟)下列四幅图中,小白球代表氢原子,大灰球代表氦原子。
最适合表示标准状况下,等质量的氢气与氦气的混合气体的是答案 B2.下列叙述正确的是A.一定温度、压强下,气体体积由其分子的大小决定B.一定温度、压强下,气体体积由其物质的量的多少决定C.气体摩尔体积是指1 mol任何气体所占的体积为22.4 LD.不同的气体,若体积不等,则它们所含的分子数一定不等解析决定气体体积大小的主要因素是气体分子数目的多少和气体分子间的距离,而气体分子本身的大小是忽略的,影响因素是温度、压强。
气体分子间的平均距离与温度成正比、压强成反比。
一定温度、压强下,气体体积之比等于其物质的量之比,故A错B对;说某气体的摩尔体积时必须指明状态,C错;不同的气体,若体积不等,但在特定温度和压强下,它们所含的分子数也可能相等,D错。
答案 B3.(2009·福建理综)设N A为阿伏加德罗常数,下列叙述正确的是A.24 g镁的原子最外层电子数为N AB.1 L 0.1 mol·L-1乙酸溶液中H+数为0.1N AC.1 mol甲烷分子所含质子数为10N AD.标准状况下,22.4 L乙醇的分子数为N A解析A项,24 g镁的原子最外层电子数为2N A。
B项,乙酸是弱酸,在水溶液中部分电离。
C项,CH4是10电子分子,1 mol CH4分子含质子数为10N A。
D项,标准状况下乙醇是液态。
答案 C4.(2010·黄冈模拟)同温同压下,x g的甲气体和y g的乙气体占有相同的体积,根据阿伏加德罗定律判断,下列叙述错误的是A.x∶y等于甲与乙的相对分子质量之比B .x ∶y 等于等质量的甲与乙的分子个数之比C .x ∶y 等于同温同压下甲与乙的密度之比D .y ∶x 等于同温同体积下,等质量的甲与乙的压强之比解析 设甲、乙的摩尔质量分别为M (甲)、M (乙),则x M (甲)=y M (乙),所以x y =M (甲)M (乙)=ρ(甲)ρ(乙),所以A 、C 均正确。
