有机化合物的性质与反应类型
- 格式:pptx
- 大小:629.98 KB
- 文档页数:25

有机化学大一知识点归纳一、有机化学的基本概念与性质有机化学是研究碳和氢以及它们的衍生物的化学性质和反应机理的科学。
它的研究对象包括有机化合物的结构、性质以及它们之间的相互作用。
1.1 碳的特殊性质碳具有四个价电子,可形成稳定的共价键,并能与其他原子进行多种多样的化学键合。
1.2 有机化合物的特点有机化合物通常具有较低的沸点、溶解度、比熔点和密度。
他们大部分是不导电的,但某些有机物能导电。
1.3 有机反应的特点有机反应具有多种多样的反应类型,包括加成、消除、取代、重排等。
它们往往需要催化剂或特定温度条件下进行。
二、有机化合物的结构与命名2.1 有机化合物的结构有机化合物的结构由碳骨架和官能团组成。
碳骨架是由碳原子通过共价键连接而成的丰富多样的结构,官能团则是在碳骨架上的特定原子或原子团。
2.2 命名有机化合物的常用规则有机化合物的命名一般遵循一定的命名规则,包括根据碳原子数目命名烷烃、根据官能团命名醇、醛、酮等。
三、有机化合物的主要类别与性质3.1 烷烃烷烃是只含有碳碳单键的有机化合物,分为饱和烷烃和不饱和烷烃。
它们具有较低的反应活性,很难发生化学反应。
3.2 烯烃烯烃含有碳碳双键,分为乙烯和非乙烯烯烃。
烯烃具有较高的反应活性,可参与加成、消除等反应。
3.3 芳香化合物芳香化合物是具有特殊的芳香环结构的化合物,如苯环。
它们具有较稳定的结构和独特的化学性质。
3.4 醇醇是含有氢氧基的有机化合物,按照羰基的位置,可分为一元醇、二元醇等。
醇具有较高的极性和良好的溶解性。
3.5 醛和酮醛和酮均含有羰基,区别在于羰基所连接的碳原子数目。
它们具有较高的活性,可发生亲核加成等反应。
四、有机反应机制4.1 加成反应加成反应是指有机化合物中双键(如烯烃)先经过破裂,形成两个相互连接的新键。
4.2 消除反应消除反应是指有机化合物中某些官能团(如卤素)与相邻原子或原子团之间的键断裂,形成烯烃或炔烃。
4.3 取代反应取代反应是指有机化合物中某些原子或原子团被其他原子或原子团取代的反应。

有机化学中的热化学反应热化学反应是有机化学中一个重要的研究领域,研究有机物在加热或吸热过程中的反应机制、热力学性质以及能量变化。
这些反应涉及到有机化合物的热解、燃烧、氧化和还原等。
一、有机物的热分解反应热分解反应是指有机物在高温条件下分解为更简单的化合物或元素的过程。
这类反应通常需要很高的温度,才能打破有机物分子的键,形成新的化学物质。
热分解反应常见的有烷烃的裂解反应和醇类的脱水反应。
以烷烃的裂解反应为例,烷烃加热至一定温度时,分子内部的碳-碳键或碳-氢键会断裂,形成较短的链烃和不饱和烃。
这个过程能够利用高温环境提供的能量,使烷烃分子更加稳定。
裂解反应在工业上广泛应用于石油加工和燃料生产。
二、有机物的燃烧反应有机物的燃烧反应是指有机物与氧气发生反应,产生二氧化碳和水,并释放出大量的能量。
在燃烧反应中,有机物作为燃料被氧气氧化,从而产生了新的化学物质和能量。
燃烧反应是一种放热反应,它释放出的能量可以用于加热、照明和发电等方面。
在有机化学中,燃烧反应是有机化合物的重要性质之一。
例如,甲烷是天然气的主要成分,它的燃烧反应可以产生大量的能量,并且生成无害的二氧化碳和水。
三、有机物的氧化反应有机物的氧化反应是指有机物和氧气之间的反应,其中有机物失去电子,氧气被还原成水。
氧化反应常见的有醇类的氧化和醛酮的氧化。
以醇类的氧化反应为例,醇在加热、催化剂催化或氧气存在下发生氧化反应,生成醛或酮,并伴随着一系列的能量变化。
这些氧化反应在有机合成中具有广泛的应用,可用于制备醛酮、酸和羧酸等重要化合物。
四、有机物的还原反应有机物的还原反应是指有机化合物和还原剂之间的反应,其中有机物获得电子,还原剂被氧化。
还原反应广泛应用于有机合成和药物制备等领域。
以醛酮的还原反应为例,醛和酮可通过还原剂(如氢气和铝镍合金催化剂)发生反应,生成对应的醇。
这类还原反应在制备醇类化合物时具有重要的应用价值,在有机合成和药物制备中有广泛的应用。


有机化学基础知识点整理有机合成中的反应类型与机理有机合成作为有机化学的重要分支,研究的是如何通过有机反应合成有机化合物。
在有机合成中,反应类型和反应机理是我们需要重点关注的内容。
本文将对有机合成中常见的反应类型和反应机理进行整理和介绍。
一、取代反应取代反应是有机化学中最基本的反应类型之一,它涉及到一个或多个原子、基团或离子与有机化合物中的原子、基团或离子发生置换反应。
根据置换的位置和取代的原子或基团的性质不同,取代反应可分为以下几种类型:1. 单取代反应:一个原子或基团被另一个原子或基团取代。
2. 多取代反应:有机化合物中的多个原子或基团被其他原子或基团同时取代。
3. 消除取代反应:有机化合物中的一个或多个原子或基团与其他物质反应后,生成的产物中去除了一个或多个原子或基团。
二、加成反应加成反应是指两个或多个化学物质的分子在一定条件下发生共价键的形成。
根据加成反应中参与的物质的不同,加成反应可分为以下几种类型:1. 酸性加成反应:以酸为催化剂或参与反应的物质,促使有机化合物中的一个或多个双键与其他物质发生加成反应。
2. 碱性加成反应:以碱为催化剂或参与反应的物质,促使有机化合物中的一个或多个双键与其他物质发生加成反应。
3. 光加成反应:利用光能使有机化合物中的一个或多个双键与其他物质发生加成反应。
4. 热加成反应:通过加热,使有机化合物中的一个或多个双键与其他物质发生加成反应。
三、消除反应消除反应是指有机化合物中的一个或多个原子或基团与一个空间位置上的化学物质反应后,生成的产物中去除了一个或多个原子或基团。
根据消除反应参与的物质不同,可分为以下几种类型:1. β-Elimination反应:有机化合物中的原子或基团与邻近位置的原子或基团形成共价键,并且同时释放出一个或多个小分子。
常见的β-Elimination反应有脱氢、脱水等。
2. α-Elimination反应:有机化合物中的原子或基团与自身的另一个位置的原子或基团形成共价键,并且同时释放出一个或多个小分子。
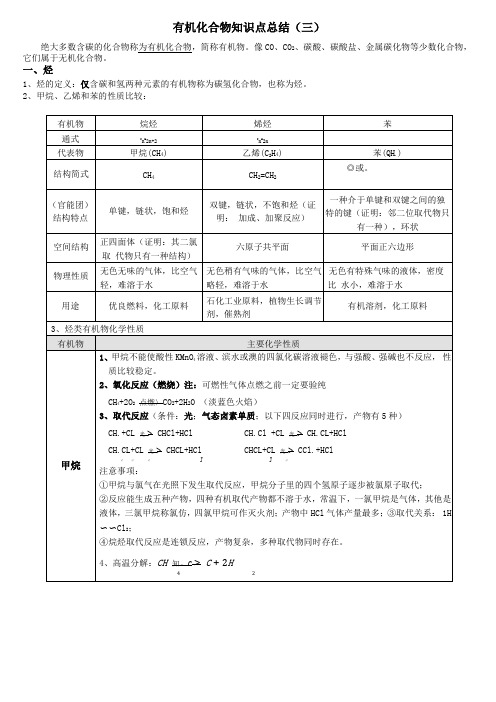
有机化合物知识点总结(三)绝大多数含碳的化合物称为有机化合物,简称有机物。
像CO、CO2、碳酸、碳酸盐、金属碳化物等少数化合物,它们属于无机化合物。
一、烃1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。
2、甲烷、乙烯和苯的性质比较:1.氧化反应 I .燃烧C 2H 4+3O 2点燃> 2CO 2+2H 2O (火焰明亮,伴有黑烟)II .能被酸性KMnO4溶液氧化为CO 2,使酸性KMnO 4溶液褪色。
2.加成反应CH 2=CH 2+Br 2 ------->CH 2Br-CH 2Br (能使滨水或澳的四氯化碳溶液褪色)在一定条件下,乙烯还可以与H 2、Cl 2、HCl 、H 2O 等发生加成反应CH2=CH2+H2 催化剂,CH3cH3CH 2=CH 2+HCl 催化剂"CH 3cH 2cl (氯乙烷:一氯乙烷的简称) CH, = CH,+H,O —催化剂尸 CH.CH.OH (工业制乙醇) 22 2高温高压 3 23 .加聚反应nCH =CH 一催化剂一^一匚三一匚三二一:,(聚乙烯)22△注意:①乙烯能使酸性KMnO 4溶液、滨水或澳的四氯化碳溶液褪色。
常利用该反应鉴别烷烃 和烯烃,如鉴别甲烷和乙烯。
②常用澳水或澳的四氯化碳溶液来除去烷烃中的烯烃,但是不 能用酸性KMnO 4溶液,因为会有二氧化碳生成引入新的杂质。
1 .不能使酸性高镒酸钾褪色,也不能是澳水发生化学反应褪色,说明苯的化学性质比较稳定。
但可以通过萃取作用使滨水颜色变浅,液体分层,上层呈橙红色。
2 .氧化反应(燃烧) 2C 6H 6+15O 2点燃> 12CO 2+6H .O (现象:火焰明亮,伴有浓烟,说明含碳量高)3 .取代反应 (1)苯的漠代:。
+ Br 2*BrR0]- Br (溴苯)+HBr (只发生单取代反应,取代一个H )①反应条件:液澳(纯澳);FeBr 3、FeCl 3或铁单质做催化剂②反应物必须是液澳,不能是滨水。

含氮化合物的性质与反应含氮化合物是指分子中至少含有一个氮原子的化合物。
它们在化学反应中展现出多样性质与反应行为。
本文将讨论含氮化合物的性质以及其常见的反应类型。
一、含氮化合物的性质1. 氮气(N2)是自然界中最常见的氮化物。
它具有无色、无味、不可燃的性质。
氮气是空气中最主要的组成成分之一,约占78%。
由于氮气的惰性,它在一般条件下不会发生反应。
2. 氨(NH3)是含氮化合物中最简单的一种。
它具有刺激性气味,能溶于水,并可形成碱性溶液。
氨是一种重要的原料,广泛用于制造化学肥料以及合成其他氮化合物。
3. 硝酸盐是常见的含氮化合物。
它们具有强氧化性,并在许多反应中发挥重要作用。
硝酸盐广泛应用于炸药、火箭推进剂等领域。
4. 腈是含氮化合物的一类。
它们含有一个或多个氰基(-CN),具有特殊的物理和化学性质。
腈常用于有机合成中作为重要的中间体。
二、含氮化合物的反应类型1. 氧化还原反应:含氮化合物在氧化还原反应中表现出重要的特性。
例如,含氮有机化合物可以通过氧化还原反应转化为不同的氮氧化物,同时伴随着化学键的变化。
2. 加成反应:许多含氮化合物能够参与加成反应,特别是双键的加成反应。
在正电荷或亲电试剂的作用下,氮原子和其他原子形成新的化学键。
3. 取代反应:含氮化合物可以发生取代反应,其中氮原子或氮气可以被其他原子或基团所取代。
这类反应在有机合成中非常常见,可以产生不同结构和性质的化合物。
4. 氨解反应:氮化合物中的氮氢键可以发生氨解反应,生成氨气和其他有机或无机产物。
这是一种重要的反应类型,通常用于合成新的化合物或分离纯化化学物质。
5. 缩合反应:含氮化合物的缩合反应是指两个或多个分子通过断裂某些化学键并形成新的化学键而结合。
这类反应在有机合成中非常有用,可以合成复杂的有机分子。
结论含氮化合物具有丰富的性质和多样的反应类型。
了解和掌握含氮化合物的性质和反应,对于理解氮化学在生物、工业和环境领域的应用具有重要意义。


有机化学中的酸和酯的反应有机化学是研究有机物(含碳元素的物质)的结构、性质、组成和反应机理的学科。
该领域涉及许多重要的反应类型,其中包括酸和酯的反应。
本文将探讨有机化学中酸和酯反应的基本原理和常见反应类型。
一、酸的性质和反应1. 酸的定义根据布朗斯特酸碱理论,酸是指能够捐赠质子(H+离子)的化合物。
常见的酸包括无机酸(如盐酸、硫酸)和有机酸(如乙酸、苯甲酸),它们在溶液中会解离释放出H+离子。
2. 酸的反应酸能够与碱、金属和碱性氧化物等反应。
酸与碱反应形成盐和水,这被称为中和反应;酸与金属反应产生氢气;酸与碱性氧化物反应生成盐和水。
二、酯的性质和反应1. 酯的定义酯是由酸与醇反应形成的有机化合物。
酸与醇发生酯化反应时,酸中的羧基(-COOH)和醇中的羟基(-OH)发生缩合反应,生成酯。
酯常用于香精、杀菌剂、溶剂等领域。
2. 酯的反应酯可以被水解为醇和酸,这一反应被称为酯水解。
酯水解是一个可逆反应,一般需要酸性或碱性催化剂。
此外,酯还可以与醇发生酯交换反应,生成不同种类的酯。
三、酸和酯的反应1. 酸催化的酯水解反应酸催化的酯水解反应是酸和酯的常见反应类型。
在酸催化下,酯与水反应生成相应的酸和醇。
反应机理涉及质子化、开环、脱水等步骤。
2. 酸催化的酯和醇的缩合反应酸催化的酯和醇缩合反应也是有机化学中常见的反应类型。
在酸催化下,酯与醇反应生成酯和水。
这种反应常用于合成酯类化合物。
3. 苯甲酸与醇的反应苯甲酸与醇的反应是一种经典的酸醇缩合反应。
在酸催化下,苯甲酸与醇反应生成酯和水。
这种反应在化学实验室中经常被用于有机合成。
4. 酯的还原反应酯的还原反应是通过还原剂(如金属碱金属或还原性金属)将酯还原为相应的醇。
在这一反应中,酯中的羰基被还原为羟基。
总结:有机化学中酸和酯的反应是该领域中重要的反应类型之一。
酸能够与碱、金属和碱性氧化物等发生反应,而酯则可以通过酸催化水解、酯交换和酸醇缩合等反应类型进行转化。

有机物官能团的性质及相关反应下属反应涉及官能团或有机物类型其它注意问题取代反应卤代烃水解(强碱水溶液)、酯水解(强酸或者强碱溶液)、卤代、硝化、磺化、醇成醚、氨基酸成肽、皂化、多糖水解、肽和蛋白质水解等等烷、苯、醇、羧酸、酯和油脂、卤代烃、氨基酸、糖类、蛋白质等等卤代反应中卤素单质的消耗量(1个H消耗1个卤素分子,同时生成一个HX分子。
条件:光照);苯环上H取代定位规则(甲基,羟基等活化苯环邻对位H);酯皂化时消耗NaOH的量(酚跟酸形成的酯水解时要特别注意,水解得到的酚亦能中和NaOH)。
加成反应氢化、油脂硬化C=C、C≡C、C=O、苯环酸和酯中的碳氧双键一般不加成;C=C和C≡C能跟水、卤化氢、氢气、卤素单质等多种试剂反应,但C=O一般只跟氢气、氰化氢等反应。
特征:断一加二,1个C=C 消耗1个X2(或者H2)分子;1个C≡C 消耗2个X2(或者H2)分子;1个C≡C相当于2个C=C;1个苯环在特定条件下加成相当于相当于3个C=C消去反应醇分子内脱水卤代烃脱卤化氢(强碱醇溶液)醇、卤代烃等、等不能发生消去反应。
(与羟基或卤素相连C的邻位C上面无H)氧化反应有机物燃烧、烯和炔催化氧化、醛的银镜反应、醛氧化成酸等绝大多数有机物都可发生氧化反应醇氧化规律(伯醇氧化为醛,仲醇氧化为酮,叔醇不能氧化);醇和烯都能被氧化成醛;银镜反应、新制氢氧化铜反应中消耗试剂的量;(1个醛基均消耗2个银氨溶液或者氢氧化铜)苯的同系物被KMnO4氧化规律(苯环上有烃基均能被氧化)。
还原反应加氢反应、硝基化合物被还原成胺类烯、炔、芳香烃、醛、酮等复杂有机物加氢反应中消耗H2的量。
加聚反应乙烯型加聚、不同单烯烃间共聚烯烃由单体判断加聚反应产物;由加聚反应产物判断单体结构。
缩聚反应酚醛缩合、二元酸跟二元醇的缩聚、氨基酸成肽等酚、醛、多元酸和多元醇、氨基酸等加聚反应跟缩聚反应的比较;化学方程式的书写。
2. 官能团与有机物性质的关系官能团 化学性质-C =C -1.加成反应:(与H 2、X 2、HX 、H 2O 等)CH 2=CH 2 + Br 2 →CH 2Br -CH 2Br (乙烯使溴水褪色) 2.氧化反应:能燃烧、使酸性KMnO 4褪色 3.加聚反应: a b 催化剂 a bn C =C [ C -C ]nc d c d-C ≡C -1.加成反应:(与H 2、X 2、HX 、H 2O 等)如:乙炔使溴水褪色CH ≡CH+Br 2→CHBr=CHBr CHBr=CHBr+Br 2→CHBr 2—CHBr 2 2.氧化反应:能燃烧、使酸性KMnO 4褪色 醇-OH1. 与活泼金属(Al 之前)的反应 如:2R -OH+2Na →2RONa + H 2↑2.取代反应 :(1)与HX ROH +HX△RX +H 2O(2)分子间脱水:2R -OH ROR + H 2O 3.氧化反应:①燃烧:C 2H 5OH+3O 2→2CO 2+3H 2O (淡蓝色火焰) ②催化氧化:2C 2H 5OH+ O 2催化剂 △2CH 3CHO +2H 2O4.消去反应:C 2H 5OH CH 2=CH 2 +H 2O5.酯化反应: C 2H 5OH +CH 3COOH CH 3COOC 2H 5 +H 2O注意:醇氧化规律(1)R -CH 2OH → R -CHO (2)-OH 所连碳上连两个烃基,氧化得酮 (3)-OH 所连碳上连三个烃基,不能被氧化(不完全氧化)但可燃烧。

有机化学的反应类型与机理引言:有机化学是研究有机化合物的结构、合成、性质和反应的科学。
在有机化学中,反应类型与机理的研究是非常重要的,它们揭示了有机化合物之间的相互作用以及反应中发生的化学变化。
本文将介绍一些常见的有机反应类型,并对其机理进行探讨。
一、取代反应取代反应是有机化学中最常见的一类反应。
它指的是一个原子或一个官能团从有机分子中脱离,而另一个原子或官能团占据其位置。
常见的取代反应有酯的水解、烷基卤化物的取代、醇的取代等。
取代反应的机理通常包括两个步骤:第一步是亲核试剂攻击反应底物,形成一个中间体;第二步是中间体失去一个离去基,生成产物。
这些步骤可以通过共轭碱和共轭酸的形成来加速。
二、加成反应加成反应是指两个或多个反应物中的原子或官能团互相结合形成一个新的化学键。
常见的加成反应有烯烃的加成反应、醛酮的加成反应等。
加成反应的机理通常可以分为两种类型:电子云互相靠近,形成新的共轭体系;或是通过亲核试剂和电子云的攻击形成化学键。
三、消除反应消除反应是指一个分子中的两个官能团结合在一起,形成新的双键或三键,并同时释放掉一个小分子。
常见的消除反应有醇的脱水反应、卤代烃的脱卤反应等。
消除反应的机理通常可以分为两个步骤:首先,一个碱吸引酸的一个负电子,形成一个中间体;然后,中间体失去一个负电子,生成产物。
四、重排反应重排反应是指有机分子中化学键的重新排列,形成不同结构的产物。
常见的重排反应包括氢、脱氢、脱卤生成双键等。
重排反应的机理通常比较复杂,它可能涉及原子或官能团的迁移,以及碳原子的重新排列。
结论:有机化学的反应类型与机理是理解和预测有机反应的关键。
通过研究反应类型和机理,我们可以揭示有机化合物之间的相互作用,并为合成有机化合物提供理论指导。
尽管反应类型与机理的研究十分复杂,但通过逐步分析每个反应的步骤和中间体的形成可以系统地理解和解释反应过程。
有机化学的反应类型与机理的研究有助于推动有机化学的发展,为新的反应和反应条件的发现提供指导和启示。

有机化学基础知识点醇的反应类型有机化学基础知识点:醇的反应类型醇是一类重要的有机化合物,是由碳、氢、氧三种元素组成的有机物。
醇具有独特的化学性质,能够参与多种反应。
本文将介绍醇的反应类型,包括醇的氧化、还原、烷基化、醚化、酯化和醇的消除反应。
一、醇的氧化反应醇可以被氧化剂氧化为醛或酮。
常用的氧化剂有酸性高锰酸钾(KMnO4)、酸性二氧化铬(CrO3/H2SO4)和过氧化氢(H2O2)。
醇的氧化反应通常伴有颜色的变化,是定性检验醇的重要方法。
二、醇的还原反应醇可以被还原剂还原为烷烃。
常用的还原剂有金属钠(Na)、锂铝氢化物(LiAlH4)和氢气(H2)等。
不同的还原剂对应不同的反应条件,需要根据具体情况选择适当的还原剂。
三、醇的烷基化反应醇可以与卤代烷发生烷基化反应,生成醚。
烷基化反应是通过醇中的羟基与卤代烷中的卤原子发生取代反应实现的。
常用的卤代烷有溴甲烷(CH3Br)、碘甲烷(CH3I)等。
四、醇的醚化反应醇可以和醇反应生成醚,这种反应称为醚化反应。
醚化反应通过醇中的一个羟基和另一个醇分子中的羟基发生取代反应实现。
常见的醚化反应例子有乙醇与甲醇反应生成乙醚(CH3-O-CH2CH3)。
五、醇的酯化反应醇可以和酸反应生成酯。
酯化反应是通过醇中的羟基和酸中的羧基发生酯键的形成。
酯化反应通常需要酸催化剂,常用的酸催化剂有硫酸(H2SO4)和过磷酸(H3PO4)等。
六、醇的消除反应醇可以参与消除反应,生成烯烃。
消除反应是指醇中的羟基和氢离子发生消除,生成双键,醇的消除反应通常是碱性条件下进行的。
常用的消除反应有酮醇消除反应和醇醚消除反应等。
综上所述,醇的反应类型包括氧化、还原、烷基化、醚化、酯化和消除反应。
这些反应广泛应用于有机合成和有机化学研究中,对于理解和掌握有机化学基础知识具有重要意义。


《有机化学反应类型》知识清单有机化学是研究有机化合物的组成、结构、性质、制备方法与应用的科学。
在有机化学中,化学反应类型众多,了解这些反应类型对于深入理解有机化学的本质和应用具有重要意义。
以下是对常见有机化学反应类型的详细介绍。
一、加成反应加成反应是指有机物分子中的不饱和键(双键或三键)两端的原子与其他原子或原子团直接结合生成新化合物的反应。
1、与氢气的加成例如,乙烯与氢气在催化剂作用下发生加成反应生成乙烷:CH₂=CH₂+ H₂ → CH₃CH₃。
这一反应在工业上常用于制备乙烷等饱和烃。
2、与卤素单质的加成如乙烯与溴水发生加成反应生成 1,2 二溴乙烷:CH₂=CH₂+ Br₂→ CH₂BrCH₂Br 。
这个反应可以用来鉴别不饱和烃和饱和烃。
3、与卤化氢的加成丙烯与氯化氢加成可以生成 1 氯丙烷或 2 氯丙烷:CH₃CH=CH₂+HCl → CH₃CH₂CH₂Cl (主产物)或 CH₃CHClCH₃。
加成的位置遵循马氏规则。
二、取代反应取代反应是指有机物分子中的某些原子或原子团被其他原子或原子团所替代的反应。
1、卤代反应甲烷与氯气在光照条件下发生卤代反应,生成一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳等:CH₄+ Cl₂ → CH₃Cl + HCl 、CH₃Cl +Cl₂ → CH₂Cl₂+ HCl 等。
2、硝化反应苯与浓硝酸、浓硫酸在加热条件下发生硝化反应生成硝基苯:3、酯化反应羧酸和醇在浓硫酸催化下发生酯化反应生成酯,如乙酸和乙醇反应生成乙酸乙酯:CH₃COOH + C₂H₅OH CH₃COOC₂H₅+ H₂O 。
三、消去反应消去反应是指在一定条件下,有机物分子脱去小分子(如 H₂O 、HX 等)生成不饱和化合物的反应。
例如,乙醇在浓硫酸、170℃条件下发生消去反应生成乙烯:C₂H₅OH CH₂=CH₂↑ + H₂O 。
四、氧化反应有机化合物的氧化反应通常是指有机物分子中加氧或去氢的反应。
1、燃烧氧化大多数有机物都能在空气中燃烧,完全燃烧生成二氧化碳和水。

有机物性质归纳有机物是由碳和氢以及其他一些元素组成的化合物。
它们在自然界中广泛存在,并且在生物体内发挥重要的作用。
有机物的性质多种多样,可以根据不同的特征进行分类。
本文将对有机物的性质进行归纳,方便读者了解和掌握这一重要的化学知识。
1. 物理性质有机物的物理性质包括颜色、气味、溶解性、熔点和沸点等。
其中,颜色和气味是人们在日常生活中最容易感知的有机物性质。
有机物的颜色可以因其分子结构而有所不同。
一些有机物呈现出鲜艳的颜色,如染料和色素,而另一些则是无色或者白色的,如乙醇和蔗糖。
有机物的气味也因其分子结构而异。
有些有机物具有芳香气味,如香水和挥发油,而另一些则具有刺激性或难闻的气味,如苯酚和胆固醇。
溶解性是有机物的重要物理性质之一。
某些有机物可以溶解于水中,如醇类和酚类化合物,而另一些则不溶解于水,如烃类和脂肪类化合物。
有机物的熔点和沸点与其分子量、分子结构和分子间相互作用相关。
通常情况下,分子量较大的有机物具有高熔点和高沸点,而分子量较小的有机物则具有低熔点和低沸点。
2. 燃烧性质有机物的燃烧性质与其分子结构中的碳、氢和氧元素有关。
一般来说,有机物可以在氧气的存在下燃烧,产生二氧化碳和水。
有机物的燃烧是一种放热反应,可以产生大量的热能。
不同的有机物燃烧时产生的热能大小也不同,与其分子结构和氧含量有关。
有机物的燃烧还可以产生光和烟雾。
一些有机物在燃烧时会释放出明亮的火焰,并且伴随着黑色的烟雾,如木材和煤炭。
3. 化学性质有机物的化学性质包括酸碱性、氧化还原性、聚合反应和酯化反应等。
这些性质主要是由有机物中的化学键和它们之间的相互作用决定的。
一些有机物具有酸性或碱性。
酸性有机物在水溶液中会释放出氢离子,碱性有机物则会释放出氢氧根离子。
酸碱性的判断可以通过检验有机物在水中的pH值来确定。
有机物中的氧化还原反应是化学反应中的一个重要方面。
氧化反应是指有机物失去电子,而还原反应是指有机物获得电子。
这些反应可以产生新的有机物,并且释放出大量的能量。

有机化学基础知识点有机锌化合物的合成和反应有机锌化合物的合成和反应有机锌化合物是一类重要的有机金属化合物,它们由锌与有机卤化物反应而成。
有机锌化合物具有丰富多样的化学性质,广泛应用于有机合成和金属有机化学等领域。
本文将介绍有机锌化合物的合成方法和常见的反应类型。
一、有机锌化合物的合成方法1. Grignard试剂法Grignard试剂是由卤代烃和金属镁反应得到的金属有机化合物。
它们可用于与卤代烃、酮、醛等底物反应,生成相应的有机锌化合物。
合成Grignard试剂的一般步骤为:首先将干燥的溶剂和金属镁放置于干燥环境中,待金属镁表面出现反应活性后,加入卤代烃或其他底物,反应生成有机锌化合物。
2. 光合成法光合成法是通过紫外光照射下,使有机卤化物与锌粉反应生成有机锌化合物。
这种方法适用于那些难以通过Grignard试剂法获得的有机锌化合物的合成。
3. 氧化还原法氧化还原法是通过将二价有机锌化合物与氧化剂反应得到三价有机锌化合物。
这种方法对于合成不同化合价态的有机锌化合物很有用。
二、有机锌化合物的反应类型1. 与卤代烃的反应有机锌化合物与卤代烃发生取代反应,生成新的有机锌化合物。
这种反应可以用于合成含有碳-碳键和碳-卤键的化合物。
2. 与醛、酮的反应有机锌化合物与醛、酮反应生成醇和醚。
这种反应被广泛应用于有机合成中,尤其是在构建碳-碳键和构建杂环化合物的合成中。
3. 与酸的反应有机锌化合物与酸反应生成相应的酯化产物。
这种反应可以用于合成酯化物和酸衍生物。
4. 与碳酸酯的反应有机锌化合物与碳酸酯反应生成酮和酮酸盐。
这种反应可以用于构建羰基化合物和杂环化合物。
5. 与酯的反应有机锌化合物与酯发生取代反应,生成醇和醚。
这种反应通常用于构建碳-碳键和构建杂环化合物的合成中。
6. 其他反应有机锌化合物还可与其他化合物发生若干其他类型的反应,如与酰基氯反应生成酮、与叔碳酮反应生成醇等。
结论本文讨论了有机锌化合物的合成方法和常见的反应类型。

有机化学基础知识点整理有机化合物的物理性质与化学性质有机化学基础知识点整理——有机化合物的物理性质与化学性质在有机化学中,有机化合物是指含有碳元素的化合物。
它们是构成生物体的基础,并且在工业生产、医药领域等方面起着重要的作用。
了解有机化合物的物理性质和化学性质,对于深入理解有机化学的基础知识非常重要。
本文将对有机化合物的一些常见物理性质和化学性质进行整理。
一、物理性质1. 熔点和沸点有机化合物的熔点和沸点是物理性质中最常见的两个指标,也是判断纯度和分析化合物的重要依据。
不同类型的有机化合物具有不同的熔点和沸点范围。
例如,醇类化合物的熔点和沸点较高,因为它们之间存在氢键,分子间相互作用力较强。
相比之下,烃类化合物的熔点和沸点较低,因为它们之间不存在氢键。
2. 密度有机化合物的密度是指单位体积内所含质量的大小,通常用于鉴别和区分化合物。
不同类型的有机化合物具有不同的密度。
例如,含有卤素的有机化合物通常比不含卤素的有机化合物密度要大,这是因为卤素的原子量较大。
3. 折射率有机化合物的折射率是指光线在化合物中传播时的偏离程度,可以用于确定化合物的结构和纯度。
不同类型的有机化合物具有不同的折射率。
4. 溶解性有机化合物的溶解性是指其在不同溶剂中溶解程度的大小。
有机化合物的溶解性与分子间相互作用力有关。
例如,极性溶剂如水通常能溶解极性有机化合物,而非极性溶剂如石油醚则能溶解非极性有机化合物。
二、化学性质1. 氧化还原反应有机化合物的氧化还原反应是指其与氧化剂或还原剂发生的反应。
氧化还原反应是有机化学中常见的反应类型,常用于合成和转化有机化合物。
例如,醇类化合物可以通过氧化反应生成酮或醛。
还原反应则可以将酮或醛还原为对应的醇。
2. 反应活性有机化合物的反应活性与其分子结构和化学键的稳定性有关。
例如,含有不饱和键(如烯烃、炔烃)的有机化合物比饱和化合物更容易发生化学反应。
3. 反应类型有机化合物可以进行许多类型的化学反应,如取代反应、加成反应、消除反应等。

有机化合物的基本分类和性质有机化合物(Organic compounds)是碳元素和氢、氧、氮、硫等其他元素(称为卤素)以及若干必需的金属元素等构成的化合物。
在自然界中,有机化合物广泛存在于石油、天然气、煤炭等化石燃料中,也存在于植物和动物的体内。
它们具有多种分类和性质,本文将对有机化合物的基本分类和主要性质进行详细介绍。
一、有机化合物的基本分类1. 根据碳骨架结构分类有机化合物可以根据其碳骨架结构的不同而进行分类。
根据碳原子的排列形式,可将有机化合物分为链状、环状和支链状三类。
(1)链状有机化合物:碳原子按直线排列形成链状结构,如甲烷(CH4)、乙烷(C2H6)等。
这类化合物的特点是分子中的碳原子与周围碳原子相连,形成直链结构。
(2)环状有机化合物:碳原子按环状排列形成环状结构,如环己烷(C6H12)、苯(C6H6)等。
这类化合物的特点是分子中的碳原子形成环状结构,环上的碳原子之间通过共享电子形成键。
(3)支链状有机化合物:碳原子排列形成直链或环状结构,并在碳链上侧支出其他碳基团,如异丁烷(C4H10)、叔丁基甲基醚(C5H12O)等。
这类化合物的特点是分子中的碳原子形成支链结构。
2. 根据官能团分类有机化合物也可以根据分子中的官能团(Functional group)进行分类。
官能团是有机分子中使化合物具有一定特定性质和反应的基团。
(1)醇类:官能团为羟基(-OH),如乙醇(C2H5OH)、甲醇(CH3OH)等。
醇类化合物在实验室中常用作溶剂,也是合成其他有机化合物的重要原料。
(2)酮类:官能团为羰基(C=O),如丙酮(CH3COCH3)、戊酮(C3H7COCH3)等。
酮类化合物在药物、香料、溶剂等领域有广泛应用。
(3)酸类:官能团为羧基(-COOH),如乙酸(CH3COOH)、丙酸(C2H5COOH)等。
酸类化合物具有酸性,可以参与酸碱中和反应等。
(4)醛类:官能团为羰基(C=O),且羰基碳原子与一个氢原子相连,如甲醛(HCHO)、乙醛(CH3CHO)等。