氢氧化钴
- 格式:doc
- 大小:436.00 KB
- 文档页数:2

氢氧化钴在锂离子电池中的应用研究及发展前景分析氢氧化钴(Co(OH)2)作为一种重要的电极材料,在锂离子电池中有着广泛的应用。
本文将重点探讨氢氧化钴在锂离子电池中的应用研究以及发展前景的分析。
首先,氢氧化钴具有很高的理论比容量,其化学反应为:Co(OH)2 + xLi+ + xe- ↔ LiCoO2在充放电过程中,氢氧化钴通过插入/脱出锂离子的过程来实现储存和释放电能。
因此,氢氧化钴作为锂离子电池的正极材料具有很高的电化学活性,并且具有较高的比容量。
这使得氢氧化钴成为锂离子电池中理想的正极材料之一。
然而,氢氧化钴在锂离子电池中存在一些问题。
首先,氢氧化钴有一定的结构不稳定性,循环稳定性较差。
随着充放电周期的增加,氢氧化钴的结构会发生改变,导致其电化学性能下降。
此外,氢氧化钴还存在着较大的体积变化,导致电极材料容易出现脱落、剥离等问题。
这些问题限制了氢氧化钴在锂离子电池中的应用。
针对上述问题,研究人员通过调控氢氧化钴的结构和表面形貌,改善其电化学性能。
例如,在合成氢氧化钴过程中控制反应条件、添加表面活性剂、进行表面修饰等手段可以有效降低氢氧化钴的结构不稳定性,提高其循环稳定性。
此外,研究人员还通过合成复合材料、纳米材料等方法来改善氢氧化钴的体积变化问题,以增强材料的结构稳定性和力学性能。
随着这些研究的不断深入,氢氧化钴在锂离子电池中的应用得到了显著的改善。
例如,通过控制氢氧化钴的结构和表面形貌,可以提高其比能量和循环寿命,从而提高锂离子电池的整体性能。
此外,氢氧化钴还可以与其他材料进行复合,形成多功能电极材料,以进一步提高电池的性能。
例如,氢氧化钴与石墨烯、二氧化钛等进行复合,可以提高电池的循环性能、充放电速率和稳定性。
综上所述,氢氧化钴作为锂离子电池的正极材料,在电化学性能、循环稳定性和容量等方面具有较高的潜力。
随着对氢氧化钴材料的深入研究,通过结构和表面形貌的调控及与其他材料的复合,有望进一步提高氢氧化钴的性能,并促进锂离子电池的发展。

氢氧化亚钴和氢氧化钴1. 开场白大家好呀!今天咱们聊聊两个听起来有点拗口的化学物质——氢氧化亚钴和氢氧化钴。
这俩名字是不是让你有点懵?别担心,我保证在接下来的时间里,我们就像在喝茶聊天一样轻松愉快,搞懂这两个小家伙的来龙去脉。
说起来,化学这玩意儿就像是一场精彩的魔术秀,台上那些炫酷的反应,台下其实都是一群原子在拼命工作呢!2. 氢氧化亚钴的故事2.1 什么是氢氧化亚钴?咱们先从氢氧化亚钴说起。
这个名字听上去像是某种神秘的药水,其实它的化学式是 Co(OH)₂。
简单来说,氢氧化亚钴是由钴、氢和氧组成的。
钴这个元素啊,大家可能听过,它可是个很重要的金属,常常出现在电池、颜料和一些超酷的科技产品里。
氢氧化亚钴在化学反应中可不是个小角色,它通常是以蓝色的固体出现,色泽鲜亮,活脱脱就像一颗闪闪发光的蓝宝石。
2.2 它的用途与特点氢氧化亚钴的用途可不少!在电池制造中,它可是个得力助手,能够提升电池的性能,简直就像是给电池打了一针强心针。
另外,它在化学实验中也常常被用作催化剂,帮助其他化学反应更顺利地进行。
想象一下,它就像是化学反应中的“红娘”,把各个反应物引导到一起,促成一场美好的“化学爱情”。
不过,虽然它看起来很棒,氢氧化亚钴也有点脆弱,容易和空气中的氧气反应,所以储存的时候可得小心翼翼。
3. 氢氧化钴的魅力3.1 氢氧化钴是什么?接下来说说氢氧化钴,化学式是 Co(OH)₃。
它是氢氧化亚钴的“大哥”,稍微复杂一些,但同样重要。
氢氧化钴也是蓝色的,不过相对来说,它的颜色更深一些,有点像天空中的云朵,时不时地变幻着颜色。
它的化学性质可谓“稳如泰山”,不容易和其他物质发生反应,因此在工业和科研领域中备受青睐。
3.2 它的用途与重要性氢氧化钴在电池、颜料和催化剂等方面的应用也让它备受关注。
在电池领域,它能帮助提高电池的能量密度,延长电池的使用寿命,真是一颗“百宝珠”。
而在化妆品行业,氢氧化钴也偶尔现身,成为了某些产品的成分之一,给肌肤带来亮泽。

粗制氢氧化钴制备四氧化三钴流程
四氧化三钴是一种重要的无机化合物,其应用范围广泛,如用于制备磁性纳米粒子、催化剂以及电池材料等。
在制备四氧化三钴的过程中,粗制氢氧化钴是非常重要的中间体。
下面将介绍以粗制氢氧化钴制备四氧化三钴的流程。
要准备好所需的材料和设备。
材料包括粗制氢氧化钴、硝酸铵、硝酸、氢氧化钠和氢氧化钴。
设备包括热板、烧杯、磁力搅拌器、滤纸和干燥器等。
将粗制氢氧化钴和硝酸铵加入烧杯中,用磁力搅拌器搅拌均匀。
然后,缓慢加入硝酸,搅拌至完全溶解。
在此过程中,需要注意控制加硝酸的速度和温度,以避免溅出和剧烈反应。
接下来,将烧杯放在热板上,用慢火加热,使其沸腾。
继续加热,直到溶液变得浓稠,出现白色沉淀为止。
然后,加入少量氢氧化钠,搅拌均匀,使其pH值保持在8.5左右。
此时,沉淀将变成蓝色。
再将溶液过滤,去除残留物,得到蓝色溶液。
接下来,将蓝色溶液加入干燥器中,用低温低压的条件下干燥,得到四氧化三钴。
以粗制氢氧化钴制备四氧化三钴的流程是比较简单的。
但是在实际操作中,需要注意控制反应条件,以保证产品的质量。
此外,在使用化学品时,需要注意安全,避免发生意外事故。

粗制氢氧化钴一、介绍粗制氢氧化钴粗制氢氧化钴是一种重要的无机化合物,其化学式为Co(OH)2。
它是一种灰白色粉末,可溶于酸和碱性溶液中。
粗制氢氧化钴是一种重要的工业原料,广泛应用于电池、催化剂、颜料等领域。
二、制备方法1. 碳酸钴法:将碳酸钴和水混合后,加入适量的碱性溶液,搅拌混合后过滤得到沉淀,再经过洗涤和干燥即可得到粗制氢氧化钴。
2. 氨水法:将硝酸钴溶解在水中,加入适量的氨水调节pH值至8-9左右,在搅拌下反应数小时后过滤得到沉淀,再经过洗涤和干燥即可得到粗制氢氧化钴。
三、应用领域1. 电池:粗制氢氧化钴是一种重要的电池材料,在镍镉电池、镍金属电池等电池中广泛应用。
2. 催化剂:粗制氢氧化钴作为催化剂,可用于有机合成、气体分离等领域。
3. 颜料:粗制氢氧化钴可用于制备蓝色颜料。
四、优缺点1. 优点:(1)粗制氢氧化钴价格低廉,易于获取;(2)具有较高的电化学性能;(3)广泛应用于电池、催化剂、颜料等领域。
2. 缺点:(1)粗制氢氧化钴纯度较低,需要进一步提纯才能应用于某些高端领域;(2)在一些应用中,其性能与其他材料相比略逊一筹。
五、安全注意事项1. 粗制氢氧化钴具有一定的刺激性和腐蚀性,操作时需戴上防护手套和口罩等防护措施。
2. 在加工和储存过程中要注意防火防爆,并保持通风良好。
六、结论粗制氢氧化钴是一种重要的无机化合物,在电池、催化剂、颜料等领域广泛应用。
其价格低廉,易于获取,具有较高的电化学性能。
但其纯度较低,需要进一步提纯才能应用于某些高端领域。
在操作过程中需注意安全防护和防火防爆等问题。

氢氧化钴和双氧水反应
氢氧化钴和过氧化氢能够发生化学反应,氢氧化钴为两性氢氧化物,能与酸发生反应,而过氧化氢属于弱酸。
氢氧化钴的化学式为Co(OH)2,一般为玫瑰红色单斜或四方晶系结晶体,不溶于水,但能溶于酸和强碱及铵盐溶液。
密度约为3.6g/cm3.熔点1100-1200℃,为两性氢氧化物。
主要用作玻璃和搪瓷的着色剂、制取其他钴化合物的原料,以及清漆和涂料的干燥剂。
氢氧化钴有两种晶相:a-Co(OH)2具有类似水滑石结构,典型特征是层状双羟基复合金属氧化物的结构,由于其大的层状结构,故其导电性较好,此类型氢氧化钴颜色通常呈蓝青色。
但是,此相并不稳定,处于亚稳态,容易转变为β相。
β-Co(OH)2具有水镁石结构,羟离子六方紧密堆积,阳离子充填于每两层相邻的羟离子之间的全部八面空隙;组成配位八面体的结构层。
结构层内属离子键,结构层间以相维系。
其颜色往往呈砖红色,或者说是玫瑰红。
溶解度:溶于酸及铵盐溶液,不溶于水,与一些有机酸反应生成相应的钴肥皂。
物质用途:化工生产中用于制造钴盐,含钴催化剂及电解法生产双氧水分解剂。
涂料工业用作油漆催干剂。
玻搪工业用作着色剂等。
用于制钴盐、钴催化剂、蓄电池电极的浸透溶液及油漆干燥剂;用于玻璃、搪瓷着色,制钴化合物,以及涂料和清漆的干燥剂。
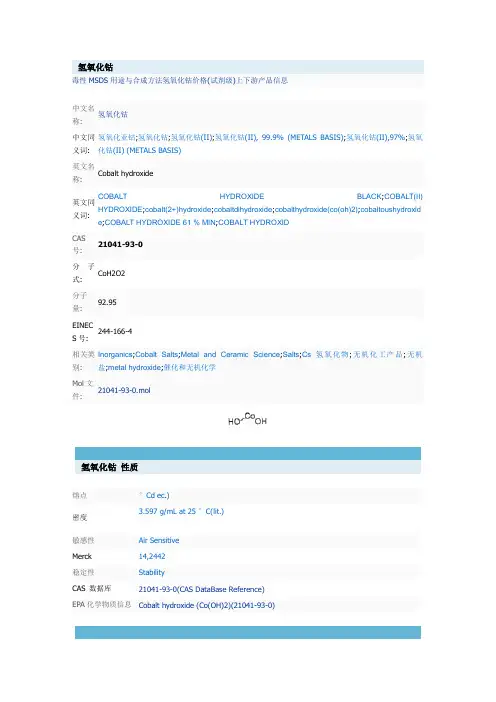
氢氧化钴毒性MSDS用途与合成方法氢氧化钴价格(试剂级)上下游产品信息中文名称:氢氧化钴中文同义词:氢氧化亚钴;氢氧化钴;氢氧化钴(II);氢氧化钴(II), 99.9% (METALS BASIS);氢氧化钴(II),97%;氢氧化钴(II) (METALS BASIS)英文名称:Cobalt hydroxide英文同义词:COBALT HYDROXIDE BLACK;COBALT(II) HYDROXIDE;cobalt(2+)hydroxide;cobaltdihydroxide;cobalthydroxide(co(oh)2);cobaltoushydroxid e;COBALT HYDROXIDE 61 % MIN;COBALT HYDROXIDCAS号:21041-93-0分子式:CoH2O2分子量:92.95EINECS号:244-166-4相关类别:Inorganics;Cobalt Salts;Metal and Ceramic Science;Salts;Cs氢氧化物;无机化工产品;无机盐;metal hydroxide;催化和无机化学Mol文件:21041-93-0.mol氢氧化钴性质熔点°Cd ec.)密度3.597 g/mL at 25 °C(lit.)敏感性Air SensitiveMerck 14,2442稳定性StabilityCAS 数据库21041-93-0(CAS DataBase Reference)EPA化学物质信息Cobalt hydroxide (Co(OH)2)(21041-93-0)氢氧化钴用途与合成方法毒性钴是生物学上重要元素,小剂量能活化调节组织呼吸、造血和其他过程的许多酶,大剂量时,则抑制这些酶的活性,对碳水化合物的代谢有影响,选择性损伤胰腺的内分泌部分,影响心血管系统,扩张血管、降低血压,选择性地损伤心肌。
吸入钴化合物,有时出现支气管哮喘。

氢氧化镍、氢氧化钴、氢氧化锰介绍氢氧化镍氢氧化镍〔ni(oh)2〕为强碱,微溶于水,易溶于酸结构式: ni(oh)2 计量式: h2ni1o2 相对分子量:熔点:230 °c 密度:4150 kg/m3 (°c).基本介绍编辑IUPAC名称:nickel hydroxide结构式: Ni(OH)2计量式: H2Ni1O2相对分子量:熔点:230 °C密度: 4150 kg/m3 (°C)形态(常温):晶或无颜色(常温):蓝绿色溶解度(水): g/100g水溶解度(其它溶剂): +CAS 号:12054-48-7PubChem CID: 25500相关性状:氢氧化镍为还原性氢氧化物,能和某些强氧化剂反应生成NiO(OH),有较强的碱性,为中强碱,在饱和水溶液(质量比浓度5%)中能电离出大量OH-和少量[Ni(OH)6]4-阴离子,也能溶于NaOH、KOH等强碱中形成Na4[Ni(OH)6]或K4[Ni(OH)6],蒸干后得到Na4NiO3等易水解盐。
产品用途编辑制镍盐原料,碱性蓄电池,电镀,催化剂。
用于制碱蓄电池、镀镍等;用于制取镍盐、碱性蓄电池、镀镍等。
3性质及稳定性编辑在一定的温度下可被溴水、氯水、次氯酸钠等氧化,生成黑色羟基氧化镍NiO(OH)。
不燃,具强刺激性。
230℃时分解成NiO和H2O。
溶于氨水、乙二胺和酸。
可用于制取镍盐、碱性蓄电池和镀镍等。
制镍盐原料,碱性蓄电池,电镀,催化剂。
4储运条件编辑贮存于阴凉、通风的库房。
远离火种、热源。
防止阳光直射。
包装密封。
应与氧化剂、酸类分开存放。
[1]5生产方法编辑络合沉淀法制备球形氢氧化镍实验一、试验目的形核与长大是无机材料制备过程中的关键环节,是无机材料化学的重要内容。
由于络合沉淀制备球形氢氧化镍是形核与长大控制的典型案例,且该技术具有重要的实践应用背景,因此,本课程选用络合沉淀法制备球形氢氧化镍作为学能试验技能与知识技能提高的重要试验。

粗氢氧化钴中钴的提取工艺及生产实践粗氢氧化钴是一种重要的过渡金属化合物,广泛应用于催化剂、电池材料、磁性材料等领域。
本文将重点介绍粗氢氧化钴的提取工艺及生产实践。
提取粗氢氧化钴的工艺一般包括以下几个步骤:原料处理、溶液制备、晶体生长、分离与干燥等。
首先,需要选择合适的原料,常见的原料有钴矿石、废钴合金等。
对原料进行破碎、磨矿等处理,获得适合溶解的颗粒度。
接下来是溶液制备过程。
将经过处理的原料与酸性溶液进行反应,通常使用硫酸、盐酸等酸性溶液。
在控制适当的温度、搅拌速度和反应时间的条件下,使得钴元素与酸性溶液发生反应,生成钴离子。
晶体生长是提取粗氢氧化钴的关键步骤之一。
将钴离子溶液进行过滤和净化处理,去除杂质物质。
然后,通过控制溶液的温度、pH值、浓度等条件,使得钴离子逐渐结晶成为氢氧化钴晶体。
晶体的形状和尺寸可以通过调节溶液中添加剂的种类和浓度来控制,如添加络合剂、表面活性剂等。
分离与干燥是最后的关键步骤。
将氢氧化钴晶体与溶液进行分离,通常采用过滤、离心等方法。
分离后的湿氢氧化钴晶体需进行干燥处理,以获得干燥的氢氧化钴产品。
干燥的过程可以通过自然风干或采用真空干燥等方法进行。
在实际生产过程中,需要充分考虑工艺参数的优化和设备的选择。
例如,选择合适的反应釜、过滤设备、干燥设备等,以提高生产效率和产品质量。
同时,需要进行严格的质量控制,监测原料的质量、反应过程中的温度、pH值等参数,并对产品进行分析和检测,确保产品达到相关标准。
粗氢氧化钴的提取工艺包括原料处理、溶液制备、晶体生长、分离与干燥等步骤。
在实际生产中,需要根据具体情况进行工艺参数优化和设备选择,并进行严格的质量控制。
通过不断的实践和改进,提高生产效率和产品质量,推动粗氢氧化钴在各个应用领域的广泛应用。

氢氧化钴三价
氢氧化钴三价是一种无机化合物,其化学式为Co(OH)3。
它的主要特点是具有良好的催化性能和电化学性质,因此在许多领域都有广泛的应用。
首先,氢氧化钴三价在催化反应中具有重要作用。
它可以作为催化剂用于氧化反应、加氢反应、羰基还原等多种反应中。
例如,在石油加工工业中,氢氧化钴三价常用于加氢裂解和醇类脱水反应;在有机合成领域中,它可以用于酮类还原、芳香族环的加氢等反应。
此外,由于其良好的光催化性能,它还可以用于光催化降解废水和空气净化等方面。
其次,在电池材料制备方面,氢氧化钴三价也是一个重要的材料。
它可以被用来制备锂离子电池、镍镉电池、镍金属-水合物电池等多种类型的电池。
此外,在超级电容器领域中,它也被广泛地使用。
除了以上两个方面之外,氢氧化钴三价还可以用于制备其他化合物。
例如,它可以被用来制备氧化钴、钴酸盐和钴碳酸盐等多种化合物。
此外,它还可以用于制备其他金属氢氧化物、金属羟基盐等。
总之,氢氧化钴三价是一种具有广泛应用前景的无机化合物。
它在催
化反应、电池材料制备以及其他领域都有着重要的作用。
未来随着科学技术的不断发展,相信它的应用范围还会进一步扩大。

氢氧化钴和过氧化氢反应方程式
氢氧化钴和过氧化氢反应方程式
氢氧化钴是一种无机化合物,其化学式为Co(OH)2。
过氧化氢则是一种强氧化剂,其化学式为H2O2。
当这两种物质发生反应时,会产生一些有趣的现象。
首先,这个反应可以看作是一个还原-氧化反应。
具体来说,过氧化氢会被还原成水,而同时,氢氧化钴会被氧化成CoO(OH):
Co(OH)2 + H2O2 → CoO(OH) + H2O
在这个反应中,过氧化氢的两个氧原子分别将钴离子的两个水合电子还原成了水。
因此,在反应后生成的产物中只有一个水分子。
另一方面,钴离子则被过氧化物离子(即HOO-)所攻击,并且失去了两个电子。
这使得它从+2价变成了+3价,并形成了CoO(OH)的结构。
总之,这个反应是一个典型的还原-氧化反应,并且产生了一些非常有
趣的产物。
如果你想要进一步研究这个反应的机理和特性,可以参考相关文献或咨询专业化学家。
最新实验做出的相关氢氧化钴样品数据如下
粒度分布
0.01 0.1 1 10 100 1000 3000
粒度 (μm)
0 2 4 6 8 10 12 14 体积 (%)CO(OH)2 - 平均, 2012年2月13日 9:05:18 0
20
40
60
80
100
粒度 (μm)体积不足 %粒度 (μm)体积不足 %粒度 (μm)体积不足 %粒度 (μm)体积不足 %粒度 (μm)体积不足 %粒度 (μm)体积不足 %
0.0100.000.1380.001.44556.0311.482100.00120.226100.001258.925100.00
0.0110.000.1580.001.66067.9613.183100.00138.038100.001445.440100.00
0.0130.000.1820.001.90578.6715.136100.00158.489100.001659.587100.00
0.0150.000.2090.002.00081.9717.378100.00181.970100.001905.461100.00
0.0170.000.2400.002.18887.3319.953100.00208.930100.002187.762100.00
0.0230.000.2752.51293.5322.909100.00239.883100.002511.886100.00
0.0300.000.3160.002.88497.3526.303100.00275.423100.002884.032100.00
0.0350.000.3630.013.00098.0630.200100.00316.228100.003311.311100.00
0.0400.000.4170.143.31199.2734.674100.00363.078100.003801.894100.00
0.0460.000.4790.763.80299.9439.811100.00416.869100.004365.158100.00
0.0520.000.5502.204.365100.0045.709100.00478.630100.005011.872100.00
0.0600.000.6314.805.012100.0052.481100.00549.541100.005754.399100.00
0.0690.000.7248.915.754100.0060.256100.00630.957100.006606.934100.00
0.0790.000.83214.866.607100.0069.183100.00724.436100.007585.776100.00
0.0910.000.95522.777.586100.0079.433100.00831.764100.008709.636100.00
0.1050.001.09632.588.710100.0091.201100.00954.993100.0010000.000100.00
0.1200.001.25943.9110.000100.00104.713100.001096.478100.00
d(0.1):0.746um d(0.5):1.350um d(0.9):2.306um
电镜如下图: