第六章《溶解现象》第二节 第1课时
- 格式:doc
- 大小:52.50 KB
- 文档页数:3


第六章溶解现象第一节物质在水中的分散1、物质以细小的固体颗粒分散在水中,则形成悬浊液;(如面粉、泥土分散到水中,不均一、不稳定)若物质以小液滴分散在水中,则形成乳浊液。
(如植物油分散到水中,不均一、不稳定)溶解:物质以分子或离子形式均匀地分散到另一种物质的过程,叫做物质的溶解。
物质溶解后形成均一、稳定的混合物叫做溶液。
如食盐水、石灰水、矿泉水等均是溶液,有些溶液还有颜色,如KMnO4溶液紫红色、CuSO4溶液蓝色、FeSO4为浅绿色、FeCl3溶液黄色。
溶液的特性:均匀性、稳定性乳化作用:洗涤剂等中的乳化剂能够把油分散到水中,使两种互不相溶的液体形成稳定乳浊液的过程。
洗涤油脂的三种方法:1、热的纯碱溶液------化学反应;2、洗涤剂-------乳化作用; (★洗洁精洗油污用了乳化的原理)3、汽油或酒精------溶解油脂,形成溶液。
2、在物质溶于水形成溶液的过程中,通常伴有热量的变化。
不变NaCl 升高NaOH、浓H2SO4降低NH4NO33、某些固体物质在水中溶解时能生成自由移动的离子,所以这些物质的水溶液能够导电。
例如,食盐溶于水生成自由移动的Na+和Cl-,食盐水能导电。
水溶液的特性;(1)凝固点的降低:如在严寒的冬季,水易结冰而酱油和食醋不会结冰;用食盐可以融化道路上的积雪。
(2)沸点的升高:煮沸的汤比沸水温度高。
(3)有的溶液有导电性:食盐水、稀硫酸、烧碱溶液均能导电是由于在其溶液中存在自由移动带电荷的离子,而蔗糖溶液不导电是由于蔗糖是由分子构成的。
第二节溶液组成的表示1、溶液的组成:(1)溶质:被溶解的物质。
它既可以是固体(如食盐水中的食盐),也可以为液体(如酒精水溶液中的酒精)或气体(如盐酸中的氯化氢、氨水中的氨气)。
(2)溶剂:能溶解溶质的物质。
水是最常见的溶剂,但也有其他溶剂,如碘酒中的酒精、汽油溶解植物油。
判断溶质、溶剂的方法:根据最终溶液中有什么成分来判断,而不是看向液体中加进了什么物质;如铁粉加到硫酸铜溶液中恰好完全反应,反应后溶液中只有硫酸亚铁和水,所以溶液中溶质是硫酸亚铁,溶剂是水。
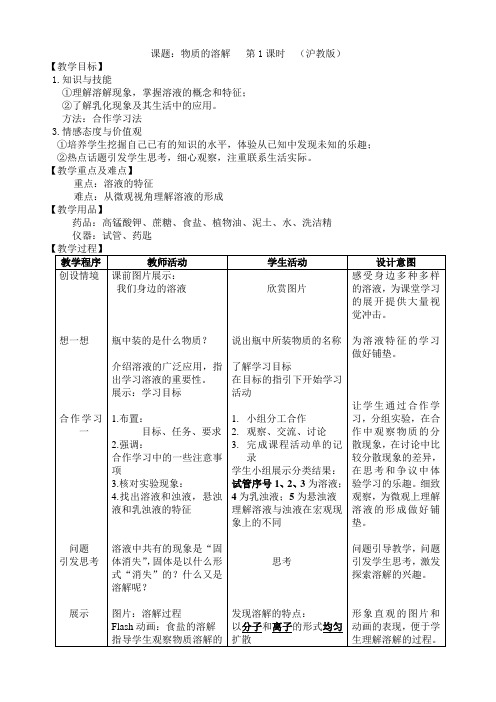
课题:物质的溶解第1课时(沪教版)【教学目标】1.知识与技能①理解溶解现象,掌握溶液的概念和特征;②了解乳化现象及其生活中的应用。
方法:合作学习法3.情感态度与价值观①培养学生挖掘自己已有的知识的水平,体验从已知中发现未知的乐趣;②热点话题引发学生思考,细心观察,注重联系生活实际。
【教学重点及难点】重点:溶液的特征难点:从微观视角理解溶液的形成【教学用品】药品:高锰酸钾、蔗糖、食盐、植物油、泥土、水、洗洁精仪器:试管、药匙《溶解现象》是一个相对比较独立的章节,《物质溶解》第1课时,既没有复杂的原理又没有探究性强的实验,是本章相对比较简单的一节内容。
本节课的核心问题是溶液和浊液的区分以及溶液概念的建立,充分利用好实验,通过学生小组合作学习,比较、分析、讨论、归纳,总结出溶液的特征,知道一些常见的乳化现象。
教学过程中应更多的源于学生已有知识来解决课上的实际问题,从已知中发现未知,从熟悉中感受新奇,这种发现的过程和新奇的体验对于学生的发展是非常有意义的。
理论联系实际,让化学走进家庭生活,突出化学的生活化信息,让学生充分体会到化学与生活的密切联系,增强其学习兴趣以及深入探究问题的热情。
只有从学生熟悉的事物出发,才能为溶液的教学提供更为广阔的空间。
后附:《化学课程活动单》第6章 溶解现象 第一节 物质的溶解班级 姓名<合作学习一>1.实验记录:几种物质分散在水中的现象2.分类:依据实验现象,将5支试管分类试管序号:类别: 特征:<合作学习二>1.怎样才能加快冰糖在水中的溶解速度? 本组的建议:①:②: ③:2.选择一条建议,设计本组的实验验证方案:(文字或画图形式均可)<家庭小实验>分别尝试用以下方法清洗餐具:①只用冷水 ②只用热水 ③冷水+洗洁精 ④热水+洗洁精 ⑤在水中加入纯碱粉末 观察哪种方法清洗最干净,自己设计并完成实验报告,在班内交流。
化学课程 活动单。

第六章溶解现象第2课时物质的溶解性命题回顾及趋势考查1.影响物质溶解性的因素、饱和溶液、不饱和溶液、溶解度涵义;结晶现象。
2.绘制溶解度曲线,能根据曲线指出曲线上点的含义、物质溶解度与温度关系以及溶解度随温度变化不一样的物质从溶液中分离出来的方法。
知识要点1.一种物质溶解在另一物质中的能力叫做溶解性。
影响固体物质溶解性的因素有因_______和_______,_______。
2.在一定温度一定量溶剂里不能再溶解某溶质的溶液叫该溶质的_______,能继续溶解的叫做该溶质的_______。
3.大多数物质的饱和溶液和不饱和溶液间的相互转化如下4.在_______下,物质在_______溶剂里达到_______状态时溶解的质量叫做(固体)物质的溶解度。
溶解度曲线是物质在水中的溶解度随_______变化而变化的关系曲线。
根据溶解度曲线,大多数物质溶解度随温度的升高而_______,如_______;少数物质的溶解度随温度_______,如___________;极少数物质的溶解度随温度的升高_______,如_______。
影响气体溶解度的外在因素有_______._______。
5.溶液中析出晶体的过程叫做结晶。
饱和溶液蒸发掉溶剂可析出晶体,对于溶解度随温度_______的物质,也可以采用冷却热饱和溶液的方法从混合物中分离。
重点突破影响物质溶解性的因素;饱和溶液和不饱和溶液间转化的方法(氢氧化钙仅温度与大多数物质相反);理解溶解度的概念,认识溶解度曲线上的点、线、面代表的含义及其应用。
【典型题目】1.下列因素中,与固体物质的溶解度无关的是A.溶质的种类B.溶剂的种类C.温度的高低D.溶质、溶剂量的多少2.若将一定质量的硝酸钾不饱和溶液变为饱和溶液,则A.溶液的质量一定变小B.溶液中溶质质量分数一定变大C.溶液的质量一定变大D.溶液中溶质的质量分数可能不变3.【2017年广西省】如图是a、b、c三种固体物质的溶解度曲线图,下列说法错误的是A.b物质为易溶物质B.a、c两物质的溶解度相同C.温度升高,c物质溶解度减小D.50℃时,a物质的溶解度为50g4.如图为a、b、c三种物质的溶解度曲线,等质量的a、b、c三种物质的饱和溶液温度由50℃降为30℃,析出晶体最多的是A.a B.b C.c D.a和b5.【2017年新疆维吾尔自治区】2017年4月22日,货运飞船“天舟一号”升入太空和“天宮二号”完成第一次交会对接。

2024年溶解完整版课件一、教学内容本节课我们将探讨《化学》教材第六章“溶液与浓度”的第二节“溶解”,详细内容涉及溶解的定义、溶解过程、溶解度及其影响因素,同时,结合实验活动,对溶解现象进行直观展示和深入理解。
二、教学目标1. 让学生理解溶解的基本概念,掌握溶解过程的特点。
2. 培养学生运用溶解度知识解释日常生活中溶解现象的能力。
3. 引导学生通过实验探究溶解度的影响因素,提高学生的实验操作能力和观察能力。
三、教学难点与重点教学难点:溶解度的概念及其影响因素的理解。
教学重点:溶解过程的特点、溶解度及其应用。
四、教具与学具准备教具:溶解实验装置、多媒体设备、PPT课件。
学具:实验报告、笔、计算器。
五、教学过程1. 实践情景引入(5分钟)通过展示日常生活中常见的溶解现象,如糖溶解在水中,引发学生对溶解现象的好奇心。
2. 理论讲解(15分钟)介绍溶解的定义、溶解过程,讲解溶解度的概念,分析溶解度的影响因素。
3. 例题讲解(15分钟)通过例题解析,让学生掌握溶解度计算方法,学会运用溶解度知识解决实际问题。
4. 实验活动(25分钟)分组进行溶解实验,观察溶解过程,探究溶解度与温度、搅拌速度等因素的关系。
5. 随堂练习(10分钟)布置与实验相关的练习题,巩固学生对溶解知识的掌握。
六、板书设计1. 溶解的定义、溶解过程、溶解度2. 溶解度的影响因素:温度、搅拌速度、溶质和溶剂性质等3. 溶解度计算方法七、作业设计1. 作业题目:(1)简述溶解的定义和溶解过程。
(2)根据实验数据,分析温度对溶解度的影响。
2. 答案:(1)溶解:溶质在溶剂中均匀分布形成稳定体系的过程。
(2)温度升高,溶解度增大。
(3)10%八、课后反思及拓展延伸本节课通过实验和理论讲解,使学生掌握了溶解的基本概念和溶解度的计算方法。
课后,教师应关注学生对实验数据的分析,引导学生运用所学知识解释生活中的溶解现象。
拓展延伸方面,可以让学生了解不同溶剂对溶质溶解度的影响,提高学生的知识储备。
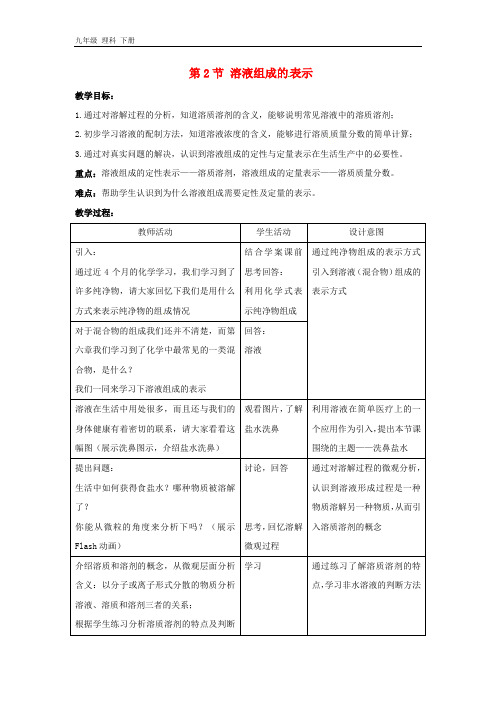
第2节溶液组成的表示教学目标:1.通过对溶解过程的分析,知道溶质溶剂的含义,能够说明常见溶液中的溶质溶剂;2.初步学习溶液的配制方法,知道溶液浓度的含义,能够进行溶质质量分数的简单计算;3.通过对真实问题的解决,认识到溶液组成的定性与定量表示在生活生产中的必要性。
重点:溶液组成的定性表示——溶质溶剂,溶液组成的定量表示——溶质质量分数。
难点:帮助学生认识到为什么溶液组成需要定性及定量的表示。
教学过程:教师活动学生活动设计意图引入:通过近4个月的化学学习,我们学习到了许多纯净物,请大家回忆下我们是用什么方式来表示纯净物的组成情况结合学案课前思考回答:利用化学式表示纯净物组成通过纯净物组成的表示方式引入到溶液(混合物)组成的表示方式对于混合物的组成我们还并不清楚,而第六章我们学习到了化学中最常见的一类混合物,是什么?我们一同来学习下溶液组成的表示回答:溶液溶液在生活中用处很多,而且还与我们的身体健康有着密切的联系,请大家看看这幅图(展示洗鼻图示,介绍盐水洗鼻)观看图片,了解盐水洗鼻利用溶液在简单医疗上的一个应用作为引入,提出本节课围绕的主题——洗鼻盐水提出问题:生活中如何获得食盐水?哪种物质被溶解了?你能从微粒的角度来分析下吗?(展示Flash动画)讨论,回答思考,回忆溶解微观过程通过对溶解过程的微观分析,认识到溶液形成过程是一种物质溶解另一种物质,从而引入溶质溶剂的概念介绍溶质和溶剂的概念,从微观层面分析含义:以分子或离子形式分散的物质分析溶液、溶质和溶剂三者的关系;根据学生练习分析溶质溶剂的特点及判断学习通过练习了解溶质溶剂的特点,学习非水溶液的判断方法方法完成练习提出问题:配制好的盐水能用来洗鼻吗?(出示资料)生理盐水指的就是我们平时在医院所用的氯化钠注射液(出示图片)我们一同来了解下“0.9%”是什么含义思考,分析引导学生认识查阅信息资料的重要性,认识如何科学的看待物质。
过渡至溶液的浓度一定量的盐水中氯化钠的质量可多可少,在日常生活中会用“浓”和“稀”来表示,那我们如何判断浓稀?为了更合理科学的区分溶液的浓稀,我们用溶液的浓度来表示溶液中溶质的量。
1
第二节 溶液组成的表示
第1课时 溶液组成的表示方法
【知识与方法】
1.知道溶液的组成,会判断溶质和溶剂。
2.了解溶液组成的定量表示。
3.能进行简单的溶质、溶液、溶质质量分数的换算。
【练习与反馈】
l.下列各组内物质相互混合后,能形成溶液的是 ( )
A.碳酸钙与水 B.煤油与水 C.面粉与水 D.油脂与汽油
2.下列溶液中.溶质是液体的为 ( )
A.10%的硫酸铜溶液 B.10 %的稀盐酸
C.3%的醋酸溶液 D.1%的高锰酸钾溶液
3.下列对溶液的叙述,正确的是 ( )
A.水是一切溶液的溶剂
B.凡是无色、透明的液体都是溶液
C.溶液中可以有一种溶质,也可以有多种溶质
D.酒精溶液的体积等于水的体积和酒精的体积之和
4.组成溶液的溶质 ( )
A.只能是由分子构成 B.只能是固体
C.只能是由离子构成 D.可以是固体、气体和液体
5.下列说法不正确的是 ( )
A.溶液的体积一溶质的体积+溶剂的体积
B.溶液的更量一溶质的质量+溶剂的质量
C.两种液体互溶时,量多的是溶剂,但水无论多少都是溶剂
D.溶液的读法是先读溶质,再读溶剂
6.每天补充适量维生素C,有利于提高人体免疫力。某维生素C泡腾片,每片含1 g
维生素C。将1片该泡腾片投入适量水中,最终得到250 g溶液。此溶液维生素C的质量
分数为 ( )
A.0.4% B.1% C.2.5% D.4%
7.将85 g某食盐溶液蒸发,得到15 g食盐,则原溶液溶质的质量分数为 ( )
A.21.4% B.17.6% C.15 % D.10%
8.下列说法正确的是 ( )
A.溶液中的溶质只能是固体.溶剂只能是液体
B.溶液的质量等于组成它的溶质、溶剂的质量之和,但溶液的体积也等于溶质、溶
剂的体积之和
C.在固态溶质刚开始溶解时.液体各部分的浓稀程度是不同的,当形成溶液后,溶
液各部分的浓稀程度一定相同
D.溶液都是无色透明的混合物
2
9.一定温度下,某蔗糖溶液中溶质与溶剂的质量比为3:7,则50g该蔗糖溶液中含蔗
糖的质量为 ( )
A.30 g B.15 g C.39 g D.35 g
10.如要将100 g溶质质量分数为20%的硝酸钠溶液稀释成溶质质量分数为10%的硝
酸钠溶液,需加入水的质量为 ( )
A.50 g B.90 g C.100 g D.200 g
11.如要将200 g溶质质量分数为5%的食盐溶液变成溶质质量分数为10%的食盐溶液,
需蒸发水的质量为 ( )
A.100 g B.95 g C.90 g D.50g
12.将质量分数为60%的乙醇溶液(密度小于1)与等体积的水混合后,则所得溶液的质
量分数为 ( )
A.等于30% B.大于30% C小于30% D.等于35%
13.把100mL10%的氯化钠溶液稀释50倍,稀释后溶液中的溶质质量 ( )
A.减小50倍 B.增大50倍 C.减小5倍 D.不变
14.填写下列空白:
15.将20 mL水倒入装有20 mL95%的酒精的烧杯中,混合均匀后体积为V mL。再将一
块手帕浸入该溶液中,用镊子夹起手帕,点燃手帕上的酒精,当手帕上的火焰即将熄灭时,将
手帕晃动几下,火熄灭,手帕完好无损。
(1)混合后的溶液中溶质是 ,溶剂是 。
(2)混合后的体积V mL 40 mL(填“>”或“<”或“=”)
原因是 。
16.配制300 g16%的硝酸钾溶液,需水和硝酸钾各多少克?
17.在180 g12%的硝酸钠溶液里加入20 g水或20 g硝酸钠固体,分别计算溶液中溶质
质量分数。
18.20℃时,将12 g食盐完全溶于108 g水中,其溶质的质量分数为 ,现将此
溶液均分成三等份。
(1)取第一份溶液,该溶液的溶质质量分数为 ;将该溶液温度升高到25℃,
所得溶液的溶质质量分数为 。
(2)取第二份溶液,要使其溶质质量分数增大一倍,需加入 g食盐或者蒸发掉
g水。
(3)取第三份溶液,要使其溶质质量分数减小为原来一半,需加入 g水。
3
参考答案
1.D 2.C 3.C 4.D 5.A 6.A 7.B 8.C 9.B 10.C 11.A 12.C 13.D
14.
15.酒精 水 < 分子间有空隙,相互填充对方分子间的空隙,使体积减小
16.48 g 252 g
17.10.8% 20.8%
18.(1) 10% l 0% (2)5 20 (3)40