评说硫氮的功与过
- 格式:ppt
- 大小:1.44 MB
- 文档页数:45

第五章评说硫,氮的“功”与“过”化学组许焕武5.1 从黑火药到酸雨第一课时1.知识与技能目标(1)硫的物理性质和化学性质(B)(2)硫化氢的毒性、气味、强还原性(B)2.过程与方法(1)通过对单质硫性质的研究,学习将理论知识应用于实际问题的解决,认识非金属元素的研究方法。
(2)通过对单质硫与铁反应的研究,认识研究化学反应的一般方法。
(3)通过黑火药发明和利用的介绍,明白我国劳动人民对化学物质及其性质的认识过程。
3.情感态度与价值观(1)通过黑火药发明和利用的介绍,激发学习兴趣,增强民族自豪感和责任感。
(2)通过硫化氢的可燃性,感悟内因和外因辩证关系。
(3)通过硫的用途以及硫化氢的性质,懂得化学与生产、生活的关系。
二.教学重点和难点1.教学重点硫的化学性质,硫化氢的物理性质和化学性质2.难点硫元素和氯元素非金属性的差异。
三.教学用品多媒体,实验用品(硫粉、水、二硫化碳、酒精、还原铁粉、试管、酒精灯、白纸、磁铁、硫化亚铁、稀硫酸、启普发生器、尖嘴导管、火柴、烧杯)四..教学过程五.教学反思对硫化氢的研究仅停留在最基本要求层面,可结合硫化氢中毒事件,对硫化氢的制备和性质作更深入探讨。
也可以布置类似“实验室多余的硫化氢应如何处理?生产或生活中如何防止硫化氢中毒?”等思考题让学生思考。
由于增加了黑火药发明和利用的介绍以及铁与硫反应的研究,时间可能不足5.1从黑火药到酸雨(共两课时)化学组许焕武第2课时从黑火药到酸雨一.教学目标1.知识与技能(1)二氧化硫的氧化性和还原性(B)(2)二氧化硫形成酸雨的化学原理(B)(3)二氧化硫与水反应及亚硫酸的弱酸性(B)(4)二氧化硫性质的实验探究实验技能(B)2.过程与方法(1)认识从物质类别、氧化还原和特性三个宏观角度探讨物质性质的化学思维习惯。
(2)通过对二氧化硫性质的实验探究,经历化学实验探究方法。
3.情感态度与价值观通过对酸雨的成因、危害以及防治的学习,培养环境保护意识,感悟人类与自然友好相处以及可持续发展的理念。

5.4 化学肥料的主角(共三课时)第3课时铵盐和建立人与自然的和谐关系[设计思想]本节课在氨的结构、性质的基础上,重点介绍了铵盐的性质和铵离子的检验方法。
在学习铵盐的性质和铵离子的检验时,先通过实验得出结论,再归纳出铵盐的共性都能与碱反应产生氨气,然后采用讨论和实验的方式,让学生总结出检验铵离子的方法。
对于自然界中氮和硫的循环,教材采用图片与问题相结合的形式,旨在通过讨论,让学生认识氮和硫的循环对生态平衡的重要作用,从而进一步理解和体会建立人与自然的和谐关系的重要性。
一、教学目标1.知识与技能(1)铵盐的性质(B)(2)铵根离子的检验方法(B)(3)自然界中氮和硫的循环对生态平衡的影响(B)2.过程与方法通过铵盐的性质和铵根离子的检验实验,提高观察能力、分析能力和归纳总结能力,认识研究问题的科学方法。
3.情感态度与价值观通过对建立人与自然的和谐关系的重要性的学习,增强关注社会、关注人类生存环境的意识,感悟对事物的分析要一分为二,辨证看待的观念。
二.教学重点和难点铵盐的性质和铵离子的检验方法。
三.教学用品投影仪、封有固体NH4Cl的玻璃管、固体Ca(OH)2、(NH4)2SO4、NH4NO3、10%的NaOH 溶液、红色石蕊试纸四.教学流程1.流程图2.流程说明1展示铵盐晶体,并溶于水:观察氯化铵晶体、硫酸铵晶体、硝酸铵晶体的色态及溶解性。
2演示实验:NH4Cl晶体受热分解的封管实验。
五.教学案例1.教学过程教学过程教师活动学生活动说明复习引入[复习提问]我们用两根玻璃棒分别在浓氨水中和浓盐酸中蘸取后靠近有何现象?其本质是什么?学生思考并回答:产生大量的白烟,此白烟是NH3与HCl形成的NH4Cl晶体微粒,其本质是NH3与H+形成NH+4。
巩固所学知识,引入新课。
铵[新课引入]NH4Cl晶体是由NH+4(铵离子)复习引入:浓氨水、浓盐酸铵盐受热铵盐与学生活动:氨气的物理共2演示实验,引入铵盐的1展示铵盐晶体,铵离子的分析比较与碘升华的区别归纳小结本学生阅读教材,自学“建立人与自然和Cl-(酸根离子)构成,像这样由铵离子和酸根离子构成的化合物叫做铵盐。

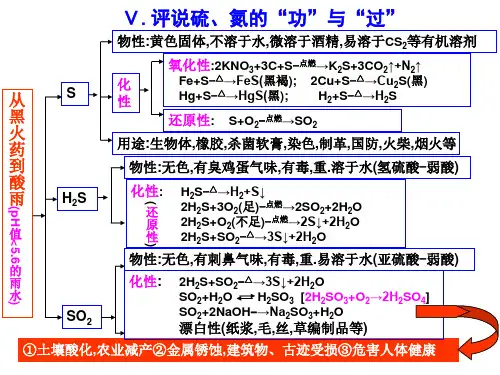
评说硫氮的功与过一、硫硫在自然界中有两种存在状态、硫单质常存在于。
⑴物理性质硫单质俗称。
在通常状况下,它是一种色或色的固体;很脆、易研成粉末;溶解性:于水,于酒精,于二硫化碳;硫的熔点、沸点都不高。
联想:(1)过氧化钠颜色(2)如何除去试管上残留的硫?硫的同素异形体常见的有和。
⑵化学性质①与金属反应铁与硫:。
反应现象:结论:联想:a、铁与氯气的反应b、铁与氧气的反应总结:氯气、硫的氧化性强弱铜与硫:。
小结:硫与金属反应规律。
氯气与金属反应规律。
②与非金属反应H2 +S △H2S,该反应表现了硫的性。
S+O2△SO2,该反应表现了硫的性。
实验现象:在空气中燃烧时;在纯氧中燃烧时。
总结:燃烧火焰为淡蓝色的物质有哪些?练习1、不能由单质直接化合而制得的是()A、SO2B、CuSC、H2SD、HCl总结:从化合价角度分析硫的化学性质,硫单质中硫元素化合价为,处于中间价态,既有又有。
③与某些化合物的反应S +2KNO3 +3C==== K2S +3CO2↑+N2↑(黑火药爆炸的反应)了解黑火药成分,一硫二硝三木炭(3)硫的用途硫黄主要用于制造硫酸、化肥、火柴及杀虫剂等,还用于制造火药、烟火爆竹等。
练习2、下列说法正确的是()A.硫是一种淡黄色的能溶于水的固体B.硫在自然界中仅以化合态存在C.铁与硫反应生成硫化亚铁D.硫在空气中燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫E.单斜硫和斜方硫都是硫单质练习3、某同学做完硫的实验后,发现试管内壁上的硫很难除去,请利用所学知识,帮他除去。
另一位同学利用如下原理清洗:3S+6NaOH (热) =2Na2S+Na2SO3+3H2O在这一反应中,体现了硫的()A.氧化性 B.还原性 C.既有氧化性又有还原性 D.既无氧化性又无还原性二、二氧化硫⑴物理性质二氧化硫是一种色、气味的毒的气体,是一种严重的大气污染物,它的密度比空点燃气,于水,常温、常压下,1体积水大约溶解体积的二氧化硫,易液化。


5.4 化学肥料的主角(共三课时)第1课时氮气和氮的固定[设计思想]氮元素在自然界的循环中起着重要的作用。
近些年来,人类活动对氮元素在自然界中循环的影响也越来越大。
氮元素在自然界的循环又是具体的物质循环。
让学生了解氮元素在自然界的循环,了解化学物质、化学反应在自然界循环中重要作用,了解化学物质、化学反应对人类生产生活的重要意义,可以使学生在掌握基本的化学知识的同时培养学生对化学的兴趣,建立可持续发展的观念,体会化学对人类、社会发展所起的重要作用。
因此,本节第一课时以“氮气和氮的固定”作为课题,重点介绍三种固氮方法,通过探究“固氮”困难的原因,掌握氮气的结构和性质。
在探究过程中,培养学生利用氧化还原思想分析解决问题的能力和探究解决问题的科学方法。
一.教学目标1.知识与技能(1)化学肥料的三要素及施用的基本原则(A)(2)固氮的途径,大气固氮和工业固氮的原理(B)(3)氮气的性质、用途(B)(4)氮分子结构及与其性质的关系(B)2.过程与方法通过对固氮原理、方法的学习,增强学生利用已有知识(氧化还原反应)分析解决问题的能力,认识通过实验探究解决问题的科学方法。
3.情感态度与价值观懂得氮元素固定的意义,从中体会化学对社会生活的重要意义。
二.教学重点和难点氮气的化学性质,氮分子结构对氮气性质的影响。
三.教学用品多媒体。
四.教学流程1.流程图12五.教学案例与正常小麦、缺钾的大豆和甘蓝图[讲述]简介化学肥料的重要性,引出化学发学生知欲。
3.相关链接(1)合成氨、化学武器和哈伯在化学发展史上,有一位化学家,虽早已长眠地下,却曾给世入留下过关于他的功过是非的激烈争论。
他就是本世纪初世界闻名的德国物理化学家、合成氨的发明者弗里茨•哈伯(Fritz Haber)。
赞扬哈伯的人说:他是天使,为人类带来丰收和喜悦,是用空气制造面包的圣人;诅咒他的人说:他是魔鬼,给人类带来灾难、痛苦和死亡,针锋相对、截然不同的评价,同指一人而言,令人愕然;哈伯的功过是非究竟如何,且看这位化学家一生所走过的辉煌而又坎坷的道路。

第五章评说硫、氮的“功”与“过”5.1 从黑火药到酸雨1.知识与技能(1)硫的物理性质和化学性质(B)(2)硫化氢的毒性、气味、强还原性(B)2.过程与方法(1)通过对单质硫性质的研究,学习将理论知识应用于实际问题的解决,认识非金属元素的研究方法。
(2)通过对单质硫与铁反应的研究,认识研究化学反应的一般方法。
(3)通过黑火药发明和利用的介绍,明白我国劳动人民对化学物质及其性质的认识过程。
本节课通过情景创设,激发学生兴趣与求知欲并落实过程与方法、情感态度与价值观教育;通过理论分析引导学生认识硫及硫化氢的氧化还原性,通过实验探究、观察思考、交流互动等学习活动,使学生深刻认识硫及硫化氢的化学性质。
学科:化学高中一年级第二学期(试用本)>上科版>第五章>第一节>第一课时作者:余方喜单位:上海市松江二中地址:上海市松江区中山东路250号 Email: Drizzl-yu@ 第五章说明本章主要介绍硫和氮元素及其化合物的知识,并介绍了物质的量浓度及其配制、水的电离与溶液的酸碱性等,该学习内容是均为高中化学重点知识。
本章在选材上着眼于硫和氮的单质及其化合物的主要性质。
在知识安排上,不过分强调知识的逻辑顺序,更突出与社会、生活、健康、环境的联系,如酸雨的形成、化肥的施用等,尽量使知识和用途相结合,体现学以致用的原则。
理论知识引入自然。
教材在编排时围绕结构决定性质、性质决定用途这条主线,使学生在掌握性质时,初步形成元素及其化合物知识学习的一般规律。
通过本章学习,学生不但能学到硫、氮元素及其化合物的性质和应用等知识,还能认识到化学物质在造福人类、推动人类社会物质文明发展中所起的作用,并形成化学物质的不合理应用也会引起环境污染等社会问题的观点,进而使学生树立珍爱自然、爱护环境、科学地应用化学物质促进社会可持续发展的科学发展观。
所以本章教学过程中应注意创设情景,充分进行相关资源的挖掘,激发学生兴趣与求知欲,落实情感态度与价值观教育。

第五章评说硫、氮的“功”与“过”知识点梳理一、硫1、物理性质:硫是一种黄色或淡黄色的固体(俗称硫磺),不溶于水,微溶于酒精,易溶于CS2(可用于清洗除硫)。
2、化学性质:单质硫既有氧化性,又有还原性。
(1)氧化性:Fe + S Fe S 黑褐色2Cu + S Cu2S 黑色Hg + S→HgS (常温下反应, 实验室中用于处理散落的汞滴)2Ag + S→Ag2S (黑色, 银器变黑)S + H 2H2S(2)还原性:S + O 2SO2(3)硫与碱反应:3S + 6NaOH →2Na 2S + Na 2SO3 + 3H 2O(可用于清洗除硫)3、用途:是重要的化工原料,制硫酸、农药、火药、药品、硫化橡胶等。
二、硫化氢1、物理性质:无色、有臭鸡蛋气味的气体,有剧毒,密度比空气略大,能溶于水,其水溶液叫氢硫酸(氢硫酸露置于空气中易被氧化2H2S +O2→2S +2H2 O)。
2、化学性质(1)还原性:2H2S + SO2→3S +2H2 OH2S + X2→S+2HX (X = Cl, Br, I )H2S + H2SO4(浓) →S+SO2+2H2O(2)不稳定性:H2S H2 + S(3)可燃性:2H2S + O 22S +2H2O(空气不足, 不完全燃烧)2H2S + 3O 22SO2+ 2H2 O(空气充足, 完全燃烧)3、实验室制法:FeS+H2SO4→FeSO4+H2S↑其发生装置与H2、CO2、SO2相同。
4、其它(1)Cl2不溶于饱和食盐水中;CO2不溶于饱和NaHCO3溶液,但溶于Na2CO3溶液Na2CO3+CO2+H2O→2NaHCO3;SO2不溶于饱和NaHSO3溶液,但溶于Na2SO3溶液Na2SO3+SO2+H2O→2NaHSO3;H2S不溶于饱和NaHS溶液,但溶于Na2S溶液Na2S+ H2S→2NaHS。
(2)H2S+CuSO4→CuS↓+H2SO4(CuS不溶于酸,因此可用CuSO4除去少量的H2S)三、SO21、物理性质:无色、有刺激性气味的气体,有毒,密度比空气大,易液化,可溶于水(1 体积水可溶解40 体积二氧化硫)2、化学性质(1)具有酸性氧化物的通性SO2 + H2 O H 2SO3SO2 + 2NaOH→Na2SO3+H2OSO2+CaO →CaSO3(2)具有弱氧化性SO2 + 2H2S →3S +2H2O高温(3)有还原性:SO 2+ X 2→H 2SO 4+2HX (X = Cl, Br, I ) 因此,SO 2可使溴水(橙色或黄色)、氯水(淡黄绿色)、碘水(浅棕色)、酸性高锰酸钾溶液(紫红色)褪色,这是利用了SO 2的还原性,而不是漂白性。

△第五章 评说硫、氮的功与过化学方程式总结1.S +2KNO K 2S +3CO 2↑+N 2↑(黑火药爆炸)2. Fe +S3. 2Cu Cu 2S4. Hg +S HgS5. H 2+S2S6. S +O 2(在氧气中发出蓝紫色火焰)7. 2H 2S +3O +2H 2O (发出淡蓝色火焰)8. 2H 2S +O 2(不足)2S +2H 2O (H 2S 不完全燃烧) 9. 2H 2S +SO 23S +2H 2O10. H 2S + CuSO 4 = CuS ↓(黑)+ H 2SO 4 (检验H 2S ) 11. H 2S + Pb(NO 3)2 = PbS ↓(黑)+ 2HNO 3 (检验H 2S )12. SO 2+H 2O H 2SO 3 (二元中强酸) 13. 2H 2SO 3+O 22H 2SO 414. 2SO 2 + O 2催化剂 加热2SO 3 (SO 2的催化氧化) 15. SO 3+H 2O H 2SO 416. SO 2 + Br 2 + 2H 4 + 2HBr (使溴水或高锰酸钾溶液褪色) 17. NaCl +H 2SO 4(浓)4+HCl ↑18. NaNO 3 + H 2SO 4+HNO 3↑19. Cu +2H 2SO 4(浓)CuSO 4+SO 2↑+2H 2O20. C + 2H 2SO 4(浓)CO 2↑+2SO 2↑+2H 2O21. BaCl 2 + H 2SO 4BaSO 4↓+2HCl 22. BaCl 2 + Na 2SO 4BaSO 4↓+2NaCl 23. BaCl 2 + Na 2CO 3BaCO 3↓+2NaCl 24. BaCO 3 +2HCl BaCl 2+H 2O +CO 2↑ 25. Ba 2+ + SO 42-BaSO 4↓放电△△△△△△在实验室里检验溶液中是否含有SO42-时,常常先用盐酸把溶液酸化,以排除CO32-、SO32-、Ag+等干扰,再加入BaCl2溶液,如果有白色沉淀出现,则说明原溶液中肯定存在SO42-。

“二氧化硫”教学设计一、教学目标通过实验探究,掌握二氧化硫的主要性质和了解二氧化硫的作用。
通过设计实验,培养学生的自主探究能力、动手操作能力及观察能力。
通过对二氧化硫功与过的讨论,培养学生辩证的哲学观。
二、教学重点、难点二氧化硫的主要化学性质。
三、教学方法、手段教学方法:实验探究、阅读讨论、对比总结等方法。
教学手段:多媒体辅助教学、实验演示。
四、教学用品1.多媒体投影、实物投影。
2.实验仪器:表面皿、试管、试管架、试管夹、酒精灯、火柴、烧杯等。
3.实验药品:蒸馏水、pH试纸、石蕊试液、高锰酸钾溶液、品红溶液、NaOH溶液、酚酞溶液等。
五、教学过程1.引入新课[教师]:上课,同学们好!请坐!上课之前我们一起来做一个小游戏!请看规则,这位同学上来做,其他每小组派一个代表做。
请开始,同学们猜猜看为何出现了不同?原来而这个只是空瓶,大家的装满了二氧化硫。
今天我们一起来学习二氧化硫!【过渡】大家通过刚才的小游戏,已经对二氧化硫有一定的认识了,请同学们结合教材P90的内容,总结归纳二氧化硫的物理性质。
【PPT】从这几个方面来总结。
[板书]一、物理性质[学生]:总结性质,投影[教师强调]:有毒气体的闻法:扇闻,使少量气体飘进鼻孔。
结合以上的游戏和教材P90实验4-7,总结如何证明二氧化硫易溶于水?[学生]:试管内的液面上升了;矿泉水瓶瘪了[过渡]:我们知道CO2溶于水的会发生化学反应而生成H2CO3 ,类比,那么SO2溶于水是否也会发生化学反应呢?其产物又是什么?[学生]:会反应生成H2SO3[教师]:好,那也即是说二氧化硫水溶液呈什么性?酸性!那我们如何用实验证明它呈酸性呢?讨论一下,给出你们的方案并预测可能有什么现象?1.小组活动:证明二氧化硫水溶液呈酸性[学生]:用pH试纸,试纸变红;用石蕊试液,溶液变红。
[学生实验]:方案一:用pH试纸测定SO2水溶液的pH方案二:SO2水溶液中加石蕊试液。
【教师】这是真的吗?请用事实说话,用试管取少量的二氧化硫水溶液做实验,每组分两个小组,分别验证方案一,方案二。