第二章 定性分析(2)
- 格式:ppt
- 大小:286.50 KB
- 文档页数:42



第二章定性分析概论第一节定性分析的任务和分析方法一、定义定性分析的任务是鉴定物质中所含有的组分。
组分:元素或离子(无机物)——无机定性分析元素、官能团或化合物(有机物)——有机定性分析我们现在学的是无机定性分析,它是无机化学的后继课程,同无机化学有紧密的联系。
二、本学期的学习目的通过本学期定性分析的学习,我们可以达到以下几个方面的目的:(1)可以对常见离子及有关化合物的性质、反应条件以及它们彼此的分离和鉴定等有更深刻的理解;(2)定性分析是理论与实际结合得很紧密的课程,学生通过己知物与未知物的分析,可进一步提高运用理论知识解决实际问题的能力;(3)定性分析的半微量操作技术有助于培养我们的细致认真的态度,提高实验操作的技能技巧,为将来进行定量分析及其他精密实验作好准备;(4)定性分析的实验方法本身有很大的实用价值,是化学实验工作者所不可缺少的知识和技能。
三、分析方法定性分析方法的分类同分析化学总的分类方法一致……定性分析方法可采用化学分析和仪器分析法进行。
化学分析法的依据是物质间的化学反应。
按反应体系的特征来分,常用有干法和湿法。
1)干法干法是指固体样品和固体试剂在常温下进行反应的方法。
如:粉沫研磨法、焰色反应和熔珠反应等。
焰色反应是根据试样在无色火焰中灼烧时,所呈现的不同颜色的火焰,来鉴定试样中含有何种元素的方法,几种金属元素焰色如下:熔珠反应是利用硼砂(Na2B4O7·10H2O)或者磷酸氢铵钠(NaNH4HPO4·4H2O)与某些金属盐类于高温下共同熔融,反应生成熔珠,由熔珠的颜色确定金属盐类成分的方法。
如:钴的化合物与硼砂共熔反应生成蓝色熔珠偏硼酸钴:Co(BO2)2;铬的化合物与磷酸氢铵钠共熔生成深绿色的熔珠磷酸铬:CrPO4。
特点:干法分析只需少量的简单仪器和试剂,操作简便,在野外矿物鉴定上被广泛应用,但这种方法不够完善,鉴定元素种类少,一般只能起辅助作用。
我们所要学习的主要是湿法。




第二章 试探题与习题1.已知用生成AsH 3气体的方式鉴定砷时,检出限量为1μg ,每次取试液。
求此鉴定方式的最低浓度(别离以ρB 和1:G 表示)。
解: 最底浓度 12005.01-⋅===mL g V m B μρ 610=⋅G B ρ466105201010⨯===∴BG ρ 1:G=1:5×1042.取一滴()含Hg 2+试液滴在铜片上,当即生成白色斑点(铜汞齐)。
通过实验发觉,显现斑点的必要条件是汞的含量应不低于100μg ·mL -1。
求此鉴定方式的检出限量。
解: 检出限量 g V m B μρ510005.0=⨯=⋅=3.洗涤银组氯化物沉淀宜用以下哪一种洗液?什么缘故?(1)蒸馏水 (2)1mol ·L -1HCl (3) 1mol ·L -1HNO 3 (4) 1mol ·L -1NaCl答:应选用(2)1mol ·L -1HCl 作洗液,因为HCl 含有与氯化物沉淀的一起离子,能够减少洗涤时的溶解损失,又维持必然的酸度条件,幸免某些水解盐的沉淀析出,另外HCl 为强电解质幸免因洗涤剂而引发胶表现象。
若是用蒸馏水洗涤,那么不具有上述条件,使沉淀的溶解损失太大,专门是PbCl 2﹑HNO 3不含一起离子,反而引发盐效应而使沉淀溶解度大,NaCl 那么虽具有一起离子,但不具有酸性条件,因此亦不宜采纳。
4.如何将以下各沉淀分离?(1)Hg 2SO 4-PbSO 4 (2)Ag 2CrO 4-Hg 2CrO 4 (3) Hg 2CrO 4-PbCrO 4 (4)AgCl-PbSO 4 (5)Pb(OH)2-AgCl (6) Hg 2CrO 4-AgCl 解:(1)用NH 4Ac 溶解PbSO 4,而不溶解Hg 2SO 4 。
(2)用氨水溶解Ag 2CrO 4,而不溶解Hg 2CrO 4 。
(3) 用NaOH 溶解PbCrO 4,而不溶解Hg 2CrO 4 。

教案2013~2014学年课程名称分析化学院(系)化学与环境科学学院教研室(实验室) 化学系授课班级主讲教师职称副教授使用教材华中师大等编《分析化学(上册)》兰州城市学院化学与环境科学学院制教案(首页)注:课程类别:公共基础课、专业基础课、专业必修课、专业选修课、集中实践环节、实验课、公共选修课教学内容:第一章绪论一、分析化学的任务和作用1.分析化学的任务分析化学是研究关于物质的化学结构、化学组成及测定方法的一门学科。
它是化学科学的一个重要分支。
定性分析的任务:就是鉴定物质的化学结构和化学组成。
定量分析的任务:就是测定物质中各组分的相对含量。
2.分析化学的作用分析化学作为一门学科,对于化学本身的发展起过重大作用。
化学上的基本定律都是依靠大量的分析实验数据才得以创立和发展起来的,而其它各门学科的发展又进一步推动了分析化学的发展。
分析化学对工业、农业、国防和科学技术的发展都有重要的作用。
分析化学在高等学校理、工、农、医、师范各有关专业中,是一门重要的化学基础课。
三、定量分析的方法1.按对象分2.按操作方法分类3.按试样用量分类4.根据被测组分含量分类5.其它专有名词四、分析化学的发展趋势(一)分析化学的发展简史(二)当前的发展趋势第二章定性分析教学内容:§2-1 概述一、定性分析的任务和方法1.任务:鉴定物质中所含有的组分。
2.方法⑴干法:指分析反应在固体之间进行。
⑵湿法:指分析反应在溶液之间进行。
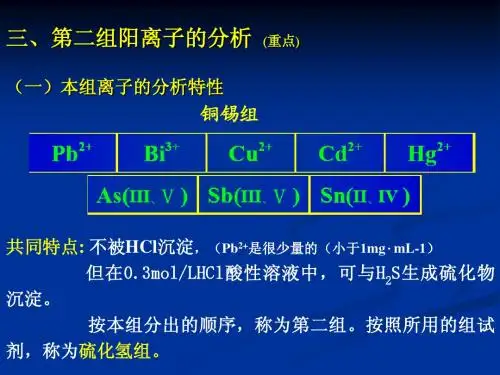
(主要学习湿法分析)二、定性分析反应进行的条件共5点三、鉴定方法的灵敏度和选择性1.鉴定方法的灵敏度鉴定反应的灵敏度常用“最低浓度”和“检出限量”来表示。
⑴最低浓度⑵检出限量⑶检出限量和最低浓度之间的关系2.鉴定反应的选择性四、空白试验和对照试验空白试验:用配制试液用的蒸馏水代替试液,用同样的方法和条件重做试验进行鉴定,就叫做空白试验。
对照试验:用已知溶液代替试液,用同样方法进行鉴定,就叫做对照试验。


第二章色谱定性分析定性分析就是要确定样品中的一些未知组分是什么物质,在色谱分析中就是要确定色谱图中一些未知的色谱峰是什么物质。
色谱分析中的定性主要是依据特征性不是很强的保留值,这需要和已知的标准物质的保留值进行比对。
由于即使保留值完全相同的两个峰,也可能是不同的物质,因此在最终准确确定色谱图中某个峰是什么物质时还需要一些辅助技术。
下面将介绍色谱分析中常用的一些定性方法。
第一节利用保留值定性在色谱分析中利用保留值定性是最基本的定性方法,其基本依据是:两个相同的物质在相同的色谱条件下应该有相同的保留值。
但是,相反的结论却不成立,即在相同的色谱条件下,具有相同的保留值的两个物质不一定是同一个物质。
这就使得使用保留值定性时必须十分慎重。
由于影响保留值的因素———色谱中的固定相和流动相在气相色谱和液相色谱中不完全相同,因此用保留值定性的方法在气相色谱和液相色谱中也不尽相同,下面就分别介绍气相色谱和液相色谱中用保留值定性的方法。
一、气相色谱中用保留值定性的方法!"利用已知物直接对照进行定性分析利用已知物直接对照法定性是一种最简单的定性方法,在具有已知标准物质的情况下常使用这一方法。
将未知物和已知标准物在同一根色谱柱上,用相同的色谱操作条件进行分析,作出色谱图后进行对照比较。
如图#$#$!中将未知试样(%)与已知标准物质(&)在同样色谱条件下得到的色谱图直接进行比较,可以推测未知样品中峰#可能是甲醇,峰’可能是乙醇,峰(可能是正丙醇,峰)可能是正丁醇,峰*可能是正戊醇。
当然,以上的推测只是初步的,如要得到准确的结论,有时还需要进一步的确认。
在利用已知纯物质直接对照进行定性时是利用保留时间(!)直接比较,这时要求载气的流速,载气的温度和柱温度一定要恒定。
载气流速+)改变,从而对定性结果产生影的微小波动,载气温度和柱温度的微小变化,都会使保留值(!+)定性,虽可避免载气流速变化的影响,但实际使用是很困难的,因为保响。