肾小管上皮细胞线粒体氧化损伤在肾间质纤维化中的作用及机制
- 格式:doc
- 大小:24.50 KB
- 文档页数:10

网络出版时间:2022-06-2717:53 网络出版地址:https://kns.cnki.net/kcms/detail/34.1065.R.20220624.1733.003.htmlNOX4 NLRP3信号通路在衰老小鼠肾脏纤维化中的激活研究韩玉立,董夏男,杨 柳,李学望,李 艳,李卫平,李维祖2022-05-18接收基金项目:国家自然科学基金(编号:81671384、81970630)作者单位:安徽医科大学基础医学院药理学教研室,合肥 230032作者简介:韩玉立,男,硕士研究生;李维祖,男,博士,教授,博士生导师,责任作者,E mail:li weizu@126.com摘要 目的 探索NADPH氧化酶4(NOX4)和核苷酸结合寡聚化结构域蛋白样受体蛋白3(NLRP3)炎症小体激活在衰老相关肾损伤中的作用和机制。
方法 以6、16、20和24月龄小鼠为研究对象,试剂盒检测血清肌酐(SCr)和尿素氮(BUN)水平;肾脏组织冰冻切片检测β 半乳糖苷酶(β Gal)及活性氧(ROS)的水平。
HE、PAS和Masson染色观察肾脏的病理变化;免疫组化检测胶原蛋白Ⅳ(COL4)和NLRP3的表达。
蛋白免疫印迹检测肾脏组织NOX4 NLRP3信号通路中相关蛋白的表达。
结果 与6月龄小鼠比较,16月龄小鼠BUN和SCr水平、肾脏β Gal活性及ROS水平轻度升高,肾小球和肾小管损伤较轻,没有明显的肾脏纤维化。
而在20和24月龄小鼠中上述指标则增加,肾小球和肾小管的损伤增加,出现了肾脏的纤维化。
此外,介导ROS生成的NOX4及NLRP3炎症小体相关蛋白的表达在20和24月龄小鼠肾脏中上调。
结论 NOX4 NLRP3信号通路可能在衰老过程中激活并促进肾脏老化和肾脏纤维化。
关键词 NADPH氧化酶4;NLRP3炎症小体;氧化应激;肾脏衰老;肾脏纤维化中图分类号 R364 3文献标志码A文章编号1000-1492(2022)07-1022-07doi:10.19405/j.cnki.issn1000-1492.2022.07.003 衰老是众多疾病的潜在风险因素。

㊃争鸣㊃基金项目:北京市自然科学基金(7172096);北京市属医院科研培育计划(PZ2022022);张炳厚全国名中医传承工作室作者单位:100029 北京中医药大学临床医学院[王婉懿(硕士研究生)㊁洪双双(硕士研究生)㊁邱依婷(硕士研究生)㊁刘芷秋(硕士研究生)];首都医科大学附属北京中医医院肾病科(王悦芬㊁刘梦超㊁赵文景);首都医科大学中医药学院[孙欣如(硕士研究生)]作者简介:王婉懿(1998-),2021级在读硕士研究生㊂研究方向:中医药防治慢性肾脏病的基础及临床研究㊂E⁃mail:787433118@通信作者:王悦芬(1967-),博士,硕士生导师,教授㊂研究方向:中医药防治慢性肾脏病的基础及临床研究㊂E⁃mail:85wyf @基于线粒体质量控制失衡从 气火失调”论治糖尿病肾脏病王婉懿 王悦芬 洪双双 邱依婷 孙欣如 刘芷秋 刘梦超 赵文景【摘要】 气火失调是糖尿病肾脏病(diabetic kidney disease,DKD)主要的中医病机,其病机演变可分为 虚㊁郁㊁炽㊁损”四个阶段,脾胃元气不足为DKD 发病基础,胃中郁火是DKD 的使动因素,阴火鸱张是DKD 的关键环节,阴阳俱损是DKD 的最终结局㊂气与火是能量代谢必备的物质基础和动力,气火失调是对能量和代谢相互作用失衡状态变化的深刻概括,线粒体质量控制失衡是DKD 气火失调的生物学基础㊂临证治疗DKD 根据其气火失调的病机特点,以保肾方为主方,根据 虚㊁郁㊁炽㊁损”四个阶段的病机特点辨证论治,加减化裁㊂基于线粒体质量控制失衡从 气火失调”论治DKD,为临床防治DKD 提供理论依据和新思路㊂【关键词】 气火失调; 糖尿病肾脏病; 线粒体质量控制失衡; 保肾方; 益气活血; 养阴除热【中图分类号】 R259 【文献标识码】 A doi:10.3969/j.issn.1674⁃1749.2024.05.017 糖尿病肾脏病(diabetic kidney disease,DKD)是糖尿病的严重微血管并发症,中国糖尿病患者中20%~40%合并DKD,是导致慢性肾脏病(chronic kidney disease,CKD)及终末期肾脏病(end stage renal disease,ESRD)的首要原因[1]㊂DKD 属于中医学 水肿” 关格” 消渴肾病”等范畴,病因多由于先天禀赋不足㊁情志不节㊁饮食失宜而致脾胃损伤,脾不散精,气机升降失常,燥热伤阴,日久及肾,病位与肾和脾密切相关[2⁃3]㊂在此基础上,现代医家常从微型癥瘕[4]㊁毒损肾络[5]㊁邪伏膜原[6]等方面阐释该病病机㊂李东垣‘兰室秘藏㊃内障眼论“云: 火之与气,势不两立,故‘内经“曰: 壮火食气,气食少火,少火生气,壮火散气’”,进而提出 气火失调”病机理论,认为脾胃亏虚㊁元气不足㊁阴火鸱张㊁气火失调是导致内伤疾病发生与发展的根本原因[7]㊂线粒体质量控制(mitochondrial quality control,MQC)是维持线粒体动态平衡的有效方式,其失调与DKD 的发生发展密切相关,其致病机制包括线粒体氧化应激㊁线粒体自噬㊁线粒体动力学改变及钙调节异常等[8]㊂脾和线粒体都是能量代谢的场所,而气与能量㊁火与代谢之间存在一定的趋同性[9]㊂元气亏虚,脾不散精,阴火炽盛,气火失调的生物学本质是线粒体质量控制失衡㊂ 气火失调”是对DKD 能量和代谢相互作用失衡状态变化的深刻概括, 气火失调”刻画了阴火与元气从相互维系到相互制约的动态变化,线粒体质量控制失衡则重新定义了病理状态下能量与物质的失稳状态㊂基于线粒体质量控制失衡病理机制探讨从 气火失调”病机理论论治DKD,希望为临床治疗本病开拓新思路㊂1 气火失调”是糖尿病肾脏病的主要病机1.1 虚 元气亏虚是DKD 的发病基础李东垣‘脾胃论㊃饮食劳倦所伤始为热中论“曰: 既脾胃气衰,元气不足,而心火独盛,心火者,阴火也 脾胃气虚,则下流于肾,阴火得以乘其土位㊂”脾胃不足,元气亏虚为阴火发病基础,而阴火产生的原因‘脾胃论“中曾提到: 皆先由喜怒悲忧恐为五贼所伤,而后胃气不行,劳役㊁饮食不节继之㊂”喜㊁怒过度可使身中元气躁动不宁而生热化火;而忧思过度,肝气郁结,横犯脾胃,长期则损耗元气,促进郁火的形成[10];或饮食失节,损伤脾胃之气;或由于先天禀赋不足㊁年老体弱㊁久病体虚,又加以劳役过度,机体正气损耗;起居失常,寒温不适,又兼伤食,损伤脾胃之气,化源不足,后天无以养先天,则一身元气俱亏㊂气火失调, 火与元气不两立,一盛则一负”,因此脾胃内伤,元气亏虚是DKD 的发病基础[11]㊂1.2 郁 胃中郁火是DKD的使动因素脾气不足,脾不散精,气机升降失常,湿气下流,闭塞其下,胃中元气郁而化火,成为初始阴火[12]㊂阴火伏于上焦则不能敷布津液,导致口渴多饮;阴火居于中焦,则多食易饥,体重下降明显;阴火内乘下焦,津液和水谷精微下行至肾,引起小便频数量多,小便浑如膏脂而味甜㊂1.3 炽 阴火鸱张是DKD的关键环节李东垣‘内外伤辨惑论㊃辨寒热“云: 乃肾间受脾胃下流之湿气,闭塞其下,致阴火上冲,作蒸蒸而燥热㊂”脾胃元气亏虚,则少阳升发之气不足,导致湿浊下流于下焦之肾,湿遏肾络,郁而生火,火与湿浊相合而成阴火㊂阴火鸱张,相火妄动,肾间阴火内生,下焦相火乘虚上冲形成病理性阴火㊂肾为一身阴阳之根本,为元气所在,肾阴不足,肾阳失于潜藏,则上扰作祟,阴火更甚㊂心不主令,下焦寄于肝肾之相火沿心包络上承于心,行正令之火,引起局部组织能量代谢异常,局部功能亢进,进一步耗伤元气,引起机体结构和功能失常㊂阴火鸱张,脾胃气虚,精微不及,无以下充肾元,则肾元不足,肾主封藏,阴火妄动,则肾不藏精,形成蛋白尿㊂1.4 损 阴阳俱损是DKD的最终结局阴火为血中伏火,煎灼人体阴津,津液匮乏,结而不润,导致阳气亏虚㊁阴血不足,最终形成阴阳两虚的结局㊂离位之火即为阴火㊁壮火,乃 元气之贼”也,阴火耗伤元气日久,气虚及阳,阳损及阴,最终脾㊁肾㊁肝三脏皆损,形成阴阳两虚之证㊂肾失气化,脾失健运,无力运化水液,水湿停聚则水肿;火热燔灼,煎熬津液,敛液为痰,炼血为瘀,痰㊁湿㊁热㊁瘀病理产物相互攀援成浊,阻滞血络,脉络不通, 肾络癥瘕”形成㊂浊邪侵犯五脏六腑,日久可引起上下格拒㊂浊邪犯胃,引起呕恶吐逆,不欲饮食;水饮射肺凌心,见心悸喘憋,胸闷气短;浊毒犯肝,可见肢体瘛疭;溺毒入脑,引起神识昏蒙,恍惚不清㊂脾肾阴阳俱衰,三焦气化不利,浊邪壅塞三焦,终致开阖失司,气机郁闭,呕恶与少尿甚至尿闭并见,发为关格㊂2 线粒体质量控制失衡是DKD气火失调的生物学基础2.1 线粒体质量控制失衡在DKD中的发生及致病作用线粒体作为细胞代谢的中枢,既是细胞能量供应㊁新陈代谢以及凋亡的重要场所,可通过氧化磷酸化产生ATP,也是脂肪酸㊁激素和氨基酸生物合成的关键中间体,参与细胞凋亡和免疫等机体功能[13]㊂肾脏能量代谢高度活跃,其线粒体含量位居脏腑第二,线粒体质量控制失衡是DKD致病机制之一㊂研究发现,高糖环境下细胞内线粒体PINK1/ Parkin含量下降,导致肾小管上皮细胞自噬潜能减弱,ATP 合成减少[14]㊂高血糖可促进肾组织内活性氧(reactive oxygen species,ROS)生成增加,诱导氧化应激,导致脂质过氧化,上调炎症小体(NOD⁃like receptor thermal protein domain associated protein3,NLRP3)㊁白细胞介素⁃1β(interleukin⁃1β,IL⁃1β)等慢性炎症标志物的表达,线粒体损伤无法产生足够的ATP来维持细胞代谢,线粒体向细胞核中释放促凋亡蛋白,致肾小球上皮细胞凋亡,基底膜逐渐增厚和硬化[15⁃16]㊂同时研究发现,糖脂等能量过剩刺激线粒体可引起其功能亢进,造成ATP合成过剩,导致胰岛素抵抗,细胞吸收葡萄糖的能力降低,引起能量代谢紊乱[17]㊂线粒体自噬是线粒体质量控制的基础,调节受损的细胞器及蛋白以维持细胞内稳态㊂高血糖可通过促进线粒体裂变和抑制线粒体融合,产生伴随线粒体动力学破坏的细胞内氧化应激及细胞凋亡,从而加剧DKD的病程进展[18]㊂肾脏是维持体内Ca2+稳态的重要器官,线粒体内适量的钙可促进ATP合成,肌浆/内质网Ca2+ATP酶的表达受损可导致内质网Ca2+耗竭,线粒体和胞质中钙超载,膜通透性转换孔开放,使膜电位降低,凋亡蛋白溢出,进而引发肾小球内皮细胞和足细胞凋亡,最终导致DKD[19]㊂2.2 基于线粒体质量控制失衡探讨气火失调的科学内涵气是人生命的物质基础,元气调控人体生理活动;火源于元气,是元阳的功能体现,生理之火是以能量代谢为基础的 代谢-能量-功能”密切协调的转化平衡系统,是各器官功能和能量代谢的直接动力,维持和平衡人体正常体温[20];病理之火是机体的调节异常产生的病理性代谢产物和局部组织能量代谢异常㊂能量与代谢之间的相互作用可以被看作调节机体稳态的核心机制,线粒体参与的糖代谢的三羧酸循环和氧化磷酸化途径是物质代谢和能量代谢的有机结合㊂火是物质燃烧过程中的一种能量释放方式,当物质的化学反应能量完全释放时,不会产生代谢废物;当氧气不足,物质无法得到充分燃烧时,可产生一氧化碳等不完全燃烧产物,这与阴火发生发展的过程极为相似[9,21]㊂阴火由脾气不足㊁元气亏虚而产生精微物质由于脾虚失运而不能充分气化,聚集于局部,致使机体气血精津液代谢异常,湿邪㊁痰浊等由此产生㊂另一方面,正常生理状态下,线粒体在正常氧化呼吸时会产生少量的ROS,通常能够被谷胱甘肽㊁硫氧蛋白㊁超氧化物歧化酶(superoxide dismutase,SOD)等抗氧化的酶或物质降解㊂高糖环境下,ROS大量产生,无法被有效降解,ROS 的增加可通过激活线粒体氧化应激,导致线粒体DNA损伤,使线粒体质控失衡,进而导致细胞代谢和功能异常,这是临床上许多疾病发生的病因[22⁃23]㊂因此,笔者团队认为阴火所致的痰瘀相混的病理结局,与物质不完全燃烧所形成的代谢废物和线粒体质控失衡蓄积的ROS均具有内在规律的一致性㊂脾和线粒体都是能量代谢的场所,脾气亏虚,脾不升清的生物学本质就是线粒体质量控制失衡㊂现代研究发现,脾虚模型大鼠体内存在脂质过氧化损伤,细胞能量代谢障碍,健脾益气中药可减轻线粒体氧化损伤,调节机体能量代谢[24]㊂长期 饮食不节”和 形体劳役”,在细胞水平将导致ATP生成障碍,线粒体结构和功能异常,而表现为 脾虚”,机体ATP生成不足,产生的能量以热量形式散失,基础代谢率和产热增加,表现为 脾气下流,阴火上乘”的症状,如四肢无力㊁体温偏高[25]㊂脾升清的过程是一个主动转运耗能过程,氧化磷酸化为 脾气升清”提供能量物质基础,线粒体是氧化磷酸化场所,其功能状态可以反应 脾气升清”的能力[26]㊂另外,机体阴火内盛的状态也和DKD高灌注㊁高滤过㊁高代谢的状态相符合㊂DKD肾脏中的氧气消耗明显㊁肾内长期慢性低氧状态通过低氧诱导因子⁃1α介导这与蛋白尿㊁肾功能减退机制不谋而合[27]㊂总而言之,元气不足,脾的功能失常可影响线粒体的能量合成及代谢,以及随之产生的能量转换过程,ATP合成减少㊁糖脂代谢紊乱,诱发线粒体能量代谢异常及内外膜电位改变,其内ROS㊁炎症因子㊁促凋亡蛋白过量溢出,使线粒体质控失衡,肾脏产生炎症㊁损伤和(或)纤维化改变[28]㊂上述分析为线粒体质量控制理论提供了一种科学的解释㊂2.3 从线粒体质量控制失衡探讨DKD气火失调病机DKD是糖尿病主要的微血管并发症,线粒体质量控制失衡是DKD发病机制之一㊂当脾虚元气不足(线粒体结构功能障碍),运化无力(线粒体物质合成和能量代谢障碍),水谷精微化生不足(ATP合成减少);脾不升清,精微物质失去动力及方向,胃中元气郁而化为初始阴火(ATP合成过剩),局部能量相对过剩(ROS蓄积引起氧化应激),无法升浮外达,精微湿浊下流于肾,郁火与湿浊相合而成阴火,阴火伏藏于肾,扰动肾精,使得肾精亏虚,肾为一身阴阳之根本,为元气所在,肾中阴精不足,肾阳失于潜藏,则上扰于心作祟,阴火更甚(炎症反应)㊂气阴亏耗,气虚及阳,阳损及阴,最终脾㊁肾㊁肝三脏皆损,阳气亏虚,阴血不足,形成阴阳两虚(线粒体凋亡㊁细胞损伤坏死)㊂肾主骨生髓,肾精亏虚,则精髓不足,筋骨不坚;精髓可化生血液,肾精不足,则阴血化生无源㊂故DKD并发症可见由钙磷代谢及维生素D代谢异常㊁继发性甲状旁腺功能亢进㊁酸碱平衡紊乱等引起的肾性骨病及因促红细胞生成素生成减少引起的肾性贫血㊂因此, 气火失调”是DKD主要中医病机,线粒体质量控制失衡与DKD气火失调病机内在联系如图1㊂3 基于线粒体质量控制失衡从 气火失调”论治糖尿病肾脏病 气火失调是DKD主要的中医病机, 虚㊁郁㊁炽㊁损”为DKD四个阶段的病机演变特点,治疗以 益气活血,养阴除热”为主要原则,以保肾方为主方㊂脾胃元气不足为DKD 发病基础,故治疗应立足于补益元气,以生黄芪㊁炒白术㊁党参补益脾胃之气,使脾胃有权,元气兴旺,以制约阴火;脾不散精,气机郁滞化火,阴火鸱张是DKD进展的关键,一方面以柴胡㊁升麻助元气升发,使清气上升,荣卫气血调和,阴火无由生起,另一方面以生地黄㊁熟地黄㊁龟板滋阴直泻阴火㊂瘀血为DKD快速进展的重要因素,辅以水蛭㊁丹参㊁刘寄奴㊁鬼箭羽活血通络,助轻清升散之品疏解阴火㊂全方益气活血,养阴除热,诸药配伍,气虚得补,气陷得举,清阳得升,气机得畅,可降低DKD患者的24小时尿蛋白㊁血清肌酐和血尿素氮,同时在体内外实验中被证明显著降低了ROS水平,减轻氧化应激损伤,并抑制B淋巴细胞瘤⁃2(B⁃cell lymphoma⁃2,bcl⁃2)家族相关的足细胞凋亡,可通过抑制ROS介导的PI3K/Akt信号通路及NOX4/ ROS/p38信号通路,保护足细胞[29⁃30]㊂气虚期重在补益脾胃,加怀山药㊁当归㊁茯苓㊁甘草益气健脾;郁滞期火郁明显,加羌活发散郁火,黄芩㊁半夏疏调气机,清解郁火;炽盛期阴火亢盛,可酌加黄芩㊁黄连㊁石膏甘寒泻火,清泻阴火;虚损期阴阳俱损,加覆盆子㊁菟丝子补肾滋阴,鳖甲胶潜阳入阴,肉桂引火归元,黄柏清泻相火㊂图1 DKD线粒体质量控制失衡与气火失调的联系4摇小结DKD是一种致病机制复杂的代谢性疾病,线粒体质量控制失衡在DKD发生发展中具有重要作用,气与火是机体能量代谢必备的物质基础和动力,从 气火失调”认识的DKD是 物质 能量 代谢”网络失稳状态变化的深刻概括,为中医论治DKD提供了新的全局视野㊂治疗时以 益气活血,养阴除热”为主要原则,以保肾方为主方,使气虚得补,气陷得举,清阳得升,气机得畅,进而促进物质与能量代谢相互作用平衡,纠正线粒体质量控制失衡,从而治疗DKD,具有巨大的基础及临床研究潜能㊂参考文献[1] 王婉懿,王悦芬.中药干预足细胞上皮间质转分化治疗糖尿病肾病的研究进展[J].环球中医药,2022,15(10):1969⁃1976.[2] 吕仁和,赵进喜,王越.糖尿病肾病临床研究述评[J].北京中医药大学学报,1994,17(2):2⁃6,72.[3] 吴深涛,王斌,章清华,等.论糖尿病从 脾不散精”到 浊毒内蕴”之病机观[J].中医杂志,2018,59(22):1920⁃1924. [4] 丁英钧,肖永华,傅强,等.糖尿病肾病 微型癥瘕”病理假说解析[J].中华中医药杂志,2009,24(1):27⁃30. [5] 于敏,张波,史耀勋,等.南征教授 毒损肾络”理论学说探析及临床运用[J].中华中医药学刊,2010,28(2):243⁃246. [6] 张宗金,王悦芬,赵文景,等.基于轴探讨糖尿病肾病中医发病机制及治疗靶点[J].世界中医药,2020,15(23):3704⁃3709.[7] 石霞,苗青,王冰.基于 火与元气不两立”探析稳定期支气管扩张症的病机与辨治[J].中医杂志,2022,63(21):2029⁃2032.[8] 张梦婷,李昱颖,张兰.中医药调控线粒体质量控制治疗糖尿病肾病研究进展[J].中国实验方剂学杂志,2023,29(4):10.[9] 黄文博,潘丽,黄娅,等.基于能量代谢重编程论 阴火”与中医肿瘤发生学[J].中医杂志,2022,63(10):905⁃909. [10] 李沅骋,周家程. 脾胃为本,命门相关”探讨阴火理论的具体内涵[J].环球中医药,2022,15(5):830⁃833. [11] 李嘉鑫,杨宇峰,王金曦,等.基于 血中伏火”理论探讨糖尿病及其微循环障碍[J].中国中医基础医学杂志,2022,28(9):1413⁃1415.[12] 黄为钧,赵进喜,丘立富.李东垣 阴火学说”初探[J].中医杂志,2015,56(15):1265⁃1268.[13] Spinelli J B,Haigis M C.The multifaceted contributions of mito⁃chondria to cellular metabolism[J].Nature Cell Biology,2018,20(7):745⁃754.[14] XU J,Kitada M,Ogura Y,et al.Dapagliflozin RestoresImpaired Autophagy and Suppresses Inflammation in HighGlucose⁃Treated HK⁃2Cells[J].Cells⁃Basel,2021,10(6):1457.[15] QIN X,JIANG M,ZHAO Y,et al.Berberine protects againstdiabetic kidney disease via promoting PGC⁃1α⁃regulatedmitochondrial energy homeostasis[J].Br J Pharmacol,2020,177(16):3646⁃3661.[16] LI J,LI N,YAN S,et al.Liraglutide protects renal mesangialcells against hyperglycemia-mediated mitochondrial apoptosis byactivating the ERK-Yap signaling pathway and upregulating Sirt3expression[J].Mol Med Rep,2019,19(4):2849⁃2860. [17] 于晓晴,钟根深,叶建平.生理病理状态下线粒体合成ATP的动态调控机制[J].中国生物化学与分子生物学报,2020,36(2):127⁃134.[18] Kim K,Lee E Y.Excessively Enlarged Mitochondria in theKidneys of Diabetic Nephropathy[J].Antioxidants(Basel),2021,10(5):741.[19] NING B,GUO C,KONG A,et al.Calcium Signaling MediatesCell Death and Crosstalk with Autophagy in Kidney Disease[J].Cells⁃Basel,2021,10(11):3204.[20] 王文炎,梁凤霞,陈瑞.基于 君火以明,相火以位”理论探析相火离位之因[J].中华中医药杂志,2019,34(10):4494⁃4496.[21] 刘惠金,贾春华.一个以 火”为始源域的中医概念隐喻认知系统[J].中华中医药杂志,2013,28(11):3158⁃3161. [22] QIN X,JIANG M,ZHAO Y,et al.Berberine protects againstdiabetic kidney disease via promoting PGC⁃1α⁃regulatedmitochondrial energy homeostasis[J].Br J Pharmacol,2020,177(16):3646⁃3661.[23] Fontecha⁃barriuso M,Martin⁃sanchez D,Martiez⁃moreno J M,etal.The Role of PGC⁃1αand Mitochondrial Biogenesis in KidneyDiseases[J].Biomolecules,2020,10(2):347. [24] 李文慧,李阳,于姚,等.基于线粒体能量代谢障碍探讨从脾论治抑郁症的机理[J].环球中医药,2020,13(9):1494⁃1498.[25] 阮诗玮,郑敏麟. 脾”的细胞生物学假说和 阴火”的一种现代医学诠释[J].中医药学刊,2003,21(2):243⁃244. [26] 张海蓉,刘雷蕾,孙一珂,等.基于脾 线粒体相关探讨脾升清功能的季节性变化机制[J].环球中医药,2022,15(11):2184⁃2188.[27] 艾思南,王珍,郑慧娟,等.基于 低氧”机制探讨糖尿病肾脏病 壮火食气”的科学内涵[J].环球中医药,2021,14(4):602⁃605.[28] Daehn I,Brem R,Barkauskaite E,et al.6⁃Thioguanine damagesmitochondrial DNA and causes mitochondrial dysfunction inhuman cells[J].Febs Lett,2011,585(24):3941⁃3946. [29] CUI F Q,TANG L,GAO Y B,et al.Effect of BaoshenfangFormula on Podocyte Injury via Inhibiting the NOX⁃4/ROS/p38Pathway in Diabetic Nephropathy[J].J Diabetes Res,2019,2019:2981705.[30] CUI F Q,WANG Y F,GAO Y B,et al.Effects of BSF onPodocyte Apoptosis via Regulating the ROS⁃Mediated PI3K/AKTPathway in DN[J].J Diabetes Res,2019,2019:9512406.(收稿日期:2023⁃05⁃25)(本文编辑:韩虹娟)。

低氧对机体的影响氧气是机体进行正常新陈代谢的必要条件,在低氧情况下,如果机体不能够适应这种低氧的环境,则会引起一系列的病理生理上的反应。
在低氧的情况下组织的代谢、机能、形态结构都会发生异常变化,过强的低氧应激反应将导致机体各种功能出现衰竭,机体的神经系统、循环系统、呼吸系统等均会受到不同程度的损伤,最终导致脑、心、肺等重要脏器因能量供应不足而死亡[1]。
1.低氧对中枢神经系统的影响中枢神经对缺氧最为敏感, 氧耗最高 , 占全身体重 2%的大脑组织 ,[2]氧耗占全身氧耗的 20% , 脑组织的代谢以有氧代谢为主 , 几乎没有无氧代谢能力 , 对氧的需求最高。
同时脑组织中的氧和 ATP的储备很少 , 因而对缺氧的耐受性差 , 是机体对缺氧最敏感的组织[3] .低氧对中枢神经系统功能的影响导致睡眠结构的改变,引起失眠、睡眠质量下降,其结果会加重中枢神经功能的紊乱[4] 。
低氧显著影响学习记忆能力,包括瞬时∕延迟记忆、短期记忆和工作记忆能力等[5] . 慢性缺氧易出现疲劳、嗜睡、注意力不集中、记忆力下降等症状,引起的脑功能损害主要表现为反应时间延长 , 动作协调性和准确性降低 , 劳动功效降低。
缺氧进一步加重出现脑功能的改变为 : 兴奋、欣快感、定向力障碍 ,而后出现运动不协调、头痛、乏力等, 甚至出现意识障碍或死亡[6,7]。
缺氧直接扩张脑血管 , 增加脑血流量和脑毛细血管内压 , 组织液生成增多 ; 长期低氧可显著抑制线粒体内膜腺苷酸转运体( ANT )转运活性,使脑内自由基增加、膜脂质过氧化、内源性抑制剂增多,进而影响细胞能量代谢[8]。
脑内乳酸和氧自由基与脂质过氧化物生成增加,抗氧化系统减弱,血脑屏障受损[9] , 缺氧致代谢性酸中毒使脑部血管痉挛和通透性增加, 造成间质性脑水肿[10] ;急性吸入含氧量低的空气同样可使脑脊液压力升高, 引起颅内高压[11] , 缺氧致 ATP生成减少 ,细胞膜钠泵功能障碍 , 细胞内钠水潴留 ; 脑充血和脑水肿使颅内压增高,脑压高又可压迫脑血管加重脑缺血和脑缺氧[12] 。


Mn^(2+)对庆大霉素导致的人肾小管上皮细胞系损伤的保护作用王志鹏;张蓉;刘莉;梅其炳【期刊名称】《中国临床药理学与治疗学》【年(卷),期】2005(10)12【摘要】目的观察Mn2+对庆大霉素导致的人肾小管上皮细胞系的损伤有保护作用,并探讨其机制。
方法用庆大霉素作用于人肾小管上皮细胞系(HK-2),造成肾损伤模型,MTT法检测Mn2+对细胞增殖活力的影响;分光光度法检测Mn2+导致的SOD、LDH活力和NAG酶含量的改变;电镜观察Mn2+作用后HK-2细胞微结构改变。
结果Mn2+可使庆大霉素损伤的HK-2细胞增殖活力增加,降低LDH酶活力,减少NAG酶含量,升高SOD酶活性,减轻细胞线粒体肿胀程度和减少溶酶体膜的破裂。
结论Mn2+对庆大霉素导致的人肾小管上皮细胞系的损伤有保护作用。
其机制可能与减轻细胞氧化损伤、降低线粒体肿胀程度、保护溶酶体的完整性和减少溶酶漏出有关。
【总页数】4页(P1364-1367)【关键词】Mn^2+;庆大霉素;肾小管上皮细胞;氧化损伤;自由基【作者】王志鹏;张蓉;刘莉;梅其炳【作者单位】第四军医大学药学系药理学教研室【正文语种】中文【中图分类】R963【相关文献】1.酸性成纤维细胞生长因子对庆大霉素和顺铂所致肾小管上皮细胞损伤的保护作用[J], 刘华钢;黄巨恩;刘丽敏;王慧杰;胡文娟;李校堃;肖健2.酸性成纤维细胞生长因子对庆大霉素诱导的肾小管上皮细胞损伤的保护作用 [J], 黄巨恩;王慧杰;刘华钢;刘海燕;李校堃;肖健3.钙拮抗剂对高草酸尿导致的大鼠肾小管上皮细胞损伤的保护作用 [J], 李文峰;张士青4.N-乙酰半胱氨酸对丙酮醛诱导的人肾小管上皮细胞损伤的保护作用及机制研究[J], 罗婷;庄晓东;凡栋;顾海风;陈燕玲;康毅;吴秀香;王晓玲5.乌司他丁对庆大霉素诱导的人肾小管上皮细胞损伤的影响 [J], 叶婷婷; 沈建明; 邓妍妍; 刘辉辉; 袁申平因版权原因,仅展示原文概要,查看原文内容请购买。

马兜铃酸Ⅰ毒性机制研究进展作者:朱哿瑞王静刘成海陶艳艳来源:《世界中医药》2022年第01期摘要自从20世纪90年代确认马兜铃酸具有肾毒性以来,已有部分药材被禁用;但由于部分含马兜铃酸药物的不可替代性,仍然应用于临床。
围绕马兜铃酸肾毒性及其毒性机制展开了诸多研究,本文对马兜铃酸肾毒性机制研究进行综述,以期为临床合理运用含马兜铃酸类中草药及预防中药药源性肾损伤提供参考。
关键词马兜铃酸;马兜铃酸肾病;肾毒性Abstract Since aristolochic acids(aristolochic acids,AAs) were confirmed to be nephrotoxic in the 1990s,some drugs which contains AAs have been banned while some others are still used in clinical practice due to their irreplaceable properties.A lot of studies have been carried out on the nephrotoxicity and toxic mechanism of aristolochic acids.This paper reviews the mechanism of aristolochic acids nephrotoxicity in order to provide reference for the rational use of Chinese herbal medicine containing aristolochic acids and the prevention of drug-induced renal injury.Keywords Aristolochic acids; Aristolochic acid nephropathy; Nephrotoxicity 中圖分类号:R285.5文献标识码:A doi:10.3969/j.issn.1673-7202.2022.01.024马兜铃酸(Aristolochic Acids,AAs)是一类硝基菲甲酸类化合物的总称,广泛存在于马兜铃属和细辛属植物中[1]。

氧化应激在急性肾损伤中的研究进展邹晓彪;罗助荣;黄明方【摘要】急性肾损伤(AKI)是多种发病机制所致的疾病.氧化应激是AKI发病机制中的重要一环,与AKI的其他发病机制间相互作用,影响AKI的发生发展.现将氧化应激与AKI其他机制间的作用及抗氧化剂在AKI中的研究进展做一综述.【期刊名称】《临床肾脏病杂志》【年(卷),期】2019(019)004【总页数】4页(P287-290)【关键词】氧化应激;急性肾损伤;抗氧化剂【作者】邹晓彪;罗助荣;黄明方【作者单位】350000福州,蚌埠医学院福总教学医院(第九○○医院)心内科;350000福州,蚌埠医学院福总教学医院(第九○○医院)心内科;350000福州,蚌埠医学院福总教学医院(第九○○医院)心内科【正文语种】中文氧化应激在1985年被Sies等[1]首次提出,是由于氧化剂生成异常增加导致内源性抗氧化剂相对不足而引起的消耗性代谢失调,导致重要细胞成分如DNA、蛋白质、脂质的氧化损伤。
在生理状态下,体内一些低水平的氧化应激是维持正常生理活动的第二信号,在病理状态下,氧化应激会诱发基因突变、蛋白质变性和脂质过氧化,引起细胞死亡[2]。
氧化应激作为急性肾损伤(AKI)一项重要的发病机制在缺血再灌注损伤、脓毒血症、药物毒性诱导的AKI等动物模型中均可被检测到[3-5]。
氧化应激不仅会引起肾实质细胞和间质细胞发生空泡样变性、凋亡、坏死等一系列形态学的改变,还会造成肾小球滤过功能和肾小管重吸收功能的降低[6]。
现将氧化应激在AKI中的作用进行综述。
一、氧化应激的形成及影响体内的氧化剂主要分为活性氧(reactive oxygen species,ROS)及活性氮(reactive nitrogen species,RNS)。
ROS是体内的主要氧化剂,其来源主要有线粒体途径和非线粒体途径。
线粒体途径在病理状态下,氧化呼吸链中的电子传递出现障碍导致ROS的产生异常增多,过量产生的ROS会进一步导致线粒体功能障碍引起线粒体释放更多的ROS,形成恶性循环。

非奈利酮治疗慢性肾脏疾病作用机制研究进展廖文建1,罗雍航1,陈秋宇1,钟莉萍1,苏勇21 广东医科大学第一临床医学院,广东湛江524023;2 广东医科大学附属阳江医院肾内科摘要:慢性肾脏病(CKD)是一种持续进展性疾病,以肾功能进行性下降和细胞外基质过多蓄积为特征,引起肾小球硬化和肾小管间质纤维化。
研究显示,盐皮质激素受体过度活化导致炎症和纤维化是CKD进展的关键驱动因素。
另外,内皮功能障碍、氧化应激、血压控制不佳、肥胖也是影响CKD预后的重要因素。
非奈利酮是一种高选择性非甾体盐皮质激素受体拮抗剂。
多项研究表明,非奈利酮能通过抗炎和抗纤维化、减轻蛋白尿、逆转内皮功能障碍、调控血压及改善代谢参数等多重机制来延缓肾脏疾病的进展并减少心血管事件的发生率,并且对血钾影响小,无性激素相关不良反应,有望成为延缓肾脏疾病进展的新手段。
关键词:非奈利酮;非甾体盐皮质激素受体拮抗剂;慢性肾脏病doi:10.3969/j.issn.1002-266X.2023.32.025中图分类号:R692 文献标志码:A 文章编号:1002-266X(2023)32-0105-04糖尿病是全球慢性肾脏病(CKD)的主要病因。
目前,约36%的糖尿病患者存在不同程度的白蛋白尿和肾小球滤过率降低,而白蛋白尿和肾小球滤过率降低与心血管病死率、心力衰竭发生风险独立相关[1]。
钠—葡萄糖协同转运蛋白2抑制剂(SGLT2i)和肾素—血管紧张素—醛固酮系统阻滞剂作为治疗2型糖尿病肾病的主力药物,虽然能够减少尿蛋白并延缓肾脏疾病进展,但肾衰竭及心血管疾病死亡的风险仍持续存在[2]。
盐皮质激素受体(MR)属于类固醇激素受体,是激活细胞内受体和核转录因子的核受体亚家族。
肾脏MR过度激活通过介导促炎因子及促纤维化因子如肿瘤坏死因子α、白细胞介素1β和转化生长因子β1的产生和蛋白激酶1、转录因子核因子κB、激活蛋白1等信号蛋白的表达增加,促进组织炎症和纤维化[3。

SIRT3在急性肾损伤中的作用研究进展 王晓凤; 杜国强; 张媛; 王鸾; 徐璨; 赵正; 赵敏 【期刊名称】《《医学综述》》 【年(卷),期】2019(025)015 【总页数】5页(P2998-3002) 【关键词】急性肾损伤; 线粒体功能障碍; 沉默信息调节因子3 【作 者】王晓凤; 杜国强; 张媛; 王鸾; 徐璨; 赵正; 赵敏 【作者单位】中国医科大学附属盛京医院急诊科 沈阳110004; 青岛市市立医院耳鼻喉科 山东 青岛266000
【正文语种】中 文 【中图分类】R692.5
急性肾损伤是以肾小球滤过率突然下降为主要特征的疾病,可由肾脏缺血、肾毒性药物、脓毒血症及泌尿系梗阻等多种病因造成,临床表现为血清肌酐浓度增加以及少尿[1],治疗措施主要包括针对病因进行的对症支持治疗,如保护肾脏功能、预防和处理并发症等。急性肾损伤以及其并发症无法单独使用药物控制时应及时使用肾脏替代疗法。然而,即便经过精心治疗,国外研究表明危重症患者的急性肾损伤的发病率为50.1%[2]、死亡率为41.8%[2](最终纳入401例患者),另一项国内研究表明急性肾损伤的发生率为54.7%[3](最终纳入3 687例患者),且90 d死亡率随着急性肾损伤的严重程度的加重而增加(急性肾损伤1、2和3期的死亡率分别为16.7%、27.5%和48.3%),部分存活患者脱离透析后有可能会进展为终末期肾病。研究发现,线粒体损伤是急性肾损伤最重要的病理生理学表现之一,而沉默信息调节因子(silent information regulator,SIRT)3参与线粒体蛋白稳态的调节,在线粒体生成、分裂、融合及自噬中发挥重要作用[4]。SIRTs是DNA编码的Ⅲ型烟酰胺腺嘌呤二核苷酸依赖性蛋白,属于组蛋白脱乙酰基酶类[4],可以通过乙酰化水平来调节蛋白的活性[5]。SIRTs由大约270个氨基酸残基构成,具有两个不一样的结构域,结构域之间存在一个裂缝,含有烟酰胺腺嘌呤二核苷酸的结合位点,结合烟酰胺腺嘌呤二核苷酸后发生催化反应。在哺乳动物中,发现该家族具有七个亚型,N端和C端结构的不同决定了各亚型在各亚细胞结构中的定位和功能各不相同[6]:SIRT1、SIRT6和SIRT7主要存在于细胞核中,SIRT2在细胞质和细胞核中发现,而SIRT3、SIRT4和SIRT5主要存在于线粒体中。SIRT3、SIRT4、SIRT5负责蛋白质乙酰化的调节。因此SIRT3在急性肾损伤的发生发展机制中可能具有潜在的研究价值。现就SIRT3在急性肾损伤中的作用研究进展进行综述。 1 SIRT3与线粒体相关的生物学作用 SIRT3是一种高度保守的依赖烟酰胺腺嘌呤二核苷酸的去乙酰化酶。SIRT3以长链形式存在,并有一个线粒体相关的靶向序列位于N端,当发生氧化应激等刺激时,细胞中的长链SIRT3经基质加工肽酶水解脱去其N端线粒体序列成为短链SIRT3,并进入线粒体发挥功能。据报道,超过65%的线粒体蛋白质转化修饰需通过乙酰化完成[7]。在敲除SIRT3基因小鼠的肝脏组织、棕色脂肪组织及梗死后心肌组织中,线粒体蛋白高度乙酰化,这种变化与SIRT3表达下调同时发生[8],说明SIRT3是主要的线粒体去乙酰化酶,可以调控线粒体蛋白乙酰化水平,进而调节机体代谢[4]。 1.1 SIRT3调节线粒体的生物发生 线粒体的生物发生是线粒体代谢的一种机制,主要由过氧化物酶增殖体激活受体γ辅激活因子1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)调控。PGC-1α属于核受体超家族,介导线粒体蛋白DNA序列的转录翻译[9]。研究表明PGC-1α可以通过雄激素相关受体α调控SIRT3的表达,雌激素相关受体α是SIRT3的启动子区,介导PGC-1α引起的SIRT3的转录[4],敲减SIRT3的表达能明显减弱PGC-1α对线粒体的转录调节。对人脐静脉内皮细胞的研究表明,SIRT3介导叉头框转录因子O3 亚型的去乙酰化,诱导其易位至细胞核内,为线粒体生物的合成提供了关键蛋白,如PGC-1α、动力相关蛋白1、线粒体融合蛋白2和线粒体转录因子A。这些发现证明SIRT3在调节线粒体生物合成,保护线粒体代谢中的核心作用。 1.2 SIRT3调节线粒体裂变与融合 细胞对能量的需求依靠线粒体裂变和融合之间的动态平衡。裂变由细胞质内的动力相关蛋白1和线粒体外膜上的分裂蛋白共同介导。线粒体通过裂变适应细胞不断生长需求。同时,视神经萎缩蛋白1和线粒体融合蛋白共同介导了线粒体的融合,融合的过程实现了线粒体应对细胞应激时对能量需求的增加。裂变导致线粒体分裂,而融合则意味着线粒体内代谢产物和线粒体DNA在线粒体之间的交换。这种正常的裂变与融合的平衡受多种内、外部因素影响。据报道,SIRT3通过去乙酰化,激活视神经萎缩蛋白1来维持甚至增强线粒体呼吸链膜蛋白复合体的活性,同时也提出,SIRT3对视神经萎缩蛋白1的去乙酰化调节可能是阻断线粒体介导细胞凋亡的机制之一[10-11]。Morigi等[12]发现在肾小管上皮细胞中,SIRT3过表达可降低动力相关蛋白1在线粒体中的聚集,并证实SIRT3可通过调节动力相关蛋白1和线粒体外膜上的分裂蛋白的表达,限制线粒体分裂。有研究表明,SIRT3在钙离子动态中起重要作用,并与细胞的凋亡调控相关[6]。细胞凋亡依赖于线粒体渗透性转换孔,线粒体渗透性转换孔的持续开放将会导致线粒体膜电位流失、细胞色素C的释放,激活前凋亡通路。SIRT3可以通过细胞色素D的去乙酰化阻止线粒体渗透性转换孔的持续开放,进而阻止活性氧类的产生,使钙离子动态稳定,稳定线粒体动力学,减少细胞的凋亡。因此,SIRT3是调节线粒体动力学的重要蛋白。 1.3 SIRT3调节线粒体生物能量的合成 能量的生成是细胞生存的核心元素,ATP产生降低是细胞凋亡的强烈信号。SIRT3调节呼吸链中酶复合物Ⅰ、酶复合物Ⅱ和酶复合物Ⅴ的活性以及线粒体核糖体蛋白10的活性,因而SIRT3几乎可以调节整个呼吸链的转录[6]。 当细胞中主要供能物质丙酮酸供给不足时,细胞中的线粒体可以通过转换供能途径为脂肪酸、氨基酸以及乙酸分解代谢,从而为细胞提供能量,这种叫华宝效应(Warburg effect)的代谢转换也受SIRT3表达水平的调节。在SIRT3敲低小鼠的肝脏中有43%的蛋白质乙酰化增加,参与三羧酸循环,说明乙酰化可能在调节三羧酸循环中的能量代谢方面发挥重要作用。研究证实,在线粒体能量生产中,SIRT3介导了脱乙酰化和活化的过程,包括异柠檬酸脱氢酶2、乙酰辅酶A合成酶2、谷氨酸脱氢酶以及电子传递链相关蛋白[13]。Hirschey等[14]发现心脏组织中广泛存在长链脂肪酸辅酶A脱氢酶的乙酰化,而SIRT3缺陷型动物显示心脏中长链脂肪酸辅酶A脱氢酶乙酰化增加,脂肪酸氧化水平减少33%。最近的研究表明,SIRT3通过线粒体蛋白的去乙酰化参与心脏ATP的调节,在SIRT3缺陷小鼠的心脏中ATP水平明显降低[15]。这些均说明SIRT3对蛋白乙酰化的调节,可能是线粒体能量合成的关键。 1.4 SIRT3对抗氧化防御系统的调节 谷胱甘肽、超氧化物歧化酶参与人体内的氧化还原反应,是重要的还原剂,可以清除体内过氧化后产生的有害代谢物质,可以阻止脂质的过氧化。活性氧类是判断氧自由基产生和组织损伤的重要生物标志物。线粒体是产生活性氧类的主要场所。生理情况下,活性氧类可以调节细胞稳态、细胞分裂与分化等多种生理活动,而在特殊环境下,因长期的缺血、缺氧或药物的毒性作用,呼吸链无法正常获得电子,呼吸链被中断,大量的电子堆积,与再灌注后摄入的游离氧结合,继而产生活性氧类。过多的活性氧类直接影响线粒体氧化和抗氧化系统的平衡,使活性氧类的清除作用受抑制,导致活性氧类大量聚集,最终造成线粒体膜脂质、蛋白质的过氧化,从而影响线粒体膜的通透性,同时破坏线粒体嵴的结构,引发线粒体损伤,影响线粒体产能,无法提供足够能量。SIRT3的过度表达抑制核因子κB的转录活性,并下调胞外调节蛋白激酶1/2和p38的磷酸化,降低活性氧类水平,故在近端肾小管上皮细胞中可能存在SIRT3介导的抗氧化机制[16]。有研究表明,SIRT3可以通过锰超氧化物歧化酶减少细胞内活性氧类水平,作为去乙酰化酶,SIRT3非特异性地使组蛋白和非组蛋白去乙酰化,可通过使超氧化物歧化酶两个关键的赖氨酸残基去乙酰化来增强细胞的抗氧化活性。另外,SIRT3可增加锰超氧化物歧化酶及异柠檬酸脱氢酶2的活性,将线粒体中咽酰胺腺嘌呤二核苷酸磷酸向还原型烟酰胺腺嘌呤二核苷酸磷酸转换,有助于维持谷胱甘肽处于还原状态,同时,与硫氧还蛋白-2相互作用参与过氧化氢的清除,提高机体抗氧化防御能力[17]。细胞核中的SIRT3可以通过去乙酰化增加叉头框转录因子O3亚型的表达,进一步促进锰超氧化物歧化酶和异柠檬酸脱氢酶2表达,减轻氧化应激对细胞的损伤[7];SIRT3还可以减少p38促分裂原活化的蛋白激酶、胞外调节蛋白激酶1/2的磷酸化作用,抑制核因子κB活化,提高锰超氧化物歧化酶的表达水平来抑制活性氧类的生成,进而减少活性氧类导致的小管间质性肾炎的恶化[18]。研究表明缺乏SIRT3的细胞和组织显示出高的氧化应激指数,但Parodi-Rullán等[19]观察到在缺血后恢复期间,SIRT3缺乏会加剧心脏功能障碍,并增加活性氧类生成,而不会对线粒体蛋白质和DNA造成氧化破坏。在氧化应激方面,SIRT3随着活性氧类的增加而上调,这种上调机制可能受缺氧诱导因子-1α调控。另一种可能存在的通路是E2相关调节因子抗氧化应激通路,一旦发生氧化应激,E2相关调节因子转移至核内,使具有抗氧化反应原件结合位点的基因激活并表达[20],而SIRT3和E2相关调节因子的功能主要在于调控能量代谢和线粒体生成[8]。 2 SIRT3在急性肾损伤中的作用机制
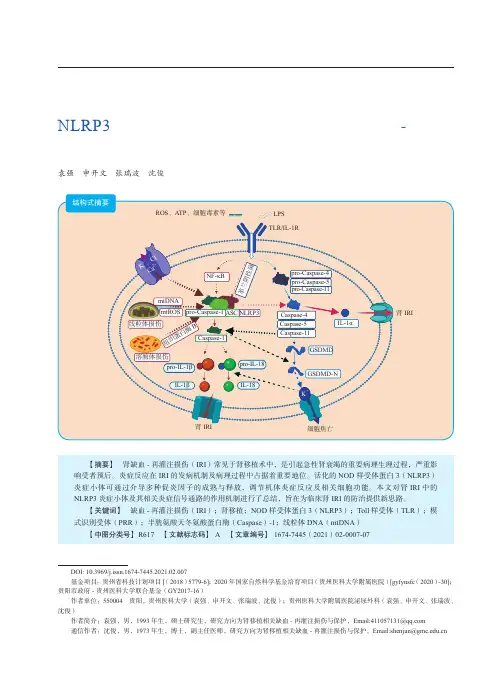
第12卷 第2期2021年3月Vol. 12 No.2Mar. 2021器官移植Organ TransplantationNLRP3炎症小体与相关炎症信号通路在肾缺血-再灌注损伤中的作用袁强 申开文 张瑞波 沈俊·移植前沿·DOI: 10.3969/j.issn.1674-7445.2021.02.007基金项目:贵州省科技计划项目[(2018)5779-6];2020年国家自然科学基金培育项目(贵州医科大学附属医院)[gyfynsfc (2020)-30];贵阳市政府-贵州医科大学联合基金(GY2017-16)作者单位:550004 贵阳,贵州医科大学(袁强、申开文、张瑞波、沈俊);贵州医科大学附属医院泌尿外科(袁强、申开文、张瑞波、沈俊)作者简介:袁强,男,1993年生,硕士研究生,研究方向为肾移植相关缺血-再灌注损伤与保护,Email:****************通信作者:沈俊,男,1973年生,博士,副主任医师,研究方向为肾移植相关缺血-再灌注损伤与保护,Email:***************.cn【摘要】 肾缺血-再灌注损伤(IRI )常见于肾移植术中,是引起急性肾衰竭的重要病理生理过程,严重影响受者预后。
炎症反应在IRI 的发病机制及病理过程中占据着重要地位。
活化的NOD 样受体蛋白3(NLRP3)炎症小体可通过介导多种促炎因子的成熟与释放,调节机体炎症反应及相关细胞功能。
本文对肾IRI 中的NLRP3炎症小体及其相关炎症信号通路的作用机制进行了总结,旨在为临床肾IRI 的防治提供新思路。
【关键词】 缺血-再灌注损伤(IRI );肾移植;NOD 样受体蛋白3(NLRP3);Toll 样受体(TLR );模式识别受体(PRR );半胱氨酸天冬氨酸蛋白酶(Caspase )-1;线粒体DNA (mtDNA )【中图分类号】 R617 【文献标志码】A 【文章编号】1674-7445(2021)02-0007-07结构式摘要LPS TLR/IL-1RROS 、ATP 、细胞毒素等NF-κB线粒体损伤mtDNAmtROS 溶酶体损伤组织蛋白酶Bpro-Caspase-4pro-Caspase-5pro-Caspase-11Caspase-5Caspase-11Caspase-4肾IRI肾IRI细胞焦亡ASC Caspase-1pro-IL-18IL-18GSDMD-N革兰阴性菌pro-Caspase-1NLRP3pro-IL-1βIL-1βGSDMDIL-1αK +、C l -Ca 2+K +·178·第12卷器官移植现阶段,全世界有10%的人口患有慢性肾病。

六味地黄丸治疗糖尿病肾病的机理研究进展简述了近年来有关六味地黄丸治疗糖尿病肾病的机理的研究,分析表明六味地黄丸治疗糖尿病肾病可能主要与控制相关基因表达等有关,为中药复方的机制研究提供新的思路和方法。
标签:六味地黄丸;糖尿病肾病;机理糖尿病腎病是糖尿病严重的微血管并发症之一,是导致肾小球硬化和终末期肾脏疾病的主要原因之一,严重影响患者的生存质量。
中医认为糖尿病肾病是以肝肾阴虚为本的病症,六味地黄丸是治疗肝肾阴虚的经典方,经过多年的临床实践,中药六味地黄丸在治疗糖尿病肾病方面积累了丰富经验。
临床研究表明六味地黄丸糖尿病肾病的临床疗效显著,能改善患者肾功能,降低血肌酐、血尿素氮及24h尿蛋白[1],不良反应发生率低[2],是一种比较安全的药物[3]。
现将近年来有关六味地黄丸治疗糖尿病肾病的机理的研究综述如下。
李志杰[4]等发现糖尿病肾病模型组大鼠肾小球肥大,毛细血管基底膜增厚,系膜基质增生,肾小管上皮细胞空泡样变,见蛋白管型,nephrin和podocin蛋白表达减少。
治疗组给予六味地黄丸灌胃,血糖、体重无明显改变,肾系数、24h 尿蛋白总量、血尿素氮、血肌酐明显降低,病理改变明显减轻,大鼠肾组织nephrin 和podocin表达明显增加。
认为六味地黄丸可能通过增加足细胞nephrin和podocin表达发挥保护糖尿病肾病大鼠肾脏的作用。
杜静静[5]等利用全自动生化分析仪测大鼠肾功能,考马斯亮蓝法测24小时尿蛋白量,Elisa法检测血清中TNF-α、IL-6的水平,同时用葡萄糖氧化酶法测定空腹血糖。
结果六味地黄丸高、中剂量组和罗格列酮治疗组IL-6在肾脏的表达均高于模型组(P<0.01),且高剂量组和罗格列酮缬组在表达上差异无统计学意义(P>0.05),认为六味地黄丸治疗糖尿病肾病可能与其能抑制DN大鼠肾脏中TNF-α、IL-6的激活有关。
谭颖颖[6][7]等以六味地黄丸含药血清处理高糖诱导的HK-2细胞24h和48h,检测系膜细胞MCP-1和ICAM-1 mRNA表达。
浅谈辛伐他汀在肾病患者降血脂治疗中的应用【摘要】目的:分析辛伐他汀在肾病患者降血脂的应用。
方法:对笔者所在医院收治的324例存在高脂血症的肾病患者进行回顾分析,a组采用辛伐他汀治疗,b组采用氟伐他汀治疗,对比两组疗效。
结果:两组治疗后tc、ldl-c均比治疗前有所降低,且a组患者较b组患者降低更明显,差异有统计学意义(p0.05),具有可比性。
1.2 高脂血症诊断标准通过两次空腹血液检测查胆固醇(tc)、三酰甘油(tg)、高密度脂蛋白(hdl-c)或低密度脂蛋白(ldl-c),除外与肾病相关的其他疾病。
1.3 方法所有接受试验患者停用以前所有降脂药,a组患者每晚顿服辛伐他汀40 mg,b组患者每晚顿服氟伐他汀40 mg,8周为一疗程,服药6个月,每4周随访一次,做自身前后对照观察。
观察指标为tc、tg、hdl-c、ldl-c。
1.4 统计学处理应用spss 13.0软件包进行统计学分析,计量资料均数±标准差(x±s)表示,采用单因素方差分析,p<0.05为差异有统计学意义。
2 结果2.1 两组患者治疗前后各项指标的比较治疗后两组tg、hdl-c比较差异有统计学意义(p<0.05)。
两组治疗后tc、ldl-c均比治疗前有所降低,且a组患者较b组患者降低更明显(p<0.05)。
具体见表1。
2.2 不良反应a组患者中有3例谷丙转氨酶(gpt)轻度升高,2例为经停药便恢复正常,1例停药4周后恢复正常。
1例出现轻度腹胀,在患者耐受范围之内。
b组患者有4例由于gtp过高而停药,4周后恢复正常。
3例患者由于恶心、腹胀、呕吐等消化道症状而停药,停药后症状消失。
还有1例患者出现了急性的颈肌痛的现象,但未予处理。
3 讨论在肾间质纤维化的发生发展的进程中起重要作用的是肾小管上皮细胞,此细胞受多种因素的影响,例如尿蛋白、肾毒性物质、葡萄糖以及炎症因子等,可参与早期炎症反应,还可分泌如pdgf、ctgf 等细胞因子,这些细胞因子在促进细胞外基质的增值、合成方面起到了关键作用;还可抑制细胞外基质的降解,加重其堆积。
肾小管上皮细胞线粒体氧化损伤在肾间质纤维化中的作用及机制
[摘要] 目的 探讨肾小管上皮细胞线粒体氧化损伤在肾间质纤维化中的作用机制。 方法 2015年6~12月期间,于本地动物实验中心选取60只健康雄性大鼠,根据处理方法的不同将其分为实验组和对照组,其中实验组行左侧输尿管结扎术,对照组则仅接受左侧输尿管游离,14 d后对两组大鼠的左侧肾脏中线粒体相关基因的表达情况、肾脏功能等参数进行检测分析。 结果 实验组大鼠术后14 d mtDNA(1.49±0.12)、NRF1(1.87±0.17)、PGC1a(1.76±0.21)、Drp1(2.49±0.24)、Mfn2(2.45±0.27)的表达水平均明显高于对照组(1.07±0.23、1.11±0.29、1.05±0.32、1.14±0.35、1.17±0.14),差异具有统计学意义(P<0.05);术后14 d,实验组大鼠肾脏组织中的COX(2.61±0.27)明显高于对照组的(1.07±0.19),SOD较对照组明显降低(0.55±0.16 vs 1.07±0.18),其RIF指数(22.76±1.39)明显高于对照组的(0.81±0.16),差异具有统计学意义(P<0.05)。 结论 在肾间质纤维化中肾小管上皮细胞线粒体氧化损伤发挥着十分重要的作用,缺氧所造成的线粒体氧化损伤会造成肾小管功能受损,引起大量致纤维因子的产生,并从多途径引起肾间质纤维化。 [关键词] 肾间质纤维化;肾小管上皮细胞;线粒体氧化损伤;肾小管功能 [中图分类号] R692 [文献标识码] A [文章编号] 1673-9701(2016)20-0032-03 [Abstract] Objective To discuss the effect and mechanism of mitochondria oxidative damage in renal tubular epithelial cells on renal interstitial fibrosis. Methods A total of 60 health male rats were selected from a local animal experimental center from June to December 2015 and divided into study group and control group. Rats in the study group were given left ureteral obstruction, while those in the control group were only given left ureteral mobilization. Parameters including the expression of genes in mitochondria and renal function of the left kidney were detected and analyzed after 14 days. Results At 14 d after surgery, the expression levels of mtDNA (1.49±0.12), regenerating gene (1.87±0.17), interrupted gene(1.76±0.21), and fusion gene(2.49±0.24, 2.45±0.27) in the study group were all significantly higher than those(1.07±0.23, 1.11±0.29, 1.05±0.32, 1.14±0.35, and 1.17±0.14) in the control group(P<0.05). The level of COX (2.61±0.27) in kidney tissues in the study group was significantly higher than that(1.07±0.19) in the control group, while the level of SOD was significantly lower than the control group(0.55±0.16 vs 1.07±0.18). The RIF index (22.76±1.39) in the study group was significantly higher than that (0.81±0.16) in the control group (P<0.05). Conclusion Mitochondria oxidative damage in renal tubular epithelial cells has a significant effect on renal interstitial fibrosis. Mitochondria oxidative damage caused by anoxia may lead to functional impairment of kidney tubules, inducing a large number of fibrosis factors and resulting in renal interstitial fibrosis from multiple pathways. [Key words] Renal interstitial fibrosis; Renal tubular epithelial cell; Mitochondria oxidative damage; Renal tubular function 绝大部分慢性肾脏疾病均存在肾间质纤维化表现,如间质细胞外基质和小管基底膜成分出现定量及定性改变、肌纤维母细胞聚集、肾小管萎缩等[1]。目前大量研究均指出,在肾小管基膜破坏过程中,患者多存在肾小管上皮细胞转化为肌纤维母细胞样细胞现象,继而引起间质区出现大量细胞外基质(engine control module,ECM)沉积,引发肾小管萎缩,最终造成间质纤维化病损[2,3]。本次研究在2015年6~12月期间通过建立大鼠模型,旨在探讨肾小管上皮细胞线粒体氧化损伤在肾间质纤维化中的作用机制。现报道如下。 1 资料与方法 1.1 一般资料 选取21日龄SD雄性成年大鼠60只,由本地动物实验中心提供,实验动物生产许可证号为SCXK2015-0002。将其随机分为对照组和实验组,实验组大鼠30只,平均体重(221.9±12.4)g,对照组大鼠30只,平均体重(216.7±13.5)g,两组大鼠的日龄、体重等一般资料比较差异无统计学意义(P>0.05)。其中对照组接受左侧输尿管游离,实验组大鼠接受左侧输尿管结扎术。 1.2 方法 1.2.1 模型制备方法 实验组:取10%水合氯醛(0.03 mL/kg)对大鼠行腹腔注射麻醉,在手术台上对其行右侧卧位固定,剪除体毛后对手术区进行消毒,取左侧腹切口,将皮肤、肌肉和腹壁各层逐层切开,使左侧输尿管暴露并对其进行分离,使用5-0丝线对其进行结扎并离断输尿管,逐层缝合完成手术。对照组大鼠仅对左侧输尿管进行游离,但不进行结扎和离断。 1.2.2 检测方法 术后14 d摘取两组大鼠左侧肾脏,并对其进行处理,对下述指标进行检测:①线粒体基因表达水平:采用Real-time PCR技术度两组大鼠肾小管上皮细胞线粒体NRF1、PGC1a、Drp1、Mfn2和mtDNA(mitochondrial DNA,mtDNA)的表达水平进行检测记录;②超氧化物歧化酶(superoxide dismutase,SOD)、环氧酶(cyclo-oxygenase,COX)水平:采用Real-time PCR技术对两组大鼠肾脏组织中的SOD和COX水平进行检测;③肾间质纤维化(renal interstitial fibrosis,RIF)指数:对大鼠肾脏组织进行Masson染色,其中胶原纤维呈绿色,对其中绿色数量进行统计;④对两组大鼠的肾组织羟脯氨酸(hydroxyproline,Hyp)含量进行比较。 1.3 统计学方法 采用统计学软件SPSS18.0进行数据分析,计量资料以均数±标准差(x±s)表示,组间结果比较进行t检验,P<0.05为差异具有统计学意义。 2 结果 2.1 两组大鼠线粒体基因表达水平比较 实验组大鼠术后14 d mtDNA(1.49±0.12)、NRF1(1.87±0.17)、PGC1a(1.76±0.21)、Drp1(2.49±0.24)、Mfn2(2.45±0.27)的表达水平均明显高于对照组,差异具有统计学意义(P<0.05),提示实验组大鼠肾脏组织中的线粒体具有较高活性。见表1。 2.2 两组大鼠术后14 d肾脏指标比较 术后14 d,实验组大鼠肾脏组织中的COX明显高于对照组,SOD较对照组明显降低,其RIF指数明显高于对照组,且实验组大鼠肾体比、肾脏Hyp含量均明显高于对照组,差异具有统计学意义(P<0.05)。见表2。 3 讨论 慢性肾脏疾病已成为严重威胁公众健康的常见慢性疾病,此种患者多以肾纤维化作为病理基础。Huising MO等[4]研究证实,在肾纤维化早期可采取有效措施促进其逆转,特别是对于肾间质和肾小管而言,其具有自我修复功能,在一定程度上可促进肾间质纤维化的逆转。 肾间质纤维化作为多种慢性肾脏疾病的终末期病例特点,在肾脏结构破坏过程中具有十分重要的作用,会造成间质毛细血管破坏、肾小管萎缩、成纤细胞增生和肾间质中细胞外基质的积聚[5-7]。相关资料显示,肾间质纤维化主要从以下四个方面实现:细胞损伤及活化、促炎因子和致纤维化因子产生、纤维化形成、肾脏结构和功能丧失,在此过程中,肾小管上皮细胞损伤和功能不全占据着十分关键的位置[8,9]。临床研究证实,缺氧性损伤会造成肾小管上皮细胞损伤,主要由于肾小管上皮细胞具有高溶转运活性特征,对于线粒体能量供给具有较高要求,缺氧会造成线粒体氧自由基产生增多,与线粒体膜结合造成其通透性改变[10-13]。从而引起细胞色素C由线粒体进入细胞浆,引发细胞损伤途径。左侧输尿管结扎会造成肾脏组织出现血流动力学改变,引起组织发生缺氧缺血性损伤,从而导致肾间质纤维化的发生[14]。 在本研究中,通过对大鼠左侧输尿管进行结扎以模拟肾小管上皮细胞线粒体氧化损伤,通过对两组小鼠肾脏组织中线粒体的