碳酸钠与碳酸氢钠性质的比较教程文件
- 格式:ppt
- 大小:277.50 KB
- 文档页数:10



二、碳酸钠和碳酸氢钠[引言][讲述][投影]碳酸钠俗名叫_______,也叫_______ ,碳酸氢钠俗名叫_______ 。
碳酸钠晶体的化学式是______________ ,碳酸钠晶体在干燥的空气中容易失去________变成碳酸钠粉末。
[科学探究](1)实验[投影][投影]《中华人民国节约能源法》第四十七条公共机构应当厉行节约,杜绝浪费,带头使用节能产品、设备,提高能源利用效率。
本法所称公共机构,是指全部或者部分使用财政性资金的国家机关、事业单位和团体组织。
[科学探究](2)碳酸钠和碳酸氢钠的热稳定性[实验]同时加热Na2CO3与NaHCO3(已检验过,装置气密性良好)[投影]现象结论Na2CO3阅读课本回答做实验,观察填写现象得出结论思考做实验,观察填写现象回归教材完善学生的实验能力,培养学生的观察能力训练学生用对比的方法认识事物了解有关节约能源法的知识,意识到平时要节约能源完善学生的实验能力,培养学生的观察能力《碳酸钠和碳酸氢钠的性质》教学设计一、教材分析《几种重要的金属化合物》是新教材中有关金属及其化合物性质的重要的学习容之一。
金属在自然界基本以化合态形式存在,因此第一节介绍金属单质的性质后,第二节重点讲述了钠、铝、铁的化合物性质。
在这一节容里,新教材安排了精彩的图片和丰富的实验探究。
旨在强调学生的主体学习能力,倡导学生主动参与,乐于探究,培养学生探究、分析和解决问题的能力、以及交流与合作的能力,对提高学生全面的科学素养具有十分重要的作用。
《碳酸钠与碳酸氢钠的性质》本节容在呈现方式上有以下特点:图画较多,有利于引起学生的学习兴趣,对所学知识留下深刻的印象;活动较多,有利于培养学生的各种能力。
在介绍碳酸钠和碳酸氢钠时,采用科学探究的形式,突出实验引探功能;利用对比的方法,让学生填写表格,可使学生在比较中学习。
教学重点是碳酸钠和碳酸氢钠的性质,难点是如何引导学生正确观察实验现象,并分析这些现象的本质,对碳酸钠和碳酸氢钠的性质作出正确的判断。



碳酸钠和碳酸氢钠的性质比较〔二〕【学习目标】1 掌握碳酸钠和碳酸氢钠性质比较的应用【知识梳理】碳酸钠和碳酸氢钠性质比较的应用一、Na2CO3和NaHCO3混合时的提纯方法1 Na2CO3粉末中混有NaHCO3加热法:2NaHCO3Na2CO3CO2↑H2O2 Na2CO3溶液中混有NaHCO3滴加适量的NaOH:NaHCO3NaOH === Na2CO3H2O3 NaHCO3溶液中混有Na2CO3通入过量CO2:Na2CO3CO2 H2O === 2NaHCO3[总结]Na2CO3和NaHCO3之间的转化关系:二、鉴别Na2CO3和NaHCO3的方法1利用热稳定性的不同,加热分解的是NaHCO3,无变化的是Na2CO3。
2利用与酸反响的速率不同,反响速率快的是NaHCO3,慢的是Na2CO3。
3分别参加CaC2或BaC2溶液,产生沉淀的是Na2CO3 ,不反响的是NaHCO3 。
三、制取Na2CO3的方法——侯氏制碱法1向饱和食盐水中依次通入足量的NH3、CO2;〔注意:先通入NH3,再通入CO2;或者NH3、CO2同时通入。
〕NaC CO2 NH3H2O===NaHCO3↓NH4C2 NaHCO3高温分解2NaHCO3Na2CO3CO2↑H2O【典型例题】[典例1] 不能用来鉴别Na2CO3和NaHCO3 两种白色固体的实验操作是〔〕A 分别加热这两种固体物质,并将生成的气体通入澄清的石灰水中B 分别在这两种物质的溶液中,参加CaC2溶液C 分别在这两种固体中,参加同浓度的稀盐酸D 分别在这两种物质的溶液中,参加少量澄清的石灰水解析:加热Na2CO3和NaHCO3两种白色固体,NaHCO3受热分解生成Na2CO3、H2O、CO2,将生成的气体通入澄清的石灰水中,能产生白色沉淀,Na2CO3受热不反响,所以选项A可以鉴别Na2CO3和NaHCO3 两种白色固体;分别在Na2CO3和NaHCO3两种物质的溶液中,参加CaC2溶液,Na2CO3溶液可以产生白色沉淀,NaHCO3和CaC2不发生反响,无任何现象产生,所以选项B可以鉴别Na2CO3和NaHCO3;选项C,分别在Na2CO3和NaHCO3两种固体中,参加同浓度的稀盐酸,NaHCO3与盐酸反响速率快,而Na2CO3与盐酸反响速率慢,可以根据放出CO2的快慢进行鉴别;别在这两种物质的溶液中,参加少量澄清的石灰水,Na2CO3和NaHCO3均可以和CaOH2反响,产生白色沉淀,所以选项D不能鉴别Na2CO3和NaHCO3。

碳酸钠与碳酸氢钠的性质比较教案教学内容化学必修1第三章第二节碳酸钠与碳酸氢钠的性质教学设计项目具体内容教学目的知识与技能1、使学生了解钠的重要化合物的性质和用途。
2、性实验,通过碳酸钠和碳酸氢钠的热稳定使学生了解鉴别它们方法。
3、通过介绍有关水污染法和节约能源法的知识,渗透法制教育。
能力与方法1、培养学生的观察能力。
2、训练学生用对比的方法认识事物。
3、完善学生的实验能力和创造思维能力。
情感与态度1、激发学生的求知欲望和学习期望;培养学生认真细致和严谨求实的科学态度。
2.、激发学生学习法律的兴趣。
重点.碳酸钠和碳酸氢钠的性质及其鉴别方法难点.碳酸钠和碳酸氢钠的性质及其鉴别方法教学用具小试管、大试管、胶头滴管、酒精灯、火柴、气球、铁架台等,Na2CO3、NaHCO3、稀盐酸、澄清石灰水、蒸馏水、小气球、酚酞试剂。
教法对比法、讨论法、实验探究法教师活动学生活动设计意图二、碳酸钠和碳酸氢钠[引言][讲述][投影]碳酸钠俗名叫_______,也叫_______ ,碳酸氢钠俗名叫_______ 。
碳酸钠晶体的化学式是______________ ,碳酸钠晶体在干燥的空气中容易失去________变成碳酸钠粉末。
[科学探究](1)实验[投影][投影]《中华人民共和国节约能源法》第四十七条公共机构应当厉行节约,杜绝浪费,带头使用节能产品、设备,提高能源利用效率。
本法所称公共机构,是指全部或者部分使用财政性资金的国家机关、事业单位和团体组织。
[科学探究](2)碳酸钠和碳酸氢钠的热稳定性[实验]同时加热Na2CO3与NaHCO3(已检验过,装置气密性良好)[投影]现象结论Na2CO3NaHCO3[科学探究](3)碳酸钠和碳酸氢钠与盐酸的反应[实验]在两根试管中分别加入2mL稀盐酸,将等量(1/3药匙)的碳酸钠和碳酸氢钠加入试管中。
注意:比较反应的剧烈程度Na2CO3+2HCl=2NaCl+ H2O+CO2↑阅读课本回答做实验,观察填写现象得出结论思考做实验,观察填写现象做实验,观察填写现象学生填写填写,总结讨论,思考,回答讨论,思考,回答回归教材完善学生的实验能力,培养学生的观察能力训练学生用对比的方法认识事物了解有关节约能源法的知识,意识到平时要节约能源完善学生的实验能力,培养学生的观察能力了解鉴别它们的方法完善学生的实验能力和创造思维能力,培养学生的观察能力,了解区别它们的方法,复习离子反应知识,实验后的酸液、碱液或者剧毒废液不能随意排放CO32 -+2H+= H2O + CO2↑NaHCO3+HCl=NaCl+ H2O + CO2↑HCO3-+H+=H2O+CO2↑结论:碳酸钠和碳酸氢钠都易与酸反应,但是碳酸氢钠与酸反应比碳酸钠更剧烈。



碳酸钠与碳酸氢钠性质比较精品文档收集于网络,如有侵权请联系管理员删除一、 Na 2CO 3与 NaHCO 3性质比较Na 2CO 3NaHCO 3 俗名 纯碱 苏打小苏打颜色状态 白色固体白色固体溶解性 都能溶解于水,但 Na 2CO 3的溶解度大于NaHCO 3的溶解度用途 制玻璃、造纸、制肥皂、纺织工业 发酵粉的主要成分、治疗胃酸过多、泡沫灭火与盐酸反应Na 2CO 3+2HCl=2NaCl+CO 2+H 2O 若逐滴滴加盐酸反应先后顺序为: Na 2CO 3+HCl=NaCl+NaHCO 3 NaHCO 3+HCl=NaCl+CO 2+H 2ONaHCO 3+HCl=NaCl+CO 2+H 2ONaHCO 3与盐酸反应的剧烈程度大于Na 2CO 3与盐酸反应的剧烈程度 与NaOH 溶液反应不反应 NaHCO 3+NaOH=Na 2CO 3+H 2O与Ca(OH)2溶液反应产生白色沉淀Na 2CO 3+Ca(OH)2=CaCO 3+2NaOH 产生白色沉淀2NaHCO 3+Ca(OH)2=CaCO 3+Na 2CO 3+2H 2O 与CaCl 2溶液反应 产生白色沉淀 Na 2CO 3+CaCl 2=CaCO 3+2NaCl 不反应与CO 2反应Na 2CO 3+CO 2+H 2O=2NaHCO 3 若向饱和的Na 2CO 3溶液中通入CO 2气体,溶液中析出白色固体,因为NaHCO 3的溶解度小于Na 2CO 3的溶解不反应 热稳定性 稳定,受热不分解不稳定,受热分解2NaHCO 3====Na 2CO 3+CO 2+H 2O二、Na 2CO 3与 NaHCO 3的相互转化三、如何区分Na 2CO 3与 NaHCO 31、加热观察是否分解:能够分解产生能使澄清石灰水变浑浊的无色无味的气体的为NaHCO 3,不分解的为Na 2CO 32、取等质量的固体(或等浓度等体积的Na 2CO 3与 NaHCO 3的溶液)分别与盐酸,反应观察剧烈程度,剧烈的为NaHCO 33、加CaCl 2,看是否有沉淀生成;有沉淀生成的为Na 2CO 3,无沉淀生成的为NaHCO 3四、CO 32—与HCO 3—的检验方法①CO 32—的检验方法: 先加CaCl 2溶液,产生白色沉淀,再加稀盐酸沉淀溶解并产生无色无味的能使澄清石灰水变浑浊的气体②HCO 3—的检验方法: 先加CaCl 2溶液,无现象,再加稀盐酸产生无色无味的能使澄清石灰水变浑浊的气体Δ。
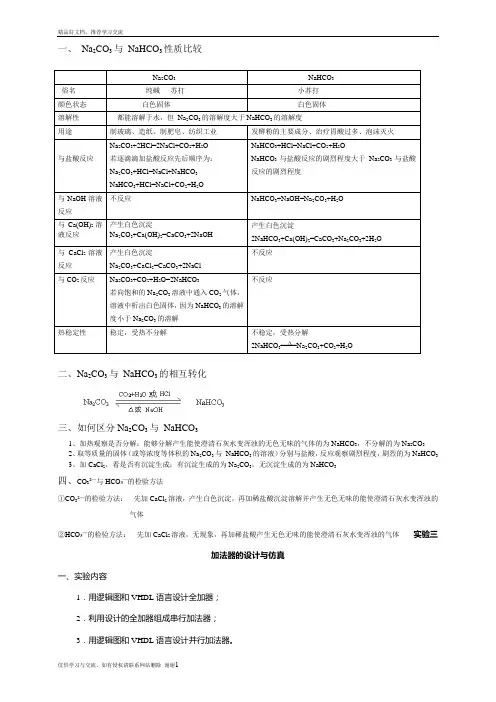
一、Na2CO3与NaHCO3性质比较Na2CO3NaHCO3俗名纯碱苏打小苏打颜色状态白色固体白色固体溶解性都能溶解于水,但Na2CO3的溶解度大于NaHCO3的溶解度用途制玻璃、造纸、制肥皂、纺织工业发酵粉的主要成分、治疗胃酸过多、泡沫灭火与盐酸反应Na2CO3+2HCl=2NaCl+CO2+H2O若逐滴滴加盐酸反应先后顺序为:Na2CO3+HCl=NaCl+NaHCO3NaHCO3+HCl=NaCl+CO2+H2ONaHCO3+HCl=NaCl+CO2+H2ONaHCO3与盐酸反应的剧烈程度大于Na2CO3与盐酸反应的剧烈程度与NaOH溶液反应不反应NaHCO3+NaOH=Na2CO3+H2O与Ca(OH)2溶液反应产生白色沉淀Na2CO3+Ca(OH)2=CaCO3+2NaOH产生白色沉淀2NaHCO3+Ca(OH)2=CaCO3+Na2CO3+2H2O与CaCl2溶液反应产生白色沉淀Na2CO3+CaCl2=CaCO3+2NaCl不反应与CO2反应Na2CO3+CO2+H2O=2NaHCO3若向饱和的Na2CO3溶液中通入CO2气体,溶液中析出白色固体,因为NaHCO3的溶解度小于Na2CO3的溶解不反应热稳定性稳定,受热不分解不稳定,受热分解2NaHCO3====Na2CO3+CO2+H2O二、Na2CO3与NaHCO3的相互转化三、如何区分Na2CO3与NaHCO31、加热观察是否分解:能够分解产生能使澄清石灰水变浑浊的无色无味的气体的为NaHCO3,不分解的为Na2CO32、取等质量的固体(或等浓度等体积的Na2CO3与NaHCO3的溶液)分别与盐酸,反应观察剧烈程度,剧烈的为NaHCO33、加CaCl2,看是否有沉淀生成;有沉淀生成的为Na2CO3,无沉淀生成的为NaHCO3四、CO32—与HCO3—的检验方法①CO32—的检验方法:先加CaCl2溶液,产生白色沉淀,再加稀盐酸沉淀溶解并产生无色无味的能使澄清石灰水变浑浊的气体②HCO3—的检验方法:先加CaCl2溶液,无现象,再加稀盐酸产生无色无味的能使澄清石灰水变浑浊的气体实验三加法器的设计与仿真一、实验内容1.用逻辑图和VHDL语言设计全加器;2.利用设计的全加器组成串行加法器;3.用逻辑图和VHDL语言设计并行加法器。
碳酸钠和碳酸氢钠的性质实验名称:碳酸钠和碳酸氢钠的性质实验目的:练习固体的取用、溶解、实验仪器的组装等基本操作;加深碳酸钠和碳酸氢钠的 性质的理解。
实验原理:Na 2CO 3和NaHCO 3的性质:①水溶液都显碱性;②热稳定性不同。
实验用品:试管、药匙、玻璃棒、蒸馏水、酒精灯、铁架台、带塞子的导管、玻璃片、标准比色卡、Na 2CO 3固体粉末、澄清石灰水、PH 试纸、NaHCO 3固体粉末、 实验步骤、现象、与装置图:1.在2支试管里分别加入少量的Na 2CO 3和NaHCO 3 (各约1g ): (1)观察二者外观上的细小差别,分别滴入几滴水,振荡试管并用手摸一摸试管底部,观察现象。
(2)继续向试管内加入10mL 水,用力振荡,观察现象。
(3)向试管内滴入1~2滴酚酞溶液,观察现象。
(4)在下表中记录实验现象,并得出初步结论。
(4)在下表中记录实验现象,并得出初步结论。
步骤 Na 2CO 3NaHCO 3结论(1) 加水后结块,能感觉到热 加水后部分溶解,感觉不到热 Na 2CO 3比NaHCO 3溶解放热多 (2) 振荡一段时间后完全溶解 振荡一段时间后仍未完全溶解Na 2CO 3比NaHCO 3溶解度大 (3)溶液变红,颜色较深溶液变红,颜色较浅Na 2CO 3比NaHCO 3溶液碱性强2. Na 2CO 3和NaHCO 3的热稳定性现象 发生反应的化学方程式结论 Na 2CO 3澄清石灰水没有变浑浊Na 2CO 3受热 不分解 NaHCO 3 澄清石灰水变浑浊2NaHCO 3Na 2CO 3+H 2O +CO 2↑NaHCO 3受热 易分解实验结论:1. 在相同温度下,Na 2CO 3的溶解度比NaHCO 3的溶解度大;2. Na 2CO 3和NaHCO 3的水溶液都显碱性,Na 2CO 3溶液的碱性比NaHCO 3溶液的强;3. Na 2CO 3固体稳定,受热不分解,NaHCO 3固体不稳定,受热易分解。