5常用化学反应还原的方法及化学还原剂还原能力的比较
- 格式:ppt
- 大小:584.51 KB
- 文档页数:20



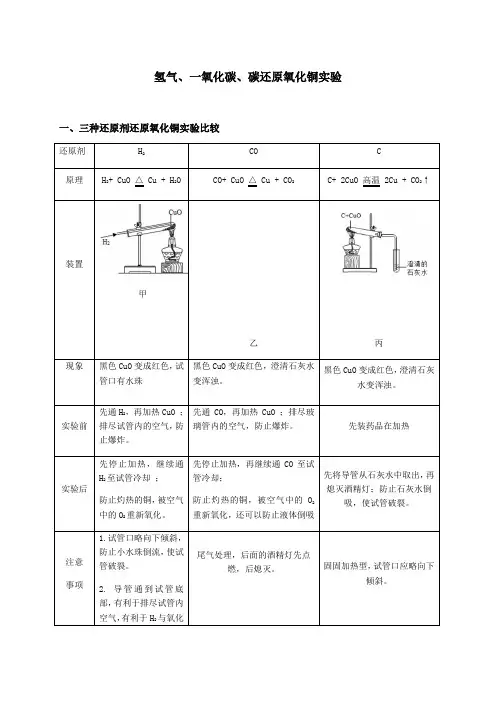
氢气、一氧化碳、碳还原氧化铜实验一、三种还原剂还原氧化铜实验比较甲黑色CuO变成红色,试黑色二、经典题型训练1.一氧化碳还原氧化铜实验的过程中有如下几步操作: ①点燃酒精灯,加热氧化铜; ②撤去酒精灯,停止加热; ③通入一氧化碳气体; ④停止通入一氧化碳气体; ⑤让还原出的金属铜完全冷却。
其中正确操作的顺序为()A. ①③②④⑤B. ③①②⑤④C. ③①②④⑤D. ①③②⑤④2.用一氧化碳还原氧化铜后,发现已制得的铜又很快变黑了,请推测产生这种现象的原因可能是( )A. 温度太低B. 试管口倾斜了C. 反应开始时,没有把试管内的空气排干净D. 铜没有在一氧化碳气流中冷却而又被空气中的氧气所氧化3.氢气和一氧化碳还原氧化铜的实验装置如下,有关说法错误的是()A. 实验时都应该先通入气体后加热,防止发生爆炸B. 两者都可以通过观察黑色固体颜色的变化判断反应是否发生C. 甲试管略向下倾斜,乙玻璃管保持水平,是因为两种气体的密度不同D. 甲无尾气处理装置而乙有,是因为一氧化碳有毒而氢气无毒4.木炭还原氧化铜和一氧化碳还原氧化铜的实验装置如下,下列说法正确的是()A.木炭、一氧化碳与氧化铜的反应都属于置换反应B.两空实验的相关反应中,只有碳元素的化合价发生改变C.两个实验中都可观察到红色固体变黑D.两个实验的操作中都要防止液体倒吸5.如图是木炭与氧化铜反应的实验装置图,下列说法错误的是()A.给酒精灯加网罩,目的是使火焰集中并提高温度B.实验过程中,可观察到澄清石灰水变浑浊C.碳在反应中发生了氧化反应,表现出还原性D.实验结束后,应先停止加热,再将导气管从澄清石灰水中撤出6.氢气、木炭、一氧化碳是金属冶炼中常用的还原剂.如图甲是氢气还原氧化铜的实验,如图乙是木炭还原氧化铁的实验,如图丙是一氧化碳还原氧化铜的实验.(1)实验装置的设计应考虑反应物、生成物的性质和反应条件等因素。
比较图甲和图丙所示的实验装置,从反应物的角度分析它们的不同点,写出一点并说明原因 。




氧化还原反应中的还原剂在化学的奇妙世界里,氧化还原反应如同一场精彩的“电子转移大战”,而还原剂则是这场大战中的关键角色。
那么,什么是还原剂呢?简单来说,还原剂就是在氧化还原反应中失去电子、化合价升高的物质。
为了更深入地理解还原剂,让我们先从一些常见的氧化还原反应例子入手。
比如,在氢气还原氧化铜的反应中,氢气(H₂)就是还原剂。
化学方程式为:H₂+ CuO == Cu + H₂O 。
在这个反应中,氢气失去电子,化合价从0 价升高到+1 价,而氧化铜中的铜元素得到电子,化合价从+2 价降低到 0 价。
再来看铁与硫酸铜溶液的反应:Fe + CuSO₄== FeSO₄+ Cu 。
这里的铁(Fe)是还原剂,它失去电子,化合价从0 价升高到+2 价,而铜离子得到电子,化合价从+2 价降低到 0 价,生成了铜单质。
那么,还原剂在这些反应中究竟发挥了怎样的作用呢?首先,还原剂为氧化还原反应提供了电子。
就好像是在一场交易中,还原剂慷慨地“送出”了自己的电子,使得其他物质能够得到电子,从而实现化合价的变化。
其次,还原剂的存在使得化学反应能够朝着特定的方向进行。
没有还原剂,很多重要的化学反应就无法发生,许多物质的转化也就无从谈起。
比如,在金属的冶炼过程中,常常需要使用还原剂将金属氧化物还原为金属单质。
此外,还原剂在生活和工业生产中也有着广泛的应用。
在电池中,负极材料通常充当还原剂,通过失去电子产生电流,为我们的电子设备提供能量。
例如常见的干电池,锌筒就是还原剂,它在反应中逐渐被消耗。
在化学分析中,还原剂也经常被用于定量分析某些物质的含量。
比如,通过使用特定的还原剂与待分析物质发生反应,然后测量反应中消耗的还原剂的量,就可以计算出待分析物质的含量。
不同的还原剂具有不同的还原能力。
这主要取决于它们失去电子的难易程度。
一些常见的强还原剂,如金属钠(Na)、钾(K)等,它们非常容易失去电子,反应活性很高。
而像一氧化碳(CO)这样的还原剂,其还原能力相对较弱。

常见的还原剂有哪些,有什么作用常见的还原剂有哪些,有什么作用常见的还原剂有哪些?其中包括有典型的非金属单质如F2、O2、Cl2、Br2、I2、S等(其氧化性强弱与非金属活动性基本一致);含有变价元素的高价化合物,如KMnO4 KClO3 H2SO4 HNO3 MnO2 等。
常见的还原剂有什么常见的还原剂是在化学反应中易失电子被氧化的物质。
(1)典型的非金属单质如F2、O2、Cl2、Br2、I2、S等(其氧化性强弱与非金属活动性基本一致)(2)含有变价元素的高价化合物,如KMnO4 KClO3 H2SO4 HNO3 MnO2 等。
(3)金属阳离子如:Fe3+、Cu2+、(H+)(在金属与酸、盐溶液的置换反应,如反应Fe+CuSO4=FeSO4+Cu中,实质上是Cu2+离子氧化Fe原子,Cu2+作氧化剂,Fe是还原剂)综上的还原剂有:氢气(H2),碳(C),一氧化碳(CO)等,还存在活泼的金属单质,如Na,Al,Zn,Fe等;某些非金属单质,如H2,C,Si等.元素(如C,S等);处于低化合价时的氧化物,如CO,SO2等.元素(如Cl,S等);处于低化合价时的酸,如HCl,H2S等.元素(如Fe,S等);处于低化合价时的盐,如Na2SO3,FeSO4等。
其中,强还原剂也是还原剂中的一种,一般氢气(H2),碳(C),一氧化碳(CO),Na,Al,Zn,Fe等都属于强还原剂。
还原剂的作用是:在氧化还原反应中,对氧化物进行还原,使氧化物的价态降低。
还原与氧化反应是同时进行的,即是说,还原剂在与被还原物进行氧化反应的同时,自身也被氧化,而成为氧化物。
所含的某种物质的化合价升高的反应物是还原剂。
还原剂是在氧化还原反应里,失去电子的物质。
一般来说,所含的某种物质的化合价升高的反应物是还原剂。
还原剂本身具有还原性,被氧化,其产物叫氧化产物。
还原与氧化反应是同时进行的,即是说,还原剂在与被还原物进行氧化还原反应的同时,自身也被氧化,而成为氧化产物。


还原氧化铜常用的三种以还原氧化铜常用的三种为标题,写一篇文章。
一、介绍氧化铜氧化铜是一种常见的无机化合物,化学式为CuO,呈黑色或棕色晶体。
它具有良好的导电性和热导性,在工业生产中应用广泛。
然而,在某些情况下,需要将氧化铜还原为纯铜或其他有用的化合物。
下面将介绍三种常用的氧化铜还原方法。
二、还原氧化铜的方法之一 - 热还原法热还原法是将氧化铜加热到一定温度,使其与还原剂反应,从而将氧化铜还原为金属铜。
常用的还原剂有碳、氢气等。
这种方法操作简单,但需要高温和长时间的反应。
三、还原氧化铜的方法之二 - 化学还原法化学还原法是将氧化铜与某些化学物质反应,使其发生还原反应。
常用的化学还原剂有亚硫酸盐、硫化氢等。
这种方法反应速度较快,可以在较低的温度下完成。
四、还原氧化铜的方法之三 - 电化学还原法电化学还原法是利用电解的原理,通过外加电流将氧化铜还原为金属铜。
将氧化铜作为阳极,在电解池中加入适当的电解质,通过电解反应将氧化铜还原。
这种方法具有选择性高、操作简便等优点,广泛应用于实际生产中。
五、总结以上介绍了三种常用的氧化铜还原方法:热还原法、化学还原法和电化学还原法。
这些方法各有优劣,可以根据具体的需求选择合适的方法。
在工业生产中,还原氧化铜是一个重要的环节,对于提高生产效率和降低成本具有重要意义。
六、展望随着科技的不断进步,还原氧化铜的方法也在不断发展和改进。
未来可能会出现更加高效、低成本的还原方法,为相关行业的发展带来更多的机遇和挑战。
希望通过不断的研究和创新,能够找到更好的还原氧化铜的方法,推动相关行业的发展。
七、结语通过本文的介绍,我们了解了三种常用的还原氧化铜的方法:热还原法、化学还原法和电化学还原法。
这些方法在工业生产中具有重要的应用价值,可以实现将氧化铜还原为纯铜或其他有用的化合物。
希望本文对您有所帮助,谢谢阅读!。
高中常见的还原剂一、引言在化学学科中,还原剂是一类能够接受其他物质的电子而使其发生氧化反应的物质。
在高中化学教学中,我们经常会接触到各种各样的还原剂。
本文将介绍高中常见的还原剂,包括其定义、性质、应用及相关实验。
二、常见的还原剂1. 金属金属是最常见的还原剂之一。
金属具有较低的电离能和较高的亲电性,能够很容易地失去电子。
其中,钠、铝和锌等金属在实验室中应用较为广泛。
•钠(Na):钠是一种非常活泼的金属,与许多物质反应迅速。
例如,钠可以与水反应生成氢气和氢氧化钠:2Na + 2H₂O → 2NaOH + H₂•铝(Al):铝也是一种常用的还原剂,在实验室合成过程中经常使用。
例如,铝粉可以与酸反应生成盐和氢气:2Al + 6HCl → 2AlCl₃ + 3H₂•锌(Zn):锌是一种常见的还原剂,可用于还原金属离子。
例如,锌可以与铜离子反应生成铜:Zn + Cu²⁺ → Zn²⁺ + Cu2. 氢气(H₂)氢气是一种重要的还原剂,在化学实验和工业生产中广泛应用。
氢气可以与许多物质发生反应,例如与卤素反应生成相应的氢化物:H₂ + Cl₂ → 2HCl此外,氢气还可以还原金属离子:2H⁺ + 2e⁻ → H₂3. 硫酸亚铁(FeSO₄)硫酸亚铁是一种常见的无机化合物,也是一种重要的还原剂。
在实验室中,硫酸亚铁常被用作滴定试剂和分析试剂。
例如,在滴定分析中,硫酸亚铁可以被用作标准溶液来测定其他溶液中某种物质的含量。
4. 还原糖还原糖是指具有还原性的糖类化合物。
它们能够将其他物质还原为其较低的氧化态。
常见的还原糖包括葡萄糖、果糖和麦芽糖等。
在生物体内,还原糖是一种重要的能量来源。
5. 硫酸亚硫酸钠(Na₂S₂O₃)硫酸亚硫酸钠是一种无色结晶性固体,常用作还原剂和消毒剂。
在化学实验中,硫酸亚硫酸钠可以用来还原其他物质,例如可以将溴水中的溴还原为无色的溴离子:2Na₂S₂O₃ + Br₂ → 2NaBr + Na₂S₄O₆三、实验示例1. 钠与水反应实验材料:钠片、蒸馏水实验步骤: 1. 取一小块钠片; 2. 在实验室通风橱中操作,将钠片放入装有蒸馏水的试管中; 3. 观察并记录反应现象。
硝基还原的方法 1.用金属加盐酸还原,常用金属是锌、铁等,适合对酸稳定的化合物;2.用催化氢化,除了你提到的催化剂,还有Pt、Ni等催化剂,温和还原的话(室温稍加压)可以只还原硝基;3.氢化锂铝,这是比较强的还原剂,除了双键三键之外全部还原。
以上均还原为氨基。
以下是硝基苯的一些特征还原反应:4.用锌在弱酸性条件下还原为苯基羟胺;5.用锌在碱性条件下还原,水溶液得偶氮苯,醇溶液得氢化偶氮苯。
暂时就能想到这些,机理是在是太繁琐了,建议找专业书籍来看。
硝基还原中各种反应过渡态如出现亚硝基偶氮连氨等是不可避免的跟踪反应时通常能看到很多反应点个人认为楼主的情况首选尝试延长反应时间(同时建议降低反应温度),一般继续反应会将这些中间体基本还原彻底如果还不行是不是可以考虑改变氢化条件如催化剂用pd/c(虽然它的活性在碱性条件下会有所降低)供氢体采用肼等虽然加入少量碱性物质如三乙胺、氨甲醇溶液、氢氧化锂等能大大提高催化剂的活性但还原硝基化合物除外虽然加入少量碱性物质如三乙胺、氨甲醇溶液、氢氧化锂等能大大提高催化剂的活性"中的催化剂是指活性镍不是pd/c 活性镍在中性和弱碱介质中能起到良好的催化作用,在弱碱性介质中效果更好Pd/C在酸性和碱性介质中都能起到催化作用,只是碱性条件下活性稍微降低最近看到很多虫子求助氢化的问题,就氢化这个反应我在这里做个肤浅阐述,还请大家批评指正.氢化反应在有机合成化学中发挥了很重要的作用,该反应不仅操作简单,而且后处理相当方便,因此得到了广泛的运用,通过氢化反应可以实现碳碳不饱和键的还原,一系列伯胺的合成,保护基的脱除等等.具体表现:碳碳双键,三键的氢化;腈基,硝基,叠氮基,肟的还原; Cbz,苄基脱除去保护;羟基的脱除或卤素(Cl, Br, I)的脱除以及一些杂芳环的氢化等等。
而氢化所用到催化剂一般为PtO2, Pd/C, Pd(OH)2/C, Raney Ni等。
1. 不饱和键的氢化;双键氢化包括一般烯烃和不饱和酮(酯)的双键的氢化,一般烯烃双键的氢化需要加热加压才能反应.例如:与芳环共轭的烯烃氢化一般需要50-60 psi的压力。