第二章 溶液及相平衡(葛)
- 格式:ppt
- 大小:1.83 MB
- 文档页数:136









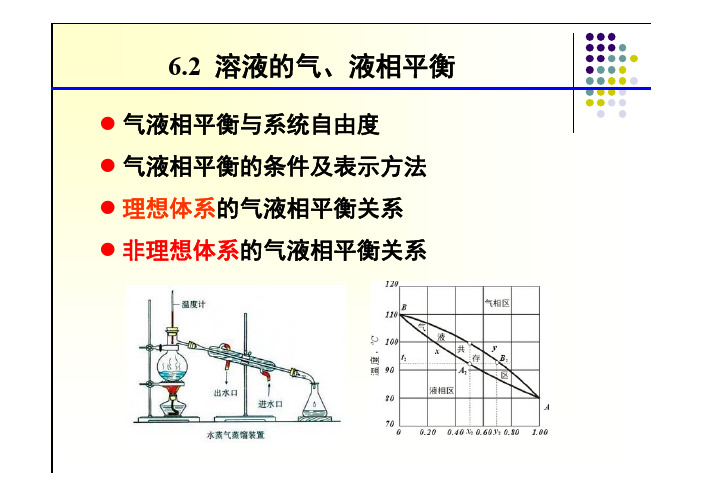
6.2 溶液的气、液相平衡●气液相平衡与系统自由度●气液相平衡的条件及表示方法●理想体系的气液相平衡关系●非理想体系的气液相平衡关系6.2 溶液的气、液相平衡●解决蒸馏问题的基础:气液相平衡(过程的极限)●相平衡关系:不同相物质相接触达到物理平衡共存时各相组成之间的关系。
理想体系●液体混合物分类:(1) 气相是理想气体混合物,液相是理想溶液;(2) 液相是理想溶液,气相是非理想气体混合物;(3) 气相是理想气体混合物,液相是非理想溶液;(4) 气相是非理想气体混合物,液相是非理想溶液。
蒸馏过程涉及气液两相间的传质问题→先讨论传质过程极限(相平衡)问题。
6.2.1 气、液相平衡与系统自由度2+-=φc F ●双组分物系的气液相平衡:C =2,Φ=2●回顾,吉布斯相律:2=F ●蒸馏过程:一般压力恒定→仅有一个自由度。
即压力一定,若所有独立变量中有一个确定,则所有的状态变量均确定。
如若x (或y )一定,则必有唯一对应的y (或x )与T ;若T 一定,则必有唯一的呈平衡的x 和y 存在。
●表示二元气液平衡的参数:汽相组成:y A 、y B液相组成:x A 、x B ;温度、压力:T ,P 6个变量:4个独立变量,规定其中两个→状态即定外界因素,T 、P6.2.2气、液相平衡的条件及表示方法●多组分体系相平衡的条件:所有各相的温度、压力及每一个组分的化学势相等。
Ci p pT T V iL iV L VL ,,2,1 ====μμ●气、液两相平衡条件:pf Kx K y i i i ii i i φγ0==通过热力学方法推导得到:K i —组分i 的气、液相平衡常数;γi —组分i 的活度系数;f i 0—组分i 的标准态逸度;Φi —组分i 的逸度系数;p -系统总压。
●多组分体系相平衡关系式6.2.3 理想体系的气、液相平衡关系气相符合道尔顿(Dalton)分压定律液相全部浓度范围内服从拉乌尔(Raoult )定律三种表达方法:(1)平衡常数法(2)相图法(3)相对挥发度法ii i x K y =xxy )1(1-+=αα理想体系(1)平衡常数法pf K x K y i i i i ii i φγ0==●理想体系:*00.10.1ii i i p f ,,===标准态逸度逸度系数活度系数φγC,i ,pp K *ii 21==*ip ●饱和蒸汽压可由Antoine 公式确定iii *iC T B A p ln +-=注意公式的使用条件!Antoine 常数,查手册确定●相平衡关系:●说明:①理想体系的相平衡常数仅与体系的压力和温度有关。

