Hela细胞培养
- 格式:doc
- 大小:34.50 KB
- 文档页数:1

HALA细胞工程实验培养方案背景知识:Hela Cells是细胞学与医学研究中使用的一种细胞,源自一位美国妇女海莉耶塔·拉克斯(Henrietta Lacks)的子宫颈癌细胞的细胞系。
这名美国妇女在1951年死于该癌症。
为了让拉克斯保持匿名,此细胞株原宣称是依“Helen Lane”命名。
HeLa细胞系被视为“不死的”(即不同于其他一般的人类细胞,此细胞株不会衰老致死,并可以无限分裂下去),至今都被不间断的培养。
此细胞系跟其他癌细胞相比,增殖异常迅速。
海拉细胞系被George Gey分送给众研究单位(并未通知拉克斯本人也未得到她的许可),并用作癌症模式细胞研究。
HeLa细胞系也被用作研究细胞信号传导。
海拉细胞系是被人类乳突病毒第18型转化的,和正常子宫颈细胞有许多不同。
已证实海拉细胞系难以控制。
此细胞系有时会污染同一实验室的其他细胞培养物,干扰生物学的研究。
污染程度难以估计,因为研究人员很少检定已确立细胞系的本质和纯度。
据说有相当数目的体外细胞系其实就是HeLa细胞系,因为原先的细胞株已被快速增殖的HeLa细胞系污染物取代了。
实验原理:(1)细胞冻存及复苏的基本原则是慢冻快融,实验证明这样可以最大限度的保存细胞活力。
目前细胞冻存多采用甘油或二甲基亚砜作保护剂,这两种物质能提高细胞膜对水的通透性,加上缓慢冷冻可使细胞内的水分渗出细胞外,减少细胞内冰晶的形成,从而减少由于冰晶形成造成的细胞损伤。
复苏细胞应采用快速融化的方法,这样可以保证细胞外结晶在很短的时间内即融化,避免由于缓慢融化使水分渗入细胞内形成胞内再结晶对细胞造成损伤。
(2)体外培养过程中,随着培养时间的延长,细胞的分裂繁殖,培养物越来越大长满培养空间并因接触抑制而生长缓慢,此时须将培养物分割成小的部分,重新接种到另外的培养器皿中,这个过程称为传代(passage)或再培养(subculture)意义:①细胞生长、增殖的需要;②扩大培养,获得大量同种细胞,为后续研究做准备。

引用格式:毕禄莎, 汪丹, 李昊, 等. HeLa 细胞内及组织内纳米碳点含量测定[J]. 中国测试,2023, 49(11): 76-82. BI Lusha, WANG Dan, LI Hao, et al. Measurement of nano-carbon dots in HeLa cells and tissues[J]. China Measurement & Test, 2023, 49(11): 76-82.DOI: 10.11857/j.issn.1674-5124.2023040035HeLa 细胞内及组织内纳米碳点含量测定毕禄莎1, 汪 丹2, 李 昊3, 赵梦凡4(1. 西南医科大学附属医院药学部,四川 成都 646000; 2. 成都大学,四川 成都 610106;3. 西南医科大学附属医院临床研究中心,四川 成都 646000;4. 西南医科大学附属医院乳腺外科,四川 成都 646000)摘 要: 为解决纳米碳点无对照品而难以定量的缺陷,该文利用碳点稳定的荧光性,以纯荧光化合物为“替代对照品”,建立碳点的细胞内及组织内含量测定方法。
将具有良好成像性能的碳点作为候选碳点,以甲酚紫、罗丹明6G 为对照品,建立候选碳点及其叶酸偶联物HeLa 细胞内以及生物组织中的含量测定法及其方法学验证。
结果表明,三种候选碳点DCCDs 、ACUCDs 、UCPG-Fe 及其叶酸偶联物在HeLa 细胞内和组织内,均在一定浓度范围内具有良好的线性关系(r 2=0.993 3~0.999 2),平均回收率为86.61%~102.5%,精密度RSD 在2.82%~3.91%之间。
以此分别检测出细胞内DCCDs 和FA-DCCDs 在摄取时间3 、6、9 、12 h 的纳米碳点含量在0.125 5~0.266 5 μg/mL 之间及0.891 7~1.239 μg/mL 之间;肝、肾组织内DCCDs 在摄取时间20、30、40、50、60、70 min 的纳米碳点含量分别在1.132~1.756 μg/mL 之间及0.335 8~0.704 3 μg/mL 之间。




HeLa细胞株在生物学与医学研究中,HeLa细胞是指源自一名美国妇女的子宫颈癌细胞的细胞。
这名美国妇女名叫Henrietta Lacks,于1951年死于癌症。
本来为了让Lacks保持匿名,此细胞株宣称是依“Helen Lane”命名。
HeLa细胞株被George Gey分送给众研究单位(而未通知Lacks本人也未得到她的许可),因用作癌症研究而广为流传。
至今已被视为“不死的”,也就是说此细胞株(不同于其他人类细胞)不会老死,而且可以不限次数的分裂下去,而且已被培养出一个不间断的系列。
从1951年至今,Hela细胞已经培养了50多年,分裂了18000次以上仍然没有停止的迹象。
此细胞株即使和其他癌细胞相比,增殖依然异常迅速。
一般两天左右即可长到35000000~40000000个。
然而,由于当初采集细胞时并没有征得患者或家属的同意,HeLa细胞株广泛应用引发了一系列的医学伦理问题。
2009年,Rebecca Skloot将这个具有传奇性的故事编撰成书,书名为《永生的海拉》[1]。
此细胞株被用作“model cancer cells”来研究细胞信号传导(cellular signal transduction)。
HeLa细胞株是由正常子宫颈细胞被一种人类乳突状瘤病毒(Human Papillomavirus 18 或HPV18)转型成癌细胞的,而且和正常子宫颈细胞有许多不同。
目前已经证实HeLa细胞株难以控制。
此细胞株有时会污染同一实验室的其他细胞培养环境(cell culture),进而影响生物研究。
由于研究人员很少检查已确立的细胞株的本质和纯粹度,因此污染的程度不明。
据说有相当数目的“人造”细胞株其实是HeLa细胞株,也就是说原来的细胞株被一群受到HeLa细胞株污染的快速增殖细胞淹没了。
有的学者已经认为此细胞株其实是一新的品种,因为此细胞株能自行繁殖和散布。
在1991年此细胞株被命名为Helacyton gartleri。

利用MTT法测定不同浓度顺铂对Hela细胞增殖的抑制效果摘要:目的:观察不同浓度顺铂对Hela细胞增殖的抑制作用,并探讨出最适合用于抑制Hela增殖的浓度梯度。
方法:采用MTT比色法对经不同浓度顺铂处理后的Hela细胞进行测定,检测不同浓度顺铂对细胞增殖的抑制情况。
结果:0.3~1μg/mL浓度的顺铂对Hela细胞的增殖主要起到促进作用;1~7.5μg/mL梯度内的顺铂作用不清晰,而7.5~80μg/mL这一浓度梯度内的顺铂则都是起抑制作用,且抑制作用随浓度升高而增强;只是在7.5~25μg/mL这一浓度梯度内,不同浓度顺铂间的抑制作用存在较大差异,而在25~80μg/mL这一范围内顺铂的抑制作用相差不大。
结论:高浓度顺铂对Hela细胞的增殖确实有抑制作用,而低浓度顺铂则不然,所以通过归结之后可知,较适合用于抑制Hela细胞增殖的顺铂梯度应在10~25μg/mL之间,可以是10μg/mL,15μg/mL,20μg/mL,25μg/mL。
关键词:MTT法,顺铂,Hela细胞,增殖,抑制MTT全称为3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-di-phenytetrazo-liumromide,汉语化学名为3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,是一种黄颜色的染料。
MTT比色法,是一种检测细胞存活和生长的方法;其检测原理是:外源性MTT在哺乳类动物类活细胞线粒体中的琥珀酸脱氢酶的作用下还原为水不溶性的蓝紫色(或蓝色)结晶甲瓒(Formazan),并沉积在细胞中;在通常情况下,甲臜生成量与活细胞数成正比[1]。
二甲基亚砜(DMSO)能溶解细胞中的甲瓒,因此用酶联免疫检测仪在490nm或570nm波长处测定其光吸收值,可间接反映活细胞数量。
而死细胞中不含琥珀酸脱氢酶,因此加入MTT 不会有反应。
该方法已广泛用于一些生物活性因子的活性检测、大规模的抗肿瘤药物筛选、细胞毒性试验以及肿瘤放射敏感性测定等。


实验十三培养细胞的形态观察和计数【实验目的】了解培养中的动物细胞的一般形态和生长状态;掌握细胞计数的基本方法。
【实验用品】一、材料和标本培养中的HeLa细胞(人子宫颈癌上皮细胞)、NIH3T3(小鼠成纤维细胞)、HL一60细胞(人白血病细胞)二、器材和仪器倒置显微镜、细胞计数板、普通光学显微镜、乳头吸管三、试剂 0.3%台盼兰染液、0.25%胰蛋白酶一0.02%EDTA混合消化液【实验内容】一、培养细胞的形态观察(一)原理体外培养的细胞主要有两种状态。
一种是能贴附在培养支持物上的细胞,如HeLa细胞、NH3T3等,叫贴壁型细胞,体外培养的细胞绝大多数都属于这种细胞。
另一种细胞并不贴附在容器的壁上,而是悬浮在培养液中生长,如HL—60,叫做悬浮型细胞,这类细胞主要是血液原性或癌原性的细胞。
(二)操作l.将细胞培养瓶从37℃二氧化碳培养箱(或温箱)中取出,注意观察细胞培养液的颜色和清澈度。
然后,将细胞培养瓶平稳地放在倒置显微镜载物台上,此时应注意不要将瓶翻转,也不要让瓶内的液体接触瓶塞或流出瓶口。
2.打开倒置镜光源,通过双筒目镜将视野调到合适的亮度。
3.调节载物台的高度进行对焦,在看到细胞层之后,再用细调节器将物像调清楚,注意观察细胞的轮廓、形状和内部结构。
在观察时,最经常使用的是10X 物镜。
(三)结果贴壁细胞一般有两种形状,即上皮细胞形和成纤维细胞形细胞。
上皮细胞形细胞呈扁平的不规则多角形,圆形核位于中央,生长时常彼此紧密连接成单层细胞片,如HeLa细胞。
成纤维细胞形细胞形态与体内成纤维细胞形态相似,胞体呈梭形或不规则三角形,中央有圆核,胞质向外伸出2~3个长短不同的突起,细胞群常借原生质突连接成网,如 NIH3T3(参照照片)。
贴壁细胞在生长状态良好时,细胞内颗粒少,看不到有空泡,细胞边缘清楚,培养基内看不到悬浮的细胞和碎片,培养液清澈透明,而当细胞内颗粒较多,透明差,空泡多时,表明生长较差。

Hela细胞的传代及HE染色生93沈睿2009012372同组:蔡珑维实验日期:2011年11月10日一.实验原理1.HE染色HE染色中的H指苏木精(Hemataxyln),E指伊红(Eosin)。
苏木精从苏木中提取,本身不是染料,不能直接染色,必须经氧化才能染色。
可以在空气中自然氧化,但需时很长,所以一般都是加氧化剂(如碘酸钠)氧化。
同时,被染材料又须经媒染剂作用后才有着色能力,所以在配制苏木精染液时,都加有媒染剂。
苏木精液主要着染细胞核。
伊红为酸性染料,可以将细胞质和细胞间质染为粉红色。
一般用0.5%伊红/70%乙醇液或1%伊红水溶液。
由于两种染液染色部位不同,所以HE染色法又称为双重对比染色法。
2.消化液消化液由0.25%胰蛋白酶和0.02%EDTA溶液配成。
胰蛋白酶可以解离贴壁细胞,EDTA 可以螯合Ca2+和Mg2+,当着两种离子浓度下降时,细胞贴壁能力就减弱。
3.固定剂固定剂是固定样品的化学试剂。
可以快速穿过细胞质膜,并将细胞中的生物大分子固相化,从而使死细胞的结构接近于原生活状态。
本实验所用固定剂为甲醛溶液。
4.DMEM培养基本实验使用的是高糖型培养基,有利于细胞停泊在一个位置生长,适合生长较快、附着较困难的肿瘤细胞。
培养基中10%的血清可以提供一些基本的营养物质(氨基酸、维生素、无机盐等)、激素、生长因子等,还可提供促接触和伸展因子使得细胞贴壁免受机械损伤,对培养中的细胞起到一定保护作用。
培养基中还添加了青霉素、链霉素以及酚红。
两种抗生素的加入可以基本保证培养中的细胞免受细菌的感染;而酚红则因为培养基的pH在7.2-7.4之间,能呈现红色,在以后的培养中可以通过观察培养基的颜色来确定是否需要换培养基,且可知细胞的生长状况。
二.实验步骤(一)细胞传代1.镜检,观察并记录细胞状态,最好是铺满皿底80%-90%的生长旺盛的时期。
2.吸弃旧培养基,加入1mL PBS溶液洗去残余培养基,吸弃PBS。
实验题目:细胞传代实验材料:细胞培养箱,安全柜,手套,酒精灯,吸管,移液管(5ml,10ml),50mL离心管,培养瓶(25cm2),移液枪,离心机,计时器,真空泵,抽滤瓶,水浴锅,记号笔,冰箱实验原理:细胞在培养瓶长成致密单层后,已基本上饱和,为使细胞能继续生长,同时也将细胞数量扩大,就必须进行传代(再培养)。
传代培养也是一种将细胞种保存下去的方法。
同时也是利用培养细胞进行各种实验的必经过程。
实验步骤:以Hela细胞为例说明具体实验操作步骤一.实验前准备工作:进细胞室先换拖鞋,带上手套75%的酒精进行表面消毒;检查酒精灯有无95%酒精,电枪有无电;将实验过程中用到的实验器材(包括培养瓶、50mL离心管、移液管)放于安全柜里,实验前安全柜开紫外照15~20min;将细胞培养液放于37℃水浴中预热;抽滤瓶与真空泵相连,废弃缸套袋。
二..准备实验:先关闭紫外等30min后再进行实验;75%酒精喷于纸上,将超净工作台仔细擦试干净;点燃酒精灯,小心的将细胞从孵箱中拿出。
1.吸除旧的DMEM培养液:拿出吸管(要拿吸管的上端),插入与抽滤瓶相连的橡胶管中,在酒精灯外焰灼烧灭菌,细胞培养瓶倾斜将吸管插入瓶底部一角,吸出旧的DMEM培养液,将用后的吸管弃于废弃缸里。
注意:一定要吸除干净,否则消化时间过长,细胞损伤过大。
2.消化:拿出5mL移液管,插入电枪中,酒精灯过火灼烧,吸取2mL 0.25%胰酶加入培养瓶中,混匀,放于37℃孵箱中消化5-6min。
取下用后的移液管。
3.中和:从孵箱中拿出培养瓶,显微镜下观察细胞是否被完全消化下来,5mL灭菌后移液管加入3mLDMEM培养液终止消化。
反复吹打混匀;吸出中和液转移到50mL离心管中。
4.离心收集细胞:配平后离心200×g,3min。
将新的DMEM培养液加入新培养瓶中,2mL/瓶(培养瓶底面积为25cm2)。
5.重悬细胞:离心后吸出中和液,(先吸出表面泡沫,一定注意不要吸出细胞)。
《HeLa细胞长期传代过程中基因组突变动态变化》篇一一、引言HeLa细胞,作为一种人类宫颈癌细胞系,自其发现以来便在生物学、医学和遗传学等多个领域中发挥着重要作用。
随着科研技术的不断进步,HeLa细胞因其易于培养、增殖迅速等特点,被广泛用于癌症研究、药物筛选、基因编辑等多个领域。
然而,在长期传代过程中,HeLa细胞的基因组会发生一系列的突变,这些突变不仅影响着细胞的生物学特性,还可能对相关研究产生深远的影响。
因此,研究HeLa细胞长期传代过程中基因组突变的动态变化具有重要意义。
二、HeLa细胞的传代与基因组突变HeLa细胞的传代是指将细胞在体外进行连续培养,使其不断分裂、增殖的过程。
在传代过程中,由于各种内外因素的影响,HeLa细胞的基因组会发生突变。
这些突变包括点突变、插入/删除突变、染色体变异等,它们会导致基因功能的改变、表达水平的改变以及蛋白质结构的改变等。
三、基因组突变的动态变化1. 突变类型与频率在HeLa细胞长期传代过程中,不同类型的基因组突变会发生。
点突变是最常见的突变类型之一,它可能导致基因编码区的氨基酸序列发生改变,从而影响蛋白质的功能。
此外,插入/删除突变、染色体变异等也会发生。
随着传代次数的增加,突变的频率也会逐渐增加。
2. 突变的时间与空间分布基因组突变的分布具有时间和空间上的特点。
在传代初期,由于细胞适应新的环境,突变的数量较少且多为适应性突变。
随着传代的进行,突变逐渐积累,并且可能会出现一些非适应性突变。
这些突变在细胞内的分布也会发生变化,有些突变可能发生在特定的基因区域或染色体区域。
3. 突变对细胞生物学特性的影响基因组突变会影响HeLa细胞的生物学特性。
例如,某些突变可能导致细胞增殖速度加快、侵袭性增强等。
这些改变可能会使HeLa细胞更适应体外培养环境,从而在传代过程中得以保留和传播。
四、研究方法与结果为了研究HeLa细胞长期传代过程中基因组突变的动态变化,可以采用多种方法。
hela细胞电转条件解释说明以及概述1. 引言1.1 概述在生物学研究领域,细胞是一个重要的研究对象。
近年来,为了更深入地了解细胞的功能和特性,科学家们不断发展新的实验技术和方法。
其中,电转技术作为一种有效的基因转染手段,在细胞研究中得到了广泛应用。
本文将对Hela细胞进行电转实验条件进行解释说明,并介绍其概述、历史、特点、应用价值和争议等方面内容。
同时,还将对电转技术的原理、过程、条件要求及其在细胞研究中的应用和发展趋势进行简要介绍。
1.2 文章结构本文分为五个主要部分:引言、Hela细胞简介、电转技术简介、Hela细胞的电转实验条件解释说明以及结论与展望。
引言部分主要对文章进行概述,并介绍电转技术在生物学研究中的重要性。
Hela细胞简介部分将详细介绍Hela细胞的定义和历史,以及其特点和应用领域。
同时,还将探讨Hela细胞所带来的价值和争议。
电转技术简介部分将对电转技术的原理、背景及其在细胞研究中的过程、条件要求和发展趋势进行简要介绍。
这一部分将为后续Hela细胞的电转实验条件解释说明提供基础知识。
Hela细胞的电转实验条件解释说明部分将解析具体的实验操作和参数优化,包括转染基因的选择与构建、细胞培养条件及支持物质控制要点以及电转参数优化与影响因素分析等内容。
结论与展望部分将对全文进行总结,并提出未来研究的展望与建议。
通过本文的研究,我们可以更全面地理解Hela细胞的特性和应用,并为相关领域的进一步研究提供参考依据。
1.3 目的本文旨在详细介绍Hela细胞在电转实验中所需的条件,通过对电转技术原理和Hela细胞特点的阐述,提供实验操作指南,并为该领域未来研究方向提供展望和建议。
同时,希望通过本文使读者们能够更好地了解和应用电转技术在细胞研究中的意义和作用。
2. Hela细胞简介:2.1 定义和历史:Hela细胞是一种人类宫颈癌细胞系,最早由美国科学家乔治·格威普斯(George Gey)在1951年从艾尔中心查理医院的病患名叫海拉(Henrietta Lacks)的宫颈癌组织中分离出来。
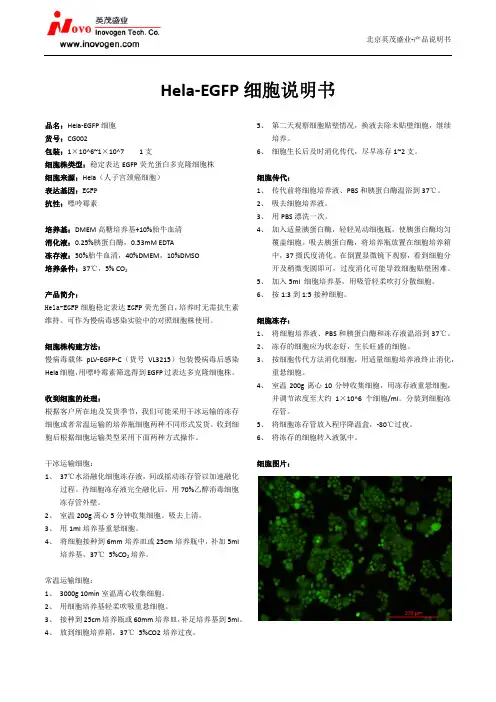
Hela细胞(人工颈癌细胞)
实验准备工作
1、Hela细胞(人宫颈癌细胞)
2、细胞培养试剂:DMEM培养基,胎牛血清,青霉素,链霉素,0.25%胰蛋白酶(含0.02%
的EDTA),PBS等
3、培养器具:培养瓶、烧杯、镊子、酒精棉、离心管、改良吸管、胶头吸管、细胞计数板、
毛细管等。
4、实验设备:二氧化碳培养箱、光学显微镜、无菌操作台、恒温水浴锅、酒精灯。
5、细胞冻存和复苏的方法
冻存液:含10%血清的完全培养基和5%-10% DMSO
取对数生长期细胞,精胰酶消化后加入适量冻存液,用吸管吹打制成细胞悬液(1×106~5×106细胞/ml),加入1ml细胞于冻存管中,密封后标记细胞名称和冷冻日
期。
复苏细胞是从零下80℃冰箱或液氮罐中取出冻存管,迅速投入37℃水浴中,使其融化(1分钟左右),用培养集缓慢稀释至原体积的10倍以上,大部分细胞完全贴
壁后(4~6小时),吸取含有冻存液的培养基,并换成完全培养基。
细胞复苏实验步骤
1. 从零下80℃冰箱或者液氮罐中取出冷冻管,迅速投入37℃水浴中,使其融化(1分钟左右)。
2.培养基缓慢稀释至原体积的10倍以上。
3.1低速离心10分钟,吸去上清,加入新鲜的培养基培养刚复苏的细胞。
3.2六个小时细胞完全贴壁后吸去含有冻存液的培养基并换成完全培养基。
6、细胞传代实验步骤
取密度80%左右的Hela细胞,吸去旧的培养基,用PBS或者Trypsin消化液润洗细胞以减少残留的血清对Trypsin的抑制作用。
吸去PBS或者Trypsin,加入Trypsin消化液,于37℃消化2~4分钟,于倒置显微镜下观察,当细胞之间出现间时或者变圆时,吸掉Trypsin消化
液。
(也可以直接加入适量含血清的新鲜培养基终止Trypsin的消化作用
并进行吹打分离细胞,消化细胞时应静置以避免漂浮的细胞滚动成团) 加入适量新鲜培养基,用移液器上下吹打数次打散细胞团块以尽可能形成单细胞悬液,吹打均匀后,按照稀释比例转移至新的培养瓶中,补充
完全培养基并以正常培养条件培养。