己二酸的绿色合成实验报告
- 格式:docx
- 大小:16.12 KB
- 文档页数:2

己二酸的制备一.实验目的1.学习己二酸制备的原理和方法2.加强重结晶的操作安全须知高锰酸钾是强氧化剂,不能将它与醇,醛等易氧化的有机化合物保存在一起。
二.反应式三.药品环己酮4ml(3.79g,0.039mol) 0.3mol/L氢氧化钠 100ml 高锰酸钾 12.6g(0.08mol)亚硫酸氢钠浓盐酸四.试验步骤(1)在锥形瓶内放入12.6g(0.08mol)高锰酸钾,100ml 0.3mol/L 氢氧化钠和4ml环己酮(3.79g,0.039mol)分批加入。
阻止反应太剧烈,放热过大。
注意温度,此反应是放热反应,反应开始后会使混合物超过45摄氏度,假如在室温下反应开始5min后,混合物温度还不能上升至45摄氏度,则可小心加热至40摄氏度,是反应开始。
(2)如反应温度超过45摄氏度时,应用冷水浴适当冷却,然后保持温度45摄氏度25min,再在石棉网上加热至微沸5min。
此时要不断振荡或搅拌,否则极易爆沸冲出容器(3)取1滴反应混合物放在滤纸上检查高锰酸钾是否还存在,无论有无在棕色二氧化锰周围出现紫色环,都需加入1药匙固体亚硫酸氢钠直至点滴试验呈负性。
(4)抽气过滤反应混合物,用水充分洗涤滤饼,最好是将滤饼移于烧杯中,经搅拌后抽滤。
滤液置于烧杯中,在石棉网上加热浓缩到20ml左右,用浓盐酸酸化溶液ph=1-2,在多加2ml浓盐酸。
冷却后过滤,为了提高收得率,最好用冰冷水冷却溶液以降低己二酸在水中的溶解度,己二酸于不同温度下在水中的溶解度不同。
(5)用水重结晶时加活性炭脱色,得白色晶体即为己二酸,烘干,称重。
五.实验结果产率=【3.1/(0.039x146)】x100%=54.4%六.思考题1.写出环己酮氧化成己二酸的平衡方程式。
并计算出此反应理论上所需高锰酸钾的用量。
n(高锰酸钾)=2n(环己酮)=2x0.039=0.078mol2.用碱性高锰酸钾氧化2-甲基环己酮时,预期会得到那些产物?(1)6-庚酮酸(2)2-甲基己二酸3.除了用环己酮为原料制备己二酮外,能否选用环己醇或环己烯为原料制备己二酸?如果能,请写出反应式,设计你的方案。

1SSN1672-4305 实验室科学第19卷第5期2016年10月CN12-1352/N LABORATORY SCIENCE Vol. 19 No. 5 Oct. 2016己二酸的绿色合成李公春,鞠志宇,张伟,孙婷,吴长增(许昌学院化学化工学院,河南许昌461000)摘要:在钨酸钠、磺酸水杨酸和十六烷基三甲基溴化铵催化下,分别以环己烯、环己醇或环己酮为原料,用30%过氧化氢作为氧化剂,回流反应7h,用冰水冷却后,抽滤,得到己二酸,产率分别为40. 4%、54. 4%和71. 6%。
己二酸的结构由红外光谱确定,并探讨了合成己二酸的反应机理。
实验给出了三种绿色合成己二酸方法,适合开设本科生实验内容。
关键词:过氧化氢;己二酸;合成;绿色化学中图分类号:G642;O621.3 文献标识码:A doi:10.3969/j.issn.1672-4305.2016.05.004Green synthesis of hexane diacidL1 Gong-chun,JU Zhi-yu,ZHANG Wei,SUN Ting,WU Chang-zeng (College of Chemistry and Chemical Engineering,Xuchang University,Xuchang461000,China) Abstract :Hexane diacid was synthesized by sodium tungstate and sulfosalicylic acid catalyzed oxidation cyclohexene,cyclohexanol or cyclohexanone with 30% hydrogen peroxide in the presence of hexa-decyl trimethyl ammonium bromide as a phase transfer catalyst,refluxing for7h,filtration after cooling by ice water.The yields are40. 4%,54. 4%and71. 6%respectively.The structure of hexane diacid is confirmed by infrared spectroscopy,and reaction mechanisms are discussed.There are three methods ofgreen synthesis of adipic acid,they are suitable for students’experiment.Key words :hydrogen peroxide;hexane diacid;synthesis;green chemistry己二酸又称肥酸,是一种重要的有机二元羧酸,主要用于制造尼龙66纤维和尼龙66树脂,聚氨酯 泡沫塑料,在有机合成工业中,为己二腈、己二胺的 基础原料,同时还可用于生产润滑剂、增塑剂己二酸 二辛酯,也可用于医药等方面,用途十分广泛。

【精品】实验12. 己二酸的制备一、实验目的:1.掌握己二酸的制备方法;2.学习己内酰胺的化学反应转化。
二、实验原理:1.己内酰胺(C6H9NO)通过氧化加水解可以制备己二酸(HOOC(CH2)4COOH)并伴随着氨气的生成,反应方程式为:C6H9NO+3O2+3H2O→HOOC(CH2)4COOH+NH3↑2.氧化过程是通过过氧化氢/铕离子或者过硫酸铵等氧化剂来实现的。
三、实验操作:1.植入灭菌棉,并称取50mL锥形瓶一只,加入6g吉兰酸和1.8g锌粉。
2.制备己内酰胺,称取9.6g辛醇(C8H18O)放入25mL的三口瓶中,加入9.5mL浓氨水,在搅拌的同时,缓缓加入4mL硝酸一水合物(HNO3 H2O),保持温度在5-10℃。
待搅拌反应约20分钟后,过滤得清晰的液体,称取其中的15mL,加入50mL锥形瓶中。
3.加热反应,向锥形瓶中加入15mL过氧化氢/氨水(30%),盖上橡胶塞,用醇灯加热使温度达到60℃,稍加搅拌。
4.添加潮气剂,加入50mL蒸馏水和少量碳酸钠。
反应结束后,转移液体至250mL锥形瓶中。
5.中和和除杂,用0.5mol/L盐酸加入至中性,过滤后倒弃,再加入0.5mol/L氢氧化钠调节pH至7-8,然后再次过滤。
6.干燥,用低温干燥将滤液干燥,分得1.8-2.0g淡黄色非结晶粉末己二酸。
7.收集氨气,将刚刚反应过程中,在黑色瓶中收集的氨气,用盐酸中和,常温常压下固定氨气的含量,根据氨气的含量和体积,可由理想气体状态方程计算出实际反应中生成的氨气体积,进而计算出定量的己二酸产率。
四、实验注意事项:1.吉兰酸和锌粉必须干燥且保存在干燥器或是防潮箱中;2.反应时必须始终保持灭菌;3.制备己内酰胺时,氨气过多需要适量放到通风处去;4.收集的氨气不宜长时间放置,应尽快加入盐酸中和;5.干燥时,不宜用高温急干,否则会使产物质量受到影响。

己二酸的制备
[实验目的]
1.学习用环己醇氧化制备己二酸的原理和方法;
2.掌握搅拌、浓缩、过滤等基本操作。
[实验原理]
[实验装置]
电动搅拌装置
[课前预习]
机械搅拌减压过滤
[实验步骤]
1.将装有5mL 10%氢氧化钠溶液和50mL水的250mL烧杯安装在磁力搅拌器上。
启动搅拌,加入9.1g高锰酸钾。
待高锰酸钾溶解后用滴管慢慢加入2.1mL环己醇。
控制滴速以保持反应温度在45℃左右。
滴完后继续搅拌至温度开始下降。
用沸水浴加热烧杯5分钟使反应完全并使二氧化锰沉淀凝结。
用玻璃棒蘸一滴反应混合物点到滤纸上做点滴试验,如有高锰酸盐存在,则在二氧化锰斑点的周围出现紫色的环,可向反应混合物中加少量亚硫酸氢钠固体至点滴试验无紫色的环出现为止。
趁热抽滤混合物,用少量热水洗涤二氧化锰滤渣3次,合并滤液与洗涤液,用约4mL 浓盐酸酸化,至溶液呈强酸性,然后小心加热,浓缩至约14~15mL左右,冷却后抽滤,收
集晶体,干燥后重约为1.8~2.2g,产率为61.6~75.3%,m.p.151~152℃。
本实验需3~4小时。
[注意事项]
1.己二酸在水中的溶解度(g/100mL水)为1.4415;3.0834;8.4650;34.170;94.880;100100,所以洗涤晶体的滤液或重结晶滤出晶体后所得母液若经浓缩后再冷却结晶,还可回收一部分纯度较低的产品。
[思考题]
1.如果滴加环己醇的速度过快,会产生什么后果?
2.在安装装置过程中需要注意哪些问题?。


己二酸的制备一、实验目的:1.学习用环己醇氧化制备己二酸的原理和方法;2.学习重结晶、减压过滤等操作。
二、实验原理: OHKMnO4OH -HO 2C(CH 2)4CO 2H + 32+MnO 2388氧化剂可用浓硝酸、碱性高锰酸钾或酸性高锰酸钾。
本实验采用碱性高锰酸钾作氧化剂。
三、主要原料、产品和副产物的物理常数【试剂】环己醇;高锰酸钾;碳酸钠;亚硫酸氢钠;浓硫酸;活性炭;10%的碳酸钠溶液M bp mp d n s 环己醇 100 161 25 0.9624 1.4641 微溶 己二酸 146 265 152 1.360 / 微溶四、实验装置本实验在烧杯中进行;普通过滤与热过滤均用抽滤装置。
五、实验步骤:1、投料在烧杯中,加入 2.6mL 环己醇和自配的碳酸钠溶液(3.8 g 碳酸钠溶于35mL 温水),搅拌下,分批小量加入11.2g 高锰酸钾粉末。
加入高锰酸钾时,控制温度在30-40o C,加完后继续搅拌至反应液温度不在上升为止。
(变为褐色,然后在50-60℃水浴中加热搅拌,至反应完全。
若长时间反应不完全,可加少量固体亚硫酸氢钠。
2、抽滤、酸化、脱色、抽滤趁热抽滤混合物,用10 ml10%的碳酸钠溶液洗涤滤渣,合并滤液。
在滤液中加入少量活性炭,煮沸5min,趁热抽滤。
冷至室温,慢慢向滤液中加入浓硫酸酸化,使溶液呈强酸性。
冷却,结晶。
得产品。
熔点151-152℃。
六、实验注意事项:1. 制备羧酸采取的都是比较强烈的氧化条件,一般都是放热反应,应严格控制反应温度,否则不但影响产率,有时还会发生爆炸事故;2.环己醇常温下为粘稠液体,防止转移中损失。
3. 注意反应终点的判断。
七、思考题:1 反应完后如果反应混合物呈淡紫红色,为什么要加入亚硫酸氢钠?2. 为什么要控制好反应温度?。

实验2-3 己二酸的制备
1、制备已二酸时,为什么必须严格控制滴加环已醇的速度和反应的温度?
答:该反应为强放热反应,若环已醇的滴加速度太快,反应温度上升太高,易使反应失控;若环已醇的滴加速度过慢,反应温度太低,则反应速度太慢,致使未作用的环已醇积聚起来。
2、用KMnO4法制备已二酸,怎样判断反应是否完全?若KMnO4过量将如何处理?
答:用玻璃棒蘸取少许反应液,在滤纸上点一下,如果高锰酸钾的紫色完全消失,说明反应已经完全。
若KmnO4过量,可用少量NaHSO3还原。
3、用同一量筒两区硝酸和环己醇,行吗?为什么?
答:不行,因为环己醇和硝酸相遇,两者会发生剧烈的反应,甚至发生意外。
4、本实验为什么必须控制反应温度和环己醇的滴加速度?
答:该反应为强放热反应,若环己醇的滴加速度太快,反应温度上升太高,易使反应失控;若环己醇的滴加速度过慢,反应温度太低,则反应速度太慢,致使未作用的环己醇积聚起来。
5、在环己醇中加1ml水有什么作用?
答:一是减少环己醇因粘稠带来的损失,二是避免反应过剧。
6、为什么有些实验在加入最后一个反应物前应预先加热?为什么一些反应剧烈的实验开始时加料速度较慢,待反应开始后可适当加快加料速度?
答:许多有机实验是放热反应,但反应的诱导又必须一定的温度,所以未加最后一个反应物前要预先加热。
有些放热反应有一定的诱导时间,而反应一旦开始则猛烈进行,所以反应开始阶段,滴加速度必须慢一些。

已二酸的制备的实验报告一、实验目的1、学习环己醇氧化制备己二酸的原理和方法;2、掌握浓缩、过滤及重结晶等操作技能二、实验原理三、实验药品及其物理常数环己醇:2g2.1ml(0.02mol);高锰酸钾6g(0.038mol);0.3N氢氧化钠溶液50ml;亚硫酸氢钠;浓盐酸四、主要仪器和材料水浴锅三口烧瓶(100 mL、19#x 3恒压滴液漏斗空心塞(14#)球形冷凝管(19#) 螺帽接头(19#, 2只)温度计(100C)布氏漏斗吸滤瓶烧杯冰滤纸水泵等.氧化剂可用浓硝酸、碱性高锰酸钾或酸性高锰酸钾。
本实验采用碱性高锰酸钾作氧化剂五、操作步骤(1)向250ml烧杯内加入50ml 0.3N氢氧化钠溶液,置于磁力搅拌上;( 2)边搅拌边将6g 高锰酸钾溶解到氢氧化钠溶液中;(3)用滴管滴加2.1ml环己醇到上述溶液中,维持反应物温度为43~ 47C°( 4)当醇滴加完毕且反应混合物温度降低至43C左右时,沸水浴将混合物加热,使二氧化锰凝聚。
( 5)在一张平整的滤纸上点一小滴混合物以试验反应是否完成,如果观察到试液的紫色存在,那么可以用少量固体亚硫酸氢钠来除掉过量的高锰酸钾。
(6)趁热抽滤,滤渣二氧化锰用少量热水洗涤3次(每次2 mL),每次尽量挤压掉滤渣中的水分;(7)合并滤液和洗涤液,用4ml 浓盐酸酸化至pH2.0;(8)小心地加热蒸发使溶液的体积减少到10ml 左右,冷却,分离析出的己二酸。
(9)抽滤、洗涤、烘干、称重、计算产率。
(10)测量产品的熔点和红外光谱,并与标准光谱比较。
六、操作要点及注意事项1. KMnO4要研细,以利于KMnO4充分反应。
2. 滴加:本实验为强烈放热反应,所以滴加环己醇的速度不宜过快(1-2滴/ 秒),否则,因反应强烈放热,使温度急剧升高而引起爆炸。
3.严格控制反应温度,稳定在43〜47C之间。
4•反应终点的判断:(1)反应温度降至43C以下。
(2)用玻璃棒蘸一滴混合物点在平铺的滤纸上,若无紫色存在表明已没有KMnO4。
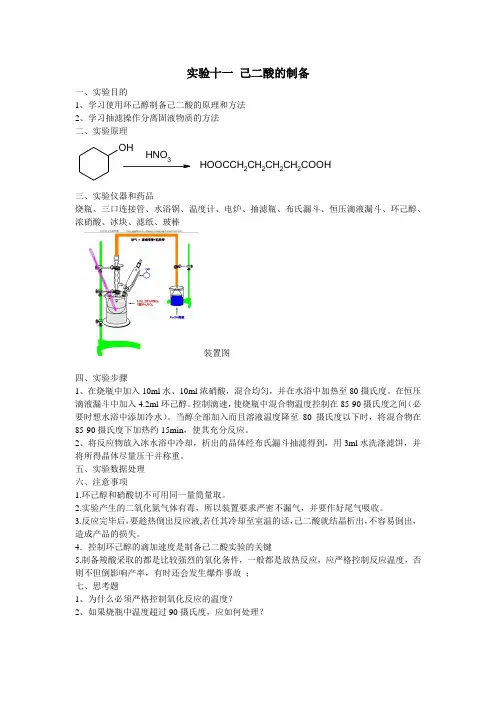
实验十一己二酸的制备
一、实验目的
1、学习使用环己醇制备己二酸的原理和方法
2、学习抽滤操作分离固液物质的方法
二、实验原理
OH
HNO
HOOCCH
2CH
2
CH
2
CH
2
COOH
三、实验仪器和药品
烧瓶、三口连接管、水浴锅、温度计、电炉、抽滤瓶、布氏漏斗、恒压滴液漏斗、环己醇、浓硝酸、冰块、滤纸、玻棒
装置图
四、实验步骤
1、在烧瓶中加入10ml水、10ml浓硝酸,混合均匀,并在水浴中加热至80摄氏度。
在恒压滴液漏斗中加入4.2ml环己醇。
控制滴速,使烧瓶中混合物温度控制在85-90摄氏度之间(必要时想水浴中添加冷水)。
当醇全部加入而且溶液温度降至80摄氏度以下时,将混合物在85-90摄氏度下加热约15min,使其充分反应。
2、将反应物放入冰水浴中冷却,析出的晶体经布氏漏斗抽滤得到,用3ml水洗涤滤饼,并将所得晶体尽量压干并称重。
五、实验数据处理
六、注意事项
1.环己醇和硝酸切不可用同一量筒量取。
2.实验产生的二氧化氮气体有毒,所以装置要求严密不漏气,并要作好尾气吸收。
3.反应完毕后,要趁热倒出反应液,若任其冷却至室温的话,己二酸就结晶析出,不容易倒出,造成产品的损失。
4.控制环己醇的滴加速度是制备己二酸实验的关键
5.制备羧酸采取的都是比较强烈的氧化条件,一般都是放热反应,应严格控制反应温度,否则不但倒影响产率,有时还会发生爆炸事故;
七、思考题
1、为什么必须严格控制氧化反应的温度?
2、如果烧瓶中温度超过90摄氏度,应如何处理?。

1 实验六 己二酸的制备(4学时)一.实验目的1、学习环己醇氧化制备己二酸的原理和方法。
2、巩固浓缩、过滤、重结晶等操作技能。
二、实验原理己二酸是合成尼龙-66的主要原料之一,它可以用硝酸或高锰酸钾氧化环己醇制得。
其中用硝酸为氧化剂反应非常剧烈,伴有大量二氧化氮毒气放出,既危险又污染环境。
因而本实验采用环己醇在高锰酸钾的酸性条件发生氧化反应,然后酸化得到已二酸。
OH MnO 338H 2+KMnO 4+HO 2C (CH 2)4CO 2H ++8KOH8三、试剂2g(2.1ml, 0.02mol)环己醇、6g (0.038mol) 高锰酸钾、10%氢氧化钠、亚硫酸氢钠、浓盐酸、 石蕊试纸四、步骤在250ml 烧杯中安装电磁搅拌。
烧杯中加入5ml 10%氢氧化钠溶液和50ml 水,搅拌下加入6g 高锰酸钾。
待高锰酸钾溶解后,用滴管慢慢加入2.1ml 环己醇,控制滴加速度,维持反应温度在450C 左右。
滴加完毕反应温度开始下降时,在沸水浴中将混合物加热5min ,使氧化反应完全并使二氧化锰沉淀凝结。
用玻棒蘸一滴反应混合物点到滤纸上做点滴试验。
趁热抽滤混合物,滤渣二氧化锰用少量热水洗涤3次。
合并滤液和洗涤液,用4ml 浓盐酸酸化,使溶液呈强酸性(如何检验?)。
在石棉网上加热浓缩使溶液体积减少至约10ml 左右,加少量活性炭脱色后放置结晶,得白色己二酸晶体,纯己二酸为白色棱状结晶,m.p. 152℃,d 4241.366,b.p. 330.5℃(分解)。
五、思考题1、本实验中为什么必须控制反应温度和环己醇的滴加速度?2、为什么有些实验在加入最后一个反应物前应先预热?为什么一些反应剧烈的实验,开始时的加料速度放得较慢,等反应开始反而可以适当加快加料速度?3、粗产物为什么必须干燥后称重?并最好进行熔点测定?。

实验12-8 己二酸的制备
1.为什么必须控制反应温度和环己醇的滴加速度?
本实验采用硝酸氧化环己醇制备己二酸,是比较强烈的氧化条件,而氧化反应一般都是放热反应,所以控制反应温度和滴加原料的速度是非常重要的。
如果反应温度失控,不但要破坏产物,使产率降低,有时还会发生爆炸。
2.为防止二氧化氮有毒气体的逸散,本实验采取了哪些措施?
在冷凝管上端接一气体吸收装置,用10%氢氧化钠溶液吸收反应中产生的二氧化氮气体。
控制环己醇的滴加速度,不要产生大量的二氧化氮。
装置应严密,最好在通风橱中进行实验。
如发现有气体逸出,应立即暂停实验,待调整严密后重新开始反应。
己二酸的制备一、实验目的1.学习环己醇氧化制备已二酸的原理和了解由醇氧化制备羧酸的常用方法。
2.熟悉电动搅拌,抽滤等实验技术。
3.熟练掌握熔点的测定技术。
二、实验原理己二酸(ADA ),又称肥酸。
常温下为白色晶体, 熔点152 ℃,沸点337.5 ℃。
主要用途:有机合成中间体,主要用于合成纤维 (尼龙-66,大约占己二酸总量的70%)其 它的 (30%) 在制备聚氨酯:PA-46,PA-66,PA-610,合成树脂,合成革,聚酯泡沫塑料, 塑料增塑剂,润滑剂,食品添加剂, 粘合剂, 杀虫剂,染料, 香料, 医药等领域得以广泛应用。
产量情况 1902年首次合成。
目前世界产量大约2.60 Mt/a ,并以3.36% 年增长率增长。
其中世界上最大的5 家企业是: Dupont (1.09 Mt/a)、Rhodia (417 kt/a)、Solutia (385 kt/a)、 BASF (240 kt/a) 和旭化成 (112 kt/a)。
2002年我国年生产能力12万t/a (巴陵石化,辽阳石化,太原化学,上海燎原化工,神马集团),市场消费量约为19.5万t/a 。
预计2010年全球ADA 生产能力有望达到3.32 Mt/a 。
制备羧酸最常用的方法是烯、醇、醛等的氧化法。
常用的氧化剂有硝酸、重铬酸钾(钠) 的硫酸溶液、高锰酸钾、过氧化氢及过氧乙酸等。
但其中用硝酸为氧化剂反应非常剧烈,伴有大量二氧化氮毒气放出,既危险又污染环境。
因而本实验采用环己醇在高锰酸钾的碱性条件发生氧化反应,然后酸化得到已二酸。
反应式 H [O O ]O []HO C O (CH 2)4OHO C环己醇 环己酮 己二酸OH MnO 338H 2+KMnO 4+HO 2C (CH 2)4CO 2H ++8KOH 8三、仪器和药品抽滤装置、100℃温度计、环己醇、高锰酸钾、氢氧化钠、亚硫酸氢钠、浓盐酸、试纸。
四、实验步骤1.安装反应装置,在烧杯中加入6g高锰酸钾和50mL0.3mol/L氢氧化钠溶液,搅拌加热至35℃使之溶解,然后停止加热;2.在继续搅拌下用滴管滴加2.1mL环己醇,控制滴加速度,维持反应温度43~47℃,滴加完毕后若温度下降,可在50℃的水浴中继续加热,直到高锰酸钾溶液颜色褪去。
己二酸的制备一、实验目的1.掌握用环己醇氧化制备己二酸的基本原理和方法。
2.掌握电动搅拌器的安装及使用方法3.巩固浓缩、过滤、重结晶等基本操作。
二、实验原理制备羧酸最常用的方法是烯、醇、醛等的氧化法。
常用的氧化剂有硝酸、重铬酸钾(钠)的硫酸溶液、高锰酸钾、过氧化氢及过氧乙酸等。
本实验采用环己醇在高锰酸钾的酸性条件发生氧化反应,然后酸化得到已二酸。
三、实验仪器及药品仪器:三口烧瓶(250ml)烧杯(1000ml)、温度计(0-150℃)、电动搅拌器、球形冷凝管、抽滤瓶、布氏漏斗、循环水多用真空泵、滴管、滤纸等。
药品:环己醇、高锰酸钾、NaOH;亚硫酸氢钠、浓盐酸、活性炭等。
四、实验步骤1. 在250mL三口烧瓶上安装电动搅拌器。
在安装电动搅拌装置时应做到:①.搅拌器的轴与搅拌棒在同一直线上。
②.先用手试验搅拌棒转动是否灵活,再以低转速开动搅拌器,试验运转情况。
③.搅拌棒下端位于液面以下,以离烧杯底部3~5mm为宜。
④.温度计应与搅拌棒平行且伸入液面以下。
2. 往三口烧瓶中加入1.0gNaOH和50mL水。
搅拌下加入6.0g高锰酸钾。
搅拌加热至35℃使之溶解,然后停止加热;3. 用滴管慢慢加入3mL的环己醇,控制滴加速度,维持温度在45℃左右。
4. 滴加完毕后若温度下降至43℃以下。
,可在50℃的水浴中继续加热,直到高锰酸钾溶液颜色褪去。
在沸水浴中将混合物加热5分钟,使氧化反应完全,可观察到有大量二氧化锰的沉淀凝结。
5. 用玻璃棒蘸一滴反应物到滤纸上做点滴实验。
如有高锰酸盐存在,则在棕色二氧化锰点的周围出现紫色的环,可加入少量固体亚硫酸氢钠直到点滴试验呈阴性为止。
6. 趁热抽滤混合物,用少量热水洗涤滤渣3次。
7. 将洗涤液与滤液合并置于烧杯中,加少量活性炭脱色,趁热抽滤。
8. 将滤液转移至干净烧杯中,并在石棉网上加热浓缩至8ml左右,放置,冷却,冷却后再用浓盐酸酸化至pH值为2~4止。
结晶,抽滤,干燥。
化学工程中己二酸绿色合成技术研究摘要:本研究旨在探索己二酸的绿色合成技术,以替代传统的合成方法,减少对环境的污染,提高资源利用效率。
通过文献综述、实验设计与操作等方面的研究,我们针对原料选取、催化剂选择和反应条件优化等关键问题展开了系统的探讨与实验验证。
在催化剂的选择上,我们考虑了金属催化剂和生物催化剂两种类型,并对其性能进行了评价。
通过对反应条件的优化与控制,我们找到了最佳的反应参数,实现了己二酸的高效合成。
这一成果为化工产业的可持续发展提供了新的思路和方法。
未来的研究将进一步完善己二酸绿色合成技术,并探索其在更广泛领域的应用,为构建绿色、可持续的社会做出更大的贡献。
关键词:己二酸;合成技术;传统方法引言随着绿色化学理念的兴起,绿色合成技术成为化工领域的研究热点之一。
绿色合成技术以减少或避免对环境的影响、提高产品的可持续性和资源利用率为目标,受到了广泛关注。
在这一背景下,探索己二酸的绿色合成技术具有重要的意义。
本文旨在研究己二酸的绿色合成技术,以替代传统的合成方法,减少对环境的污染,提高资源利用效率。
通过文献综述、实验设计与操作、实验结果与分析等方面的研究,探讨了不同催化剂、反应条件对己二酸合成的影响,优化了合成工艺,并对绿色合成技术的应用前景进行了展望。
2 文献综述2.1 己二酸的应用及市场需求己二酸是一种重要的化工原料,在聚酯、聚醚、聚酰胺等高分子材料的生产中具有广泛应用。
它被广泛用于纺织、塑料、涂料等工业领域,是这些行业中不可或缺的重要原料。
随着人们对功能性和性能更高的材料需求不断增长,己二酸的市场需求也在不断扩大。
尤其是在可持续发展和环保意识日益增强的今天,对替代传统合成方法、绿色生产的需求更为迫切。
2.2 传统合成方法及存在的问题传统合成己二酸的方法主要包括氧化己烷和氧化环己烷两种途径,但这些方法存在着一系列问题。
首先,这些方法依赖于石油等非可再生资源,存在原料资源消耗大的问题;其次,反应产生的气体排放严重,对环境造成污染;此外,传统合成方法的能耗较高,反应条件严苛,生产成本较高。
实验名称:己二酸Adipic acid编号: 002 日期: 2011 ⑼17 温度:17.6 C 气压:97.37KPa 目标化合物的结构式:3HO 2C (CH 2)4CO 2H中文名称:(iupac 法):2-呋喃甲酸英文名称:(iupac 法):Adipic acid商品名称或别名:肥酸3HO 2C(CH 2)4CO 2H _ 8NO + 7出。
| 4°2 * 8NO 2 分子量(mW : 146.14投料量(g ): 2实验步骤 步骤 现象在250ml 烧杯中加入NaOH 、水、KMnO4 溶液变为紫色向溶液中缓慢滴加环己醇, 45 r沸水浴加热5min做点滴实验停止酸化,趁热抽滤 反应控制在烧杯壁附有黄棕色沉淀,溶液为黄褐色 溶液为黄棕色,壁上附有墨色沉淀 无紫色的环 滤液为淡黄色,得淡黄色固体结果与讨论产品:所得1.5g 己二酸为淡黄色固体 收率:收率为 1.5/2.08*100%=75.0% 讨论:1. 分子伴侣:一组从细菌到人广泛存在的蛋白质,非共价地与新生肽链和解折 叠的蛋白质肽链结合,并帮助它们折叠和转运,通常不参与靶蛋白的生理功反应方程式:物料比(mol 比):1:1.9理论产量:2.08gOH一 8HNO能。
主要有三大类:伴侣蛋白、热激蛋白70家族和热激蛋白90家族。
2.冷冻干燥:将待干燥物快速冻结后,再在高真空条件下将其中的冰升华为水蒸气而去除的干燥方法。
由于冰的升华带走热量使冻干整个过程保持低温冻结状态,有利于保留一些生物样品(如蛋白质)的活性。
3.10%NaOH或NaHC03作用是什么?答:使7价生成氧化锰沉淀,便于过滤4.己二酸的熔点为151-152C,为什么干燥温度不超过 80C 答:温度过高己二酸易软化结块甚至变质。
文献研读:环己酮在双氧水条件下制备己二酸最佳温度为92摄氏度催化剂NaW(°H2配体的量为3.5% 反应时间为12h钨酸盐与草酸是一种有效的催化,30%过氧化氢水溶液,具有收率高,不使用有机溶剂, 反应体系中不存在任何无机或有机卤化物等绿色化学所要求特点。
•、实验目的
1 、通过己二酸的制备,了解传统合成方法的劣势和绿色合成方法的优势;
2 、熟悉催化剂无需回收条件下的循环使用。
二、实验原理
己二酸(adipic acid )俗称肥酸,分子式为 GHiQ 。
对于己二酸的生产工艺目前全世界用 的最广泛的是采用以环己乙醇或环己酮为原料的硝酸氧化工艺路线(图
1)。
在此生产路线
中,使用强氧化性的硝酸,严重腐蚀设备,而且生产过程中产生的 N20气体被认为是引起全 球变暖和臭氧减少的原因之一,给环境造成极大的污染。
日本科学
Ryoji Noyon 于1998年
Science 上发表了一篇有关己二酸的绿色合成方法,
提出了用水作溶剂,H2O2作氧化剂,钨
酸钠(Na2WO )作催化剂,在硫酸氢钾(KHSO4的参与下,甲基三辛氯化铵(aliquat 336) 作相转移催化
剂的绿色制备路线。
这个路线不用强酸,不产生N2O 有害气体,用水作溶剂不
产生废液,并且催化剂不用回收可以直接循环使用。
此后,又有研究人员发现,无需相转移 催化剂,采用水作溶剂,
H2O2作催化剂,利用钨酸钠--草酸原位合成的配位催化剂亦可合
成己二酸(图2 )。
O OH
O
1、仪器 磁力加热搅拌器,冷凝管,圆底烧瓶,烧杯,干燥管,
表面皿,碱式滴定 管,熔点测定仪,三颈烧瓶,真空泵,分析天枰。
2、试剂 钨酸钠(AR ,环己醇(AR ),环己烯(AR ,浓硝酸(AR ,硫酸氢钾(AR ),
甲基三辛基氯化铵(AR ,过氧化氢(AR ),草酸(AR )。
四、实验步骤
1、传统制备方法
将2ml 浓硝酸加入到10mL 圆底烧瓶中,放入搅拌磁子,装上冷凝管,装置图如下(见 图3)。
在通风橱里(为有 N2O 气体放出)加热到 80°G 接着将1mL 环己醇通过滴管从冷凝 管上方缓慢滴加到圆底烧瓶中,
在滴加的过程中,尽量避免环己醇与冷凝管内壁的接触,
滴
加速度控制在1滴/min 左右,滴加过程持续30~40min 。
滴加完后,保持80°C 继续反应2h , 然后冷却至室温,冰水浴中冷却,晶体析出。
用布氏漏斗抽滤,用少量冰水洗涤,再用少量 乙醇洗涤,尽量抽干晶体。
收集药品在干燥箱中进行干燥 15min ,称量计算产率,取少量产
品测定熔点。
NaWO ・ 2H 2O- H 2Q KHSO ,W !O qU 2
lt3f O 6
图2两种不同的绿色合成方法制备己一
H2C2O4- 2H 2O- H 2O 2 三、仪器和试剂
HO
O
O
OH
酸
O OH
HO
图1传统合成方法制备己二酸
O
图3传统制备方法装置图
2、绿色制备方法——钨酸钠-草酸做催化剂
在100mL三颈烧瓶中加入钨酸钠,草酸,%的H2O2和磁子。
室温下搅拌15~20min后,
加入环己烯。
搭好回流装置(见图4),继续快速剧烈搅拌并加热至回流。
反应过程中回流
温度将慢慢升高,回流后,将热的反应液倒入100mL烧杯中,冷水冷却至近室温后,再在冰水浴中冷却20min。
用布氏漏斗抽滤,5mL冰水洗涤后,再用5mL乙醇洗涤,尽量抽干晶体,将产品干燥至衡中后,称量,记录己二酸的质量,计算产率,取少量产品测定熔点。
图4绿色制备方法装置图
3、己二酸含量的测定
用酸碱滴定法测定己二酸的含量。
分别准确称取两次实验产品(准确至)于250ml锥形瓶中,加入50mL热的蒸馏水,搅拌溶解样品。
加入1滴酚酞指示剂,用L-1的氢氧化钠标准溶液滴定至微红色,30s 内不退色即为终点。
各滴定2份。
计算样品中己二酸的百分含量。
由上表可知,传统方法制备产品的产率要比绿色方法高,但污染较大而在纯度上,绿色制备方法略占优势,可谓各有优劣。
六、实验思考
本实验在绿色制备中,由于加入原料过早,导致反应提前进行,最终导致产率较低,且熔程较长。