5.医疗器械生产质量管理规范现场检查表
- 格式:docx
- 大小:19.61 KB
- 文档页数:6

《医疗器械生产质量管理规范》
无菌医疗器械现场检查指导原则(2015版)
内审检查表(含记录)
目录
内部审核检查表(生产部) (3)
内部审核检查表(采购部) (18)
内部审核检查表(技术部) (22)
内部审核检查表(销售部) (32)
内部审核检查表(质管部) (36)
内部审核检查表(管理层) (45)
内部审核检查表(办公室) (48)
第1页共50页
《医疗器械生产质量管理规范》
无菌医疗器械现场检查指导原则不适用条款说明
内部审核检查表(生产部)
内部审核检查表(采购部)
内部审核检查表(技术部)
第22页共50页
第23页共50页
第24页共50页
第25页共50页。

《医疗器械生产质量管理规范》
自查报告
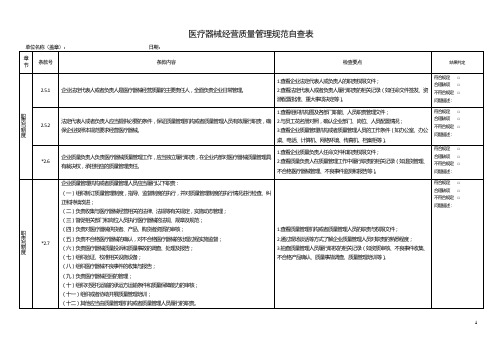
医疗器械生产质量管理规范自查/检查表
1 / 20
3 / 20
5 / 20
7 / 20
注解:
本指导原则条款编号的编排方式为:X】X2 X3,其中X】为章节的顺序号,如1丄2的第一位X】表示“机构与人员”章节,2.1.1的第一位X」表示"厂房与设施”章节;X2为同一章节内条款的顺序号,如1丄1的第二位X2表示“机构与人员”章节第一条要求,1.2.1的第二位X2表示“机构与人员”章节第二条要求;X3为同一条款内细化的检查指导的顺序号,如1.1.1的第三位X3表示"机构与人员”章节对第一条要求细化的第一个检查要点,1.1.2的第三位沧表示"机构与人员”章节对第一条要求细化的笫二个检查要点。
其他章节编号规则相同。



审核实施计划
编号:XXXX-XX-XX
1.审核组组长:A 组员:B
2.审核时间:XX年X月X日至XX年X月X日
3.审核目的:
(1)检查本公司的质量管理体系运行的符合性和有效性;
(2)检查新修订质量体系文件是否符合YY/T 0287-2017/ISO 13485:2016、《医疗器械生产质量管理规范》及现场检查指导原则的要求;
(3)完善公司质量管理体系。
4. 审核依据:
(1)YY/T 0287-2017/ISO 13485:2016《医疗器械质量管理体系用于法规的要求》(简称“标准”);
(2)《医疗器械生产质量管理规范》(国家食品药品监督管理局令第64号)、《医疗器械生产质量管理规范现场检查指导原则》(食药监械监〔2015〕218号附件1)等相关法律法规;(3)公司质量管理体系文件;
(4)产品技术文件;
(5)公司的有关合同。
5. 现场审核期间请被审核方有关人员参加下列活动:
首末次会议:管理者代表、内审员全体成员及各部门负责人参加;
审核活动:按审核日程安排,被审核方有关人员在本岗位。
编制:审批:日期:
内审检查表
不符合项报告
内部质量管理体系审核报告
编制:审批:日期:。
《医疗器械生产质量管理规范》
自查报告
医疗器械生产质量管理规范自查/检查表
注解:
本指导原则条款编号的编排方式为:X1。
X2。
X3,其中X1为章节的顺序号,如1.1.1的第一位X1表示“机构与人员”章节,2.1.1的第一位X1表示“厂房与设施”章节;X2为同一章节内条款的顺序号,如1.1.1的第二位X2表示“机构与人员”章节第一条要求,1.2.1的第二位X2表示“机构与人员”章节第二条要求;X3为同一条款内细化的检查指导的顺序号,如1.1.1的第三位X3表示“机构与人员”章节对第一条要求细化的第一个检查要点,1.1.2的第三位X3表示“机构与人员”章节对第一条要求细化的第二个检查要点。
其他章节编号规则相同。
本文档部分内容来源于网络,如有内容侵权请告知删除,感谢您的配合!。
医疗器械质量方针和质量目标情况检查表1. 简介医疗器械质量方针和质量目标是医疗器械行业中非常重要的文件,它们对于保障医疗器械的安全性、有效性和可靠性具有至关重要的作用。
本文将围绕医疗器械质量方针和质量目标情况检查表展开讨论,分析其内容和应用。
2. 医疗器械质量方针医疗器械质量方针是企业制定的对于医疗器械质量管理的总体要求和指导原则。
它体现了企业对于产品质量的追求和承诺,为企业提供了一个明确的发展方向。
2.1 质量方针内容一份好的医疗器械质量方针应该具备以下几个要素:2.1.1 安全性安全性是医疗器械最基本的要求之一。
在制定质量方针时,企业应明确强调产品安全性,并承诺不会以任何方式妥协产品的安全性。
2.1.2 有效性医疗器械的有效性直接关系到产品是否能够发挥预期的治疗效果。
质量方针应明确要求企业在设计、生产和销售过程中要保证产品具备良好的有效性。
2.1.3 可靠性可靠性是医疗器械质量的重要指标之一,它体现了产品在正常使用情况下的稳定性和可信赖程度。
质量方针应强调企业对于可靠性的追求,并承诺不断提升产品可靠性。
2.1.4 合规性医疗器械行业有着严格的法律法规和标准要求,企业必须确保其产品符合相关规定。
质量方针应明确要求企业遵守法律法规,并建立健全的合规体系。
2.2 质量方针制定过程制定医疗器械质量方针需要经过以下几个步骤:2.2.1 确定参与者确定参与制定质量方针的各个相关方,包括高层管理人员、技术人员、市场人员等。
他们应具备相关的专业知识和经验,以确保质量方针的全面性和可行性。
2.2.2 审查现状对企业现有的质量管理体系进行审查,了解企业目前的优势和不足之处。
这将为制定质量方针提供重要的参考依据。
2.2.3 制定草案根据参与者的意见和审查结果,制定医疗器械质量方针的草案。
草案应包括对安全性、有效性、可靠性和合规性等要素的明确表述。
2.2.4 内外部沟通将制定好的草案与内外部相关方进行沟通,并征求他们的意见和建议。
医疗器械生产质量管理规范现场检查记录表
检查报告
3
填表说明
一、本表包括《医疗器械生产质量管理规范现场检查记录表》(以下简称《检查表》)及《检查报告》两个部分。
二、《检查表》主要用于记录检查组现场发现企业存在的不符合项目,《检查表》一式两份,经被检查企业确认后,一份返检查派出单位,一份返企业。
三、《检查报告》主要用于检查组根据发现的不符合项,对企业质量管理体系进行总体评价,检查结束后反馈至检查派出单位,派出单位根据检查组反馈《检查表》及《检查报告》做出相关行政决定。
四、本表适用于医疗器械注册现场核查、医疗器械生产许可(含延续或变更)现场检查以及根据工作需要对生产企业开展的各类监督检查。
五、检查内容包括:
(一)全项检查:按照规范及有关附录全项目的检查;
(二)单项检查:按照规范及有关附录单项或多项,非全项的检查;
(三)专项检查:按照医疗器械监管相关法规文件(不局限于规范及有关附录)开展的专项检查;
(四)有因检查:因投诉举报、不良事件监测等原因对涉及企业(单位)实施的检查。
六、检查方式包括:
飞行检查,是指食品药品监督管理部门针对医疗器械研制、生产、经营、使用等环节开展的不预先告知的监督检查。
通知检查,是指食品药品监督管理部门针对医疗器械研制、生产、经营、使用等环节开展的预先告知的监督检查。
七、检查结果包括:
(一)通过检查。
适用于所有检查情形。
检查未发现不符合项或违法违规行为的,检查组出具此结论。
(二)未通过检查。
适用于注册环节的现场核查、生产许可(含变更)等现场检查,检查发现有不符合项的,检查组出具此结论;生产许可延续现场检查中发现企业存在不符合项的,企业未能限期完成整改或整改后仍不符合要求的,检查组出具此结论。
(三)限期整改。
适用于日常监管,检查发现仅有一般检查项不符合的,且不对产品质量产生直接影响的,检查组出具此结论;生产许可延续现场检查中发现企业存在不符合项的,检查组出具此结论。
(四)停产整改。
适用于日常监管现场检查等,检查发现关键项不符合的,或虽然仅有一般项目不符合要求,但可能对产品质量产生直接影响的,检查组出具此结论。
八、检查结束后,检查组应认真填写本表格内容,字迹应工整,被检查单位应签字确认并加盖公章。
5
九、填写本表时,表格不足可另附页,并在附页注明总页数及每张页码。