试管苗生根
- 格式:doc
- 大小:27.50 KB
- 文档页数:2



试管苗的移栽和管理试管苗是指通过组织培养技术培育出来的植物苗,它们通常生长在试管中,具有较高的成活率和生长速度。
然而,一旦试管苗长大了,就需要将其移栽到土壤中进行进一步的生长和发育。
本文将介绍试管苗的移栽和管理方法,帮助读者更好地了解如何有效地移栽和管理试管苗。
一、移栽前的准备工作在移栽试管苗之前,我们需要做好以下准备工作:1. 准备好移栽所需的土壤和容器:选择适合试管苗生长的土壤,如腐殖质和营养丰富的土壤。
同时,准备好适合试管苗生长的容器,确保容器具有良好的透气性和排水性。
2. 适时进行移栽:根据试管苗的生长情况,选择适当的时间进行移栽。
一般来说,试管苗生长到一定高度或者根系发达时,就可以进行移栽了。
二、移栽方法1. 将试管苗取出:在移栽之前,先将试管苗从试管中取出。
可以用消毒的镊子或者其他工具轻轻夹住试管苗的茎部,将其小心地取出。
2. 处理苗体:将试管苗放在清水中,轻轻摇晃,让水冲洗掉试管外的凝胶物质。
然后,将试管苗放在含有生长调节剂的溶液中浸泡一段时间,有助于促进试管苗的生根和适应土壤环境。
3. 移栽到土壤中:将处理好的试管苗小心地放入事先准备好的容器中,确保试管苗的根系完整无损。
然后,将土壤填充到容器中,轻轻压实,使试管苗稳固地生长在土壤中。
4. 浇水和光照:移栽后,及时给试管苗浇适量的水,保持土壤湿润。
同时,确保试管苗能够获得充足的阳光或人工光照,促进其正常的生长和发育。
三、移栽后的管理移栽后,我们还需要进行相应的管理工作,以确保试管苗能够健康地生长。
1. 控制水分:试管苗刚移栽到土壤中时,根系可能较为脆弱,因此需要注意控制水分。
避免过浇水或者过干燥,以免对试管苗的生长造成不利影响。
2. 施肥:根据试管苗的生长情况,适时施肥。
选择合适的肥料,按照肥料的使用说明进行施肥,有助于提供足够的营养供给,促进试管苗的生长。
3. 定期修剪:试管苗在移栽后会不断生长,我们需要定期修剪试管苗的茎和叶,保持其形态美观,并促进其分枝和侧芽的生长。
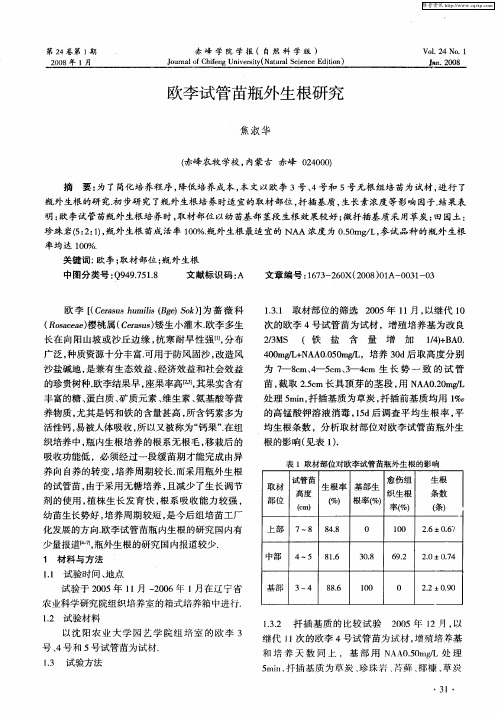


黄檗试管苗生根的研究
金玲玲;姚睿;朴炫春;高日
【期刊名称】《安徽农业科学》
【年(卷),期】2013(041)004
【摘要】[目的]探讨黄檗离体培养生根的最佳条件,为建立其再生体系提供理论依据.[方法]以黄檗试管苗为试材,研究IBA浓度、培养基和活性炭浓度对其生根的影响.[结果] IBA浓度为2.0mg/L时,黄檗试管苗的生根率为64.2%,生根数为3.9,根长2.4 cm,且植株生长健壮;3/4MS培养基是最适合诱导黄檗试管苗生根的基本培养基,地上部生长健壮,地下部生长良好;活性炭对黄檗试管苗生根有明显促进作用,当培养基中加入1.0 g/L活性炭时,黄檗试管苗的生根率达85.1%,生根数这9.3条,根平均长度达3.1 cm.[结论]黄檗试管苗适宜的生根培养基为3/4 MS+ 2.0 mg/L IBA+ 1.0 g/L活性炭.
【总页数】2页(P1442-1443)
【作者】金玲玲;姚睿;朴炫春;高日
【作者单位】延边大学农学院,吉林延边133002
【正文语种】中文
【中图分类】S567
【相关文献】
1.甘蔗试管苗瓶内生根与瓶外生根培养方法比较研究 [J], 刘红坚;范业赓;何为中;莫磊兴;王天顺;牙禹
2.生根粉剂诱导马铃薯脱毒试管苗生根研究 [J], 唐子永;王延玲;程淑云
3.黄檗试管苗水培瓶外生根的研究 [J], 高日;岳园园;徐亚男;任镘蓉;廉美兰;赵丽
4.名贵菊花试管苗生根与移栽试验研究 [J], 王俊侠; 刘全凤; 王静; 范惠菊
5.微环境对金钻蔓绿绒试管苗气生根抑制研究 [J], 徐盼盼;刘健斌;张黎
因版权原因,仅展示原文概要,查看原文内容请购买。
试管苗生根
录入时间:2009-6-15 9:08:16 来源:百度
--------------------------------------------------------------------------------
试管苗生根
离体繁殖产生大量的芽、嫩梢、原球茎,需进一步诱导生根,才能得到完整的植株。生根属试管繁殖的第三个阶
段,其后栽入土中。这是最后一道微繁工序,也是能否进行大量生产和实际应用的又一重要问题,同时也是商品化生
产出售产品,取得效益的最终关节,应给予高度重视。试管繁殖往往诱导产生大量的丛生芽或丛生茎、原球茎,再转
入生根培养基中生根或直接栽入基质中,进一步长大成苗。试管苗的生根可分为试管内生根和试管外生根两种方式。
1、试管内生根
植物离体培养根的发生都来自不定根。根原基的形成和生长素有关,根原基的伸长和生长则可以在没有外源生长
素下实现。一般从诱导至开始出现不定根时间,快的只需3d—4d,慢的则要3周—4周。植物组织培养中,关于根的
发生规律研究的还不够,尤其是在木本植物培养中,往往芽易诱导并且生长良好,而根则难发生(例如牡丹),故应当
加强这方面的研究。影响植物离体培养中生根的因素很多,有离体材料自身的生理生化状态,也有外部的多种因素。
(1)植物材料 不同植物、不同基因型、同一植株不同部位和不同年龄对分化根都有决定性的影响。生根难易还
与母株所处的生理状态有关,因为取材季节和所处环境条件均有影响。所以试管内若不生根,不要完全从培养中去找
原因,也应在取材时考虑。不同植物生根的一般规律是:木本植物比草本植物难,成年树比幼年树难,乔木比灌木难。
(2)基本培养基 大多数使用低浓度的MS培养基,其中不少使用1/2MS和1/3MS培养基。如许智宏等在无籽西
瓜生根中,用不同浓度的MS培养基(用MS、1/2MS和1/2MS无机盐加铁盐)进行生根对此,结果降低无机盐浓度,
有利于生根,而且根多而粗壮,发根也快,加铁盐则更好。水仙的小鳞茎在1/2MS培养基下才生根。矿质元素对生根
的影响也有一些报道。大量元素中有人认为NH 多可能不利于发根,生根需要磷和钾元素,但不宜太多;而Ca2+多数
报道有利于根的形成和生长。糖的浓度,生根培养时通常使用的是蔗糖,其浓度多数采用低浓度,一般在1%—3%。
如桉树的不定枝发根最适蔗糖浓度为0.25%,马铃薯发根为1%。但也有些植物在高浓度时生根较好,李明军等(1998)
在怀山药试管繁殖中发现3%—9%的蔗糖浓度均能诱导生根,但6%时根粗而发达。
(3)植物生长调节剂 生根培养中使用激素的情况,据报道单用一种生长素的占51.5%,生长素加激动素占20.1%。
按外植体类型归类统计,愈伤组织分化根时,使用萘乙酸最多,浓度在0.02—6.0,以1.0—2.0为多。使用吲哚乙酸+
激动素的浓度范围分别为0.1—4.0和0.01—1.0,而以1.0—4.0和0.01—0.02居多数。而胚轴、茎段、插枝、花梗等材
料分化根时,使用吲哚丁酸居首位,浓度为0.2—10,以1.0为多。可见生根培养多数使用生长素,大都以吲哚丁酸、
吲哚乙酸、萘乙酸单独用或配合使用,或与低浓度激动素配合使用。萘乙酸与细胞分裂素配合时摩尔比在(20—30):
1为好。由此可见,在不定根形成中,植物激动起着决定性作用,生长素都能促进生根。一般赤霉素、细胞分裂素、乙
烯通常不利于发根,如与生长素配合,一般浓度宜低于生长素浓度。脱落酸(ABA)可能有助于发根。植物生长延缓
剂如多效唑(MET)对不定根的形成也有良好的作用,在诱导生根中所使用的浓度一般为0.1—4.0(李明军,1995)。
(4)植物生长调节剂的使用方法 通常的使用方法是将植物生长调节剂剂预先加入到培养基中,然后再接种材料
使其诱导生根。近年来为促进试管苗的生根,改变了这种做法,而将需生根材料先在一定浓度植物生长调节剂中浸泡
或培养一定时间,然后转入无植物生长调节剂培养基中培养,能显著提高生根率。如将苹果新梢预先在吲哚乙酸溶液
中浸泡1h,这样比预先加到培养基中效果要好。又如将栗的新梢基部1cm处在1.0浓度的IBA溶液中浸泡2min,然后
转入1/2硝酸盐的MS培养基上,可使生根率高达90%,每茎生根数为12.3条。再如将桃新梢浸入100BA溶液中浸2h
后,再转入除去激素、蔗糖和水解乳蛋白的1/2MS培养基上,可诱导生根。
(5)其他物质 有些材料报道培养基中加入一些其他物质,有利于生根。
(6)继代培养 许多作者报道,新梢生根能力随继代时间增长而生根能力增加。如杜鹃茎尖培养,随培养次数的
增加,小插条生根数量逐渐增加,第四代最高,最后达百分之百的生根。
(7)光照 光照强度和光照时数对发根的影响十分复杂,结果不一。一般认为发根不需要光,如胡霓云等发现,
毛樱桃新梢转入1/2LS附加0.1mol/L萘乙酸培养基中经12d暗培养,比不经暗处理的发根率增加20%。据报道4个苹
果品种,叶、节间、根诱导愈伤组织后,转入生根培养,加入NAA,在黑暗中培养,使茎的愈伤组织再生了不定根。
另据报道苹果试管苗经8d暗处理,用1.0 IBA能促进生根,并改善根系质量。
(8)pH值 试管苗的生根,也要求一定的pH值范围,一般在5.0—6.0。据报道pH值显著影响小萝卜幼苗切后侧
根的形成,pH为3.8时,侧根原基为为每平方厘米60条,pH为5.8时则降为每平方厘米18条。水稻离体种子根生长,
随pH值由3.3升高至5.8而加快。
(9)温度 试管苗在试管内生根,或在试管外生根,都要求一定的适宜温度,一般在16℃—25℃,过高过低均不
利于生根。不同植物最适生根温度不同。据报道,草莓继代培养芽的再生是32℃,生根是28℃最好,16℃时根长增加
5mm—8mm,根数为5条,而28℃时根长可增加11mm,产生19条根。温度对马铃薯块茎离体培养物发根也有影响,
发根最适温度高于分枝的最适温度。
2、试管外生根
有些植物种类在试管中难以生根,或有根但与茎的维管束不相通,或根与茎联系差,或有根而无根毛,或吸收功
能极弱,移栽后不易成活,这就需要采用试管外生根法。
试管外生根有以下三种方法:
1、在试管内诱导根原基后再移栽 朱鹿鸣等(1989)报道月季试管苗移栽时易发生机械损伤,成活率低,又不稳
定。用有根原基的试管苗移栽既耐贮运,又能异地移栽,成活率还高(97%)。其方法是剪取丛生芽,转入
MS+0.5BA+0.01NAA中待小芽生长,当长至3cm—4cm时,转入加有0.5NAAMS培养基中,培养7d—10d后,待嫩茎
基部长出根原基后取出栽入营养钵中,5d—6d后自行生根,此根系有根毛,吸收功能好。此法不仅移栽成活率高,而
且可缩短生产周期,还适于长距离运输。一个广口保温瓶可装1000株带有根原基的小苗,转运千里之外再进行移栽,
实现苗木运输移栽的微型化。1984年他们用此法移栽50个品种月季试管苗,成活2万余株。此法简便、易行,不伤根
又便于贮运。在楸树、猕猴桃、山楂等试管苗中也获得了成功。
2、在生根小室进行生根和炼苗 做一个生根小室,不用琼脂和蔗糖,而用透气又保湿的基质如泥炭、蛭石、珍珠
岩、苔藓等,并要人工控制温度、光照、采用人工喷雾,雾滴要细,以提高空气湿度,又不致使叶面有水滴流出。把
剪下长1cm—3cm的嫩茎转入生根小室,经3周—4周培养,即可产生发育良好,具吸收功能的根。其后再栽入温室,
则易成活。国外杜鹃即用此法移栽。杜鹃花的嫩枝在试管内外都能很好地生根,而一种银球花长约1cm的嫩枝,切下
栽入瓶外基质,比试管内根长的更好。生根小室效果好,条件易控制,但成本高,面积小。国外有些商业性实验室用
自动化湿度调节系统,旋转培养,进行生根驯化,取得了良好效果,但因费用很高已不再使用(Preece和Sutter,1991)。
3、盆插或瓶插生根法 巴岩磊等(1986)为解决我国西北干旱地区杨树试管苗难以移栽问题,提出用盆插或瓶插
生根法来简化生根和移栽,节省设备,降低成本,提高移栽成活率。其法是用罐头瓶或盆内装有泥炭或腐殖土与细沙,
每瓶插入20株—30株无根苗,插入深度约为0.3cm—1.2cm,加入1/2MS+1.0—5.0IBA或LAA生根营养液,在一定温
度、湿度及光照下培养,20d后长出新根,30d后二级根长至8cm—12cm时移栽,成活率高而稳定。甘肃农大葡萄脱
毒研究组研制成功葡萄脱毒苗简易快繁技术,用废旧罐头瓶代替三角瓶,用蛭石代替琼脂,用去糖的GN营养液,瓶
口用打了孔的膜包扎,当接入10株—12株二节无根小苗或一节带根小苗,半开放培养,经15d—20d培养能长4cm—
5cm的健壮幼苗,即可栽入沙床。变三步炼苗为一步炼苗,大幅度降低成本,简化移栽过程,在较粗放移栽下也有较
高的成活率,适用于葡萄试管苗的繁殖与移栽。
有些植物可以把试管繁殖的嫩枝当作微型插条,直接入土生根,也能成活。如Berbee等,Chalupa & McCowns,
以及Amos(1981)将杨树、桦木和其他阔叶树试管繁殖的嫩梢,直接栽入泥炭和蛭石基质中,很快生根,并有很高的成
活率。
英国格拉斯哥植物园全国秋海棠中心(1988),用无菌简易快繁技术对秋海棠叶进行离体繁殖获得成功,也是体外
生根和驯化一步完成,还是在带菌条件下完成,认为在植物微繁殖及保存中有广泛的应用前景。