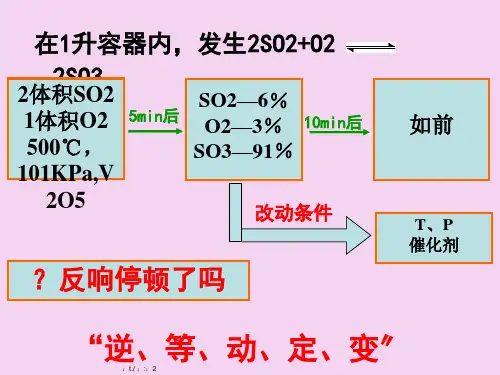
第三单元、化学平衡的移动
【复习】化学平衡状态的定义:(化学反应的限度)
一定条件下,可逆反应里,正反应速率和逆反应速率 相等,反应混合物中各组分的浓度保持不变的状态。
v
v正
v逆
0
v正=v逆
t
条件改变,使v正≠ v逆原平衡被破坏,可见,化学平衡只
有在一定的条件下才能保持。当外界条件改变,旧的化学 平衡将被破坏,并建立起新的平衡状态。
②只要是增大浓度,不论增大的是反应物浓度, 还是生成物浓度,新平衡状态下的反应速率一定 大于原平衡;减小浓度,新平衡状态下的速率一 定小于原平衡。
③反应物有两种或两种以上, 增加一种物质的浓度, 该物质的平衡转化率降低, 而其他物质的转化率提 高。
思考:合成氨工业中重要一步是:N2+3H2 2NH3 该反应在一定条件下达平衡时,为提高H2的转 化率,从浓度角度分析可采取什么措施?
练习:下列反应达到化学平衡时,增大压强, 平衡是否移动?向哪个方向移动?
① 2NO(g) + O2(g) 2NO2(g) 正向移动 ② H2O(g) + CO(g) CO2(g) + H2(g) 不移动 ③ H2O(g) + C(s) CO(g) + H2(g) 逆向移动 ④ CaCO3(s) CaO(s) + CO2(g) 逆向移动 ⑤ H2S(g) H2(g) + S(s) 不移动
2.研究对象: 已建立平衡状态的体系
3.平衡移动的本质原因:
v正≠ v逆
【思考】 如何通过改变条件来打破旧平衡?
可通过改变影响反应速率的条件来打破原有平衡, 建立新平衡。 【回忆】影响化学反应速率的外界条件主要有哪些?
浓度
温度