有机考试之缩醛缩酮的命名
- 格式:doc
- 大小:1.24 MB
- 文档页数:7


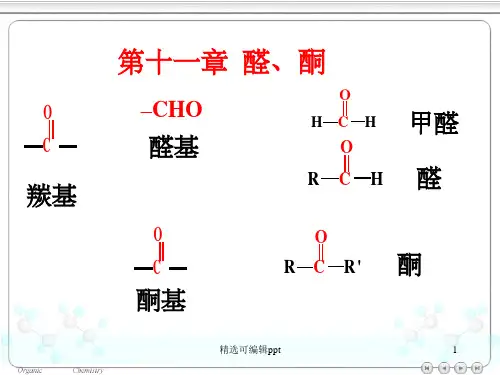


第十一章醛、酮教学要点:掌握醛、酮、醌的结构、性质、制备;掌握常见的氧化剂和还原剂;了解亲核加成反应的历程。
教学时数: 10 学时教学方法:教师讲授、 教学手段:多媒体、自制模型含有羰基(C=O )的化合物为羰基化合物。
R 1、R 2均为烷基时,分子称为酮;R 1、R 2有一个或二个为氢分子称为醛。
在醛和酮的分子中都含有羰基 C=O ,统称羰基化合物。
醛( Aldehyde )的通式为 RCHO 或 ArCHO ,酮的通式为 RCOR ’或 ArCOR 和 Ar 2CO ,由于羰基是醛和酮这两类化合物共有的官能团,所以在化学性质上醛和酮有许多共同之处。
但由于醛的羰基上连有一个氢原子,又使醛和酮的化学性质有所不同。
第一节 醛、酮的分类和命名一、 醛和酮的结构和分类 1.醛和酮的结构在醛、酮分子中,羰基碳原子以sp 2 杂化状态与其它三个原子成键,羰基碳原子的P 轨道与氧原子上的P 轨道以相互平行的方式侧面重叠形成π键,即羰基是一个平面构型的;与羰基碳原子直接相连的其它三个原子处于同一平面内,相互间的键角约为120度,而π键是垂直于这个平面的。
在羰基中由于氧原子的电负性明显大于碳原子,所以羰基中双键的电子偏向氧原子一方,这种电子偏移造成了羰基具有极性,而且氧原子是富电子的,碳原子是缺电子中心。
羰基是一个较强的极性基团,羰基的氧原子具有一定的碱性。
羰基具有极性,醛、酮是极性分子,小分子的醛、酮其极性的是较强的由于羰基具有强吸电子作用(—O R 1CR 2C,—I),使连接在羰基上的烷基显示出明显的供电效应(+I,+C),烷基的这种给电子作用使羰基碳原子上的缺电子性质有所减弱,而且也使羰基化合物的稳定性有所增加。
2.分类根据醛、酮的羰基上连接烃基的情况,可把醛、酮分为脂肪族和芳香族醛、酮两大类,根据烃基是否饱和又可分为饱和及不饱和醛、酮。
由分子中含有羰基的个数,可以分为一元、二元、多元醛、酮等。
羰基直接与芳环相连的醛、酮称为芳醛或芳酮。

醛酮的命名和化学性质及制备本章要点一、分类命名和结构二、主要化性(一)醛酮1、亲核加成(水/氢氰酸/亚硫酸氢钠/醇/羰基试剂/格式试剂/烷基锂/金属炔化物)2、α-H的反应(卤代/卤仿反应,羟醛缩合)3、氧化还原(不同还原体系产物不同)4、α、β-不饱和醛酮的特征反应(了解)(二)醌1、C=C亲电加成2、C=O亲核加成3、共轭体系1,4-加成一、醛酮的命名1、含CO、较多取代的最长碳链→⨯醛、⨯酮2、CHO总是1位,不饱和醛酮的C=O位号﹤重键3、酮离羰基最近端起编,羰基位次要标明(有些可省)4、有环基取代→环基作取代基5、环酮命名与酮类似,加前缀→环⨯酮例题:1、CHO2、HO CHO3、PhCH=CHCHO4、OHC CHO5、COCH36、CO7、COCH2CH39、H3CO COCH39、(CH3)3CCOCHCH3CH310、CH3CHCHCOCH3CH311、CH3COCH2COCH312、OBr13、CH3O14、CH3O15、COHOOH16、CH3COCH2NH2解:1、苯甲醛2、对羟基苯甲醛3、3-苯基-2-丙稀醛4、乙二醛5、苯乙酮6、二苯甲酮7、苯丙酮8、对甲氧基苯乙酮9、2,2,4-三甲基-3-戊酮10、3-甲基-4-苯基-2-戊酮11、2,4-戊二酮(乙酰丙酮,acac.) 12、2-溴环戊酮13、4-甲基-2-环己烯酮14、4-甲基-2,4-环己二烯酮14、3,4’-二羟基二苯甲酮16、对氨基苯-2-丙酮二、醛酮的结构特点COδδ+1、醛酮中的羰基是极性双键,由于氧的电负性强,因此碳上带有δ+,氧上带有δ-;2、δ+的碳与δ-的氧比较而言,前者更易受到试剂(亲核试剂)的进攻,因此羰基的加成属 于亲核加成;3、受羰基影响,α-H 具有一定的酸性,可发生卤代等反应;4、羰基的氧化度处于中间状态,可继续氧化亦可被还原。
三、醛酮的主要化学性质H Cα-H的反应氧化还原醛的反应(一)羰基的亲核加成反应通式:CNuO C O δδ++ Nu -E+NuC OE注:(1)羰基加成反应属于亲核加成,有别于C=C 的亲电加成,因此,易与C=C 加成的试剂如卤素、卤化氢等,就不易与C=O 进行亲核加成;反之同理。




第十一章醛和酮第一节醛、酮的分类和命名一、分类二、命名 1 醛、酮的系统命名以包含羰基的最长碳链为主链看作母体。
从靠近羰基的一端开始依次标明碳原子的位次。
在醛分子中醛基总是处于第一位命名时可不加以标明。
酮分子中羰基的位次除丙酮、丁酮外必须标明因为它有位置异构体。
戊醛2-戊酮3-戊酮醛、酮碳原子的位次除用1234??表示外有时也用αβγ??希腊字母表示。
α是指官能团羰基旁第一个位置β是指第二个位置??。
忻州师范学院精品课程有机化学电子教案2 β-羟基丁醛αα’-二溴-3-戊酮酮中一边用αβγ??另一边用α’ β’ γ’??。
ⅰ含醛基、酮基的碳链上的氢被芳环或环烷基取代就把芳环或环烷基当作主链上的取代基看待2-苯丙醛1-环己基-1-丙酮ⅱ醛基与芳环、脂环或杂环上的碳原子直接相连时它们的命名可在相应的环系名称之后加―醛‖字。
环己醛12-萘二醛ⅲ当芳环上不但连有醛基而且连有其它优先主官能团时则醛基可视作取代基用甲酰基做词头来命名。
4-甲酰基苯甲酸2. 酮还有另一种命名法忻州师范学院精品课程有机化学电子教案3 根据羰基所连的两个烃基名来命名把较简单的烃基名称放在前面较复杂的烃基名称放在后面最后加―酮‖字。
甲乙酮丁酮甲基乙烯基酮丁烯酮后面是母体如含有两个以上羰基的化合物可用二醛、二酮等醛作取代基时可用词头―甲酰基‖或―氧代‖表示酮作取代时用词头―氧代‖表示。
3-氧代戊醛3-oxopentanal 24-戊二酮24-pentanedione 英文羰基做取代基时用―oxo‖氧代表示不饱和醛、酮的命名是从靠近羰基一端给主链编号。
23二甲基4戊烯醛23-dimethylpent-4-enal 3甲基4己烯2酮3-methyl-4-hexen-2-one 第二节醛、酮的物理性质和光谱性质一、物理性质忻州师范学院精品课程有机化学电子教案4 除甲醛是气体外十二个碳原子以下的醛、酮都是液体高级的醛、酮是固体。
低级醛常带有刺鼻的气味中级醛则有花果香所以C8C13的醛常用于香料工业。