第二节 铁和铁的化合物
- 格式:doc
- 大小:43.50 KB
- 文档页数:2


4-2-2 铁和铁的化合物(第二课时)[教学目标]1.知识目标(1)使学生初步理解、掌握铁化合物和亚铁化合物之间相互转变的规律及其条件;巩固、加深对氧化还原反应的认识。
(2)铁的氢氧化物的性质与比较。
(3)铁“三角”(即Fe、Fe2+、Fe3+之间的转化)。
铁离子的检验。
2.能力和方法目标(1)通过本节内容中的演示实验操作,指导学生用简单的实验探究化学性质、化学事实的能力。
(2)通过铁的氧化物的比较、铁的氢氧化物的比较、亚铁离子和铁离子的比较,提高归纳比较能力。
明确“比较”是学习和研究化学的一种基本方法。
3.情感和价值观目标(1)通过对我国钢铁工业的发展,其中钢产量由1949年居世界第26位跃居1996年的世界首位的事实,对学生进行爱国主义教育。
(2)通过用众多的化学实验学习和研究铁及化合物性质,培养“事实胜于雄辩”,用事实说话的态度,教育学生化学是一门以实验为基础的科学,培养他们实事求是、脚踏实地的科学精神。
[重点与难点]本课时的重点和难点是“铁三角”。
[教学过程]见ppt文件。
课堂练习:1.在三氯化铁溶液中通入二氧化硫,然后再滴入氯化钡溶液,有白色沉淀生成,则该白色沉淀可能是()。
(A)硫酸钡(B)亚硫酸铁(C)亚硫酸钡(D)硫磺2.在含Fe3+、Fe2+、Mg2+、NH4+的稀溶液中加入足量过氧化钡固体,充分作用后,再加入过量稀盐酸,完全反应,离子数目没有变化的是()(A)Fe3+ (B)Fe2+ (C)Mg2+ (D)NH4+3.把20g铁粉投入盛有一定量的稀硝酸的烧杯中,反应时,硝酸的还原产物为NO。
反应停止后,烧杯中溶液的质量增加了12.27g,此时,烧杯中的物质可能是()。
(A)硝酸亚铁(B)铁和硝酸亚铁(C)硝酸和硝酸亚铁(D)硝酸亚铁和硝酸铁4.某溶液可能含有硫酸盐、硝酸盐和氯化物。
经测定得知溶液中含有浓度较大的H+、Fe2+和Ba2+,该盐溶液中的阴离子主要是()。
(A)NO-3(B)Cl-(C)SO-24(D)Cl-和SO-245.把含有氧化铁的铁片投入到足量的稀硫酸中,直到铁片全部溶解。


第二节铁和铁的化合物【教学目的】1.铁的原子结构和化合价2.铁的单质,氧化物,氢氧化物的性质3.“铁三角”(即 Fe、Fe2+、Fe3+之间的相互转化)4.Fe2+、Fe3+的检验5.通过介绍我国悠久的炼铁史,对学生进行爱国主义教育。
【教学重点】铁及其化合物的化学性质【教学难点】“铁三角”(即 Fe 、Fe2+、Fe3+之间的相互转化)【教学过程】第一课时【引言】人类使用铁已有4500年的历史了。
目前已发现的金属虽然已有90种,但其中应用最广泛、用量最多的仍然是铁。
小到铁钉,大到桥梁、铁道、舰船、车辆和各种机械等,都需要大量的钢铁来制造。
就连动植物体内也含有铁,人体内缺铁会导致缺铁性贫血,钢铁的生产和使用是人类进步和社会进步的重要标志。
那么,是哪个国家、哪个民族首先使用铁呢?我国的劳动人民在春秋时期就会冶铁,出土最早的铁器为春秋时秦国。
比欧洲早近2000年,并且我国铁矿石的储量居世界第一,从1996年开始我国年钢产量连续超1亿吨,居世界首位。
我们为我国悠久的炼铁史和发达的钢铁工业而感到自豪和骄傲!这节课我们一起来学习铁和铁的化合物知识。
第二节铁和铁的化合物一铁在元素周期表的位置及原子结构(1)铁在元素周期表的位置:铁位于第四周期第Ⅷ族。
(2)铁的原子结构示意图:铁的原子结构有哪些特点?从原子结构示意图上看,和主族元素不同,Fe 的次外层电子未达到饱和,不仅最外层上2个电子是价电子,而且次外层也有价电子,当铁与弱氧化剂反应时,只能失去最外层上2个电子形成Fe2+,当跟强氧化剂反应时,还能进一步失去次外层上的一个电子而形成Fe3+。
Fe-2e-=Fe2+Fe-3e-=Fe3+所以,铁在其化合物中通常呈+2价或+3价。
二 铁的性质 (一)物理性质学生回忆初中所学铁的知识、观看实物、联系生活实际(如铁锅导热),总结出铁的物理性质:铁是银白色金属,熔点,沸点较高;抗腐蚀能力强;具有较好的导电性,导热性和延展性;易被磁性物质吸引和磁化。
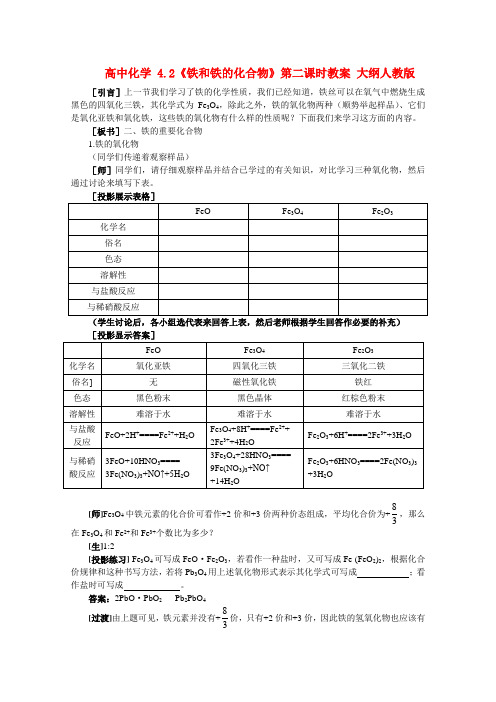
高中化学 4.2《铁和铁的化合物》第二课时教案 大纲人教版[引言]上一节我们学习了铁的化学性质,我们已经知道,铁丝可以在氧气中燃烧生成黑色的四氧化三铁,其化学式为Fe 3O 4,除此之外,铁的氧化物两种(顺势举起样品)、它们是氧化亚铁和氧化铁,这些铁的氧化物有什么样的性质呢?下面我们来学习这方面的内容。
[板书]二、铁的重要化合物 1.铁的氧化物(同学们传递着观察样品)[师]同学们,请仔细观察样品并结合已学过的有关知识,对比学习三种氧化物,然后通过讨论来填写下表。
[投影展示表格](学生讨论后,各小组选代表来回答上表,然后老师根据学生回答作必要的补充)[师]Fe 3O 4中铁元素的化合价可看作+2价和+3价两种价态组成,平均化合价为+38,那么在Fe 3O 4和Fe 2+和Fe 3+个数比为多少?[生]1:2[投影练习] Fe 3O 4可写成FeO ·Fe 2O 3,若看作一种盐时,又可写成Fe (FeO 2)2,根据化合价规律和这种书写方法,若将Pb 3O 4用上述氧化物形式表示其化学式可写成 ;看作盐时可写成 。
答案:2PbO ·PbO 2 Pb 2PbO 4[过渡]由上题可见,铁元素并没有+38价,只有+2价和+3价,因此铁的氢氧化物也应该有两种,即氢氧化亚铁和氢氧化铁。
下面我们来学习它们的性质。
[板书]二、铁的氢氧化物[师]那么,如何制得这两种氢氧化物呢?下面我们来做两个实验,同学们一定要仔细观察实验现象。
[演示实验4—9][师]在逐滴滴入NaOH的过程中,观察到了什么现象?[生]溶液里立即生成了红褐色的沉淀。
[师]请同学们写出该反应的离子方程式,然后分析红褐色的沉淀是何种物质?[板书]Fe3++3OH-====Fe(OH)3↓(红褐色)[师]在FeSO4溶液中滴加NaOH会生成什么物质呢?下面我们再做一个实验,请注意观察。
[演示实验4—10][师]你们都观察到了哪些现象?[生]开始时生成白色的絮状沉淀,白色絮状沉淀迅速变成灰绿色,最后变成红褐色。

第二节铁和铁的化合物单质 ----- 水反h 站亠瘦反应—“铁二角"—F 出F F 針的检验(一)铁的单质1. 物理性质:铁与其他金属一样,具有金属的通性。
纯铁为银白色,质软,重金属。
铁位于第四周期第忸族, 是过渡金属,有4个电子层,最外层有 2个电子,从它的结构 可以看出,铁容易失去最外层的 2个电子,同时次外层的1个电子也经常参加反应, 因此具 有还原性:Fe 2e Fe 22. 化学性质:(1) 与非金属反应 ①02: ② Cl 2 : ③ S :(2) 铁与水的反应(3)铁与酸的反应(4)铁与盐的反应知识导图制备一F P (OH)厂 合EA 氢氣花£」与盐溶液反应—F/的还性一 的氧化性FeO -1 FezOs - Fc ;iOi 氣化物胶休Fe 3e Fe 3(二)铁的重要化合物 1.2. 铁的氧化物 (1) 不溶于水,不与水反应 (2) 与酸反应 铁的氢氧化物Fe 330H Fe 220H4Fe(0H )2Fe(OH)3 Fe(OH)2 02 2H 2O (红褐色)(白色)4Fe(OH)3铁化合物和亚铁化合物的相互转换3. (三)Fe 3+的检验S 应后溶于水能与Fe 3+反应,又能证明Fe 3+具有氧化性的微粒是(SCN ②Fe ③Fe 2+ ④Cu ⑤ tS⑥OHA. [例6] 离子是(A.只有 Fe 2+B.只有 Fe 3+C.有 Fe 2+和 Cu 2+D.有 Fe 3+和 Cu 2+[例7]根据图中现象和转化推断 A B 、C D E 、F 、G 各是什么物质?写出①②反应的离子方程式,③④反应的化学方程式。
D 黑色沉淀its 邑度 应呈董色注黄色況&[例8]40g 铁粉投入到500g 稀HNO 中,若两物质恰好完全反应( HNO 的还原产物为NC ), 求此稀HNO 的溶质质量分数和生成的气体在标准状况下的体积?【典型例题】[例1]将适量铁粉放入三氯化铁溶液中,完全反应后,溶液中的 反应的Fe 3+和未反应的Fe 3+的物质的量之比是()A.2:3B. 3:2C. 1:2D. 1:1[例2]将括号内的气体通入对应的溶液(或水中),气体只作氧化剂,反应后得一种澄清溶液的是()氢氧化钠溶液(二氧化硫) 水(二氧化氮) Fe 3+和Fe 2+浓度相等。
普通高中人教版化学必修1第三章金属及其化合物第二节几种重要的金属化合物(第三课时)《铁和铁的化合物----亚铁盐、铁盐》教案李艳一、内容分析1.本节课的内容是铁的重要化合物:铁盐和亚铁盐,重点介绍Fe3+的检验方法以及Fe2+的还原性与Fe3+的氧化性。
2.教材内容编排注意与第一、二章知识的衔接。
本节课教材内容突出了课程标准中要求的铁的化合物的主要性质,并且注意与已学知识:“离子反应”与“氧化还原反应”的联系与衔接,引导学生主动运用已有知识分析和解决新的问题,并逐步形成较为系统的知识网络3.通过对实验探究获取知识与培养能力。
教材介绍Fe3+离子检验、Fe2+与Fe3+相互转化等知识的介绍,主要通过实验探究的方法,引导学生思考实验现象背后所反映的物质性质,培养学生的实验观察与分析能力。
二、学情分析1.学生的知识、技能的基础。
学生在学习本课之前,已学习了氧化还原、离子反应、物质的量等基本概念,初步理解了从实验学化学的思想,巩固了化学实验的基本方法,能在教师指导下独立完成实验,为本课学习奠定了一定的知识、技能和心理基础。
但学生对实验现象分析能力、思维能力、探究能力有待进一步培养和提高。
2.学生认知心理特点及认知发展水平。
高一学生有很强的好奇心,尤其对化学实验充满期待和向往,因此创设教学情境,激发学习兴趣显得尤为重要。
三、教学目标1、知识与技能(1)掌握铁离子、亚铁离子的性质及其相互转化。
(2)学会用多种方法鉴别铁离子、亚铁离子。
(3)了解铁离子、亚铁离子之间的相互转化在生产生活中的具体应用2、过程与方法(1)通过学习铁的重要化合物的性质,学会分类、比较、归纳的学习方法。
(2)体验从化合价的角度分析微粒的氧化性、还原性,让学生逐步掌握学习元素化合物知识的一般方法。
(3)在“大胆推测→设计实验→实验验证→得出结论→解决实际问题”过程中,学习知识、体验科学研究过程。
3、情感、态度、价值观(1)通过对铁的化合物性质的学习,体验科学探究成功的喜悦;培养探究意识和善于与他人合作的精神。
第二节几种重要的金属化合物(三)
三维目标
1.知识与技能
(1)常识性介绍过渡元素的概念
(2)使学生掌握铁的化学性质
2.过程与方法
启发提问、实验探究、观察法、阅读法
3.情感态度价值观
通过同一种元素在不同物质间的转化体验事物之间的因果关系。
教学重点:铁的化学性质
教学难点:对铁的化学性质比较活泼的理解
教学过程
第一课时
[引言]
(教师举起银白色的铁)
[师]同学们,我这儿有刚用钢锯锯开的粗铁丝,请同学们迅速传着看一下,要注意它的横断面,并且能说出它的颜色。
[生]银白色,具有金属光泽。
[师]好,可我们对人类使用铁的历史又知道多少呢?现在我简单地给同学们介绍一下这方面的内容。
铁是在自然界中广泛存在、在生活中应用极为普遍、在现代工业中最重要和应用最多的金属。
铁和碳元素的合金(即钢和生铁)在人类生产及生活中起着极为重要的作用。
历史上,把广泛使用铁制生产工具的时代称为“铁器时代”,以标志生产力的发展水平。
现代,生铁和钢已成为用量最多的金属材料。
1980年世界生产生铁5.05亿吨,钢7.18亿吨。
我国是世界上最早使用铁的国家之一,1996年,我国钢产量超过1亿吨,跃居世界首位。
从公元1世纪起铁便成了我国最主要的金属。
钢铁的生产和使用是人类文明和社会进步的一个重要标志。
看来,铁是非常重要的一种金属,那么,我们就来学习一下铁及其化合物的性质。
[板书]铁和铁的化合物
一、铁的性质
[师]请同学们打开元素周期表,要能够说出Fe元素在周期表中的位置及在地壳中的含量。
[生](教师确认正确后板书)
[板书]1.Fe元素在周期表中的位置及在地壳中的含量
[讲解并板书]Fe位于第四周期第VⅢ族,铁原子最外层电子数为2个,除容易失去最外层电子显+2价外,次外层的一个电子也经常参加反应,故表现出两种价态。
Fe元素在地壳中的含量居第4位,金属元素中仅次于Al。
[师]铁是一种历史悠久、应用最广泛、用量最大的金属。
下面我们来学习它的性质。
铁的物理性质我们早已在初中学习过,现在我们来共同回忆一下。
[板书](学生回答老师补充)
2.铁的性质
(1)物理性质:纯净的单质铁为银白色,具有金属光泽,密度较大,熔点较高,易导电、导热,有良好延展性,质地较软的固体。
可被磁化。
[师]铁的化学性质非常活泼,它能跟许多物质发生化学反应。
下面我们着重学习Fe跟非金属单质、水、酸、盐溶液的反应。
[板书](2)化学性质
a.铁跟非金属的反应
[师]在初中时,我们曾学过,灼热的铁丝在氧气里燃烧,生成黑色的四氧化三铁。
那么,铁还
能跟其他非金属反应吗?下面让我们共同做一个实验。
第四章几种重要的金属
第二节铁和铁的化合物
一、铁的性质
在元素周期表中,铁位于第四周期第Ⅷ族,最外层有2个电子。
1.物理性质
(1)与非金属反应:与强氧化剂反应生成Fe3+,与弱氧化剂反应生成Fe2+。
3Fe+2O2
点燃
========Fe3O4
2Fe+3Cl2
点燃
========2FeCl3
Fe+S
∆
========FeS
(2)与水蒸气反应
3Fe+4H2O(g)
高温
========Fe3O4+4H2
(3)与酸反应
a.与非氧化性酸反应
Fe+2H+====Fe2++H2↑
b.与氧化性酸反应
Fe+4HNO3(稀)====Fe(NO3)3+NO↑+2H2O(Fe不足)
3Fe+8HNO3(稀)====3Fe(NO3)2+2NO↑+4H2O(Fe过量)
(4)与某些盐溶液反应
Fe+Cu2+====Fe2++Cu
Fe+2Fe3+====3Fe2+
教后记
学生在初中阶段曾学过一些铁的知识,如铁的性质、几种铁合金、生铁和钢的冶炼等。
本节是在这些知识的基础上,结合高一学的元素周期律、氧化还原反应的知识,进一步介绍铁的化学性质。
教学过程中,要注意新旧知识的衔接,并通过采用边讲边练的教学手段,使本节课的知识得以巩固,可收到较好的效果。