乙酸乙酯
- 格式:ppt
- 大小:37.50 KB
- 文档页数:2

乙酸乙酯的分离原理乙酸乙酯是一种常见的有机化合物,也是一种重要的溶剂。
在化学实验和工业生产中,乙酸乙酯的分离和纯化是非常重要的。
下面将介绍乙酸乙酯的分离原理及其应用。
一、乙酸乙酯的物化性质乙酸乙酯是一种无色透明的液体,在常温下具有芳香气味。
其密度为0.895g/cm³,沸点为77℃。
乙酸乙酯在水中的溶解度较小,但在多数有机溶剂中溶解度较大。
乙酸乙酯的分离原理是利用其在不同溶剂中的相对溶解度差异进行分离。
常用的分离方法有蒸馏法、萃取法、结晶法等。
1. 蒸馏法蒸馏法是将混合物加热,使其中的乙酸乙酯汽化,然后通过冷凝器使其重新凝结,从而实现分离的方法。
蒸馏法的优点是操作简单,适用范围广,但是对于混合物中含有水的情况,蒸馏法的分离效果较差。
2. 萃取法萃取法是利用乙酸乙酯在不同溶剂中的溶解度差异进行分离的方法。
常用的萃取剂有水、醇类、酯类等。
在分离乙酸乙酯和水的混合物时,首先将其加入到萃取漏斗中,然后加入萃取剂,轻轻摇动,使混合物中的乙酸乙酯转移到萃取剂中,从而实现分离的方法。
萃取法的优点是对混合物中水的含量不敏感,分离效果好,但是需要使用大量的萃取剂,操作较为繁琐。
3. 结晶法结晶法是利用乙酸乙酯在不同溶剂中的溶解度差异进行分离的方法。
当混合物中的乙酸乙酯与某一溶剂形成不溶性的结晶时,可以通过过滤的方法将其分离。
结晶法的优点是分离效果好,但是对于含有水的混合物,其分离效果较差。
三、乙酸乙酯的应用乙酸乙酯作为一种溶剂,在化学制剂、医药、印刷、染料等领域都有广泛的应用。
在制备某些化合物时,乙酸乙酯是不可或缺的溶剂。
此外,乙酸乙酯还常用于油墨和胶黏剂的制备中。
乙酸乙酯作为一种重要的有机化合物,在化学实验和工业生产中有着广泛的应用。
乙酸乙酯的分离原理主要是利用其在不同溶剂中的相对溶解度差异进行分离。
通过蒸馏法、萃取法、结晶法等方法,可以将乙酸乙酯从混合物中分离出来,为其应用提供了有力的保障。
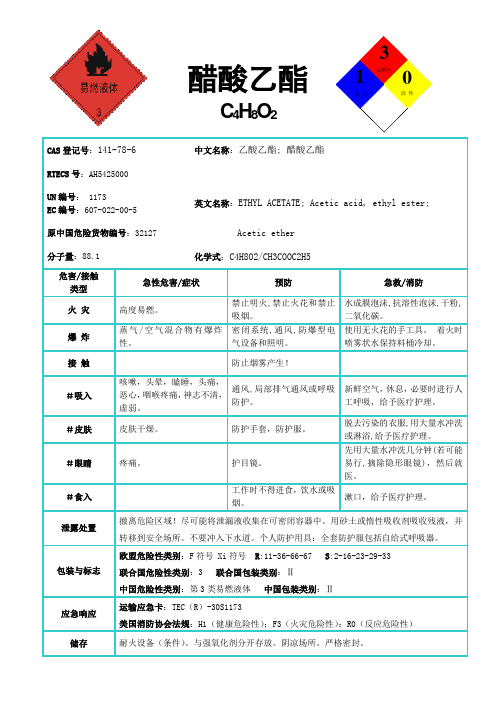
醋酸乙酯C 4H 8O 2CAS 登记号:141-78-6 中文名称:乙酸乙酯; 醋酸乙酯 RTECS 号:AH5425000UN 编号: 1173EC 编号:607-022-00-5 英文名称:ETHYL ACETATE; Acetic acid, ethyl ester;原中国危险货物编号:32127 Acetic ether分子量:88.1 化学式:C4H8O2/CH3COOC2H5危害/接触 类型 急性危害/症状 预防急救/消防火 灾 高度易燃。
禁止明火,禁止火花和禁止吸烟。
水成膜泡沫,抗溶性泡沫,干粉,二氧化碳。
爆 炸 蒸气/空气混合物有爆炸性。
密闭系统,通风,防爆型电气设备和照明。
使用无火花的手工具。
着火时喷雾状水保持料桶冷却。
接 触防止烟雾产生!#吸入咳嗽,头晕,瞌睡,头痛,恶心,咽喉疼痛,神志不清,虚弱。
通风,局部排气通风或呼吸防护。
新鲜空气,休息,必要时进行人工呼吸,给予医疗护理。
#皮肤皮肤干燥。
防护手套,防护服。
脱去污染的衣服,用大量水冲洗或淋浴,给予医疗护理。
#眼睛 疼痛。
护目镜。
先用大量水冲洗几分钟(若可能易行,摘除隐形眼镜),然后就医。
#食入工作时不得进食,饮水或吸烟。
漱口,给予医疗护理。
泄露处置撤离危险区域!尽可能将泄漏液收集在可密闭容器中。
用砂土或惰性吸收剂吸收残液,并转移到安全场所。
不要冲入下水道。
个人防护用具:全套防护服包括自给式呼吸器。
包装与标志欧盟危险性类别:F 符号 Xi 符号 R :11-36-66-67 S :2-16-23-29-33联合国危险性类别:3 联合国包装类别:Ⅱ中国危险性类别:第3类易燃液体 中国包装类别:Ⅱ应急响应 运输应急卡:TEC (R )-30S1173美国消防协会法规:H1(健康危险性);F3(火灾危险性);R0(反应危险性) 储存耐火设备(条件)。
与强氧化剂分开存放。
阴凉场所。
严格密封。
易燃性1活 性毒 性3重要数据物理状态、外观:无色液体,有特殊气味。

乙酸乙酯分离提纯原理
乙酸乙酯分离提纯的原理是基于其在溶剂中的溶解度差异。
乙酸乙酯是一种具有较强溶解度的有机物,常用的溶剂中包括水和其他有机溶剂,如醇类和醚类溶剂。
首先,乙酸乙酯和水在一定温度下不相溶,形成两相体系。
利用这个特性,可以通过萃取的方法将乙酸乙酯与水分离。
一种常用的方法是采用漏斗,将混合溶液倒入漏斗中,待两相分离后分别收集上层的乙酸乙酯和下层的水。
此外,乙酸乙酯也可以通过蒸馏来提纯。
由于乙酸乙酯的沸点较低(约77℃),而水的沸点较高(100℃),因此可以利用
蒸馏的原理将乙酸乙酯从混合溶液中分离出来。
在蒸馏过程中,加热混合溶液,使乙酸乙酯汽化,然后通过冷凝管冷凝收集纯净的乙酸乙酯。
此外,还可以利用其他物理化学方法,如结晶和凝固等方法,对乙酸乙酯进行提纯。
这些方法都是基于乙酸乙酯和杂质在不同条件下的溶解度或凝固度差异实现的。
总之,乙酸乙酯的分离提纯主要依靠其与其他溶剂的溶解度差异,并通过各种物理化学方法加以利用。
这些方法可以根据具体需要选择,并结合实际情况进行操作。

乙酸乙酯的制备原理
1. 反应方程式:
乙酸 + 乙醇⇌乙酸乙酯 + 水。
2. 原理:
乙酸乙酯的制备是通过酯化反应实现的。
酯化反应是一种酸催化的酯化反应,需要乙酸和乙醇作为反应物,酸作为催化剂。
3. 催化剂:
常用的酸催化剂有硫酸、磷酸、氯化亚砜等。
这些催化剂能够提供质子(H+),促进酯化反应的进行。
4. 反应条件:
酯化反应通常在适当的温度下进行,一般在酒精的沸点以下。
反应容器中的乙酸和乙醇按一定的摩尔比例加入,然后加入酸催化剂,反应进行一段时间后,生成的乙酸乙酯可以通过蒸馏提取。
5. 原理分析:
酯化反应是一个酸催化的酯化反应,通过质子的转移,乙酸中
的羧基(-COOH)和乙醇中的羟基(-OH)发生缩合,生成乙酸乙酯。
反应的平衡常数决定了反应的方向和产物的生成量。
6. 应用:
乙酸乙酯广泛应用于溶剂、涂料、油墨、胶水、香水等工业领域。
它具有低毒性、挥发性好、溶解力强等特点,在化学实验室中
也常用作有机合成反应的溶剂。
总结起来,乙酸乙酯的制备原理是通过酸催化的酯化反应,乙
酸和乙醇在适当的条件下反应生成乙酸乙酯和水。
制备乙酸乙酯需
要选择合适的催化剂和反应条件,同时控制反应时间和摩尔比例,
以提高产率和纯度。

乙酸乙酯有关的化学方程式乙酸乙酯是一种有机化合物,化学式为CH3COOC2H5。
它是一种无色透明的液体,具有水果味,常用作溶剂和麻醉剂。
乙酸乙酯的制备和反应涉及许多化学方程式,下面将对其相关的化学方程式进行解释和描述。
1. 乙醇酸化反应:乙醇与氧气在催化剂存在下反应生成乙酸乙酯和水。
C2H5OH + CH3COOH → CH3COOC2H5 + H2O这是乙酸乙酯的主要制备方法之一。
乙醇和乙酸在催化剂的作用下发生酸化反应,生成乙酸乙酯和水。
2. 酸酐酯化反应:乙酸酐和乙醇在硫酸催化剂存在下反应生成乙酸乙酯和硫酸。
(CH3CO)2O + C2H5OH → CH3COOC2H5 + CH3COOH乙酸乙酯也可以通过乙酸酐和乙醇的酯化反应制备。
硫酸作为催化剂,促使反应进行。
3. 酮醇缩合反应:丙酮和乙醇在酸性条件下反应生成乙酸乙酯和水。
CH3COCH3 + C2H5OH → CH3COOC2H5 + H2O丙酮和乙醇可以通过酮醇缩合反应生成乙酸乙酯。
这个反应需要在酸性条件下进行。
4. 醇酯交换反应:乙醇和乙酸乙酯在碱性条件下反应生成乙醇和乙酸乙酯。
C2H5OH + CH3COOC2H5 → CH3COOC2H5 + C2H5OH乙醇和乙酸乙酯可以通过醇酯交换反应互相转化。
这个反应需要在碱性条件下进行,常用碱催化剂如氢氧化钠。
5. 氧化反应:乙酸乙酯可以被氧化剂如高锰酸钾氧化为乙酸。
CH3COOC2H5 + KMnO4 → CH3COOH + CO2 + H2O + K2MnO4乙酸乙酯可以通过氧化反应转化为乙酸。
高锰酸钾是常用的氧化剂,反应产物还包括二氧化碳、水和锰酸钾。
6. 氢解反应:乙酸乙酯可以在催化剂存在下被氢气催化氢解为乙醇和乙酸。
CH3COOC2H5 + H2 → C2H5OH + CH3COOH乙酸乙酯可以通过氢解反应被氢气催化氢解为乙醇和乙酸。
以上是乙酸乙酯相关的一些化学方程式的解释和描述。

乙酸乙酯百科名片乙酸乙酯是乙酸中的羟基被乙氧基取代而生成的化合物,结构简式为CH3COOCH2CH3。
目录[隐藏]外观与性状主要用途注意事项实验室制取乙酸乙酯参见乙酸乙酯ethyl acetate实验室制取乙酸乙酯装置乙酸乙酯又称醋酸乙酯。
纯净的乙酸乙酯是无色透明有芳香气味的液体,是一种用途广泛的精细化工产品,具有优异的溶解性、快干性,用途广泛,是一种非常重要的有机化工原料和极好的工业溶剂,被广泛用于醋酸纤维、乙基纤维、氯化橡胶、乙烯树脂、乙酸纤维树酯、合成橡胶、涂料及油漆等的生产过程中。
其主要用途有:作为工业溶剂,用于涂料、粘合剂、乙基纤维素、人造革、油毡着色剂、人造纤维等产品中;作为粘合剂,用于印刷油墨、人造珍珠的生产;作为提取剂,用于医药、有机酸等产品的生产;作为香料原料,用于菠萝、香蕉、草莓等水果香精和威士忌、奶油等香料的主要原料。
我们所说的陈酒很好喝,就是因为酒中含有乙酸乙酯。
乙酸乙酯具有果香味。
因为酒中含有少量乙酸,和乙醇进行反应生成乙酸乙酯。
因为这是个可逆反应,所以要具有长时间,才会积累导致陈酒香气的乙酸乙酯。
[1]名称名称1:乙酸乙酯ethyl acetate名称2:醋酸乙酯acetic esterCAS No.:141-78-6分子式C4H8O2结构式CH3COOC2H5相对分子质量88.11球棍模型存在:除人工合成外,还存在于许多酒以及菠萝、香蕉等果品中。
[编辑本段]外观与性状外观:无色澄清液体。
比例模型香气:有强烈的醚似的气味,清灵、微带果香的酒香,易扩散,不持久。
熔点(℃):-83.6折光率(20℃):1.3708--1.3730沸点(℃):77.06相对密度(水=1):0.894--0.898相对蒸气密度(空气=1): 3.04饱和蒸气压(kPa):13.33(27℃)燃烧热(kJ/mol):2244.2临界温度(℃):250.1临界压力(MPa): 3.83辛醇/水分配系数的对数值:0.73闪点(℃)(开杯):7.2引燃温度(℃):426爆炸上限%(V/V):11.5爆炸下限%(V/V): 2.0室温下的分子偶极距:6.555*10^-30溶解性:微溶于水,溶于醇、酮、醚、氯仿等多数有机溶剂。
乙酸乙酯的制备实验报告实验目的:通过酯化反应制备乙酸乙酯,并了解酯化反应的基本原理和实验操作技术。
实验原理:乙酸乙酯是一种常见的酯类化合物,其制备主要通过酯化反应来实现。
酯化反应是酸和醇在酸催化下发生的一种酯键的形成反应。
在本实验中,我们将乙酸和乙醇在硫酸的催化下进行酯化反应,生成乙酸乙酯和水。
实验仪器与试剂:1. 实验仪器,反应釜、冷却器、滴液漏斗、蒸馏设备等。
2. 实验试剂,乙酸、乙醇、浓硫酸。
实验步骤:1. 在反应釜中加入适量的乙酸和乙醇,然后加入少量的浓硫酸作为催化剂。
2. 将反应釜连接至冷却器,并进行加热,使反应液发生酯化反应。
3. 在反应结束后,将产生的混合物进行蒸馏,分离出乙酸乙酯。
实验结果与分析:通过实验操作,我们成功地制备出了乙酸乙酯。
在蒸馏过程中,我们得到了透明的无色液体,这就是我们所需的乙酸乙酯。
而在蒸馏残渣中,我们也观察到了少量的水的存在。
实验结论:通过本次实验,我们深入了解了酯化反应的原理和实验操作技术。
同时,我们也成功地制备出了乙酸乙酯,并对其进行了初步的分析。
这次实验不仅帮助我们加深了对酯化反应的理解,也为我们今后的化学实验打下了良好的基础。
实验注意事项:1. 在操作过程中,要注意安全第一,避免接触有毒化学品。
2. 实验结束后,要及时清洗实验仪器,保持实验环境的整洁。
3. 在进行酯化反应时,要控制好反应温度和反应时间,避免产生副反应。
通过本次实验,我们不仅学会了制备乙酸乙酯的方法,也对酯化反应有了更深入的了解。
希望在今后的实验中,能够继续努力,不断提高实验操作技术,为化学研究做出更大的贡献。
化学品安全技术说明书第一部分化学品及企业标识化学品中文名:乙酸乙酯化学品英文名:ethyl acetate;acetic acid ethyl ester化学品别名:醋酸乙酯CAS No.:141-78-6EC No.:205-500-4分子式:C4H8O2产品推荐用途:用途广泛,是一种重要的有机化工原料和工业溶剂。
第二部分危险性概述紧急情况概述:液体。
高度易燃,其蒸气与空气混合,能形成爆炸性混合物。
对眼睛有严重刺激性。
气体可能会引起头晕或窒息。
GHS 危险性类别:根据根据《危险化学品分类信息表》(2015)危险性类别判定,该产品分类如下:易燃液体,类别2;眼损伤/眼刺激,类别2A;特定目标器官毒性-单次接触:麻醉效应,类别3。
标签要素象形图警示词:危险危险信息:高度易燃液体和蒸气,造成严重眼刺激,可能造成昏睡或眩晕。
预防措施:远离热源、热表面、火花、明火以及其它点火源。
禁止吸烟。
保持容器密闭。
容器和接收设备接地和等势联接。
使用不产生火花的工具。
采取措施,防止静电放电。
避免吸入粉尘/烟/气体/烟雾/蒸气/喷雾。
作业后彻底清洗。
受沾染的工作服不得带出工作场地。
戴防护手套/穿防护服/戴防护眼罩/戴防护面具。
事故响应:求医/就诊。
如误吸入:将受人转移到空气新鲜处,保持呼吸舒适的体位。
如仍觉眼刺激:求医/就诊。
如皮肤(或头发)沾染:立即去除/脱掉所有沾染的衣服。
用水清洗皮肤或淋浴。
如进入眼睛:用水小心冲洗几分钟。
如戴隐形眼镜并可方便地取出,取出隐形眼镜。
继续冲洗。
安全储存:存放在通风良好的地方。
保持容器密闭。
存放在通风良好的地方。
保持低温。
废弃处置:按照地方/区域/国家/国际规章处置内装物/容器。
物理化学危险:高度易燃液体,其蒸气与空气混合,能形成爆炸性混合物。
健康危害:吸入蒸气可能引起瞌睡和头昏眼花,可能伴随嗜睡、警惕性下降、反射作用消失、失去协调性并感到眩晕。
吸入该物质可能会引起对健康有害的影响或呼吸道不适。
乙酸乙酯的合成(酯化反应)乙酸乙酯是一种重要的有机化合物,广泛应用于日常生活和工业生产中。
它可以用作溶剂、香料、涂料、油墨等行业的原料,同时也被广泛用于高级化学品合成和医药生产。
本文将介绍乙酸乙酯的合成方法——酯化反应。
一、酯化反应的原理酯化反应是指酸与醇在催化剂的作用下发生的化学反应,生成酯和水的过程,可简单表示为以下方程式:RCOOH + R'OH ⇋ RCOOR' + H2O其中,RCOOH为酸,R'OH为醇,RCOOR'为酯,H2O为水。
这是一个可逆反应,向左反应称为“酸水解”,向右反应称为“酯化反应”。
酯化反应的主要催化剂包括硫酸、盐酸、氢氧化钠、氢氧化钾等,其中硫酸是较常用的催化剂,因其对反应的加速作用明显且价格较低。
乙酸乙酯是一种二元酯,由乙酸和乙醇在硫酸催化下酯化而成。
反应方程式如下:在实验室中,常用浓硫酸作为催化剂,将乙酸和乙醇按摩尔比1:1加入反应瓶中,旋转振荡混合并冷却。
反应过程中,应该加入足量的干燥剂,以吸收反应过程中产生的水分,保持反应的持续进行。
在反应结束后,用食用苏打粉或氢氧化钠溶液中和反应瓶中剩余的酸,并加入适量的水,使得酯化产物乙酸乙酯从上层分离出来。
将有机相过滤、蒸馏和脱水,即可得到纯度较高的乙酸乙酯。
三、实验注意事项1.实验室中酸和醇均为易燃、易挥发的有机物,需注意安全措施,加入量应避免过多;2.应使用足量的干燥剂,防止水分对反应造成影响;3.实验过程中,应尽量避免反应混合物溢出,以免污染实验室环境;4.在反应结束后,应稍作加热脱水,避免反应瓶中留有过多的水分;5.实验结束后,应做好废液的处理工作,以保证实验室卫生和安全。
四、结语乙酸乙酯的合成是酯化反应的一个典型应用。
该反应具有简单、高效、成本低等特点,因此在工业生产和实验室中得到了广泛的应用。
通过对酯化反应原理和乙酸乙酯的合成过程的介绍,可以进一步了解化学反应的基本原理和实验操作技能。
乙酸乙酯的水解反应机理乙酸乙酯是一种无色透明的液体,具有愉悦的香气,常用作溶剂和香料成分。
它是乙酸和乙醇反应生成的酯类。
乙酸乙酯的水解反应机理包括酸催化和碱催化两种情况。
1.酸催化水解反应机理:首先,乙酸乙酯在酸性条件下发生水解。
通常使用硫酸或磷酸作为催化剂。
反应的机理如下:第一步:乙酸乙酯在酸催化下与水发生酯酸反应,生成乙醇和乙酸。
CH3COOC2H5 + H2O → CH3COOH + C2H5OH第二步:乙酸与催化剂再次发生酯酸反应,生成酯水合物。
CH3COOH + H2O → CH3COOH2O第三步:酯水合物进一步发生酸解作用,失去乙基,生成乙酸和水。
(CH3COOH2O) + H2O → CH3COOH + H3O+整个反应的总方程式为:CH3COOC2H5 + H2O → CH3COOH + C2H5OH这个反应是一个可逆反应,水是生成物,同时也是底物,因此反应向右的方向进行完全,生成产物乙醇和乙酸。
2.碱催化水解反应机理:乙酸乙酯在碱性条件下也可以水解,常用的碱催化剂有氢氧化钠和醇钠等。
碱催化下的反应机理如下:第一步:乙酸乙酯在碱性条件下与水发生酯水解反应,生成乙醇和乙酸盐离子。
CH3COOC2H5 + H2O → CH3COO- + C2H5OH第二步:乙酸盐离子与碱发生酸碱反应,生成乙酸和碱盐的共轭碱。
CH3COO- + Na+OH- → CH3COOH + Na+O-整个反应的总方程式为:CH3COOC2H5 + H2O + Na+OH- → CH3COOH + Na+O- + C2H5OH这个反应也是可逆反应,水和碱盐的共轭碱是生成物,同时也是底物,因此反应向右的方向进行完全,生成产物乙醇和乙酸。
总结起来,乙酸乙酯的水解反应分为酸催化和碱催化两种情况。
在酸催化下,乙酸乙酯首先与水发生酯水解反应生成乙醇和乙酸,然后进一步发生酸解作用产生乙酸和水。
在碱催化下,乙酸乙酯首先与水发生酯水解反应生成乙醇和乙酸盐离子,然后与碱发生酸碱反应生成乙酸和碱盐的共轭碱。