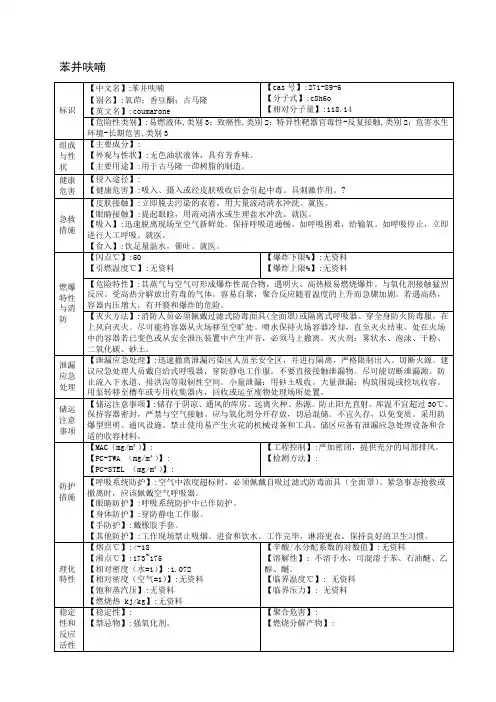
苯并二呋喃酮的无溶剂绿色合成研究
- 格式:pdf
- 大小:251.12 KB
- 文档页数:4

综合化学实验山西大学化学化工学院综合化学实验室2015 年 3 月前言化学是一门实践性很强的学科。
化学实验是培养学生动手能力、实验技能乃至创新意识的重要课程。
进入九十年代以来,我国高等教育思想发生了重大变革,就是推行素质教育,为适应化学专业以素质教育为中心的“厚基础,宽口径”专业体系建立,山西大学化学化工学院实验教学中心于2003年对在原二级学科设立的专业教育课程和专业实验课程进行整合、重组,成立综合化学实验室,新开设《综合化学实验》这门专业必修实验课程。
该课程是本科生在完成各门基础化学实验之后向毕业论文阶段过渡的一个重要教学环节,并融合了我院部分教师的科研成果,将科研优势转化为教学优势,使学生从实验中领悟科学探索和研究的方法,创新意识和创新能力得到更好的启迪和培养。
由于编者水平所限,以及实验内容选择受到实验室条件的制约,本讲义难免存在许多不足,希望实验教师和学生在使用中提出宝贵意见,共同来修改完善。
编者2010年3月目 录实验一 安息香的合成及表征实验二 安息香衍生物的合成及表征实验三 槐米中芦丁、槲皮素的提取、分离及含量测定实验四[Co(Ⅱ)Salen ]配合物的制备和载氧作用实验五 三乙二胺合钴配离子光学异构体的制备、离析和旋光度测定 实验六 荧光粉Y 2O 2S ∶Eu 的高温合成实验七 硫酸促进型氧化铝固体超强酸的制备及电位滴定法测定实验八 电化学分析方法实验九 溶胶-凝胶法固定α-淀粉酶及其活性测定实验十 成核剂1,3-2,4-二(对甲基苄基)山梨醇(MDBS)的合成与表征 实验十一 浸渍法制备Pd/ -Al 2O 3催化剂实验十二 连续流动微型催化反应器评价催化剂活性实验一安息香的合成及表征一实验目的学习辅酶催化合成安息香的反应原理及其合成方法,利用红外光谱表征其分子结构。
二实验原理本实验采用了有生物活性的辅酶维生素B1(Thiamine)来代替剧毒的氰化物完成安息香缩合反应,反应时,维生素B1 分子中的噻唑环上的氮原子和硫原子邻位的氢,在碱的作用下可生成负碳离子(Ⅳ)。



植物生长调节剂苯肽胺酸的绿色合成研究程伟琴;赵增兵;成兰兴;王毅楠;冯明;王延花;霍二福【摘要】以苯酐和苯胺为原料,自配混合溶剂A为溶剂,不添加任何催化剂,室温下反应制备高纯度的植物生长调节剂苯肽胺酸;采用反应母液循环利用的方法,不仅可提高反应收率,还可以降低生产成本及减少有机溶剂对环境的污染.通过原料投料比、反应时间及反应温度等反应条件对比实验,获得最佳的反应条件;通过熔点,红外光谱和核磁共振氢谱对目标产物进行表征.%The high purity plant growth regulator phthalanillic acid was synthesized through anhydride and aniline as raw materials and self-mixing solvent A as reaction solvent under the room temperature condition.Then,the method of recycle the reaction mother liquid was adopted which not only can improve the reaction yield,but also cut down the cost of production and reduces the environmental pollutionof organic solvents.Moreover,the optimum reaction conditions were obtained by compared experiments of the reaction conditions,such as material ratio,reaction time and reaction temperature.The structure of the product was confirmed by melting point,FT-IR and 1H NMR.【期刊名称】《化学工程师》【年(卷),期】2017(031)009【总页数】3页(P15-17)【关键词】苯肽胺酸;植物生长调节剂;绿色合成【作者】程伟琴;赵增兵;成兰兴;王毅楠;冯明;王延花;霍二福【作者单位】河南省化工研究所有限责任公司,河南郑州450052;河南省精细化工中间体工程技术研究中心,河南郑州450052;河南省化工研究所有限责任公司,河南郑州450052;河南省精细化工中间体工程技术研究中心,河南郑州450052;河南省化工研究所有限责任公司,河南郑州450052;河南省精细化工中间体工程技术研究中心,河南郑州450052;河南省化工研究所有限责任公司,河南郑州450052;河南省精细化工中间体工程技术研究中心,河南郑州450052;河南省化工研究所有限责任公司,河南郑州450052;河南省精细化工中间体工程技术研究中心,河南郑州450052;河南省化工研究所有限责任公司,河南郑州450052;河南省精细化工中间体工程技术研究中心,河南郑州450052;河南省化工研究所有限责任公司,河南郑州450052;河南省精细化工中间体工程技术研究中心,河南郑州450052;河南省科学院质量检验与分析测试研究中心,河南郑州450008【正文语种】中文【中图分类】O625.6N-苯基邻苯二甲酸单酰胺又名苯肽胺酸,在生物、医学及生命科学领域都有着广泛的应用[1]。

第三章有机化合物的制备实验实验十环己烯的制备一、实验目的1.学习环己醇在酸催化作用下分子内脱水制备环己烯的原理和方法。
2.了解分馏原理及其基本操作。
二、实验原理醇在脱水剂作用下分子内脱去一分子水而形成烯烃。
主反应:OH85%+H O342副反应:OH34+H O22O三、仪器与试剂仪器:图1.8分馏装置和图1.6普通蒸馏装置。
试剂:环己醇 10g(10.4mL,0.1mol),85% 磷酸 5mL,氯化钠 1g,无水氯化钙 1~2g,5%碳酸钠溶液 4mL 。
四、实验步骤在50mL 干燥的圆底烧瓶中,分别加入 10g 环己醇(10.4mL)(1),5mL85% 磷酸(2),充分摇荡使两种液体混合均匀。
投入几粒沸石,按图1.8安装好分馏装置。
用小锥形瓶作接收器,置于冷水浴中。
用小火慢慢加热混合物至沸腾,以较慢速度进行蒸馏,控制分馏柱顶部温度不超过73℃(3)。
当无液体蒸出时,可适当加大火源,继续蒸馏。
当温度达到 85℃时,停止加热,馏出液为环己烯和水的浑浊液。
在馏出液中分批加入约 1g 食盐,使之饱和。
再加入 3~4mL5% 的碳酸钠溶液,以中和其中的微量酸。
然后,将上述液体倒入分液漏斗中,振荡后静止分层。
分出下面的水层,将有机层转入干燥的小锥形瓶中,加入适量无水氯化钙将其干燥(4)。
将干燥后澄清透明的粗环己烯滤入 30mL 蒸馏瓶中,加入几粒沸石,加热蒸馏收集80℃~85℃馏分。
所用的蒸馏装置必须是干燥的。
产量:4~5g 。
纯环己烯为无色透明液体,沸点 83℃,n201.4465。
环己烯的红外光谱图见图3.1。
D本实验约需 4h 。
有 机 化 学 实 验图3.1 环己烯的红外光谱图五、注释(1)环己醇在常温下是粘稠液体,如果用量筒量取,约 12.4mL ,应注意转移过程中的损失。
也可用称量法称取。
(2)脱水剂用磷酸或硫酸均可。
磷酸的用量是硫酸用量的 2 倍。
但用磷酸的好处一是反应中不生成碳渣,二是反应中无刺激性气体生成。

降血脂药非诺贝特的绿色合成李敢;王德堂;时光侠;刘颖;夏先伟;肖先举【摘要】The esterification of fenofibrate acid with isopropyl alcohol was studied with sodium bisulfate as catalyst and dimethylbenzene as water carrying agents.The effects of different factors such as mole ratio of reactants, catalyst dosage and amount of carrying agent on the yield of fenofibrate were investigated.The experimental results showed that sodium bisulfate monohydrate exhibited excellently catalytic activity.The optimum reaction conditions were found as follows:0.1 mol fenofibrate acid, mole ratio of isopropyl alcohol to fenofibrate acid was 3.5:1, the weight of the catalyst was 3.5 g, 40 mL dimethylbenzene, and refluxing reaction time was 30 min.Under these conditions, the yield of fenofibrate was up to 88.6%.The catalyst could be repeatedly used for five times without lossing its catalytic activity.The structure was characterized by IR.%以一水合硫酸氢钠为催化剂,二甲苯为带水剂,对非诺贝特酸与异丙醇的酯化反应进行了研究,考察了醇酸摩尔比、催化剂用量、带水剂用量等因素对非诺贝特产率的影响。

苯并噻唑衍生物参与的开环反应研究苯并噻唑衍生物参与的开环反应研究引言:苯并噻唑衍生物是一类含有苯并噻唑骨架结构的有机化合物。
由于其独特的化学性质和广泛的生物活性,苯并噻唑衍生物在药物开发、农药研究和材料科学等领域受到了广泛的关注。
开环反应作为有机合成中的重要反应类型之一,对于构建复杂有机分子架构具有重要意义。
本文将介绍苯并噻唑衍生物参与的开环反应研究进展,并对其在药物发现和材料科学领域的应用进行展望。
一、苯并噻唑衍生物的结构特点苯并噻唑衍生物具有苯和噻唑两个环的共轭结构,其结构特点决定了其具有较高的稳定性和生物活性。
该类化合物可以通过合成方法合成,如:路易斯酸催化、金属催化等。
目前,已经发展出许多合成方法来获得不同取代基的苯并噻唑衍生物。
二、苯并噻唑衍生物参与的开环反应研究进展1. 烯酮开环反应烯酮开环反应是一种有效构建环结构的方法,苯并噻唑衍生物可以通过参与烯酮开环反应来获得多样的环结构。
以苯并噻唑环为基础结构,通过引入氧、硫或氮等原子,可以获得具有不同功能团的化合物。
该反应不仅可以用于有机合成,也可以应用于药物分子的改造和功能材料的制备。
2. 环腈开环反应环腈开环反应是另一种重要的开环反应类型,可以构建苯并噻唑衍生物的骨架。
该反应通常通过叠氮化合物加成到环腈上来形成环中的叠氮键,从而实现环的开合。
苯并噻唑衍生物通过环腈开环反应可以得到具有不同取代基和官能团的化合物,丰富了其结构多样性和应用领域。
3. 环酯开环反应环酯开环反应是一种重要的合成方法,可获得具有苯并噻唑骨架的环酯化合物。
该方法的优点在于反应条件温和、反应选择性高,且产率较高。
通过该反应可以合成一系列环酯化合物,并通过后续的改造反应获得具有不同生物活性的分子。
三、苯并噻唑衍生物在药物和材料科学领域的应用展望苯并噻唑衍生物作为一类具有独特结构和广泛生物活性的化合物,其在药物开发和材料科学领域具有广泛的应用前景。
1. 药物开发苯并噻唑衍生物在抗肿瘤、抗炎、抗感染等领域显示出潜在的活性。

2019年6月| 632 结果与讨论二(三氯甲基)碳酸酯是一种白色结晶固体,又被称之为固体光气,将其作为氧化剂使用,会有氯化氢、二氧化碳等副产物生成,两者与反应体系皆不溶,因此会以气化的方式排出,当水吸收了氯化氢之后可完成盐酸的制备。
故而,与传统氯化亚砜相对比而言,将氧化剂另选为二(三氯甲基)碳酸酯,会将环境受到的危害有效降低。
对2-硝基-4-甲砜基苯甲酸于二(三氯甲基)碳酸酯氧化反应过程中收率受到的物料配比影响进行考察。
倘若2-硝基-4-甲砜基苯甲酸、二(三氯甲基)碳酸酯、原料摩尔比依次分别为:(1)24.5g、10.4g、1:0.35;(2)24.5g、9.8g、1:0.33;(3)24.5g、9.5g、1:0.32,其产品质量、收率及纯度也依次分别为:(1)25.8g、97.6%、96.5%;(2)25.1g、97.5%、93.8%;(3)23.4g、98.0%、87.9%。
根据上述数据不难发现,氯化反应后得到了97.0%纯度以上的中间体,n(2-硝基-4-甲砜基苯甲酸):n(二(三氯甲基)碳酸醋)比值为1:0.35时,可实现最佳的产品收率。
而对缩合反应中原料配比对收率的影响进行考察。
倘若2-硝基-4-甲砜基苯甲酸、 1,3-环己二酮、原料摩尔比依次分别为:26.3g、12.0g、1:1.09;(2)26.3g、12.2g、1:1.11;(3)26.3g、12.4g、1:1.13,其产品质量、收率及纯度也依次分别为:(1)28.7g、95.0%、81.2%;(2)29.5g、95.2%、83.6%;(3)30.0g、95.5%、85.3%。
根据上述数据得知,缩合重排反应后获得了高达95.0%纯度以上的硝磺草酮,n(2-硝基-4-甲砜基苯甲酸):n(1,3-环己二酮)比值为1:1.15时,可实现最佳的产品收率。
3 结语原料选用2-硝基-4-甲砜基苯甲酸,通过氯化、缩合、重排反应完成硝磺草酮的制备,纯度超过95.0%、收率超出87.0%。

药物化学及药物合成反应实验指导书(供药学、制药工程、药剂、药学专升本、药学专科、药分专科专业用)药物化学-制药工程教研室编写安徽中医学院自编前言我国加入世界贸易组织(WTO)以来,制药行业迎来难得的发展机遇,也面临着前所未有的挑战。
我国的药物研究正经历着一个从仿制为主到创制新药为主的历史性转变时期,如何抓住机遇,顺利实现这个历史性转变,关键在于创新型人才的培养。
药物化学是药学类各专业和制药工程专业重要的专业课,也是一们实验性很强的课程,在药学类创新型人才培养方面发挥着重要作用。
安徽中医学院药物化学-制药工程教研室积极探索药物化学与药物合成反应实验课教学改革,并依据药物化学及药物合成反应教学大纲的要求编定了本实验指导用书,目的是通过实验加深理解药物化学的基本理论和基本知识,掌握合成药物的基本方法,掌握对药物进行结构改造与修饰的基本方法,了解拼合原理在药物化学中的应用,进一步巩固有机化学实验的操作技术及有关理论知识,培养学生理论联系实际的作风,实事求是,严格认真的科学态度与良好的工作习惯。
在实验指导用书的编写中,介绍了药物的绿色合成内容和文献来源,安排了一些中药有效成分的合成,以及中药活性物质的结构修饰与改造内容,充分体现了中医药院校的特色和实用性。
本实验指导用书由三部分组成,第一部分介绍了实验室的安全常识和基本知识;第二部分介绍了十六个药物合成和中药有效提取、合成及结构改造与修饰内容;第三部分为附录介绍了生产工艺中避免使用和限制使用的溶剂和部分与药物化学或合成相关的文献来源,供实际工作中参考使用。
本实验教材是药化化学-制药工程教研室教学经验的集体总结,限于水平,难免有误,我们要在使用过程中不断总结经验,收集反映,以便进一步修正提高。
安徽中医学院药物化学-制药工程教研室2008年12月目录第一部分实验须知一、实验室安全二、化学药品、试剂的存储及使用三、废品的销毁四、实验室中一般注意事项五、实验记录和实验报告第二部分实验项目一、苯妥英的制备二、贝诺酯的制备三、磺胺醋酰钠的制备四、对羟基苯乙酮的制备五、桂皮酰哌啶的制备六、烟酸的制备七、香豆素-3-羧酸的合成八、苯佐卡因的合成九、1,4-二氢吡啶类钙离子拮抗剂的绿色合成十、阿司匹林的合成十一、哌嗪枸橼酸盐的合成十二、阿魏酸哌嗪盐的合成十三、氟哌酸的合成十四、去甲斑蝥素中间体的合成十五、苦参生物碱的提取十六、氧化苦参碱的化学合成附录一:生产工艺中避免使用和限制使用的溶剂附录二:部分与药物化学或合成相关的文献来源第一部分实验须知一、实验室安全药物化学及药物合成反应和有机化学一样是一门实践性很强的学科,因此,在进入实验室工作之前,希望参加实验者必须对实验课程的内容,要有充分的准备,而且要通晓实验室的一些基本规则,遵守实验室安全操作须知,才能避免可能发生的一些危险情况。
第41卷第6期 2013年12月 浙江工业大学学报
J0URNAL OF ZHEJIANG UNIVERSITY OF TECHNOLOGY VolI 41 NO.6
Dec.2Ol3
苯并二呋喃酮的无溶剂绿色合成研究 李郁锦。徐凤双。黄焕明,余武斌,高建荣 (浙江工业大学绿色化学合成技术国家重点实验室培育基地,浙江杭州310032)
摘要:研究了在酸催化条件下苯并二呋喃酮的无溶剂绿色合成新工艺,以对苯二酚和扁桃酸为原 料,探索和优化了工艺参数:扁桃酸、对苯二酚和98 硫酸的摩尔比为2:1:0.5,反应温度为130 ℃,反应时间4 h,以70 的收率得到产物苯并二呋喃酮.在此基础上,进一步合成了4个对称型烷 氧基取代苯并二呋喃酮,收率在56 到70 之间.该工艺具有低污染、低能耗、操作简便及反应效 率高等优点,为苯并二呋喃酮的绿色合成工艺开发提供了一定的理论依据和可行的工艺参数. 关键词:苯并二呋喃酮;无溶剂;扁桃酸;酸催化 中图分类号:O626.11 文献标志码:A 文章编号:1006—4303(2013)06—0620—04
Solvent—free synthesis of benzodifuranones LI Yu-jin,XU Feng—shuang,HUANG Huang—ming,YU Wu—bin,GAO Jian—rong (State Key Laboratory Breeding Base of Green Chemistry-Synthesis Technology,Zhejiang University of Technology,Hangzhou 310032,China)
Abstract:The solvent—free process for prepared benzodifuranone catalyzed by 9 8 H2 SO4 was studied in this paper.Starting from hydroquinone and mandelic acids,the optimum process was conducted as follows:the molar ratio of mandelic acid,hydroquinone and concentrated sulfuric acid as 2:1:0.5,at 130℃reacted for 4 h,produced benzodifuranone in 70 yield.Further four symmetrical benzodifuranones with alkoxy substituded were synthesized in middle yield. This green synthesis of benzodifuranones has the advantages such as low pollution,low energy consumption,convenient operation and high reaction efficiency,etc..It provides a theoretical basis and feasible parameters for the green synthesis of benzodifuranones.
Key words:benzodifuranone;solvent—free;mandelic acid;acid catalyze 苯并二呋喃酮系分散染料是上世纪8O年代日 本住友公司和英国ICI公司联合开发出的一类高坚 牢度分散染料口],以其色泽鲜艳、发色值高、耐光性 佳、提升力好,特别是其优越的耐洗牢度,引起了人 们的高度重视,成为超细旦纤维用染料的一个优良 品种 ].迄今为止,各大公司在苯并二呋喃酮系染 料的开发上做了大量工作,开发了一系列的苯并二 呋喃酮系分散染料__6 . 因原料的不同,苯并二呋喃酮主要有三条合成
路线:苯醌路线L1 、四氯苯醌路线n 和氢醌(苯二 酚)路线口 ,其中氢醌路线相对经济有效.该路线 其合成方法主要有乙酸法_7 ¨]、硫酸法[1 和甲苯 法Ⅲl 三种.这些方法往往需要在大量的酸存在下进 行,存在废酸量大、溶剂量大、后处理复杂和生产成 本高等问题.近年来,随着绿色化学的深入研究,越 来越多的科学家将有机合成的研究重点放在对环境 无污染的绿色合成上.绿色合成要求反应或合成过 程中采用无毒的试剂、溶剂或催化剂口 ,避免或减
收稿日期:2013—01-23 基金项目:国家自然科学基金资助项目(21176223);浙江省自然科学基金资助项目(Y407306) 作者简介:李郁锦(1976),女,浙江武义人,副教授,博士,研究方向为精细有机合成与绿色化学研究,E-mail:lyizjut@ziut.edu.com. 第6期 李郁锦,等:苯并二呋喃酮的无溶剂绿色合成研究 少合成过程中酸和溶剂的使用对苯并二呋喃酮合成 工艺具有重要的意义.我们在查阅文献的基础上研 究了酸催化条件下苯并二呋喃酮的无溶剂合成,实 现了苯并二呋喃酮的绿色合成工艺开发.并对反应 的催化剂及催化剂用量、温度和时间等条件进行了 优化. 1 实验部分 1.1试剂与仪器 实验中所用的仪器:Bruker Avance llI 500 MHz核磁共振仪;PerkinElmer ELAN DRC—e电感 耦合等离子体质谱仪;Varian 210一GCMS.所有试剂 都为直接购买的AR级. 1.2实验操作 1.2.1取代扁桃酸的制备 取代扁桃酸的合成式为 0 。 相转移催化剂 H3CO 0H co 在装有机械搅拌的100 mL四口烧瓶中,加入 6.8 g(O.05 mo1)茴香醛、12.0 g(0.1 mo1)三氯甲烷 和0.5 g相转移催化剂,搅拌并缓慢升温至6O℃, 控制反应液温度在6O~65℃滴加50 NaOH水 溶液12.5 mL,65℃反应6 h至反应液接近中性.冷 却至室温,用8 ~10 的盐酸酸化至溶液pH≈1, 乙醚萃取(20 mL×3),合并有机层,无水Na SO 干 燥,减压蒸馏除去乙醚,得黄色粘稠液体,加入甲苯 20 mL,置于冰浴中冷却结晶得微黄色粗产物7.3 g,甲苯重结晶,活性炭脱色,得白色固体6.0 g,收 率65.8 ,mp:102 ̄103℃ . 1.2.2 苯并二呋喃酮的合成典型操作 苯并二呋喃酮的合成式为 O.H H SO O ¨ 人c0 H Ph 狮。 , Ph Ia Ph o Ph IIa 3,7一二苯一2,6一二酮一2,6一二氢苯并[1,2-b:4,5一 b3--呋喃(II a)的合成:在玛瑙研钵中依次加入 98 浓硫酸(0.05 g,0.5 mmo1)、DL一扁桃酸 (0.304 3 g,2.0 mmo1)和对苯二酚(0.110 1 g,1.0 retoo1),研磨均匀,恒温130℃反应4 h,冷却后转移 至10 mL试管中,加入乙酸2 g,30 过氧化氢水溶 液(0.23 g,2.0 retoo1),搅拌反应5 h,冷却待固体析 出完全,离心,除去上清液,并用少量乙酸洗涤,所得 红褐色固体真空干燥,得II a粗品,甲苯重结晶得暗 红色片状固体. Ⅱa(0.237 6 g,70 9/6),m.P.300~301℃: H NMR(500 MHz,CDC1。): 一7.80(d,4H,J一 7.0Hz,ArH),7.49~7.56(m,6H,ArH),6.92(S, 2H).FT—IR(KBr),v(cm )3 080(C—H),1 759 (C—O),1 579(C=一C),1 444,1 366,1 219 (C-一0一C).Elem.Ana1.Calcd for C22 H12 O4:C 77.64,H 3。55.Found:C 77.49,H 3.53. 1ib(0.242 2 g,66 ):123.P.>3OO℃: H NMR (500 MHZ,CDC13), 一7.71(d,4H,J一8.0 HZ, ArH),7.34(d,4H,J一8.5 Hz,ArH),6.89(S, 2H),2.44(S,6H,CH3);EI—MS m/z:368(46.3 , M ),128(100 ).FT—IR(KBr),v(cm ):3 050 (一C—H),2 900(C—H),1 766(C—O),1 580 (C—C),1 370,1 216(C一0一C).Elem.Ana1. Calcd for C24 H16 O4:C 78.25,H 4.38;Found:C 77.96,H 4.38. Ⅱc(0.224 5 g,56 ): H NMR(500 MHz, CDC13):艿一7.82(d,4H,J一9.0 Hz,Ar),7.34(d, 4H,J一8.5 Hz,ArH),6.90(S,2H),3.90(S,6H, oCH3);EI—MS m/z:400(100 ,M。。). Hd(0.2538 g,56 9/6):EI—MS m/z:456(100 , M ).
2结果与讨论 以扁桃酸和对苯二酚为模型底物,筛选了催化 剂、温度以及原料配比等反应条件. 2.1反应条件的筛选 2.1.1 催化剂的筛选 首先我们考察了不同酸催化剂对该反应的促进 作用,具体实验结果如表1所示.在本实验中我们考 察了实验室常用的质子酸及路易斯酸对苯并二呋喃 酮的促进作用.由表1可以看出:所选的9种酸中, 98%浓硫酸的反应效果最佳,能够以67 的收率得 到产物苯并二呋喃酮.在质子酸中,乙酸酐和多聚磷 酸催化下并没有得到产物,主要的原因可能是由于 酸性较弱不能催化扁桃酸与对苯二酚的环合反应. 磷酸催化下只能得到半缩环的中间体.在所选择的 Lewis酸中,氯化锌和氯化亚锡均有一定的催化活