铁铜化学性质概括
- 格式:doc
- 大小:88.00 KB
- 文档页数:4


铁、铜的性质
(一)铁及其化合物的性质
1、铁在周期表中的位置及结构
铁位于第四周期第Ⅷ族,电子排布式为:1s22s22p63s23p63d64s2
原子结构示意图为
在化学反应中易失去两个或三个电子形成+2或+3价:Fe―2e―=Fe2+;Fe―3e―=Fe3+
2、纯铁具有银白色光泽、密度大,熔沸点高,延展性、导电、导热性较好、能被磁铁吸引。纯铁的抗腐蚀能力很强,通常我们所见的铁中由于含有碳等物质,抗腐蚀能力较弱,易发生电化腐蚀。
在酸性介质中发生:析氢腐蚀:负极:Fe-2e-=Fe2+;正极反应为:2H+=H2;
在中性或碱性介质中发生:吸氧腐蚀:负极:Fe-2e-=Fe2+;正极反应为:2H2O+O2+4e- =4OH-
3、化学性质:铁是较活泼的金属,易失去最外层和次外层的电子,常显+2、+3价,且Fe3+比Fe2+稳定。
(1)与非金属反应:铁与强氧化剂反应生成+3价铁的化合物,与弱氧化剂反应生成+2价铁的化合物。如:
3Fe+2O2Fe3O4;2Fe+3Cl22FeCl3;Fe+S FeS
(2)与水反应:铁在加热至红热时能与水蒸气发生反应。
3Fe+4H2O(g)Fe3O4+4H2
常温下,铁与水不起反应,但在水和空气里O2、CO2等共同作用下,铁易被腐蚀。
(3)与酸反应:非氧化性酸:Fe+2H+=Fe2++H2↑
氧化性酸:常温下,铁遇浓硫酸、浓硝酸会钝化,加热条件下可发生氧化还原反应。
Fe+4HNO3(过量)=Fe(NO3)3+NO↑+2H2O
3Fe(过量)+8HNO3=3Fe(NO3)2+2NO↑+4H2O
Fe+6HNO3(浓)Fe(NO3)3+3NO2↑+3H2O
(4)与盐溶液反应:Fe+Cu2+=Fe2++Cu;Fe+2Fe3+=3Fe2+
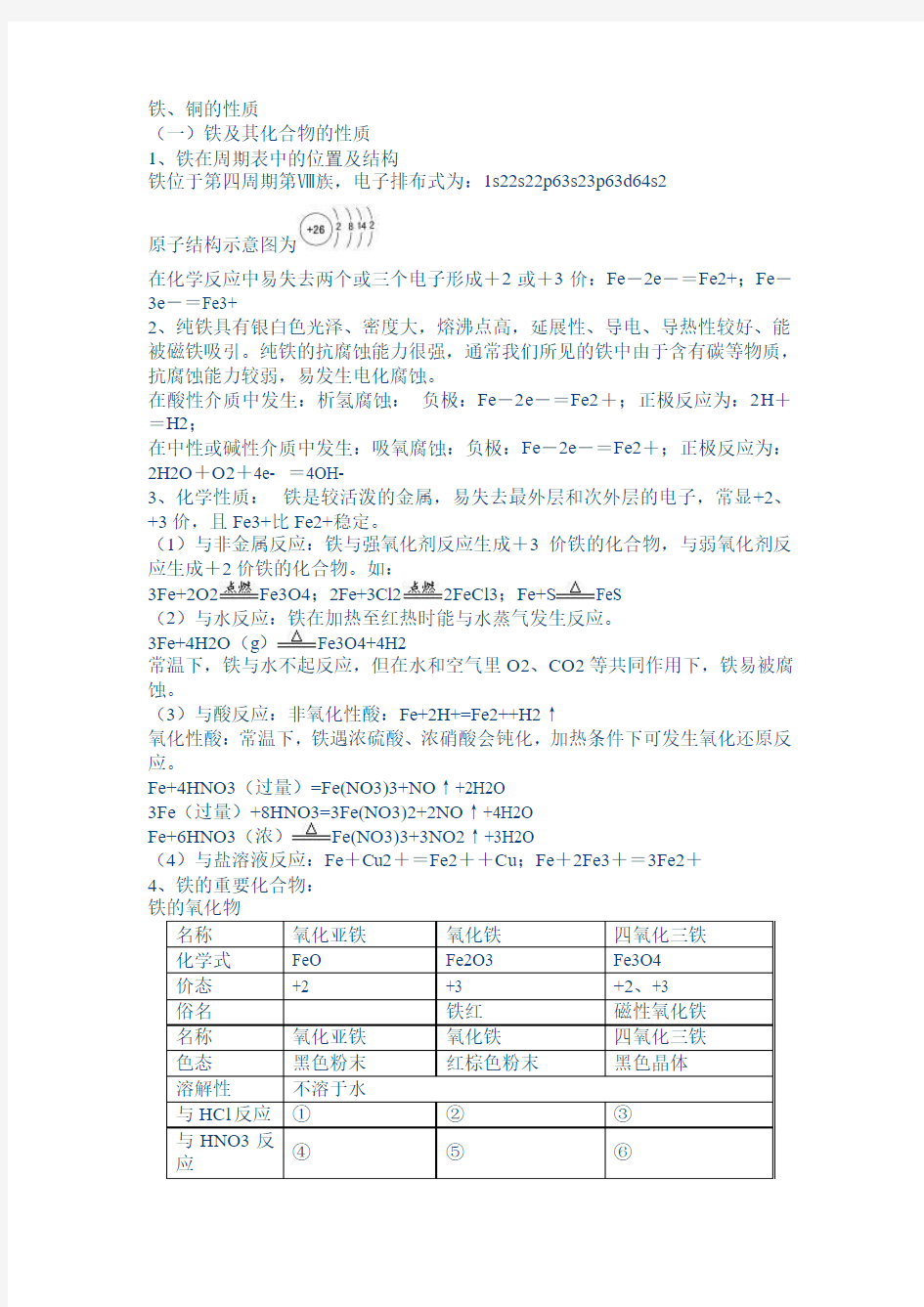
4、铁的重要化合物:
③Fe3O4+8H+==Fe2+ +2Fe3+ +4H2O ④3FeO+10HNO3==3Fe(NO3)3+NO↑+5H2O
⑤Fe2O3+6H+==2Fe3+ + 3H2O ⑥3Fe3O4+28HNO3==9Fe(NO3)3+NO ↑+14H2O
⑦FeO+2H+==Fe2++H2O ⑧Fe2O3+6HI==2FeI2+I2+3H2O
⑨Fe3O4+8HI==3FeI2+I2+4H2O
1、铁在化学反应中不仅可失去最外层的电子显+2价,还可以失去部分次外层的电子显+3价,当失去d能级中1个电子时,形成3d5的半充满状态,比较稳定,因此,铁的+3价化合物较稳定。
2、铁的三种价态之间的转变:铁三角之间的关系
3、铁在冷的浓硝酸和浓硫酸中钝化,但在热的浓硫酸或浓硝酸中可以发生氧化还原反应。铁在稀硝酸中发生氧化还原反应时,铁元素的价态与铁和硝酸的量的多少有关,当铁过量时,生成+2价铁,当硝酸过量时,生成+3价铁。
4、Fe2+和Fe3+的检验
(1)观察法:其溶液呈棕黄色者是Fe3+,呈浅绿色者是Fe2+
(2)H2S法:通入H2S气体或加入氢硫酸,有浅黄色沉淀析出者是Fe3+,无明显变化的是Fe2+。
(3)KSCN法:加入KSCN或其它可溶性硫氰化物溶液,呈血红色者是Fe3+,
无明显变化的是Fe2+。Fe3++3SCN-=Fe(SCN)3
(4)苯酚法:加入苯酚溶液,呈紫色者是Fe3+,无明显变化的是Fe2+。
Fe3++6C6H5OH →[Fe(C6H5O)6]3-+6H+
(5)碱液法:分别通入氨气或加入氨水或碱液,生成红褐色沉淀者是Fe3+,生成白色沉淀,并变为灰绿色,最终变成红褐色者是Fe2+。
(6)淀粉KI试纸法:能使淀粉KI试纸变蓝者为Fe3+,无明显变化的是Fe2+。2Fe3++2I-=2Fe2+ +I2
(7)铜片法:分别加入铜片,铜片溶解且溶液变为蓝色者是Fe3+,无明显变化的是Fe2+。2Fe3++Cu=2Fe2++Cu2+
(8)KMnO4法:分别加入少量酸性KMnO4溶液,能使KMnO4溶液的紫红色变浅的是Fe3+,颜色基本无变化的是Fe2+:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
(二)铜及其重要的化合物:
铜位于第四周期第ⅠB族,电子排布式为:1s22s22p63s23p63d104s1,铜是一种亮红色的固体,具有良好的导电导热性。铜在化学反应中易失去两个电子形成+2价。
铜的化学性质比较稳定,一般不与其他物质发生化学反应,利用铜的这一性质,古代人用铜制作货币。但铜在特定的条件下,也能被许多氧化性物质所氧化。如:1、铜在加热条件下与O2、S、Cl2等非金属单质化合:
2Cu+O22CuO;2Cu+S Cu2S;Cu+Cl2CuCl2
在潮湿空气中还可发生腐蚀生成绿色的铜锈:2Cu+O2+H2O+CO2=Cu2(OH)2CO3
△
2、铜与非氧化性酸一般不反应,但与强氧化性酸,则可以发生氧化还原反应,
但无H2产生:如:Cu+2=CuSO4+SO2↑+2H2O
3、铜还可以与某些盐溶液反应:如:
2FeCl3 +Cu=2FeCl2+CuCl2;Cu+2AgNO3 =Cu(NO3)2 +2Ag
4、铜的冶炼:工业上,主要采用高温冶炼黄铜矿的方法获得铜。这种方法冶炼的铜,其含量为99.5%~99.7%,还有Ag、Au、Fe、Zn等杂质。要达到电气化生产铜的要求,这种由黄铜矿高温冶炼的铜还必须经过电解精炼,电解精炼得到的铜,其含量高达99.95%~99.98%。
5、铜及其化合物的相互转化关系:
说明:
1、铜在和强氧化性物质如:X
2、O2等反应时生成+2价,而在和S等弱氧化性物质反应时,则生成+1价。铜可以和强氧化性酸反应,但不能与H+作用;2、CuO在高温下可以分解产生Cu2O和O2。在用H2还原CuO时,也可能产生少量的Cu2O(红色)。在有H+存在时不稳定:Cu2O+2H+=Cu2++Cu+H2O,利用这一性质,可鉴别H2还原CuO的产物中是否存在Cu2O;
3、铜可以与多种物质形成络合物,CuCl2在水溶液中存在如下平衡:
[Cu(H2O)4]2++4Cl-[CuCl4]2-+4H2O,当浓度较大时,平衡正向
移动,[CuCl4]2-增大,显绿色,浓度较稀时,平衡逆向移动,溶液显蓝色。向Cu2+溶液中加入氨水,先生成蓝色沉淀,继续加入氨水,生成深蓝色溶液:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++4H2O
4、新制的Cu(OH)2可以和含有醛基的物质作用产生砖红色的Cu2O,利用这一性质可以鉴别含有醛基的物质。
CH3CHO+2Cu(OH)2→CH3COOH+Cu2O+2H2O