硼酸盐溶液(0.1molL,pH8.5-10)
- 格式:doc
- 大小:27.73 KB
- 文档页数:1
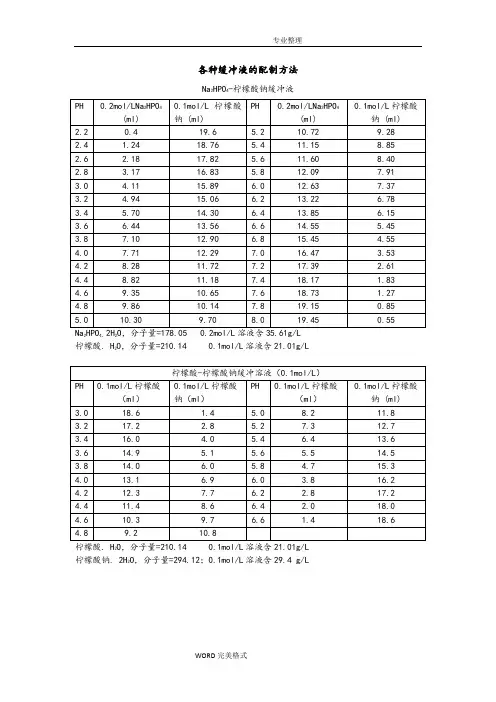
各种缓冲液的配制方法Na2HPO4-柠檬酸钠缓冲液24。
2柠檬酸. H2O,分子量=210.14 0.1mol/L溶液含21.01g/L2柠檬酸钠. 2H2O,分子量=294.12;0.1mol/L溶液含29.4 g/LNaAC.3 H2O,分子量=136.09 0.2mol/L溶液含27.22g/L(1)醋酸盐溶液的配制:醋酸-醋酸钠缓冲液(pH3.6)取醋酸钠5.1g,加冰醋酸20ml,再加水稀释至250ml,即得。
醋酸-醋酸钠缓冲液(pH3.7)取无水醋酸钠20g,加水300ml溶解后,加溴酚蓝指示液1ml及冰醋酸60~80ml,至溶液从蓝色转变为纯绿色,再加水稀释至1000ml,即得。
醋酸-醋酸钠缓冲液(pH3.8)取2mol/L醋酸钠溶液13ml与2mol/L醋酸溶液87ml,加每1ml含铜1mg的硫酸铜溶液0.5ml,再加水稀释至1000ml,即得。
醋酸-醋酸钠缓冲液(pH4.5)取醋酸钠18g,加冰醋酸9.8ml,再加水稀释至1000ml,即得。
醋酸-醋酸钠缓冲液(pH4.6)取醋酸钠5.4g,加水50ml使溶解,用冰醋酸调节pH值至4.6,再加水稀释至100ml,即得。
醋酸-醋酸钠缓冲液(pH6.0)取醋酸钠54.6g,加1mol/L醋酸溶液20ml溶解后,加水稀释至500ml,即得。
用醋酸和醋酸钠配制的缓冲溶液的PH=PKa+lg[C(NaAc)/C(HAc)](在此,C(HAc)指醋酸的浓度,C(NaAc)指醋酸钠的浓度,Ka是醋酸的解离常数=1.8*10-5(1.8乘10的-5次方),PKa=-lgKa=4.75,将PH=5.5代入,可得C(NaAc)/C(HAc)=5.6 通常我们配制时会使C(HAc)=0.1mol/L,或是C(HAc)=0.2mol/L等。
若是配制C(HAc)=0.1mol/L,则C(NaAc)=0.56mol/L 称量醋酸钠固体质量为82*0.56=46克量取冰醋酸体积为0.1*1000/17.5=5.7mL。

硼酸溶液的化学方程式嘿,朋友们!今天咱们来聊聊硼酸溶液那点事儿。
硼酸溶液啊,它的主要成分就是硼酸(H₃BO₃)。
这硼酸啊,就像一个神秘的小魔法师,在溶液里有着独特的魔法。
你看啊,当硼酸溶解在水里的时候,它就像一个害羞的小精灵慢慢融入水的世界。
它在水里的状态就好像是在泡温泉,可惬意了呢。
化学方程式就是H₃BO₃(s) ⇌ H⁺(aq) + H₂BO₃⁻(aq),就像小精灵在水里分解出了自己的小分身,一个氢离子和一个硼酸一氢根离子。
要是往硼酸溶液里加点碱,那可就热闹啦。
就好比一场激烈的拔河比赛,碱里的氢氧根离子(OH⁻)一上场,就朝着硼酸溶液里的氢离子(H⁺)冲过去。
反应方程式是H₃BO₃ + OH⁻ = B(OH)₄⁻,这就像氢离子被氢氧根离子拉走,组成了新的小团体,变成了四羟基硼酸根离子,感觉就像是一群小伙伴突然换了组合一样。
如果把硼酸溶液加热呢?它又像一个爱变装的小明星。
加热会促进它的电离,就好像给它打了一针兴奋剂,让它更积极地展现自己的不同状态。
不过它可不会像孙悟空那样七十二变那么夸张啦,只是在电离程度上有所变化。
再想象一下,如果有金属离子跑到硼酸溶液里,就像一群外来的小侠客闯进了硼酸的小王国。
比如镁离子(Mg²⁺)进去了,可能会发生一些奇妙的相互作用,但不会像武侠小说里那样大打出手,而是通过一些复杂的化学平衡来相处。
有时候啊,硼酸溶液还像一个低调的小工匠。
它可以参与到一些材料的制作过程中,比如在玻璃制造里,它就像一个小小的黏合剂,虽然不起眼,但是缺了它还真不行。
它在里面可能发生一些复杂的反应,具体的反应方程式可能涉及到和玻璃原料中的各种物质相互作用,就像一场无声的合作舞蹈。
要是把硼酸溶液放在一个封闭的小瓶子里,它就像一个安静的小囚犯,在里面安安稳稳地待着,但是里面还是会有它那些电离的小动静,就像囚犯在牢房里还会小声嘀咕一样,始终遵循着H₃BO₃(s) ⇌ H⁺(aq) +H₂BO₃⁻(aq)这个规律。

免疫组化,免疫检测北京华越洋生物-----------------------------------------------DMDC玻片硅化剂(2%) 100ml 免疫组化40% 室温,6个月玻片的硅化,包括盖玻片和载玻片主要由二甲二氯硅烷(DMDC)组成。
玻片硅化试剂盒(APES法) 3×100ml 免疫组化40% 4℃,6个月玻片的硅化,包括盖玻片和载玻片主要由APES、洗涤液、DEPC水组成。
玻片硅化试剂盒(APES法) 3×500ml 免疫组化40% 4℃,6个月玻片的硅化,包括盖玻片和载玻片主要由APES、洗涤液、DEPC水组成。
PBS-Triton去污剂100ml 免疫组化40% 室温,12个月去污主要由PBS、Triton-100组成。
Sorensen磷酸缓冲液(0.1mol/L,pH5.3-8.04)500ml 免疫组化40% 4℃,6个月组织化学常用缓冲液主要由磷酸二氢盐(钠/钾)和磷酸氢二盐(钠/钾)溶液组成,按不同比例混合后获得对用PH值。
pH值可选5.3,5.6,5.91,6.24,6.47,6.64,6.81,6.98,7.17,7.73,8.04。
Sorensen磷酸缓冲液(1×,pH6.2) 500ml 免疫组化40% 4℃,6个月少量细胞趋化实验主要由磷酸氢二钠、磷酸二氢钾、氯化镁、氯化钙组成,终浓度17mM。
Sorensen磷酸缓冲液(10×,pH6.2) 500ml 免疫组化40% 4℃,6个月少量细胞趋化实验主要由磷酸氢二钠、磷酸二氢钾、氯化镁、氯化钙组成,终浓度170mM。
TBS缓冲液(0.02mol/L,pH8.2) 500ml 免疫组化40% 室温,6个月免疫金银染色缓冲液主要由Tris、氯化钠组成。
TBS缓冲液(0.05mol/L,pH7.4) 500ml 免疫组化40% 室温,6个月免疫金银染色缓冲液主要由Tris、氯化钠、叠氮钠、BSA组成。
【引用】常用pH缓冲溶液的配制和pH值2011-05-13 20:01:24| 分类:生物|字号订阅本文引用自DSC《常用pH缓冲溶液的配制和pH值》一、常用溶液的配制(文章来自:医药园() 整理:zfg)(一)溶液配制注意事项1.药品要有较好的质量试剂分为优级纯(保证试剂,Guaranteed reagent,G.R.)、分析试剂(Antalytical reagent,A.R.)化学纯(Chemical pure,C.P.)和实验试剂(Laboratory reagent,L.R.)等等。
工业用的化学试剂,杂质较多,只在个别情况下应用,如配洗液用的硫酸、配干燥剂的氯化钙等。
2.药品称量要精确。
3.配制试剂用水应用新鲜的去离子水或双蒸馏水,比电阻值在50万欧姆以上,pH在5.5~7.0之间才可应用,在组织培养等特殊用途时应注意此项要求,配制一般化验用溶液只要求用双蒸馏水或去离子水。
4.配好后的溶液,应立即除菌处理(如高压灭菌、抽滤或加抑菌物质),以防杂菌生长。
(二)0.067(1/15)Mol/L磷酸缓冲液1.1/15Mol/L磷酸二氢钾溶液的配制:称取磷酸二氢钾(KH2PO4,A.R.)9.08g,用蒸馏水溶解后,倾入1 000ml容量瓶内,再稀释至刻度(1 000ml)。
2.1/15Mol/L磷酸二氢钠溶液的配制:称取无水磷酸氢二钠(Na2HPO4,A.R.)9.47g (或者Na2HPO4·2H2O 11.87g)用蒸馏水溶解后,放入1 000ml容量瓶内,再加蒸馏水稀释至刻度(1 000ml)。
3.按附表的比例,配制成不同pH值的缓冲溶液。
(三)0.15Mol/L PB液Na2HPO4·2H2O分子量=175.05 0.15Mol/L溶液含26.7g/L。
Na2HPO4·12H2O分子量=358.22 0.15Mol/L溶液含53.7g/L。
NaH2PO4·H2O分子量=138.00 0.15Mol/L溶液含20.7g/L。
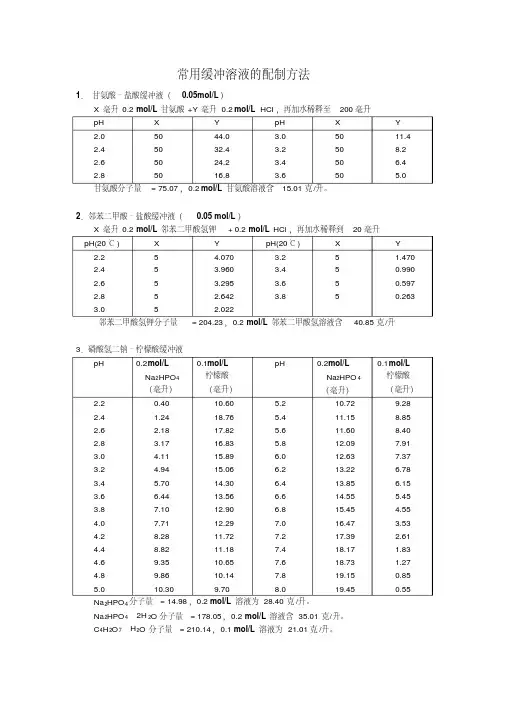
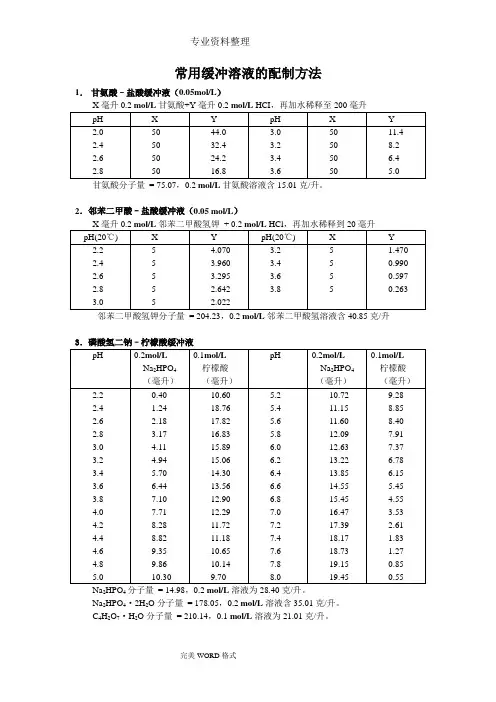
常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)甘氨酸分子量= 75.07,0.2 mol/L甘氨酸溶液含15.01克/升。
2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升3.磷酸氢二钠–柠檬酸缓冲液Na2HPO4分子量= 14.98,0.2 mol/L溶液为28.40克/升。
Na2HPO4·2H2O分子量= 178.05,0.2 mol/L溶液含35.01克/升。
C4H2O7·H2O分子量= 210.14,0.1 mol/L溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液①使用时可以每升中加入1克克酚,若最后pH值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
5.柠檬酸–柠檬酸钠缓冲液(0.1 mol/L)柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。
柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1mol/L溶液为29.41克/毫升。
7.磷酸盐缓冲液242Na 2HPO 4·12H 2O 分子量 = 358.14,0.2 mol/L 溶液为71.628克/升。
NaH 2PO 4·2H 2O 分子量 = 156.01,0.2 mol/L 溶液为31.202克/升。
磷酸盐是生物化学研究中使用最广泛的一种缓冲剂,由于它们是二级解离,有二个pKa 值,所以用它们配制的缓冲液,pH 范围最宽:NaH 2PO 4: pKa1=2.12,pKa2=7.21; Na 2HPO 4:pKa1=7.21,pKa2=12.32配酸性缓冲液:用NaH 2PO 4,pH =1~4,配中性缓冲液:用混合的两种磷酸盐,pH =6~8, 配碱性缓冲液:用Na 2HPO 4,pH =10~12。

一、实验目的1. 熟悉实验室的基本操作,提高实验技能。
2. 学习硼酸的制备方法,掌握硼酸溶液的配制过程。
3. 了解硼酸的化学性质及其应用。
二、实验原理硼酸(H3BO3)是一种无机化合物,是一种重要的工业原料,广泛应用于玻璃、陶瓷、制药、农药等领域。
本实验采用硼砂(Na2B4O7·10H2O)与硫酸反应制备硼酸溶液。
反应方程式如下:Na2B4O7·10H2O + 3H2SO4 → 4H3BO3 + 2NaHSO4 + 9H2O三、实验器材与试剂1. 器材:烧杯、玻璃棒、漏斗、滤纸、容量瓶、移液管、电子天平、滴定管、洗瓶、烧瓶、铁架台、酒精灯等。
2. 试剂:硼砂(Na2B4O7·10H2O)、硫酸(H2SO4)、蒸馏水、酚酞指示剂。
四、实验步骤1. 称取一定量的硼砂,准确至0.01g。
2. 将称量好的硼砂放入烧杯中,加入适量的蒸馏水,用玻璃棒搅拌使其溶解。
3. 将溶解后的硼砂溶液转移至容量瓶中,用蒸馏水洗涤烧杯和玻璃棒,并将洗涤液一并转移到容量瓶中。
4. 向容量瓶中加入适量的硫酸,用玻璃棒搅拌均匀。
5. 将容量瓶中的溶液静置一段时间,待沉淀完全沉降后,用漏斗和滤纸过滤。
6. 将滤液收集于烧杯中,用酚酞指示剂检验溶液的酸碱性,如呈酸性,可继续加入少量硫酸进行滴定。
7. 将滴定后的溶液转移至容量瓶中,用蒸馏水定容至刻度线。
8. 计算硼酸溶液的浓度。
五、实验数据与结果1. 硼砂的质量:0.5g2. 溶液体积:100mL3. 硼酸溶液的浓度:0.1mol/L六、实验讨论1. 在实验过程中,硼砂的溶解速度较慢,可能是因为硼砂的溶解度较小。
因此,在实验过程中应充分搅拌,以提高溶解速度。
2. 在滴定过程中,酚酞指示剂的颜色变化不明显,可能是因为溶液的酸碱性较弱。
在这种情况下,可适当延长滴定时间,以提高滴定的准确性。
3. 实验过程中,应注意防止溶液溅出,以免影响实验结果。
七、实验总结本次实验通过硼砂与硫酸反应制备硼酸溶液,掌握了硼酸溶液的配制方法。
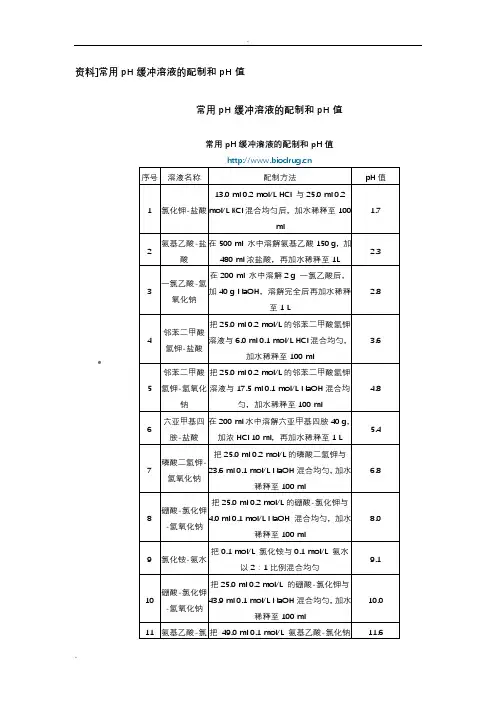
资料]常用pH缓冲溶液的配制和pH值•常用pH缓冲溶液的配制和pH值常用pH缓冲溶液的配制和pH值一、常用溶液的配制(一)溶液配制注意事项1.药品要有较好的质量试剂分为优级纯(保证试剂,Guaranteed reagent,G.R.)、分析试剂(Antalytical reagent,A.R.)化学纯(Chemical pure,C.P.)和实验试剂(Laboratory reagent,L.R.)等等。
工业用的化学试剂,杂质较多,只在个别情况下应用,如配洗液用的硫酸、配干燥剂的氯化钙等。
2.药品称量要精确。
3.配制试剂用水应用新鲜的去离子水或双蒸馏水,比电阻值在50万欧姆以上,pH在5.5~7.0之间才可应用,在组织培养等特殊用途时应注意此项要求,配制一般化验用溶液只要求用双蒸馏水或去离子水。
4.配好后的溶液,应立即除菌处理(如高压灭菌、抽滤或加抑菌物质),以防杂菌生长。
(二)0.067(1/15)Mol/L磷酸缓冲液1.1/15Mol/L磷酸二氢钾溶液的配制:称取磷酸二氢钾(KH2PO4,A.R.)9.08g,用蒸馏水溶解后,倾入1 000ml容量瓶内,再稀释至刻度(1 000ml)。
2.1/15Mol/L磷酸二氢钠溶液的配制:称取无水磷酸氢二钠(Na2HPO4,A.R.)9.47g(或者Na2HPO4·2H2O 11.87g)用蒸馏水溶解后,放入1 000ml容量瓶内,再加蒸馏水稀释至刻度(1 000ml)。
3.按附表的比例,配制成不同pH值的缓冲溶液。
•(三)0.15Mol/L PB 液Na 2HPO 4·2H 2O 分子量=175.05 0.15Mol/L 溶液含26.7g/L 。
Na 2HPO 4·12H 2O 分子量=358.22 0.15Mol/L 溶液含53.7g/L 。
NaH 2PO 4·H 2O 分子量=138.00 0.15Mol/L 溶液含20.7g/L 。

常⽤缓冲溶液的配制常⽤缓冲液的配制当缓冲液被稀释或浓缩时,pH也应不变。
其pH值应近似恒定不变,或当其中的离解的阳离⼦(K+、Na+)或阴离⼦(Cl-、Br-)被其它种类的离⼦替换时。
表1—4中给出了响应的配制⽅法,平衡阳离⼦为Na+,缓冲液的最终浓度为0.1mol/l,对于其它浓度的缓冲溶液或阳离⼦种类(通常K+)更好,表中的数据也可供参考。
较稀的或较浓的缓冲溶液,及包含有不同阳离⼦的溶液,其pH值会与表中的数据稍有出⼊。
在⽅法建⽴过程中,精确的流动相pH值往往并不重要,重要的是每次新配制的流动相的pH值与第⼀次基本相同(最好控制在±0.02范围内)。
注意,只有当缓冲溶液的pH在缓冲试剂解离常数pKIa±1范围内时,缓冲溶液才具有有效的缓冲容量(如⼄酸盐的pKa=4.6,其适宜的pH范围为3.6—5.6)。
表1低pH值(25℃)磷酸盐缓冲溶液的配制⽅法溶液A1:0.1M磷酸。
配制精确pH值缓冲液时,所⽤磷酸需滴定H3PO4的含量。
溶液A2:0.1M磷酸⼆氢钠溶液,称量13.8gNaH2PO4?H2O溶解于⽔中,定容于1L容量瓶中。
pHA1体积(ml)A2体积(ml)pHA1体积(ml)A2体积(ml)2.05654352.81758252.24555453.01108902.43456553.2559452.6250750表2不同pH值(25℃)醋酸缓冲溶液的配制⽅法溶液A1:0.1M醋酸溶液。
6.0g(5.8ml)冰醋酸溶于⽔中,定容到1L容量瓶中。
溶液A2:0.1M醋酸钠溶液。
8.2gC2H3O2Na(或13.6gC2H3O2Na?3H2O)溶解于⽔中定容到1L容量瓶中。
pHA1体积(ml)A2体积(ml)pHA1体积(ml)A2体积(ml)3.6926744.84006003.88801205.02967044.08201805.22107904.27362645.41768244.46103905.6969044.6510490表3不同pH值(25℃)柠檬酸缓冲溶液的配制⽅法溶液A1:0.1M柠檬酸溶液。

背景尿酸氧化酶(Urate Oxidase, EC1.7.3.3),又称尿酸酶(Uricase)是生物体嘌呤降解代谢途径中的一种酶,大部分生物在嘌呤的代谢过程中产生尿酸,而尿酸酶能催化尿酸氧化为尿囊素。
许多物种中均发现有尿酸酶存在,但在鸟类,爬行类动物以及高等哺乳动物(灵长类包括人类)等生物的进化过程中,尿酸酶基因发生突变,使得在这些生物体,嘌呤不能被氧化为尿囊素,而是以尿酸为终产物。
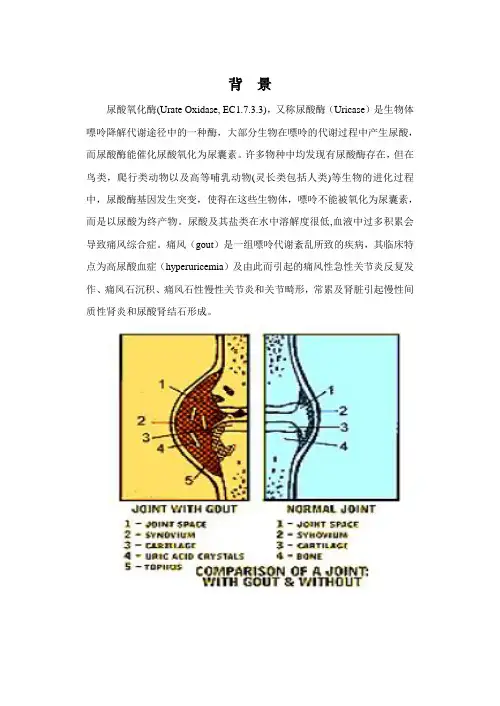
尿酸及其盐类在水中溶解度很低,血液中过多积累会导致痛风综合症。
痛风(gout)是一组嘌呤代谢紊乱所致的疾病,其临床特点为高尿酸血症(hyperuricemia)及由此而引起的痛风性急性关节炎反复发作、痛风石沉积、痛风石性慢性关节炎和关节畸形,常累及肾脏引起慢性间质性肾炎和尿酸肾结石形成。
The pathway of purine metabolism目前临床上治疗痛风的主要药物是别嘌呤醇,它占领了美国95%以上的治疗痛风药物的市场。
它是尿酸代谢过程中黄嘌呤氧化酶的抑制剂,与嘌呤代谢物竞争性抑制黄嘌呤氧化酶,使次黄嘌呤及黄嘌呤不能转化为尿酸,从而减少尿酸的生成。
但该药的副作用也很明显,个别病人可有发热、过敏性皮疹、腹痛、腹泻、白细胞及血小板减少,甚而肝功能损害等副作用。
尿酸酶可以氧化尿酸为可溶性的尿囊素,在基因工程技术发展以前,从微生物中提取尿酸酶可用于临床诊断和治疗,例如产朊假丝酵母。
但微生物产酶量较低,限制了其广泛应用。
通过DNA重组技术高效表达酶基因是一条提高产酶量的途径。
迄今为止,已有多个物种的尿酸酶基因被克隆。
但是,尿酸酶仍具有蛋白质类药物的共同缺点,如在胃肠道极易被蛋白酶水解;血浆半衰期较短,需反复多次注射;并且由于大分子化合物具有免疫原性,易产生过敏反应,同时还会因局部产生抗体而减效等,这些缺点限制了尿酸酶的大围的、持续的应用。
实验容尿酸氧化酶的纯化尿酸氧化酶的性质研究发酵菌液(1)尿酸酶的动力学参数的测定↓ (2)尿酸酶的酸碱稳定性测定超声破碎(3)温度对尿酸酶稳定性的影响↓盐析↓DEAE离子交换↓SDS-PAGE实验一尿酸氧化酶粗酶提取一.实验目的学习可溶性表达蛋白质的初步分离纯化二.实验原理细菌工程菌胞表达主要分为两种形式,一种是在强启动子条件下的高效表达,由于蛋白的过度表达,使蛋白不能及时有效折叠而发生无规则卷曲,以固体颗粒的形式堆积于胞间质中,这就是所说的包涵体。
锌的测定(一)锌试剂比色法1、方法提要:在PH8.5-9.5的碱性溶液中,锌与锌试剂生成兰色络合物。
最大吸收峰在620nm出,在50mL水溶液中含0-120微克锌,符合皮尔定律。
用铜试剂分离Cu、Pb、Mn、Ni等干扰元素,残留Mn加入抗坏血酸钠盐掩蔽。
2、试剂(1)锌试剂溶液—0.2%:称取0.2g锌试剂,溶于1mL1N的氢氧化钠中,用水稀释至100mL,置于暗处,配制后可稳定1星期。
(2)抗坏血酸钠盐溶液:取25g抗坏血酸,溶于含有5.7g的氢氧化钠溶液中,用水稀释至100mL。
(3)硼酸盐缓冲溶液(PH8.8-9):取8.3g氢氧化钠溶于水中,加入37.3g氯化钾,31g硼酸,溶解后用水稀释至1000mL。
(4)锌标准溶液:称取纯金属锌0.2500g置于烧杯中,加盐酸10mL,低温溶解,移入250mL 容量瓶中,用水稀释至个度,此溶液每1mL相当于1mg锌。
使用时稀释50倍,每mL相当于20微克锌。
3、分析步骤:称取试样0.2000g置于250mL的是锥型瓶中,加1+1盐酸10mL。
浓硝酸5mL,加热溶解至干,加盐酸5mL及少量水(约30mL)温热溶解,滴加氢氧化铵至生成氢氧化铁沉淀,并过量5mL,加铜试剂2g,振摇锥形瓶至沉淀凝聚。
过滤于250mL烧杯中,加热至无氨味,稍冷后加硫酸2-3mL,加热冒烟取下,再加硫酸、硝酸数滴,高氯酸1-2滴,加热蒸发至近干,加水5mL,温热使盐类溶解,加甲基橙指示剂1滴,用1N氢氧化钠溶液中和至刚呈黄色,将溶液移入50mL容量瓶中。
加抗坏血酸钠盐2mL,加硼酸缓冲溶液10mL摇匀,加锌试剂5mL,用水稀释至刻度,摇匀。
放置10min,以72型或721型分光光度计,用1cm比色皿,于波长625nm 处测消光度。
4、标准曲线:吸取相当于10、20、30、40微克锌的溶液于50mL容量瓶红忠,以下操作与试样铜绘制曲线。
5、计算:Zn%=mG×1000×1000×100m----曲线上查得锌量(微克);G----样重;也可用标准比较法计算结果。
【引用】常用pH缓冲溶液的配制和pH值2011-05-13 20:01:24| 分类:生物|字号订阅本文引用自DSC《常用pH缓冲溶液的配制和pH值》一、常用溶液的配制(文章来自:医药园() 整理:zfg)(一)溶液配制注意事项1.药品要有较好的质量试剂分为优级纯(保证试剂,Guaranteed reagent,G.R.)、分析试剂(Antalytical reagent,A.R.)化学纯(Chemical pure,C.P.)和实验试剂(Laboratory reagent,L.R.)等等。
工业用的化学试剂,杂质较多,只在个别情况下应用,如配洗液用的硫酸、配干燥剂的氯化钙等。
2.药品称量要精确。
3.配制试剂用水应用新鲜的去离子水或双蒸馏水,比电阻值在50万欧姆以上,pH在5.5~7.0之间才可应用,在组织培养等特殊用途时应注意此项要求,配制一般化验用溶液只要求用双蒸馏水或去离子水。
4.配好后的溶液,应立即除菌处理(如高压灭菌、抽滤或加抑菌物质),以防杂菌生长。
(二)0.067(1/15)Mol/L磷酸缓冲液1.1/15Mol/L磷酸二氢钾溶液的配制:称取磷酸二氢钾(KH2PO4,A.R.)9.08g,用蒸馏水溶解后,倾入1 000ml容量瓶内,再稀释至刻度(1 000ml)。
2.1/15Mol/L磷酸二氢钠溶液的配制:称取无水磷酸氢二钠(Na2HPO4,A.R.)9.47g (或者Na2HPO4·2H2O 11.87g)用蒸馏水溶解后,放入1 000ml容量瓶内,再加蒸馏水稀释至刻度(1 000ml)。
3.按附表的比例,配制成不同pH值的缓冲溶液。
(三)0.15Mol/L PB液Na2HPO4·2H2O分子量=175.05 0.15Mol/L溶液含26.7g/L。
Na2HPO4·12H2O分子量=358.22 0.15Mol/L溶液含53.7g/L。
NaH2PO4·H2O分子量=138.00 0.15Mol/L溶液含20.7g/L。
循环水质检测方法一、工业循环冷却水中总碱度的测定——指示剂法本方法适用于测定循环冷却水和天然水中的碱度。
1方法提要中和1升水样至某一指定PH值时所需酸的毫克当量数,称为碱度。
一般滴定到PH8.3时所测定的碱度为酚酞碱度(P),它主要归因于水中的OH-及CO32-,继续滴定至PH=4.5时所测得的碱度(包括前者酚酞碱度)称为甲基橙碱度(M),即总碱度,它包括OH-、CO32-、HCO3-及其它弱酸盐等所产生的碱度。
2 试剂2.1 盐酸标准溶液0.1mol/l;2.2 甲基红—溴甲酚绿混合指示剂。
3 准备工作3.1 0.1mol/l盐酸标准溶液的配制和标定:配制:取市售含HCl为37%、密度为1.19g/ml的分析纯盐酸溶液9ml,用蒸馏水稀释至1000ml,此溶液的浓度约为0.1mol/l。
标定:准确称取于270~300℃灼烧至恒重的基准无水碳酸钠0.15g(准确至0.2mg),置于250ml锥形瓶中,加蒸馏水约50ml,使之全部溶解。
加10滴溴甲酚绿-甲基红混合指示剂,用0.1mol/l盐酸滴定至由绿色变为暗红,煮沸2min,冷却后继续滴定至暗红色为终点。
读取盐酸溶液消耗的体积。
盐酸标准溶液的浓度为m×1000c(HCl)= mol/LV×53.00式中m —碳酸钠的质量,g;V —滴定消耗的盐酸体积,ml;53.00 —1/2 Na2CO3的摩尔质量,g/mol。
3.2 甲基红—溴甲酚绿指示剂的配制:称取100mg溴甲酚绿溶于100ml95%乙醇溶液中,再称200mg甲基红溶于100ml 95%乙醇溶液中,以3+1混合。
4 试验步骤4.1 取100ml水样于250ml锥形瓶中,加4滴四甲基红指示剂,溶液呈浅蓝色;4.2 用盐酸标准溶液滴定上述溶液至浅紫色,记下盐酸的用量。
5 计算总碱度可按下式计算(以CaCO3计)C×V1×1000×50X= mg/lV2式中 c —盐酸标准溶液浓度,mol/l;V2—水样体积,ml;V—消耗的盐酸体积,ml。
硼酸缓冲溶液范围1. 什么是硼酸缓冲溶液?硼酸缓冲溶液是一种含有硼酸和其共轭碱(如氢氧化钠)的混合物,用于调节溶液的pH值。
硼酸(H3BO3)是一种弱酸,具有缓冲作用,可以在一定范围内稳定溶液的pH值。
2. 硼酸缓冲溶液的作用硼酸缓冲溶液广泛应用于生物化学、分子生物学、细胞生物学等实验中。
它可以稳定溶液的pH值,阻止pH值的剧烈变化,从而保持实验条件的稳定性。
此外,硼酸缓冲溶液还可用于某些特殊反应条件下的催化剂或配位试剂。
3. 硼酸缓冲溶液的范围硼酸缓冲溶液通常具有一个特定的pH范围,在这个范围内它才能发挥最佳效果。
具体来说,硼酸缓冲溶液的范围通常在pH 8.2至pH 9.8之间。
4. 硼酸缓冲溶液的制备方法硼酸缓冲溶液的制备方法相对简单,以下是一种常用的制备方法:材料准备:•硼酸(H3BO3)•氢氧化钠(NaOH)•蒸馏水制备步骤:1.使用天平称取适量硼酸粉末,并加入一定体积的蒸馏水中。
2.搅拌溶解硼酸,直到完全溶解。
3.使用天平称取适量氢氧化钠粉末,并加入一定体积的蒸馏水中。
4.搅拌溶解氢氧化钠,直到完全溶解。
5.将硼酸溶液和氢氧化钠溶液按照一定比例混合,搅拌均匀。
6.使用pH计测量混合后溶液的pH值,如果不在所需范围内,则可以适量添加硼酸或氢氧化钠来调节pH值。
7.最后,使用蒸馏水稀释至所需浓度,制备好的硼酸缓冲溶液即可使用。
5. 硼酸缓冲溶液的注意事项在制备和使用硼酸缓冲溶液时,需要注意以下几点:•硼酸为弱酸,具有一定的毒性,操作时要避免吸入或接触皮肤和眼睛。
应戴好实验手套、防护眼镜等个人防护装备。
•硼酸溶液会对铝、锌等金属产生腐蚀作用,在制备和保存过程中要避免与金属接触。
•制备硼酸缓冲溶液时,应严格按照配比和步骤进行操作,以确保溶液的准确性和稳定性。
•制备好的硼酸缓冲溶液应密封保存,避免受到空气中二氧化碳的干扰。
6. 硼酸缓冲溶液的常见应用硼酸缓冲溶液在生命科学领域有广泛的应用,以下是其中几个常见的应用场景:蛋白质电泳硼酸缓冲溶液常用于蛋白质电泳中,作为电泳缓冲液的组成部分。
2024届新高考化学第一轮复习微专题课时训练弱电解质的电离平衡一、选择题(共15题)1、H2S水溶液中存在电离平衡:H2S H++HS-和HS-H++S2-。
若向H2S溶液中 ( )A.加水,平衡向右移动,溶液中氢离子浓度增大B.通入过量SO2气体,平衡向左移动,溶液pH增大C.滴加新制氯水,平衡向左移动,溶液pH减小D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小2、硼酸(H3BO3)大量用于玻璃工业,可以改善玻璃制品的耐热、透明性能,提高机械强度等。
硼酸水溶液呈弱酸性,原因是其能够结合水电离出来的氢氧根离子从而释放出氢离子。
以下说法正确的是() A.往纯水中加入少许硼酸,水的电离程度增加B.等浓度的硼酸与碳酸相比,硼酸酸性强C.H3BO3为三元酸D .1 mol H 3BO 3最多能和1 mol 甲醇发生酯化反应3、一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )A .a 、b 、c 三点溶液的pH :c<a<bB .a 、b 、c 三点CH 3COOH 的电离程度:c <a <bC .用湿润的pH 试纸测量a 处溶液的pH ,测量结果偏小D .a 、b 、c 三点溶液用1 mol·L -1NaOH 溶液中和,消耗NaOH 溶液的体积:c <a <b4、由于血液中存在如下平衡过程: CO 2(g) CO 2(aq)、CO 2(aq)+H 2O(l)H 2CO 3(aq)、H 2CO 3(aq)H +(aq)+HCO -3(aq),使血液的pH 维持在7.35~7.45。
如超出这个范围会造成酸中毒(pH 过低)或碱中毒(pH 过高),急性中毒时需静脉注射NH 4Cl 或NaHCO 3进行治疗。
下列叙述正确的是( )A .血液中CO 2浓度过高会导致酸中毒,使血液中c HCO -3c H 2CO 3的值增大B .治疗碱中毒时,患者需降低呼吸频率,以增加血液中CO 2浓度C.急性酸中毒时,救治方式是静脉注射NH4Cl溶液D.酸或碱中毒时,会导致血液中的酶发生水解5、如图所示,烧杯中的溶液为2 mol·L-1 CH3COOH溶液,接通直流电源。
北京雷根生物技术有限公司
硼酸盐溶液(0.1mol/L,pH8.5-10)
简介:
平衡盐溶液(Balanced Salt Solution ,BSS)与细胞生长状态下的pH 值、渗透压等环境状态一致,具有维持渗透压、控制酸碱平衡、供给细胞生存代谢所必需的能量和无机盐成分等作用,可满足体外实验中细胞生存并维持一定的代谢的基本需要。
Leagene 硼酸盐溶液(0.1mol/L,pH8.5-10)由0.1M 的硼酸钠、硼酸等组成,pH 值为
8.5-10。
组成:
操作步骤(仅供参考):
1、 无需配制,直接使用。
注意事项:
1、 为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期: 24个月有效。
相关:
编号 名称 IH0215 Storage 硼酸盐溶液(0.1mol/L,pH8.5-10) 500ml RT 使用说明书 1份
编号 名称 CC0007 磷酸缓冲盐溶液(10×PBS,无钙镁) CC0130 胰蛋白酶-EDTA 溶液(0.25%:0.02%) CS0001 ACK 红细胞裂解液(ACK Lysis Buffer)
CZ0061 台氏液(Tyrode's solution)
NR0003 Lezol(总RNA 提取试剂)
PS0009 Western 及IP 细胞裂解液
TC0713 葡萄糖检测试剂盒(GOD-POD 比色法)。