SNAP-tag蛋白标记技术
- 格式:ppt
- 大小:1.54 MB
- 文档页数:14

anti-his-tag在wb中原理一、引言WB(Western Blotting)是一种常用的蛋白质分析技术,可以用来检测特定蛋白质在样本中的存在及其相对丰度。
为了方便WB实验的进行,研究人员开发了许多标记技术,其中anti-his-tag就是一种常用的标记方法。
本文将介绍anti-his-tag在WB中的原理及其应用。
二、anti-his-tag的原理anti-his-tag是一种抗体,特异性地结合带有His标签的蛋白质。
His标签是一种小型多肽序列,通常由6个连续的组氨酸(histidine)残基组成。
His标签广泛用于蛋白质的表达和纯化过程中,通过His标签可以方便地将目标蛋白质与其他蛋白质分离开来。
在WB实验中,研究人员通常会将目标蛋白质表达为带有His标签的融合蛋白,在WB膜上进行蛋白质分离和检测。
为了检测这些带有His标签的蛋白质,需要使用特异性的抗体,即anti-his-tag。
anti-his-tag抗体可以通过免疫动物(如小鼠或兔子)免疫制备。
在免疫过程中,动物的免疫系统会识别His标签并产生相应的抗体。
这些抗体可以与带有His标签的蛋白质特异性地结合,形成抗原-抗体复合物。
三、anti-his-tag在WB中的应用1. 目标蛋白质的表达和检测通过将目标蛋白质表达为带有His标签的融合蛋白,可以方便地将其与其他蛋白质分离开来,并使用anti-his-tag抗体进行检测。
这种方法可以在WB实验中快速、准确地检测目标蛋白质的存在及其相对丰度。
2. 蛋白质的纯化在蛋白质表达和纯化过程中,可以利用His标签和anti-his-tag抗体来纯化目标蛋白质。
通过将带有His标签的目标蛋白质与anti-his-tag抗体结合,可以方便地将目标蛋白质从复杂的混合物中分离出来。
3. 蛋白质相互作用的研究通过将两个目标蛋白质分别表达为带有不同His标签的融合蛋白,可以利用anti-his-tag抗体来研究这两个蛋白质之间的相互作用。

研究蛋白质相互作用的九种方法,写标书用得上寒风凛冽,又到了一年一度写标书的季节,你开始准备了么?在分子机制的研究中,蛋白和蛋白之间的互作研究可以说是非常经典了,研究蛋白互作的方法有很多,今天我们来介绍九种。
1、免疫共沉淀(Co-Immunoprecipitation,CoIP)CoIP其实就是两个蛋白相互的IP(免疫沉淀反应)实验,在已知蛋白B和C之间有相互作用的前提下,这种前提一般需要有一个酵母双杂实验或者Pulldown实验来作为支持。
IP就是用来验证蛋白C和蛋白B之间相互作用的。
如果在Agarose珠上的Protean A/G所结合的抗体,可以结合并拉下蛋白B,那用Western Blot即可检测出蛋白C的表达,反之亦然,通过这种相互间免疫共沉淀的实验,就可以明确地验证出,B与C之间的相互作用了。
比如这份标书:PYK2促进肝癌细胞迁移的一个新的分子机制研究:结合并磷酸化E-cadherin?(百度检索题目可查到全文)2、Pull-down实验这个实验跟免疫共沉淀实验很像,不同的是免疫共沉淀是在细胞里进行的,在众多的蛋白里,拉住A蛋白的同时,把B蛋白也给拉出来了,这还不能证明是直接的结合,很有可能是A 拉住了C,而C拉住了B,这样拉住A蛋白的同时也能把B蛋白也给拉出来。
要证明直接的结合就是Pull-down实验。
提纯所要研究的两个蛋白(一般是在BL21等菌种表达提纯),这两个蛋白带上不同的标签(提纯蛋白一般带GST或者HIIS标签),然后将他们放在同一个体系里,使用GST-beads或者NI-beads,把其中一个蛋白拉下来,用WB检测另一个蛋白的存在。
比如这份标书:恶性肿瘤的发生、发展的细胞表观遗传学机制。
(同样可以百度检索到全文)3、免疫荧光(Immunofluorescence,IF)——共定位将免疫学方法(抗原抗体特异结合)与荧光标记技术结合起来研究特异蛋白抗原在细胞内分布的方法。
由于荧光素所发的荧光可在荧光显微镜下检出,从而可对抗原进行细胞定位。

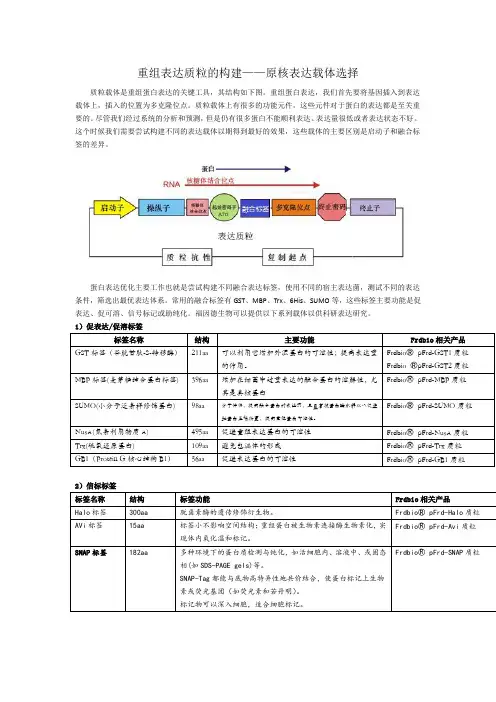
重组表达质粒的构建——原核表达载体选择质粒载体是重组蛋白表达的关键工具,其结构如下图。
重组蛋白表达,我们首先要将基因插入到表达载体上,插入的位置为多克隆位点。
质粒载体上有很多的功能元件,这些元件对于蛋白的表达都是至关重要的。
尽管我们经过系统的分析和预测,但是仍有很多蛋白不能顺利表达、表达量很低或者表达状态不好。
这个时候我们需要尝试构建不同的表达载体以期得到最好的效果,这些载体的主要区别是启动子和融合标签的差异。
蛋白表达优化主要工作也就是尝试构建不同融合表达标签,使用不同的宿主表达菌,测试不同的表达条件,筛选出最优表达体系。
常用的融合标签有GST、MBP、Trx、6His、SUMO等,这些标签主要功能是促表达、促可溶、信号标记或助纯化。
福因德生物可以提供以下系列载体以供科研表达研究。
1)促表达/促溶标签2)信标标签3)纯化标签我们选择表达载体的时候不但要考虑蛋白怎么表达成功,更要考虑蛋白怎么纯化出来,纯化的问题主要是考虑纯化标签和酶切位点的选择,下表我们列举了常见的纯化标签和酶切位点。
4)酶切位点以上为原核表达常用的标签和酶切位点,其性质也都作了简要的介绍,各专业网站或专业书籍已对此做详尽解释,科研工作者可根据具体实验设计方案,组合设计以上标签和酶切位点的使用。
特别值得注意的是,选用和设计蛋白酶切位点的时候首要考虑的是序列内部有没有蛋白酶位点,同时要考虑酶切的效率和蛋白酶试剂成本。
一般商业化载体,在标签蛋白与载体多克隆位点之间都设计有酶切位点。
标签可设计在N-端也可在C-端,设计在N-端的优势是,可通过标签高效翻译起始位点带动插入蛋白的表达,可溶性标签的高效表达更可促进蛋白的可溶性表达;同时,大部分的蛋白内切酶的切割位点在C-端,所以标签设计在N-端可将标签切割完全。
在设计标签序列与酶切位点的时候还要考虑N-端稳定性原则,也就是所谓宿主细胞的N-端规则(N-end rule),这个要避免;同时,还应该检查是否引入了可与别的蛋白相互作用的序列或者蛋白酶切位点。

蛋白表达载体系统重组蛋白表达技术和重组蛋白表达载体现已广泛应用于生物学各个具体领域,尤其是体内功能研究和蛋白质的大规模生产。
GeneCopoeia的蛋白表达载体按照表达宿主的不同分为3类:B类,M类和Lv 类。
B类的表达宿主为大肠杆菌,M类的宿主为哺乳动物细胞,Lv类是慢病毒载体,宿主可以为哺乳动物细胞或原代细胞。
除了必要的复制和筛选的元件,协助表达和翻译的元件外,本文将各类载体按荧光蛋白标签、多功能标签、促溶解度标签和抗体免疫共沉淀标签四种,先将几种主流的标签功能初步介绍如下:eGFP/eCFP/eYFP/mCherry分别是增强型绿色荧光蛋白/增强型黄绿色荧光蛋白/增强型黄色荧光蛋白/单体红色荧光蛋白标签,具有不同的激发波长和发射波长,均由野生型荧光蛋白通过氨基酸突变和密码子优化而来。
就eGFP而言,相对于GFP,其荧光强度更强、荧光性质更稳定。
同时载体中构建的Kozak序列使得含有eGFP的融合蛋白在真核表达系统中表达效率更高。
mCherry是从DsRed演化来的性能最好的一个单体红色荧光蛋白,可以和GFP系列荧光蛋白共用,实现多色标记体内、外实验表明,mCherry在N端和C端融合外源蛋白时,荧光蛋白活性和被融合的目标蛋白功能相互没有明显影响。
这些荧光标签蛋白,其融合表达目的蛋白后具有以下优点:1.不用破碎组织细胞、不加任何底物,直接通过荧光显微镜就能在活细胞中发出绿色荧光,实时显示目的基因的表达情况,而且荧光性质稳定,被誉为活细胞探针。
2.其自发荧光,不需用目的基因的抗体或原位杂交技术就可推知目的基因在细胞中的定位等情况。
3.同时细胞内的其它产物不会干扰标签蛋白检测,从而使其检测效果更快速、简便、灵敏度高而且重现性好。
4.其低消耗、高灵敏度检测的特性,十分适用于高通量的药物筛选。
现eGFP 表达标签被广泛地应用于基团表达调控、转基因功能研究、蛋白在细胞中的功能定位、迁移变化及药物筛选等方面。

常见tag蛋白标签介绍蛋白标签蛋白标签(proteintag)是指利用DNA体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪和纯化等。
随着技术的不断发展,研究人员相继开发出了具有各种不同功能的蛋白标签。
目前,这些蛋白标签已在基础研究和商业化产品生产等方面得到了广泛的应用。
美国GeneCopoeia(复能基因)为客户提供50多种蛋白标签,可以满足客户的不同需求,包括各种最新型的标签,如:SNAP-Tag?、Halo Tag?、A viTag?、Sumo等;也提供齐全的各种常用标签,如eGFP、His、Flag等等标签。
以下是部分蛋白标签的特性介绍,更加详细的介绍可在查询克隆产品的结果列表里面看到各种推荐的蛋白标签和载体。
标签纯化促进溶解度抗体效价细胞标记His6 + +/- +/-Flag + +/- +GST + + +MBP + ++ +His-MBP ++ + +HA +eGFP/CFP/YFP +++Myc +His-Myc + +His-AviTag?++ ++ ++Sumo +++ +His-Sumo ++ ++ +SNAP-Tag?++ + +++Halo Tag?++ + +++TrxHISHis6是指六个组氨酸残基组成的融合标签,可插入在目的蛋白的C末端或N末端。
当某一个标签的使用,一是能构成表位利于纯化和检测;二是构成独特的结构特征(结合配体)利于纯化。
组氨酸残基侧链与固态的镍有强烈的吸引力,可用于固定化金属螯合层析(IMAC),对重组蛋白进行分离纯化。
使用His-tag有下面优点:标签的分子量小,只有~0.84KD,而GST和蛋白A分别为~26KD 和~30KD,一般不影响目标蛋白的功能;His标签融合蛋白可以在非离子型表面活性剂存在的条件下或变性条件下纯化,前者在纯化疏水性强的蛋白得到应用,后者在纯化包涵体蛋白时特别有用,用高浓度的变性剂溶解后通过金属螯和亲和层析去除杂蛋白,使复性不受其它蛋白的干扰,或进行金属螯和亲和层析复性;His标签融合蛋白也被用于蛋白质-蛋白质、蛋白质-DNA相互作用研究;His标签免疫原性相对较低,可将纯化的蛋白直接注射动物进行免疫并制备抗体。

重组蛋白表达技术现已经广泛应用于生物学各个具体领域。
特别是体内功能研究和蛋白质的大规模生产都需要应用重组蛋白表达载体。
美国GeneCopoeia的蛋白表达载体按照表达宿主的不同新推出3类,分别为表达宿主为大肠杆菌,哺乳动物细胞的,以及慢病毒载体,宿主可以为哺乳动物细胞和原代细胞。
除了必要的复制和筛选的元件,协助表达和翻译的元件外,本文将各类载体分别按照功能标签的不同确定种类并将个标签的功能初步介绍如下:His6:His6是指六个组氨酸残基组成的融合标签,可插入在目的蛋白的C末端或N末端。
当某一个标签的使用,一是能构成表位利于纯化和检测;二是构成独特的结构特征(结合配体)利于纯化。
组氨酸残基侧链与固态的镍有强烈的吸引力,可用于固定化金属螯合层析(IMAC),对重组蛋白进行分离纯化。
使用His-tag有下面优点:1.标签的分子量小,只有~0.84KD,而GST和蛋白A分别为~26KD和~30KD,一般不影响目标蛋白的功能;2.His标签融合蛋白可以在非离子型表面活性剂存在的条件下或变性条件下纯化,前者在纯化疏水性强的蛋白得到应用,后者在纯化包涵体蛋白时特别有用,用高浓度的变性剂溶解后通过金属螯和亲和层析去除杂蛋白,使复性不受其它蛋白的干扰,或进行金属螯和亲和层析复性;3.His标签融合蛋白也被用于蛋白质-蛋白质、蛋白质-DNA相互作用研究;4.His标签免疫原性相对较低,可将纯化的蛋白直接注射动物进行免疫制备抗体;5.可应用于多种表达系统,纯化的条件温和;6.可以和其它的亲和标签一起构建双亲和标签。
Flag:Flag标签蛋白为编码8个氨基酸的亲水性多肽(DYKDDDDK),同时载体中构建的Kozak序列使得带有FLAG的融合蛋白在真核表达系统中表达效率更高。
FLAG作为标签蛋白,其融合表达目的蛋白后具有以下优点:1.FLAG作为融合表达标签,其通常不会与目的蛋白相互作用并且通常不会影响目的蛋白的功能、性质,这样就有利用研究人员对融合蛋白进行下游研究。

strep tag序列Strep Tag序列是一种常用于蛋白质标记的相关序列。
它是从Streptococcus pyogenes(链球菌)的表面蛋白Protein G中衍生出来的。
Strep Tag序列的核心部分是八个氨基酸残基的序列:Trp-Ser-His-Pro-Gln-Phe-Glu-Lys。
这个序列在与StrepTactin结合时,可以牢固地结合在蛋白质表面,因此被广泛用于蛋白质的标记和纯化。
Strep Tag标记系统具有一系列的优势,这也是它被广泛应用的原因之一。
首先,Strep Tag序列非常小,仅有八个氨基酸残基,因此对于蛋白质产生的干扰较小。
此外,由于Strep Tag序列与StrepTactin结合强度很高,因此可以将其用于非常高纯度的蛋白质分离和纯化。
与其他标记系统相比,Strep Tag 序列还具有较高的耐温性和稳定性,使其适用于各种复杂条件下的蛋白质研究。
在实验中,研究人员通常使用基因工程技术将Strep Tag序列与研究对象的目标蛋白质融合,以实现Strep Tag的标记。
融合蛋白通常通过表达载体在细胞中大量表达,并通过细胞裂解和特定的实验步骤,与StrepTactin亲和纯化树脂结合。
该树脂可以与Strep Tag序列高度特异地结合,从而将融合蛋白与其他非特异性蛋白质和杂质分离开来。
然后,可以通过溶解蛋白质和纯化过程中不断的洗涤步骤,最终将纯化的蛋白质从纯化树脂上洗脱下来。
除了蛋白质纯化外,Strep Tag标记系统还可以在其他实验中发挥作用。
例如,研究人员可以利用Strep Tag序列来跟踪蛋白质在细胞中的定位,例如通过将荧光标记与Strep Tag融合,可以通过显微镜观察蛋白质的亚细胞定位。
此外,Strep Tag序列还可以与其他表位或标记序列组合使用,以实现更多功能,例如与荧光染料结合以进行荧光共振能量转移(FRET)实验。
总之,Strep Tag序列是一种重要的蛋白质标记序列,它具有高特异性、稳定性和耐温性,广泛应用于蛋白质的表达、纯化和定位等实验。

SNAP-tag蛋白标签技术与荧光分析法在蛋白原位分析中的联合应用乔庆龙;周伟;陈婕;刘文娟;苗露;尹文婷;徐兆超【摘要】为将生物体内微观的蛋白行为可视化并以宏观信号呈现出来对蛋白进行实时、动态分析,借助SNAP-tag蛋白标签技术与有机小分子荧光染料,构建了一系列用于活细胞内实时监测目标蛋白的免洗荧光探针.标签蛋白SNAP-tag能够特异性识别探针中的苄基鸟嘌呤,从而使目标蛋白共价连接上荧光团(萘酰亚胺),携带上荧光信使.此外,由于萘酰亚胺从水环境中被牵引至SNAP-tag蛋白的疏水空腔,其荧光信号呈现出2~13倍的增强.通过SNAP-tag标签蛋白与目标蛋白的融合,该荧光探针实现了对活细胞内线粒体蛋白CoX8A及核内蛋白H2B特异性识别,在免洗条件下完成了对目标蛋白的实时追踪及原位分析.【期刊名称】《色谱》【年(卷),期】2019(037)008【总页数】6页(P872-877)【关键词】SNAP-tag;原位;有机小分子荧光染料;免洗荧光探针【作者】乔庆龙;周伟;陈婕;刘文娟;苗露;尹文婷;徐兆超【作者单位】中国科学院大连化学物理研究所,辽宁大连116023;中国科学院大连化学物理研究所,辽宁大连116023;中国科学院大连化学物理研究所,辽宁大连116023;中国科学院大连化学物理研究所,辽宁大连116023;中国科学院大连化学物理研究所,辽宁大连116023;中国科学院大连化学物理研究所,辽宁大连116023;中国科学院大连化学物理研究所,辽宁大连116023【正文语种】中文【中图分类】O658蛋白是生命科学领域最重要的研究对象,参与多种生命过程中所必需的信号转导,其功能通过与小分子、DNA、其他蛋白底物之间相互作用实现[1,2]。
因此,对蛋白的原位分析,包括蛋白识别、蛋白分布及实时动态追踪等,能够更真实地揭示蛋白在生理过程中发挥的作用。
然而,紫外吸收法、圆二色光谱法、电化学法、红外光谱法、核磁共振法等均很难实现活细胞及活体内蛋白的原位分析[3]。

各种蛋白标签汇总各种蛋白标签汇总蛋白标签蛋白标签(proteintag)是指利用DNA体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪和纯化等。
随着技术的不断发展,研究人员相继开发出了具有各种不同功能的蛋白标签。
目前,这些蛋白标签已在基础研究和商业化产品生产等方面得到了广泛的应用。
TrxHISHis6是指六个组氨酸残基组成的融合标签,可插入在目的蛋白的C末端或N末端。
当某一个标签的使用,一是能构成表位利于纯化和检测;二是构成独特的结构特征(结合配体)利于纯化。
组氨酸残基侧链与固态的镍有强烈的吸引力,可用于固定化金属螯合层析(IMAC),对重组蛋白进行分离纯化。
使用His-tag有下面优点:•标签的分子量小,只有~0.84KD,而GST和蛋白A分别为~26KD和~30KD,一般不影响目标蛋白的功能;•His标签融合蛋白可以在非离子型表面活性剂存在的条件下或变性条件下纯化,前者在纯化疏水性强的蛋白得到应用,后者在纯化包涵体蛋白时特别有用,用高浓度的变性剂溶解后通过金属螯和亲和层析去除杂蛋白,使复性不受其它蛋白的干扰,或进行金属螯和亲和层析复性;•His标签融合蛋白也被用于蛋白质-蛋白质、蛋白质-DNA相互作用研究;•His标签免疫原性相对较低,可将纯化的蛋白直接注射动物进行免疫并制备抗体。
•可应用于多种表达系统,纯化的条件温和;•可以和其它的亲和标签一起构建双亲和标签。
Flag标签蛋白Flag标签蛋白为编码8个氨基酸的亲水性多肽(DYKDDDDK),同时载体中构建的Kozak序列使得带有FLAG的融合蛋白在真核表达系统中表达效率更高。
FLAG作为标签蛋白,其融合表达目的蛋白后具有以下优点:•FLAG作为融合表达标签,其通常不会与目的蛋白相互作用并且通常不会影响目的蛋白的功能、性质,这样就有利用研究人员对融合蛋白进行下游研究。
•融合FLAG的目的蛋白,可以直接通过FLAG进行亲和层析,此层析为非变性纯化,可以纯化有活性的融合蛋白,并且纯化效率高。

常见tag蛋白标签介绍在分子生物学和生物化学领域中,蛋白质标签是进行蛋白质表达、纯化和定位的重要工具。
其中,tag蛋白质标签是通过在蛋白质的N端或C端结合不同的蛋白质标签,可用于检测、纯化和追踪蛋白质。
下面,我们将介绍几种常见的tag蛋白标签。
His-TagHis-Tag是由6个组氨酸序列(His-His-His-His-His-His)组成,并且容易被许多金属离子亲和树脂(如Ni-NTA矩阵)捕捉。
这使得His-Tag成为常用的纯化标签之一。
此外,His-Tag蛋白标签具有中性对目标蛋白质溶解压力的作用,能够在蛋白质纯化的过程中保持目标蛋白原始的构象和生物活性。
GST-TagGST-Tag是由谷氨酸(G)-丝氨酸(S)-硫氨酸(T)三个氨基酸,以及谷氨酸二肽(DGP)组成的标签。
GST-Tag主要用于增强蛋白质的溶解和稳定性,并且也常用于纯化蛋白质。
此外,由于GST-Tag蛋白标签对多种酶具有亲和性,也可以用于显微镜研究中的指示标记。
FLAG-TagFLAG-Tag标签由Asp-Tyr-Lys-Asp-Asp-Asp-Asp-Lys(DYKDDDDK)组成,通常用于识别和高效表达蛋白质。
FLAG-Tag的鉴定方法是通过利用抗体识别FLAG标签,从而对FLAG标签的蛋白产物进行检测分析。
由于其广泛应用和成功的用例,它成为了最常用的蛋白质标记之一。
HA-TagHA-Tag标签由YPYDVPDYA序列组成,被广泛用于病毒插入物好转载体的制备。
HA-Tag蛋白标签可以将蛋白质捕捉到表面上的抗HA抗体上,并通过其特异性快速检测引入的基因。
Myc-TagMyc-Tag通常由EQKLISEEDL序列组成,并且通常被用于稳定的表达和检测。
当蛋白质连接到Myc-Tag标签时,它与特异性抗体反应,从而实现检测。
Myc-Tag 标签是许多流行的促进反应的标记中最新的标记之一。
GFP-TagGFP-Tag由最常见的荧光蛋白质GFP(Green Fluorescence Protein)制成。
鉴定his-tagHis-Tag是一种常用的蛋白质标签,被广泛应用于蛋白质表达、纯化和鉴定等领域。
本文将介绍His-Tag的原理、应用及鉴定方法。
一、His-Tag的原理His-Tag是一段由6个组氨酸残基(His)组成的多肽序列。
His-Tag可以在目标蛋白质的N端、C端或内部位置插入,使得目标蛋白与His-Tag融为一体。
His-Tag具有亲和力,可以与金属离子(如Ni2+、Co2+)发生配位作用,形成稳定的His-Tag-金属离子络合物。
通过His-Tag与金属离子之间的相互作用,可以实现对目标蛋白的快速纯化和鉴定。
二、His-Tag的应用1. 蛋白表达:利用His-Tag可以方便地将目标蛋白表达到大肠杆菌等表达系统中。
His-Tag可以帮助蛋白在细胞中得到正确的折叠和定位,提高表达量和纯度。
2. 蛋白纯化:His-Tag可以与金属离子亲和层析树脂(如Ni-NTA 树脂)结合,通过洗脱步骤将目标蛋白从复杂的混合物中纯化出来。
这种亲和层析方法简单快速,适用于高通量的蛋白纯化。
3. 蛋白鉴定:His-Tag可以通过Western blot、ELISA等方法进行鉴定。
可以利用His-Tag特异性的抗体检测His-Tag蛋白的存在与表达水平。
4. 蛋白互作研究:利用His-Tag可以将目标蛋白与其他蛋白或配体结合,研究蛋白的互作关系及功能。
三、His-Tag的鉴定方法1. SDS-PAGE:利用聚丙烯酰胺凝胶电泳分析His-Tag蛋白在分子量上的特异性。
通过与其他蛋白对比,可以确定目标蛋白的存在与表达水平。
2. Western blot:将His-Tag蛋白转移至聚丙烯酰胺膜上,利用His-Tag特异性的抗体进行检测。
通过与His-Tag蛋白的特异结合,可以准确鉴定His-Tag蛋白的存在与表达水平。
3. 质谱分析:利用质谱仪对His-Tag蛋白进行分析,确定其分子量和序列信息。
通过与已知His-Tag蛋白的质谱图谱对比,可以确认目标蛋白是否具有His-Tag标签。
人内皮素受体A基因克隆及表达潘晓菲;时丽丽;谭初兵;吕超君;徐为人;汤立达【摘要】为了建立内皮素受体拮抗剂筛选系统,克隆人ETA基因,构建真核表达载体,并实现pTag-Lite SNAP-ETA在CHO-K1细胞中的瞬时表达.从人肺腺癌细胞系A549中克隆人ETA基因,连接到pTag-Lite SNAP质粒,构建表达载体pTag-Lite SNAP-ETA,用FuGENER HD转染试剂将表达载体pTag-Lite SNAP-ETA转染入CHO-K1细胞内,通过荧光显微镜检测融合蛋白SNAP-ETA的表达.DNA测序结果表明pTag-Lite SNAP-ETA表达载体构建成功,荧光显微镜检测结果表明人ETA在CHO-K1细胞中有效表达.【期刊名称】《生物技术通报》【年(卷),期】2014(000)002【总页数】6页(P187-192)【关键词】内皮素受体A;RT-PCR;pTag-Lite SNAP载体;CHO-K1细胞;表达【作者】潘晓菲;时丽丽;谭初兵;吕超君;徐为人;汤立达【作者单位】天津医科大学基础医学院,天津300070;天津药物研究院天津市新药设计与发现重点实验室,天津300193;天津药物研究院天津市新药设计与发现重点实验室,天津300193;天津医科大学基础医学院,天津300070;天津药物研究院天津市新药设计与发现重点实验室,天津300193;天津药物研究院天津市新药设计与发现重点实验室,天津300193【正文语种】中文内皮素(Endothelin,ET)是一种含有21个氨基酸的多肽,是目前已知的作用最强和效应最持久的血管活性肽,有强烈的血管收缩和促平滑肌细胞迁移、增殖作用,广泛作用于体内多系统,有ET-1、ET-2、ET-3三种亚型,与高血压、充血性心力衰竭、糖尿病、癌症及纤维化等有着密切联系。
内皮素主要通过与靶细胞膜上的内皮素受体(Endothelin receptor,ETR)结合后发挥其生物学效应,并在心血管疾病、肾脏疾病、糖尿病、自身免疫性疾病和肿瘤等众多疾病的发生发展中扮演了重要的角色,因此拮抗ET与ETR的相互作用被认为是治疗此类疾病的有效治疗途径,而抑制ETR是阻断ET生理病理学效应的主要手段[1-9]。
halotag技术标记原理
Halotag技术是一种用于蛋白质标记的技术,它是一种可逆的、共价的标记方法,可以实现对蛋白质的快速、高效、可控的标记。
其基本原理是利用一种特殊的酶——haloalkane dehalogenase(HaloTag酶),通过基于简单的化学反应的方式,将Halotag融合蛋白质与特定化学物质之间实现共价结合。
在Halotag技术中,需要将Halotag融合到目标蛋白质上,这可以通过遗传工程方法实现。
将Halotag与目标蛋白质的基因重组到一起,利用真核或原核细胞表达系统来表达融合蛋白质。
随后,将表达的蛋白质分离出来,并利用一种叫做HaloLink化学物质的试剂来实现Halotag与标记物的共价结合。
这样,就实现了目标蛋白质的标记。
总的来说,Halotag技术的原理是基于化学共价的方式实现蛋白质的标记。
这种方法快速、高效、可逆,具有较好的应用前景。