胶体金标记蛋白A技术(ProteinA-goldtechnique,PAg法)
- 格式:pptx
- 大小:127.69 KB
- 文档页数:13

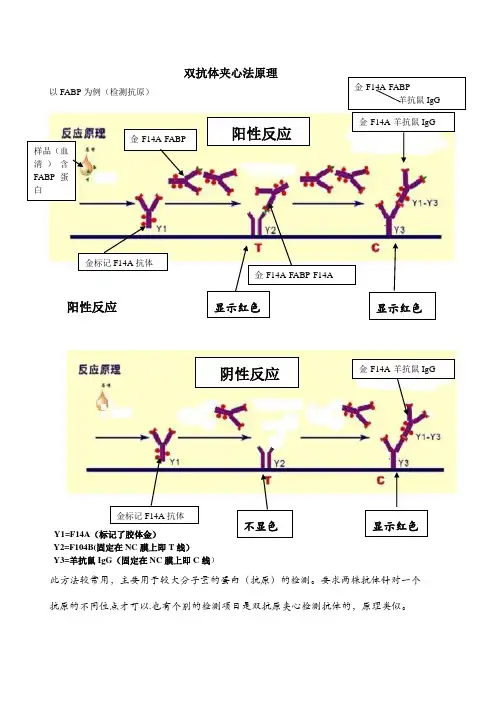
双抗体夹心法原理以FABP 为例(检测抗原)阳性反应Y1=F14A (标记了胶体金)Y2=F104B(固定在NC 膜上即T 线)Y3=羊抗鼠IgG (固定在NC 膜上即C 线)此方法较常用,主要用于较大分子量的蛋白(抗原)的检测。
要求两株抗体针对一个抗原的不同位点才可以.也有个别的检测项目是双抗原夹心检测抗体的,原理类似。
样品(血清)含FABP 蛋白金标记F14A 抗体金-F14A-FABP金-F14A-FABP-F14A金-F14A-羊抗鼠IgG金-F14A-FABP羊抗鼠IgG显示红色 显示红色金标记F14A 抗体不显色 显示红色金-F14A-羊抗鼠IgG阴性反应阳性反应竞争法原理以吗啡为例(检测抗原)阳性反应Y1=胶体金标记的吗啡单抗 Y2=吗啡-BSA 偶联物 Y3=羊抗鼠此方法主要用于小分子抗原(毒品、农药、肽链等)的检测.由于抗原分子量小不能直接固定于NC 膜上,常常用化学方法把小分子偶联到BSA 等大分子物质上再固定于NC 膜上。
此结果与双抗原夹心法相反,阴性CT 两条都是红线,阳性只有C 线一条红线。
金-吗啡抗体-吗啡吗啡-BSA金标记吗啡抗体显示红色不显色金-吗啡抗体-吗啡羊抗鼠样品(尿液)含吗啡显示红色显示红色 金标记吗啡抗体金-吗啡抗体-羊抗鼠阴性尿液抗体-吗阴性反应阳性反应间接法原理以HIV 为例(检测抗体)此方法主要用于血清中抗体检测,纯化或者重组的抗原固定于NC 膜上,标记多为蛋白A (ProteinA 或叫SPA ,抗体Fc 端结合而与其它蛋白质不结合)。
此方法要求胶体金过量,一般来说样品再加入前需要稀释或者加极少量后再加缓冲液。
斑点免疫渗滤法使用就是间接法。
显示红色 显示红色显示红色不显色。

胶体金标记蛋白a偶联抗体步骤
胶体金标记蛋白a偶联抗体的步骤如下:
1.胶体金的制备:去离子水溶解氯金酸,煮沸后加入柠檬酸三钠,再煮沸7分钟。
通过电镜观察胶体金的粒度。
2.免疫胶体金的制备:取颗粒直径为15 nm的胶体金100 mL,用0.1 mol/L K2CO3调至pH 6.2,在搅拌状态下加入SPA(1 g/L)0.6 mL,继续搅拌10分钟;再加入50 g/L BSA 10 mL,继续搅拌5分钟。
4℃下3000 r/min离心5分钟,弃沉淀,上清液以12 000 r/min 离心15分钟,小心移去上清液,沉淀即为制备的胶体金。
用20 mL 悬浮液悬浮沉淀,以吸水纤维吸附后冷冻干燥4小时,4℃保存备用。
3.免疫层析测试条的制备:测试条由吸水纤维、硝酸纤维素膜和吸水滤纸三部分组成。
在硝酸纤维素膜上用CagA(1.5 mg/L)及人IgG(1 mg/L)划线(1 mm宽),分别作为检测线和对照线,晾干,用50 g/L BSA封闭2小时,以0.01 mol/L PBS洗涤3次,干燥后依次粘于白色塑料片(支持物)上,切成0.5 cm×10 cm的试条,加干燥剂密封保存。
4.抗Hp-CagA IgG的检测:以新鲜血清为佳。
试管中加入0.1 mL~0.2 mL血清,将测试条含有金标记物的一端插入血清内即可。

胶体金标记工艺胶体金标记工艺是一种常用于生物医学领域中的标记技术。
该技术利用纳米级的金颗粒作为标记物,通过将其附着在生物分子表面上,实现对分子生物学、细胞生物学等领域中的生物实体进行追踪和观察。
在医学领域中,胶体金标记工艺具有较高的生物相容性和生物学稳定性,并且该技术标记出的分子具有较明显的颜色,方便观察和分析。
胶体金标记工艺的步骤主要包括:制备胶体金溶液、表面修饰、选择适宜子和标记反应。
首先,需要制备胶体金溶液,一般采用还原金盐的方法制备,即在还原剂的作用下,将金盐还原成具有红色或蓝色色泽的胶体金颗粒。
其次,在得到的胶体金颗粒表面修饰,以增强这些颗粒的稳定性和生物相容性。
接着,通过选择适宜的生物分子,例如抗体、酶、 DNA 等,将其与表面修饰的胶体金颗粒结合,形成金标记化合物,标记出需要研究的生物实体,例如细胞、蛋白质等。
胶体金标记工艺具有一些优点,包括:①生物相容性优良,可以应用于生物体内;②标记物稳定性高,可以长时间保存;③信号强度高,可观察性好。
此外,该技术在应用上有很大的灵活性,可以选择不同大小、形状的胶体金颗粒和不同种类的生物分子,作为标记物进行应用。
然而,胶体金标记工艺也存在一些挑战,例如:①标记物数量难以准确控制;②标记物存在信号交叉的情况;③标记物在复杂生物环境下的作用机理尚不完全清楚。
此外,胶体金标记工艺的应用需要严格控制实验条件,以避免样本干扰和实验误差的影响。
综上所述,胶体金标记工艺是一种应用较广泛的标记技术,不仅在生物医学领域有着广泛的应用前景,也在其他领域,例如材料科学和化学分析等方面有所涉及。
然而,对于该技术进行应用时需要注意实验条件的控制,以便能够获得准确可靠的实验结果。
未来,随着生物技术的发展,胶体金标记工艺将会在更多领域得到应用和推广。

胶体⾦法的定义和分类胶体⾦是⼀种常⽤的标记技术,是以胶体⾦作为⽰踪标志物应⽤于抗原抗体的⼀种新型的免疫标记技术,有其独特的优点。
近年已在各种⽣物学研究中⼴泛使⽤。
在临床使⽤的免疫印迹技术⼏乎都使⽤其标记。
同时在流式、电镜、免疫、分⼦⽣物学以⾄⽣物芯⽚中都可能例⽤到。
1971年Faulk 和Taytor将胶体⾦引⼊免疫化学,此后免疫胶体⾦技术作为⼀种新的免疫学⽅法,在⽣物医学各领域得到了⽇益⼴泛的应⽤。
⽬前在医学检验中的应⽤主要是免疫层析法(immunochromatogra-phy)和快速免疫⾦渗滤法(Dot-immuogold filtration assay DIGFA),⽤于检测 HBsAg、HCG 和抗双链DNA抗体等,具有简单、快速、准确和⽆污染等优点。
免疫胶体⾦技术的基本原理:胶体⾦是由氯⾦酸(HAuCl4)在还原剂如⽩磷、抗坏⾎酸、枸橼酸钠、鞣酸等作⽤下,可聚合成⼀定⼤⼩的⾦颗粒,并由于静电作⽤成为⼀种稳定的胶体状态,形成带负电的疏⽔胶溶液,由于静电作⽤⽽成为稳定的胶体状态,故称胶体⾦。
胶体⾦在弱碱环境下带负电荷,可与蛋⽩质分⼦的正电荷基团形成牢固的结合,由于这种结合是静电结合,所以不影响蛋⽩质的⽣物特性。
胶体⾦除了与蛋⽩质结合以外,还可以与许多其它⽣物⼤分⼦结合,如SPA、PHA、ConA 等。
根据胶体⾦的⼀些物理性状,如⾼电⼦密度、颗粒⼤⼩、形状及颜⾊反应,加上结合物的免疫和⽣物学特性,因⽽使胶体⾦⼴泛地应⽤于免疫学、组织学、病理学和细胞⽣物学等领域。
胶体⾦标记,实质上是蛋⽩质等⾼分⼦被吸附到胶体⾦颗粒表⾯的包被过程。
吸附机理可能是胶体⾦颗粒表⾯负电荷,与蛋⽩质的正电荷基团因静电吸附⽽形成牢固结合。
⽤还原法可以⽅便地从氯⾦酸制备各种不同粒径、也就是不同颜⾊的胶体⾦颗粒。
这种球形的粒⼦对蛋⽩质有很强的吸附功能,可以与葡萄球菌A蛋⽩、免疫球蛋⽩、毒素、糖蛋⽩、酶、抗⽣素、激素、⽜⾎清⽩蛋⽩多肽缀合物等⾮共价结合,因⽽在基础研究和临床实验中成为⾮常有⽤的⼯具。

免疫胶体金的制备及其在医学检验中的应用周友泉的免疫印迹技术几乎都使用其标记。
同时在流式、电镜、免疫、分子生物学以至生物芯片中都可能例用到。
1971年Faulk 和Taytor将胶体金引人免疫化学,此后免疫胶体金技术作为一种新的免疫学方法,在生物医学各领域得到了日益广泛的应用。
目前在医学检验中的应用主要是免疫层析法( immunochromatogra-phy)和快速免疫金渗滤法(Dot-immuogold filtration assay DIGFA),用于检测HBsAg、HCG 和抗双链DNA抗体等,具有简单、快速、准确和无污染等优点。
免疫胶体金技术的基本原理氯金酸(HAuCl4)在还原剂作用下,可聚合成一定大小的金颗粒,形成带负电的疏水胶溶液。
由于静电作用而成为稳定的胶体状态,故称胶体金。
胶体金标记,实质上是蛋白质等高分子被吸附到胶体金颗粒表面的包被过程。
吸附机理可能是胶体金颗粒表面负电荷,与蛋白质的正电荷基团因静电吸附而形成牢固结合。
用还原法可以方便地从氯金酸制备各种不同粒径、也就是不同颜色的胶体金颗粒。
这种球形的粒子对蛋白质有很强的吸附功能,可以与葡萄球菌A蛋白、免疫球蛋白、毒素、糖蛋白、酶、抗生素、激素、牛血清白蛋白多肽缀合物等非共价结合,因而在基础研究和临床实验中成为非常有用的工具。
免疫金标记技术(Immunogold labelling techique) 主要利用了金颗粒具有高电子密度的特性,在金标蛋白结合处,在显微镜下可见黑褐色颗粒,当这些标记物在相应的配体处大量聚集时,肉眼可见红色或粉红色斑点,因而用于定性或半定量的快速免疫检测方法中,这一反应也可以通过银颗粒的沉积被放大,称之为免疫金银染色。
胶体金的制备方法胶体金的制备一般采用还原法,常用的还原剂有柠檬酸钠、鞣酸、抗坏血酸、白磷、硼氢化钠等。
下面介绍最常用的制备方法及注意事项。
1、玻璃容器的清洁:玻璃表面少量的污染会干扰胶体金颗粒的生成,一切玻璃容器应绝对清洁,用前经过酸洗、硅化。

⑥包被后的金溶胶也可浓缩后于Sephadex G-200柱进行凝胶层析分离纯化,以含0.1%BSA的缓冲溶液洗脱。
通常用IgG包被的金溶胶洗脱液pH为8.2,以A蛋白包被的金溶胶洗脱液为pH7.0。
以上操作中应注意,一切溶液中不应含杂质微粒,可用高速离心或微孔滤膜预处理。
(4)胶体金标记蛋白的纯化1)超速离心法:根据胶体金颗粒的大小,标记蛋白的种类及稳定剂的不同选用不同的离心速度和离心时间。
用BSA做稳定剂的胶体金—羊抗兔IgG结合物可先低速离心(20nm金胶粒用1 200r/min,5nm金胶粒用1 800r/min)20min,弃去凝聚的沉淀。
然后将5nm胶体金结合物用6 000g,4℃离心1h;20nm~40nm胶体金结合物,14 000g,4℃离心1h。
仔细吸出上清,沉淀物用含1%BSA 的PB液(含0.02%NaN3),将沉淀重悬为原体积的1/10,4℃保存。
如在结合物内加50%甘油可贮存于-18℃保存一年以上。
为了得到颗粒均一的免疫金试剂,可将上述初步纯化的结合物再进一步用10%~30%蔗糖或甘油进行密度梯度离心,分带收集不同梯度的胶体金与蛋白的结合物。
2)凝胶过滤法:此法只适用于以BSA作稳定剂的胶体金蛋白结合物的纯化。
将胶体金蛋白结合物装入透析袋,在硅胶中脱水浓缩至原体积的1/5~1/10。
再经1 500r/min离心20min。
取上清加至Sephacryl S-400(丙烯葡聚糖凝胶S-400)层析柱分别纯化。
层析柱为0.8 cm×20cm,加样量为床体积的1/10,以0.02Mol/L PBS液洗脱(内含0.1%BSA,0.05%NaN3,pH8.2者用IgG标记物),流速为8ml/h。
按红色深浅分管收集洗脱液。
一般先滤出的液体为微黄色,有时略混浊,内含大颗粒聚合物等杂质。
继之为纯化的胶体金蛋白结合物,随浓度的增加而红色逐渐加深,清亮透明,最后洗脱出略带黄色的为标记的蛋白组分。
胶体金标记技术胶体金是一种常用的标记技术,有其独特的优点。
近年已在各种生物学研究中广泛使用。
在临床使用的免疫印迹技术几乎都使用其标记。
同时在流式、电镜、免疫、分子生物学以至生物芯片中都可能利用到。
1971年Faulk 和Taytor将胶体金引人免疫化学,此后免疫胶体金技术作为一种新的免疫学方法,在生物医学各领域得到了日益广泛的应用。
目前在医学检验中的应用主要是免疫层析法(immunochromatogra-phy)和快速免疫金渗滤法(Dot-immuogold filtration assay DIGFA),用于检测 HBsAg、HCG 和抗双链DNA抗体等,具有简单、快速、准确和无污染等优点。
(一)基本原理免疫胶体金技术是以胶体金作为示踪标志物应用于抗原抗体的一种新型的免疫标记技术。
胶体金是由氯金酸(HAuCl4)在还原剂如柠檬酸钠、鞣酸、抗坏血酸、白磷、硼氢化钠等作用下,聚合成为特定大小的金颗粒,并由于静电作用成为一种稳定的胶体状态,称为胶体金。
胶体金在弱碱环境下带负电荷,可与蛋白质分子的正电荷基团形成牢固的结合,由于这种结合是静电结合,所以不影响蛋白质的生物特性。
胶体金除了与蛋白质结合以外,还可以与许多其它生物大分子结合,如SPA、PHA、ConA等。
根据胶体金的一些物理性状,如高电子密度、颗粒大小、形状及颜色反应,加上结合物的免疫和生物学特性,因而使胶体金广泛地应用于免疫学、组织学、病理学和细胞生物学等领域。
(二)胶体金的制备胶体金的制备一般采用还原法,根据不同的还原剂可以制备大小不同的胶体金颗粒。
常用来制备胶体金颗粒的方法如下:1.枸橼酸三钠还原法(1)10nm胶体金粒的制备:取0.01%HAuCl4水溶液100ml,加入1%枸橼酸三钠水溶液3ml,加热煮沸30min,冷却至4℃,溶液呈红色。
(2)15nm胶体金颗粒的制备:取0.01%HAuCl4水溶液100ml,加入1%枸橼酸三钠水溶液2ml,加热煮沸15min~30min,直至颜色变红。

尿微量白蛋白(胶体金法)技术要求哎呀,说起尿微量白蛋白(胶体金法)技术要求,这可真是个技术活儿,得慢慢道来。
首先,咱们得聊聊这个尿微量白蛋白是个啥。
简单来说,它就是尿液里的一种蛋白质,正常情况下,尿液里是不应该有这种蛋白质的。
但是,如果肾脏出了点小问题,比如糖尿病肾病啊,高血压肾病啊,这种蛋白质就会偷偷溜进尿液里。
所以,检测这个尿微量白蛋白,对于早期发现肾脏问题还是挺重要的。
接下来,咱们得说说这个胶体金法。
这是一种检测方法,用一种叫做胶体金的东西来标记抗体,然后通过化学反应来检测尿液中的微量白蛋白。
这个方法的好处是灵敏度高,操作简便,结果也快。
那么,这个技术要求具体是啥呢?首先,你得有个干净的尿样。
这个尿样得是新鲜的,最好是早上第一次尿,因为这时候尿液浓度最高,检测结果最准确。
然后,你得有个靠谱的检测试剂盒,这个试剂盒里包含了胶体金标记的抗体和一些其他必要的化学试剂。
操作的时候,你得按照说明书来,一步步来。
首先,把尿样滴到试剂盒的测试区,然后等个几分钟,让尿液和试剂充分反应。
这个过程中,你可能会看到一些颜色变化,这就是胶体金抗体和尿微量白蛋白结合的结果。
最后,你得对照试剂盒上的对照线,看看测试区的颜色变化,以此来判断尿微量白蛋白的浓度。
这个过程中,你得注意几个细节。
首先,操作的时候手要干净,别让脏东西污染了尿样或者试剂。
其次,等待时间要准确,太短了反应不充分,太长了结果可能会受影响。
最后,读结果的时候要仔细,别因为颜色变化不明显就忽略了。
总的来说,尿微量白蛋白(胶体金法)技术要求就是:干净的尿样,靠谱的试剂盒,准确的操作,仔细的结果解读。
虽然听起来有点复杂,但只要按照步骤来,还是挺简单的。
这个技术对于早期发现和监测肾脏问题还是挺有帮助的,希望我说的这些对你有所帮助。


胶体金(金标)检验法胶体金是一种常用的标记技术,有其独特的优点。
近年已在各种生物学研究中广泛使用。
免疫胶体金技术的基本原理是:氯金酸(HAuCl4)在还原剂作用下,可聚合成一定大小的金颗粒,形成带负电的疏水胶溶液。
由于静电作用而成为稳定的胶体状态,故称胶体金。
胶体金标记,实质上是蛋白质等高分子被吸附到胶体金颗粒表面的包被过程。
免疫金标记技术(Immunogold labelling techique) 主要利用了金颗粒具有高电子密度的特性,在金标蛋白结合处,在显微镜下可见黑褐色颗粒,当这些标记物在相应的配体处大量聚集时,肉眼可见紫色斑点,因而用于定性或半定量的快速免疫检测方法中。
为什么霍乱可以用胶体金(金标)检验法进行快速筛查?霍乱弧菌快速检测卡是利用单克隆抗体胶体金标记技术和膜层析技术研制而成,用于定性检测样本中可能存在的霍乱弧菌的特异性抗原A及O139血清型。
首先按常规方法制备并筛选出效价高的抗O1群A 抗原和抗O139抗原的单抗细胞株。
然后采用枸缘酸钠还原法制备胶体金颗粒,选择玻璃纤维吸附最适浓度的金标抗体。
按常规方法免疫家兔,制备霍乱弧菌的多克隆抗体。
根据检测对象(疑似病人粪便)的特殊性,研制了特异的稀释液。
一方面可裂解细菌,释放抗原,提高检测敏感性,另一方面可起到防止污染的作用。
经二年多的反复试制,我公司完成的霍乱弧菌O1群(O139)快速检测试纸,其对霍乱弧菌最低敏感性10分钟内106菌/ml阳性,达到临床最低检出量的要求,符合卫生部《霍乱防治手册》要求,且对高浓度的菌液109 菌/ml无前置反应;用萃取液、正常人粪便标本及其它大肠中寄生菌进行的特异性鉴定表明,该试纸条特异性为100%金特敏? 霍乱快速检测卡的特点是什么?最低检出量:不低于105cfu/ml适合临床需要。
快速出结果:稀释直接裂解细菌,10分钟观察结果满足疾病控制要求。
便利使用:独立包装,“插”式设计,操作简捷,避免二次污染。
胶体金是一种常用的标记技术,是以胶体金作为示踪标志物应用于抗原抗体的一种新型的免疫标记技术,有其独特的优点。
近年已在各种生物学研究中广泛使用。
在临床使用的免疫印迹技术几乎都使用其标记。
同时在流式、电镜、免疫、分子生物学以至生物芯片中都可能例用到。
1971年F aulk和Tayto r将胶体金引入免疫化学,此后免疫胶体金技术作为一种新的免疫学方法,在生物医学各领域得到了日益广泛的应用。
目前在医学检验中的应用主要是免疫层析法(immuno chrom atogr a-phy)和快速免疫金渗滤法(Dot-immuog old filtra tionassayDIGFA),用于检测 HBsAg、HCG 和抗双链DNA抗体等,具有简单、快速、准确和无污染等优点。
免疫胶体金技术的基本原理:胶体金是由氯金酸(HAuCl4)在还原剂如白磷、抗坏血酸、枸橼酸钠、鞣酸等作用下,可聚合成一定大小的金颗粒,并由于静电作用成为一种稳定的胶体状态,形成带负电的疏水胶溶液,由于静电作用而成为稳定的胶体状态,故称胶体金。
胶体金在弱碱环境下带负电荷,可与蛋白质分子的正电荷基团形成牢固的结合,由于这种结合是静电结合,所以不影响蛋白质的生物特性。
胶体金除了与蛋白质结合以外,还可以与许多其它生物大分子结合,如SPA、PHA、ConA 等。
根据胶体金的一些物理性状,如高电子密度、颗粒大小、形状及颜色反应,加上结合物的免疫和生物学特性,因而使胶体金广泛地应用于免疫学、组织学、病理学和细胞生物学等领域。
胶体金标记,实质上是蛋白质等高分子被吸附到胶体金颗粒表面的包被过程。
吸附机理可能是胶体金颗粒表面负电荷,与蛋白质的正电荷基团因静电吸附而形成牢固结合。
胶体金标记技术胶体金标记技术是以胶体金作为示踪标志物或显色剂,应用于抗原抗体反应的一种新型免疫标记技术。
由于它不存在内源酶干扰及放射性同位素污染等问题,且利用不同颗粒大小的胶体金还可以作双重甚至多重标记,使定位更加精确。
因此已成为继荧光素、酶、同位素及乳胶标记技术之后的一种新型标记技术。
现已广泛应用于电镜、流式细胞仪、免疫印迹、蛋白染色、体外诊断试剂的制造等领域。
用胶体金作为特殊标记物的研究始于60年代初,1962年Feldberr等报道了用胶体金标记细胞进行电子显微镜的研究。
1971年,Taylor又将胶体金引入电镜免疫标记技术中。
近年来的研究表明,胶体金也可作为体外免疫加层试验的指示物。
由于胶体金作为标记物具有很多优点,因此自其问世以来,在国内外的许多研究领域中得到了迅速的发展。
近年来,它更多的被应用于免疫学和细胞学相关分子水平的检测中。
尤其随着人们物质生活的改善,有关人类健康的问题在现实生活中已显得非常突出。
从90年代至今的多篇报道都是关于动物体或人体相关抗体和病原体检测的。
制备方法在溶液中金颗粒呈圆形,边缘平整,界线十分清楚。
金颗粒表面带有大量负电荷,由于静电的排斥力,使其在水中保持稳定状态,形成稳定的胶体,所以称其为胶体金。
胶体金的制作方法有白磷还原法,抗坏血酸还原法,柠檬酸三钠还原法和鞣酸—柠檬酸三钠还原法。
通过改变反应体系中氯金酸与还原剂的比例(即增加或减少还原剂的量)可得到所需不同直径的金颗粒。
但前两种方法制备得到的金颗粒直径大小不均一,所以目前常用后两种方法,以柠檬酸三钠还原法为例,有两种方法。
1.Frens标准方法:1)取0.01%HAuCl4溶液50mL,加热煮沸,随即快速加入1%柠檬酸三钠溶液0.5mL。
2)约过25s沸腾的溶液变为淡蓝色,大约再过70s,蓝色突然转变为亮红色,3)继续煮沸约5分钟后结束反应。
4)冷却后用0.1M K2CO3溶液调至所需PH值。
5)此后再延长反应时间或另加入额外的柠檬酸三钠都不影响实验结果。
胶体金标记蛋白及应用姜先荣 杨 杰 摘 要 胶体金做为标记物用于免疫标记技术的时间不长,但发展迅速,在免疫组织(或细胞)化学检测和免疫学检验领域中都得到了广泛的应用。
本文将介绍胶体金、胶体金标记蛋白及其应用。
关键词 胶体金 胶体金标记蛋白 免疫组化研究 免疫加层试验 用胶体金作为特殊标记物的研究始于60年代初。
1962年Feldh err等报道了用胶体金标记细胞进行电子显微镜的研究。
1971年,Taylor又将胶体金引入电镜免疫标记技术中。
近年来的研究表明,胶体金也可作为体外免疫加层试验的指示物。
由于胶体金作为标记物具有很多优点,因此自其问世以来,在国内外的许多研究领域中得到了迅速的发展。
1.胶体金标记蛋白质技术的基本原理及制备1.1 基本原理 在溶液中金颗粒呈圆形,边缘平滑、完整,界线十分清楚,使其具有确定性。
金颗粒表面带有负电荷,由于静电的排斥力,使其在水中保持稳定状态,形成稳定的胶体,所以称其为胶体金。
由于胶体金的颗粒表面带有较多的电荷,能够对蛋白质等高分子物质进行吸附结合。
利用这种表面吸附作用,使蛋白质吸附在金溶胶颗粒表面就得到胶体金标记蛋白质。
在免疫组织(或细胞)化学研究中,吸附在胶体金表面的抗体或抗原能定向将胶体金颗粒载运到组织或细胞中的相应抗原位置或固相载体上抗原、抗体的相应位置。
由于金颗粒具有高电子密度的特性,且这些标记物在固相载体上抗原抗体反应处聚集达到一定密度时(即当金颗粒107/mm2)可出现肉眼可见的粉红色斑点,所以其既可用于免疫电镜、光镜下的抗原定位、定量、定性研究,也可作为指示物,用于体外免疫加层试验中检测抗原或抗体的存在。
1.2 制备 胶体金标记蛋白质的制备包括胶体金的制备和蛋白质——胶体金复合物的形成。
用不同种类、不同剂量的还原剂还原氯金酸(HA u CL4),可制备粒径不同的胶体金。
常用的还原剂有柠檬酸钠、白磷、抗坏血酸等。
还原剂的选择与制备的胶体金颗粒的大小有关。