鲁科版化学必修2练习:章末系统总结 Word版含解析
- 格式:doc
- 大小:177.00 KB
- 文档页数:5
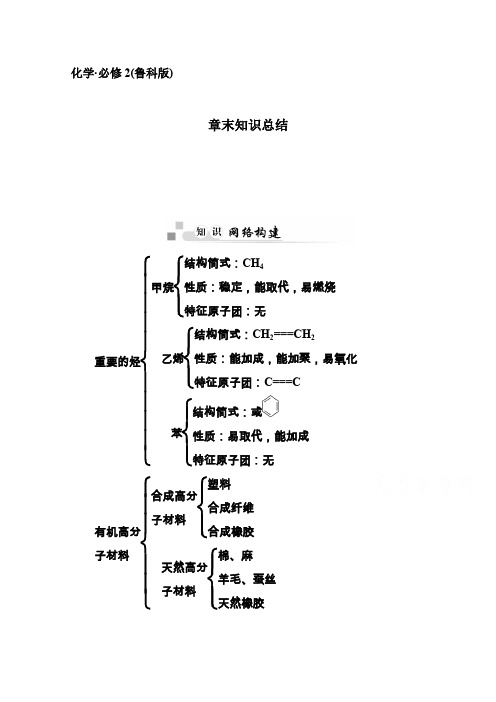
化学·必修2(鲁科版)章末知识总结重要的烃⎩⎪⎪⎪⎪⎨⎪⎪⎪⎪⎧甲烷⎩⎪⎨⎪⎧结构简式:CH 4性质:稳定,能取代,易燃烧特征原子团:无乙烯⎩⎪⎨⎪⎧结构简式:CH 2===CH 2性质:能加成,能加聚,易氧化特征原子团:C===C苯⎩⎪⎨⎪⎧结构简式:或性质:易取代,能加成特征原子团:无有机高分子材料⎩⎪⎪⎨⎪⎪⎧合成高分子材料⎩⎪⎨⎪⎧塑料合成纤维合成橡胶天然高分子材料⎩⎪⎨⎪⎧棉、麻羊毛、蚕丝天然橡胶热点一 烃的燃烧规律若烃的分子式用C x H y 表示,烃完全燃烧的化学方程式可表示为:C x H y +⎝ ⎛⎭⎪⎫x +y 4O 2――→点燃xCO 2+y 2 H 2O 。
根据不同的情况,可总结出与烃完全燃烧有关的几条规律:1.等物质的量的烃完全燃烧耗氧量的计算。
(1)耗O 2量的多少取决于⎝ ⎛⎭⎪⎫x +y 4,(x +y 4)值越大,耗O 2量越大。
(2)产生CO 2的量取决于x ,x 越大,产生CO 2的量也越多。
(3)产生H 2O 的量取决于y ,y 越大,产生H 2O 的量也越多。
注意:实验式(最简式)相同、分子式不同的两种烃,等物质的量完全燃烧时,耗O 2量并不相等。
耗O 2量也可用上述规律进行比较,但两种烃的耗O 2的量之比、产生CO 2的量之比、产生H 2O 的量之比完全相同,比值等于两种烃分子中C(或H)原子个数之比。
2.等质量的烃完全燃烧耗氧量的计算。
因等质量的H 比等质量的C 耗O 2多,故:(1)耗O 2量的多少取决于y x ,y x值越大,耗O 2量越大。
注意:y x值越大,意味着烃分子中H 的质量分数越大,耗O 2量也越大。
(2)产生H 2O 的量取决于y x ,y x值越大,产生H 2O 的量也越大。
(3)产生CO 2的量取决于y x ,y x值越大,产生CO 2的量越小。
注意:实验式相同的烃,y x相同,等质量完全燃烧时耗O 2量、产生CO 2的量、产生H 2O 的量完全相同。

1、据报道,某些花岗岩会产生氡(22286Rn),从而对人体产生伤害。
请回答:(1)该原子的质量数是,质子数是,中子数是。
(2)请补全Rn的原子结构示意图(3)请根据Rn的原子结构预测,氡气的化学性质()A.非常活泼,容易与氧气等非金属单质反应B.比较活泼,能与钠等金属反应C.不太活泼,与氮气性质相似D.很难与其他物质发生反应⑶研究发现,镭能蜕变为22286Rn,故称22286Rn为镭射气;钍能蜕变为22086Rn,故将22086Rn称为钍射气;锕能蜕变为21986Rn,故将21986Rn称为锕射气。
22286Rn、21986Rn是()A.同种元素B.同位素C.同种核素D.同种原子由此可见,决定元素种类,质子数和决定核素种类。
2、请利用原子结构的知识解释下列事实(1)在硫化钠中,钠元素显+1价,硫元素显-2价(2)钠原子和铝原子电子层数相同,但金属钠与氯气的反应要比金属铝与氯气的反应容易而且剧烈。
第二节元素周期律和元素周期表ag jb c f i l me h kd(1)表中所列元素中:属于短周期元素的有________________________________,属于主族元素的有____________________,e元素在周期表中的位置是_________周期,_______族。
(2)下列___________组元素的单质可能都是电的良导体A.b,c,iB.a,g,kC.c,g,lD.d,e,f(3)将元素a,b,c,f,l的原子半径按从小到大的顺序排列:_______________________ (4)i元素属于___________元素,它的最高化合价是____________,最低化合价是_______。
它能与氧气反应,生成一种吸水性很强的物质,这种物质在实验室里常用作干燥剂,写出i 的单质与氧气反应的化学方程式:___________________________________________。

化学键化学反应规律(时间90分钟,满分100分)一、选择题(本题包括20小题,每小题3分,共60分)1.绿色交通工具是指在行驶中对环境不产生污染或只产生微量污染的载客工具。
下列不属于绿色交通工具的是( )A.无轨电车B.氢气动力车C.太阳能汽车D.柴油汽车D[无轨电车以电能为动力,不会产生大气污染物,是绿色交通工具,A项不符合题意。
氢气动力车是以氢气为燃料,燃烧时产生的物质是水,不会产生大气污染物,是绿色交通工具,B项不符合题意。
太阳能汽车是以太阳能为动力,无污染,是绿色交通工具,C项不符合题意。
柴油汽车是以化石燃料柴油为能源,燃料燃烧时会产生污染性气体,同时还会产生许多CO2,会造成温室效应,因此不属于绿色交通工具,D项符合题意。
]2.下列化学用语书写正确的是( )3.下列说法正确的是 ( )A.化学键的变更必定会引起能量变更,所以能量变更也肯定会引起化学变更B.全部化学变更的能量都可以通过原电池转化为电能C.全部化学变更肯定遵循质量守恒和能量守恒D.化学变更肯定会引起物质种类的变更,所以反应体系内物质种类变更肯定是发生了化学变更C[能量变更不肯定会引起化学变更,如物质的三态变更是物理变更,A错误;只有自发进行的氧化还原反应才能设计成原电池,B错误;物质种类发生变更不肯定是发生了化学变更,D错误。
]4.下列选项中的原子在形成分子时,肯定以共价键结合的是( )A.两种非金属元素的原子之间B.活泼金属与活泼非金属的原子之间C.同周期元素的原子之间D.同主族元素的原子之间A[通常活泼金属与活泼非金属的原子化合形成离子键,B项错误;同周期元素的原子之间可以形成共价键,如CO2,也可以形成离子键,如NaCl,C项错误;对于同一主族中既有金属元素又有非金属元素的,同主族元素间也可形成离子键,如ⅠA族的H与Na可形成NaH,即为离子键,D项错误。
]5.为消退目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。

鲁科版必修第二册第一章原子结构元素周期表.............................................................................................. - 2 - 第1节原子结构与元素性质........................................................................................ - 2 - 第1课时原子结构.............................................................................................. - 2 -第2课时原子结构与元素原子得失电子能力.................................................. - 7 - 第2节元素周期律和元素周期表................................................................................ - 12 - 第1课时元素周期律........................................................................................ - 12 -第2课时元素周期表.......................................................................................... - 17 - 第3节元素周期表的应用............................................................................................ - 22 - 第1课时认识同周期元素性质的递变规律.................................................... - 22 -第2课时研究同主族元素的性质.................................................................... - 27 -第3课时预测元素及其化合物的性质............................................................ - 34 - 微项目海带提碘与海水提溴——体验元素性质递变规律的实际应用................. - 41 - 第二章化学键化学反应规律............................................................................................ - 45 - 第1节化学键与物质构成........................................................................................ - 45 - 第2节化学反应与能量转化........................................................................................ - 50 - 第1课时化学反应中能量变化的本质及转化形式........................................ - 50 -第2课时化学反应能量转化的重要应用——化学电池.................................. - 56 - 第3节化学反应的快慢和限度.................................................................................... - 63 - 第1课时化学反应的快慢................................................................................ - 63 -第2课时化学反应的限度................................................................................ - 71 - 微项目研究车用燃料及安全气囊—利用化学反应解决实际问题 ........................ - 78 - 第三章简单的有机化合物.................................................................................................... - 80 - 第1节认识有机化合物................................................................................................ - 80 - 第1课时有机化合物的一般性质与结构特点................................................ - 80 -第2课时有机化合物的官能团同分异构现象............................................ - 86 - 第2节从化石燃料中获取有机化合物........................................................................ - 93 - 第1课时从天然气、石油和煤中获取燃料石油裂解与乙烯 .................... - 93 -第2课时煤的干馏与苯.................................................................................. - 100 -第3课时有机高分子化合物与有机高分子材料.......................................... - 107 - 第3节饮食中的有机化合物...................................................................................... - 113 - 第1课时乙醇.................................................................................................. - 113 -第2课时乙酸.................................................................................................. - 118 -第3课时糖类、油脂和蛋白质...................................................................... - 125 - 微项目自制米酒—领略我国传统酿造工艺的魅力 .............................................. - 130 -第一章原子结构元素周期表第1节原子结构与元素性质第1课时原子结构1.下列有关原子的说法正确的是( )①原子是由核外电子和原子核构成的②原子不能再分③原子在化学变化中不能再分④原子在化学变化中不发生变化⑤原子的质量主要集中在原子核上A.①②③B.①③④C.①②⑤D.①③⑤答案 D解析所有原子都是由原子核和核外电子构成的,①正确;原子是由原子核和核外电子构成的,可以再分,②错误;原子是化学变化中的最小微粒,所以原子在化学变化中不能再分,③正确;原子在化学变化中可以通过得失电子变为离子,④错误;由于电子的质量很小,所以原子的质量主要集中在原子核上,⑤正确。

2020-2021学年新教材鲁科版化学必修第二册章末综合测评1原子结构元素周期律含解析章末综合测评(一)原子结构元素周期律(时间90分钟,满分100分)一、选择题(本题包括20小题,每小题3分,共60分)1.某元素原子R的原子核外有16个电子,质量数为34,则原子核的中子数为()A.32B.20C.16 D.18D[某元素原子R的原子核外有16个电子,所以质子数=核外电子数=16,中子数=质量数-质子数=34-16=18.] 2.金属钛对体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称.下列有关错误!Ti和错误!Ti的说法中正确的是()A.错误!Ti和错误!Ti中均含有22个中子B.错误!Ti和错误!Ti质子数相同C.错误!Ti和错误!Ti质量数不同,不能互称同位素D.错误!Ti和错误!Ti化学性质不同B[因质量数=质子数+中子数,错误!X中的Z表示质子数,A 表示质量数,所以错误!Ti和错误!Ti的中子数分别为26、28,故A 错误;错误!Ti和错误!Ti质子数都为22,故B正确;错误!Ti和错误!Ti质量数不同,但质子数相同,中子数不同,互为同位素,故C错误;决定元素化学性质的主要原因是原子的最外层电子数,同位素的电子排布相同,所以化学性质相同,故D错误.]3.下列说法正确的是()A.F、Cl、Br的最外层电子数都是7,次外层电子数都是8 B.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增的规律C.卤素按F、Cl、Br、I的顺序,其非金属性逐渐减弱的原因是随着核电荷数的增大电子层数增大起主要作用D.砹是第6周期的卤族元素,根据卤素性质的递变规律可知,砹单质易溶于水,难溶于CCl4C[A项,F的次外层电子数为2,Br的次外层电子数为18,所以错误;B项,元素的非金属性强弱可以根据其最高价氧化物对应的水化物(最高价含氧酸而不是无氧酸)的酸性强弱比较,所以错误;C项,电子层数增大导致原子半径增大,核对最外层电子的吸引能力减弱,因此电子层数增大是非金属性减弱的主要原因,所以正确;D项,由碘单质微溶于水、易溶于四氯化碳可知,砹单质微溶于水,易溶于CCl4,所以错误。

章末系统总结一、重点知识梳理二、实验专项探究——元素性质递变规律的实验探究某研究性学习小组设计了一组实验验证元素周期律。
(Ⅰ)甲同学在a、b、c三只烧杯里分别加入50 mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾块,观察现象。
(Ⅱ)乙同学设计了如图所示的装置实验以验证氮、碳、硅元素的非金属性强弱。
已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成。
思考探究(1)甲同学设计实验的目的是什么?反应最剧烈的烧杯是哪个?提示:甲同学设计的实验目的是验证锂、钠、钾金属性的强弱。
钾最活泼和水反应最剧烈,c烧杯中的反应最剧烈。
(2)乙同学设计的实验中A、B、C装置中所选用的物质分别是什么?提示:硝酸常温下可与铜反应,所以A是硝酸,根据“强酸制弱酸”原理可以判断B为CaCO3,C为可溶性硅酸盐。
(3)试用离子方程式表示乙实验的原理。
提示:CaCO3+2H+===Ca2++CO2↑+H2O CO2+SiO2-3+H2O===H2SiO3↓+CO2-3或2CO2+SiO2-3+2H2O===H2SiO3↓+2HCO-3。
(4)结合乙同学设计实验的现象分析,你认为氮、碳、硅三种元素的非金属性强弱关系如何?提示:根据实验现象可知,最高价氧化物对应水化物的酸性HNO3>H2CO3>H2SiO3,说明元素非金属性N>C>Si。
即时训练1.验证周期表中元素性质的变化规律:(1)同一周期内从左到右元素的金属性逐渐减弱;(2)同一主族内从上到下元素的非金属性逐渐减弱。
从下表(Ⅰ) 中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写在空格中(不一定全选)。
弱的原因:解析:②金属与氧气反应的剧烈程度,③最高价氧化物对应水化物的碱性强弱;判断非金属性强弱的依据:①与H2化合的条件,②对应氢化物的稳定性,③最高价氧化物对应水化物的酸性强弱。
答案:2.某同学做同主族元素性质的相似性、递变性实验时,自己设计了一套实验方案,并记录了有关实验现象(表中的“实验方案”与“实验现象”前后不一定是对应关系)。
第一章第一节原子结构1据报道,某些花岗岩会产生氡( 22286Rn),从而对人体产生伤害。
请回答:(1) 该原子的质量数是 ,质子数是 ,中子数是 。
(3)请根据Rn 的原子结构预测,氡气的化学性质( )A •非常活泼,容易与氧气等非金属单质反应B .比较活泼,能与钠等金属反应C •不太活泼,与氮气性质相似D .很难与其他物质发生反应⑶研究发现,镭能蜕变为22286Rn ,故称22286Rn 为镭射气;钍能蜕变为22086Rn ,故将22086Rn 称为钍射气;锕能蜕变为21986Rn ,故将21986Rn 称为锕射气。
22286Rn 、1 2 3 4%Rn 是()A .同种元素B .同位素C .同种核素D .同种原子 由此可见, _____________ 决定元素种类,质子数和 ______________ 决定核素种类。
2、请利用原子结构的知识解释下列事实 (1) 在硫化钠中,钠元素显 +1价,硫元素显-2价(2 )钠原子和铝原子电子层数相同,但金属钠与氯气的反应要比金属铝与氯气的反应容易而且剧烈。
第二节元素周期律和元素周期表agjbcfilmehkd1 表中所列元素中:属于短周期元素的有 ________________________________________ ,属于主 族元素的有 ______________________ , e 元素在周期表中的位置是 __________ 周期, _______ 族。
2 下列 _____________ 组元素的单质可能都是电的良导体 A. b , c , i B.a , g , k C.c , g , l D.d , e , f3 将元素a , b , c , f , l 的原子半径按从小到大的顺序排列: ______________________________4 i 元素属于 _____________ 元素,它的最高化合价是 ______________ ,最低化合价是 _______ 。
化学·必修2(鲁科版)章末知识总结重要的烃⎩⎪⎪⎪⎪⎨⎪⎪⎪⎪⎧甲烷⎩⎪⎨⎪⎧结构简式:CH 4性质:稳定,能取代,易燃烧特征原子团:无乙烯⎩⎪⎨⎪⎧结构简式:CH 2===CH 2性质:能加成,能加聚,易氧化特征原子团:C===C 苯⎩⎪⎨⎪⎧结构简式:或性质:易取代,能加成特征原子团:无有机高分子材料⎩⎪⎪⎨⎪⎪⎧合成高分子材料⎩⎪⎨⎪⎧塑料合成纤维合成橡胶天然高分子材料⎩⎪⎨⎪⎧棉、麻羊毛、蚕丝天然橡胶热点一 烃的燃烧规律若烃的分子式用C x H y 表示,烃完全燃烧的化学方程式可表示为:C x H y +⎝ ⎛⎭⎪⎫x +y 4O 2――→点燃xCO 2+y 2 H 2O 。
根据不同的情况,可总结出与烃完全燃烧有关的几条规律:1.等物质的量的烃完全燃烧耗氧量的计算。
(1)耗O 2量的多少取决于⎝ ⎛⎭⎪⎫x +y 4,(x +y 4)值越大,耗O 2量越大。
(2)产生CO 2的量取决于x ,x 越大,产生CO 2的量也越多。
(3)产生H 2O 的量取决于y ,y 越大,产生H 2O 的量也越多。
注意:实验式(最简式)相同、分子式不同的两种烃,等物质的量完全燃烧时,耗O 2量并不相等。
耗O 2量也可用上述规律进行比较,但两种烃的耗O 2的量之比、产生CO 2的量之比、产生H 2O 的量之比完全相同,比值等于两种烃分子中C(或H)原子个数之比。
2.等质量的烃完全燃烧耗氧量的计算。
因等质量的H 比等质量的C 耗O 2多,故:(1)耗O 2量的多少取决于y x ,y x值越大,耗O 2量越大。
注意:y x值越大,意味着烃分子中H 的质量分数越大,耗O 2量也越大。
(2)产生H 2O 的量取决于y x ,y x值越大,产生H 2O 的量也越大。
(3)产生CO 2的量取决于y x ,y x值越大,产生CO 2的量越小。
注意:实验式相同的烃,y x相同,等质量完全燃烧时耗O 2量、产生CO 2的量、产生H 2O 的量完全相同。
第二章化学键化学反应与能量
第一节化学键与化学反应
§1 化学键与化学反应中的物质变化
化学键:分子内、晶体中相邻的两个或多个原子之间的强烈相互作用叫化学键。
化学键的类型:
§2 化学键与化学反应中的能量变化
1、反应物的能量(E 1)>生成物的能量(E 2) 反应释放能量,为放热的反应
2、反应物的能量(E 1)<生成物的能量(E 2) 反应吸收能量 为吸热的反应
3、旧键断裂吸收的能量(E 3)> 新键形成释放的能量E 4 反应吸收能量 为吸热反应
4、旧键断裂吸收的能量(E 3)< 新键形成释放的能量E 4 反应释放能量 为放量反应
第二节 化学反应的快慢和限度 §1 化学反应的快慢
化学反应速率:化学反应速率指的是单位时间里反应物浓度或生成物浓度的变化。
表达式:t
c
V ∆∆=
单位: mol·L -1·S -1 mol·L -1·min -1 注:(1)化学反应速率是指某段时间内的平均反应速率,而不是某时刻的瞬时速率。
(2)在反应中固体或纯液体浓度不变,因而不用固体或液体来表示化学反应速率。
(3)同一反应,用不同物质浓度变化来表示化学反应速率时,其数值大小可能不一样,但意义相同,故在应用时应指明是哪种物质表示的化学反应速率。
(4)在同一反应中,各物质所表示的反应速率之比等于各物质的转化浓度之
反应物 (E 1)
旧键断裂(吸吸能量E 3) 新键形成(释放能量E 4)
生成物
(E 2)。
期末综合测评(时间:90分钟满分:100分)一、选择题(本题包括10小题,每题2分,共20分。
每小题只有一个选项符合题意)1.中国传统文化对人类文明贡献巨大,古代文献中记载了很多化学研究成果。
下列常见古诗文对应化学知识正确的是(),钾的焰色反应是紫色的,通过“强烧之,紫青烟起,乃真硝石也”可判断该鉴别方法利用了焰色反应,A正确;玻璃的主要成分是二氧化硅,能与氢氟酸反应,由“惟玻璃可盛”可判断,强水不可能是氢氟酸,B错误;铁的合金硬度比纯铁的大,熔点比纯铁的低,C错误;糖类不一定都有甜味,例如淀粉属于多糖,没有甜味;葡萄糖虽有甜味,但是不能发生水解,D错误。
2.下列我国古代的技术应用中,其不涉及化学反应的是()A.火药使用B.粮食酿酒续表C.活字印刷D.造纸技术,不选A;酿酒是淀粉发生一系列反应最终生成乙醇,是化学反应,不选B;活字印刷过程中没有新的物质生成,不是化学变化,选C;造纸过程中发生化学变化,不选D。
3.下列物质加入水中或与水发生反应后,溶液温度降低的是()A.生石灰与水反应B.氢氧化钠固体加入水中C.浓硫酸加入水中D.硝酸铵晶体加入水中;氢氧化钠固体加入水中溶解后会放出热量;浓硫酸加入水中会放出大量的热量,溶液的温度会升高;硝酸铵晶体加入水中吸收热量,溶液温度降低。
4.下列说法不正确的是()A.甲烷分子的填充模型为,其二氯取代物有1种结构B.苯和乙烯都能使溴水褪色,其褪色原理相同C.相同质量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的物质的量相同D.在一定条件下,苯与氯气生成氯苯的反应类型是取代反应解析甲烷为正四面体结构,其分子中只有一种H,则填充模型为,其二氯取代物有1种结构,A正确;苯与溴水不反应,但苯能萃取溴水中的溴,乙烯与溴水发生加成反应,则褪色原理不同,前者为萃取,后者为化学反应,B错误;乙炔与苯的最简式相同,均为CH,含C、H的质量分数相同,则相同质量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的物质的量相同,C正确;苯与氯气生成氯苯的反应为取代反应,D正确。
章末系统总结
一、重点知识梳理
二、实验专项探究——元素性质递变规律的实验探究
某研究性学习小组设计了一组实验验证元素周期律。
(Ⅰ)甲同学在a、b、c三只烧杯里分别加入50 mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾块,观察现象。
(Ⅱ)乙同学设计了如图所示的装置实验以验证氮、碳、硅元素的非金属性强弱。
已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成。
思考探究
(1)甲同学设计实验的目的是什么?反应最剧烈的烧杯是哪个?
提示:甲同学设计的实验目的是验证锂、钠、钾金属性的强弱。
钾最活泼和水反应最剧烈,c烧杯中的反应最剧烈。
(2)乙同学设计的实验中A、B、C装置中所选用的物质分别是什么?
提示:硝酸常温下可与铜反应,所以A是硝酸,根据“强酸制弱酸”原理可以判断B为CaCO3,C为可溶性硅酸盐。
(3)试用离子方程式表示乙实验的原理。
提示:CaCO3+2H+===Ca2++CO2↑+H2O CO2+SiO2-3+H2O===H2SiO3↓+CO2-3或2CO2+SiO2-3+2H2O===H2SiO3↓+2HCO-3。
(4)结合乙同学设计实验的现象分析,你认为氮、碳、硅三种元素的非金属性强弱关系如何?
提示:根据实验现象可知,最高价氧化物对应水化物的酸性HNO3>H2CO3>H2SiO3,说明元素非金属性N>C>Si。
即时训练
1.验证周期表中元素性质的变化规律:(1)同一周期内从左到右元素的金属性逐渐减弱;(2)同一主族内从上到下元素的非金属性逐渐减弱。
从下表(Ⅰ) 中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写在空格中(不一定全选)。
弱的原因:
解析:
②金属与氧气反应的剧烈程度,③最高价氧化物对应水化物的碱性强弱;判断非金属性强弱的依据:①与H2化合的条件,②对应氢化物的稳定性,③最高价氧化物对应水化物的酸性强弱。
答案:
2.某同学做同主族元素性质的相似性、递变性实验时,自己设计。