江西省会昌中学2017-2018学年高一下学期期中考试化学试卷有答案
- 格式:doc
- 大小:166.02 KB
- 文档页数:7

江西省赣州市十四县(市)2017-2018 学年高一化学放学期期中联考试题(含分析)可能用到的相对原子质量:O 16 Na 23 S 32 Cl 35.5 Fe 56第I卷(选择题共 48分)一、选择题(此题包含16 小题,每题 3 分,共 48 分。
每题只有一个选项切合题意)1.在以下图的微粒中,联合电子能力最强的是A.B.C.D.【答案】 C2.图中没有波及到的能量转变形式是A.化学能转变为热能B.太阳能转变为化学能C.势能转变为电能D.化学能转变为势能【答案】 D【分析】 A.木材焚烧,存在化学能转变为热能,故A正确;B.绿色植物的光合作用,存在太阳能转变为化学能,故 B 正确; C.水力发电,存在热能转变为电能,故 C 正确; D.图中无化学能转变为热能的能量转变,故D错误;答案为D。
3.以下元素中属于长周期主族元素的是A. Li B.P C.Fe D.Br【答案】 D4.以下电子式书写错误的选项是A.B.C.D.【答案】 C【分析】 A.OH-的电子式为确; C.HCl 的电子式为,故,故 A 正确; B.氮气的电子式为C 错误; D. Na2S 的电子式为,故 B正,故 D正确;答案为C。
【点睛】解决这种问题过程中需要要点关注的有:①书写电子式时应特别注意以下几个方面:阴离子及多核阳离子均要加“”并注明电荷,书写共价化合物电子式时,不得使用“”,没有成键的价电子也要写出来。
②书写构造式、构造简式时第一要明确原子间联合次序(如 HClO 应是H—O— Cl ,而不是 H— Cl — O),其次是书写构造简式时,碳碳双键、碳碳三键应当写出来。
③比率模型、球棍模型要能表现原子的相对大小及分子的空间构造。
④热化学反响方程式中物质的齐集状态、离子方程式中的电荷守恒、化学反响的客观性是常常出现错误的地方,在判断时需要注意。
5.短周期元素的性质递变规律以下图,以下说法正确的选项是A.横坐标为质子数,纵坐标为元素的最高正价B.横坐标为原子序数,纵坐标为元素原子的最外层电子数C.横坐标为核电荷数,纵坐标为元素原子的半径D.横坐标为中子数,纵坐标为元素的非金属性【答案】 B6 .必定条件下,将 1 mol X气体和1mol Y气体充人一 1 L的恒容密闭容器中,发生反响:X(g)+2Y(g)3Z(g), 1s后测得c(Y) =0.6 mol·I-1 ,则0~1 s内 Y 的均匀反响速率为-l-lA.0.2 mol·L ·s-l-l B.0.4 mol·L ·s-l-lC .0.6 mol·L ·s-l-l D.0.8 mol·L ·s【答案】 B【分析】依据均匀速率V=错误!未找到引用源。

会昌中学2018-2019学年第二学期高一第二次月考化学试卷可能用到的相对原子质量H 1 C 12 N 14 O 16 Na 23 Cl 35.5 Al 27一、选择题(每题只有一个正确选项,每题3分,共48分)1.如图是网络热传的“苯宝宝表情包”,它是由苯及其衍生物配以相应的表情、文字组成的。
下列关于苯的说法正确的是( )A. 苯通常是无色、有特殊气味的气体B. 苯中含有单、双键交替的结构C. 该分子中12个原子全部在一个平面上D. 苯使酸性高锰酸钾溶液和溴水褪色的原理相同【答案】C【解析】【详解】A. 苯通常是无色、有特殊气味的液体,而不是气体,A项错误;B. 苯中碳碳键是介于单键和双键之间的独特的键,不存在单双键交替结构,B项错误;C. 苯是平面型分子,分子式为C6H6,12个原子都在同一平面内,C项正确;D. 苯分子中不含碳碳双键,不能被酸性高锰酸钾氧化,所以不能使酸性高锰酸钾溶液褪色,D项错误;答案选C。
2.新版人民币的发行,引发了人们对有关人民币中化学知识的关注。
下列表述不正确的是( )A. 制造人民币所用的棉花、优质针叶木等原料的主要成分是纤维素Fe O是一种磁性物质B. 用于人民币票面文字等处的油墨中所含有的34C. 某种化学验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的是淀粉D. 防伪荧光油墨由颜料与树脂连接料等制成,树脂与油脂一样,属于高分子化合物【答案】D【解析】【详解】A. 棉花、优质针叶木等的主要成分是纤维素,A项正确;Fe O具有磁性,是磁性物质,B项正确;B. 用于人民币票面文字等处的油墨中所含有的34C. 验钞笔中含有碘酒溶液,遇假钞呈现蓝色,遇碘变蓝的是淀粉,C项正确;D. 树脂相对分子质量很大,树脂属于有机高分子材料,但油脂不属于高分子化合物,D项错误;答案选D。
3.己知,下列说法错误的是A. 该反应属于加成反应B. 异丙苯的一氯代物共有6种C. 可用溴水鉴别异丙烯苯和异丙苯D. 异丙苯是苯的同系物【答案】B【解析】由题可知,异丙烯苯中含有碳碳双键,与氢气发生反应生成的异丙苯中没有碳碳双键,可知异丙烯苯了发生加成反应,A正确;根据异丙苯的对称性,共有5种等效氢,所以异丙苯的一氯代物共有5种,B错误;双键可以使溴水褪色,而苯环中无碳碳双键,不能使溴水褪色,所以可用溴水鉴别异丙烯苯和异丙苯,C正确;异丙苯的分子式是C9H12,符合苯的同系物组成通式C n H2n-6(n≥6)且与苯的结构相似,是同系物的关系,D正确,答案为B。

江西省会昌中学2017-2018学年高一下期中考试英语试卷第Ⅰ卷(选择题,共100分)第一部分听力(共两节,满分30分)做题时,先将答案标在试卷上。
录音内容结束后,你将有两分钟的时间将试卷上的答案转涂到答题卡上。
第一节(共5小题;每小题1.5分,满分7.5分)听下面5段对话。
每段对话后有一个小题,从题中所给的A、B、C三个选项中选出最佳选项,并标在试卷的相应位置。
听完每段对话后,你都有10称钟的时间来回答有关小题如阅读下一小题。
每段对话仅读一遍。
1. What does the woman probably want to do?A. Write a paper.B. Attend a class.C. Get some sleep.2. When will the man see his parents?A. At 11:00.B. At 10:00.C. At 9:00.3. Why didn’t the man see the woman at breakfast time?A. She went for a long walk.B. She finished her breakfast early.C. She didn’t go to the dining hall.4. What does the woman think of the new art museum?A. It is nice inside.B. It looks attractive outside.C. It has no attraction for her.5. What did the woman do with the report?A. She made suggestions on it.B. She asked the man to rewrite it.C. She got someone else to read it.第二节(共15小题;每小题1.5分,满分22.5分)听下面5段对话或独白。

江西省会昌中学2017-2018学年高一化学下学期期中试题编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(江西省会昌中学2017-2018学年高一化学下学期期中试题)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为江西省会昌中学2017-2018学年高一化学下学期期中试题的全部内容。
江西省会昌中学2017—2018学年高一化学下学期期中试题相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 S 32 Al 27 Fe 56Cu 64 Cl 35.5第Ⅰ卷选择题(共48分)一、选择题(每小题只有一个正确选项符合题意,每小题3分,共48分)1、化学与生活、社会发展息息相关,下列有关说法不正确的是()A.在元素周期表的金属和非金属分界线附近寻找半导体材料B.“青蒿一握,以水二升渍,绞取汁",屠呦呦对青蒿素的提取属于化学变化C.“霾尘积聚难见路人",雾霾所形成的气溶胶有丁达尔效应D. 氢氧燃料电池是一种能量转换率较高、符合绿色化学理念的新型动力能源2、简单原子的原子结构可用下图来形象表示:①②③其中·表示质子或电子,°表示中子,则下列有关的叙述中,不正确的是()A.①②③具有相同的质子数B.①②③互为同位素C.①②③是三种粒子的化学性质几乎完全相同D.①②③具有的电子数不同3、下列化学用语中,正确的是()A.次氯酸的结构式:H—O—ClB.氮气的电子式:∶N∶∶∶N∶C.CO2分子的电子式:O=C=OD.用电子式表示氯化氢分子的形成过程:4、下列叙述正确的是( )A.碘晶体受热转变为碘蒸气,吸收的热量用于断裂共价键B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素C.多电子原子中,在离核较近的区域内运动的电子能量较高D.两个非金属元素原子间只可能形成共价键,而含金属元素的化合物中一定含离子键5、下列说法中正确的是( )A.氢键是一种较弱的化学键B.NH3的稳定性很强,是因为其分子间能形成氢键C.最外层能达到稳定结构的微粒只有稀有气体的原子D.常温下Cl2、Br2、I2状态由气态到固态变化的主要原因是分子间作用力在逐渐增大6、设N A为阿伏伽德罗常数的数值,下列说法正确的是( )A.1mol/L的NaCl溶液中含有的离子总数为2N AB.1 mol Na2O2与CO2完全反应时转移电子数为2N AC.标准状况下,22。

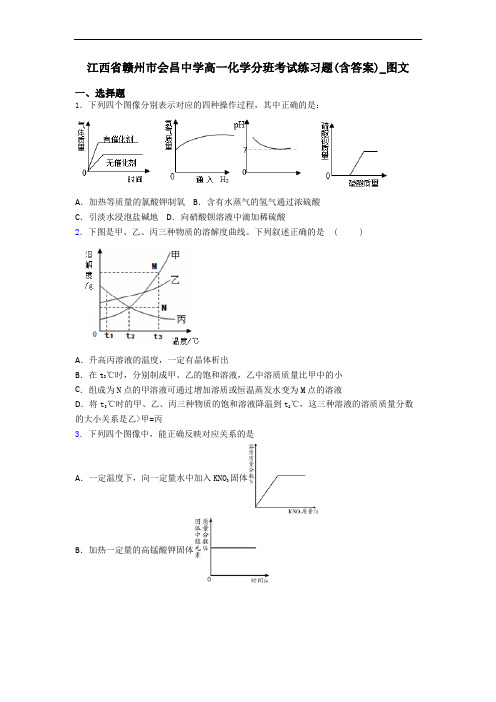
江西省赣州市会昌中学高一化学分班考试练习题(含答案)_图文一、选择题1.下列四个图像分别表示对应的四种操作过程,其中正确的是:A.加热等质量的氯酸钾制氧 B.含有水蒸气的氢气通过浓硫酸C.引淡水浸泡盐碱地 D.向硝酸钡溶液中滴加稀硫酸2.下图是甲、乙、丙三种物质的溶解度曲线。
下列叙述正确的是 ( )A.升高丙溶液的温度,一定有晶体析出B.在t3℃时,分别制成甲、乙的饱和溶液,乙中溶质质量比甲中的小C.组成为N点的甲溶液可通过增加溶质或恒温蒸发水变为M点的溶液D.将t3℃时的甲、乙、丙三种物质的饱和溶液降温到t2℃,这三种溶液的溶质质量分数的大小关系是乙>甲=丙3.下列四个图像中,能正确反映对应关系的是A.一定温度下,向一定量水中加入KNO3固体B.加热一定量的高锰酸钾固体C .向一定量的硫酸铜溶液中加入铁粉D .向一定量的MnO 2中加入H 2O 2溶液4.等质量的镁、铝、锌分别与相同质量20%的盐酸充分反应,产生氢气的质量大小关系的猜测:①Al>Mg >Zn; ②Al=Mg =Zn; ③Al=Mg >Zn; ④Al=Zn >Mg; ⑤Al>Mg =Zn.其中错误的个数为A .5个B .2个C .3个D .4个5.下列图象中,能正确反映其对应变化关系的是( )A .服用胃舒平[主要成分是Al (OH )3]治疗胃酸过多,胃液pH 的变化B .向一定质量的稀盐酸和氯化铜的混合溶液中加入氢氧化钠溶液C .将等质量的镁和铁分别投入到盛有足量同种稀硫酸的两个容器中D .浓盐酸敞口放置6.甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )A .2t ℃时,甲物质的饱和溶液溶质质量分数为50%B .乙物质的溶解度小于甲物质的溶解度C .2t ℃时,乙的饱和溶液降温至1t ℃,乙溶液变为不饱和溶液D .当甲中含有少量乙时,可以用降温结晶提纯甲7.将一个不与盐酸反应的小球放入盛有盐酸的烧杯中,小球漂浮在液面上,将几枚洁净的小铁钉投入烧杯中,当不再有气泡逸出时(忽略溶液体积的变化),小球的位置与开始时比较,将( )A.下沉一些 B.不变 C.上浮一些 D.无法判断8.向某AgNO3和Fe(NO3)2的混合溶液中加入一定质量的Zn粉,充分反应后过滤,得到滤渣和浅绿色溶液,关于该滤渣和滤液有下列四种说法,其中正确的说法有①向滤渣中加入稀盐酸,一定有气泡产生②滤渣中一定有Ag,可能含有Fe③向滤液中加入稀盐酸,一定有沉淀产生④滤液中一定含有Zn(NO3)2,可能含有Fe(NO3)2和AgNO3A.只有① B.只有② C.只有①②③ D.只有①③④9.除去下列各物质中的少量杂质所选用的试剂及操作方法均正确的是()项目物质杂质(少量)试剂操作方法A CaO固体CaCO3固体加入适量的稀盐酸过滤、洗涤、干燥B CO2CO通O2点燃C NaNO3Na2SO4适量氢氧化钡溶液过滤D KClO3MnO2水溶解、过滤、蒸发A.A B.B C.C D.D10.下列不能正确反映相关实验过程中量的变化关系的图像是( )A.分别向等质量Fe和Al中加入足量的溶质质量分数的稀盐酸B.一定压强下,氧气在水中的溶解度C.一定温度下,向不饱和硝酸钾溶液中加入硝酸钾D.氯酸钾和二氧化锰混合加热制氧气中,a使用催化剂,b未使用催化剂11.除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是()A.CaCO3固体(CaO固体)—高温煅烧B.N2气体(O2气体)——通过灼热的铜网C.CO2气体(CO气体)——在氧气中点燃D.KCl溶液(CaCl2溶液)——加碳酸钠溶液至恰好完全反应,过滤12.将a g铁粉和锌粉的混合物加入到b g AgNO3和Cu(NO3)2组成的混合溶液中,充分反应后过滤,得到滤液和滤渣。
2017-2018学年高一化学第二学期期中考试及答案(共七套)2017-2018学年高一化学第二学期期中考试及答案(一)可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Al-27 S-32第Ⅰ卷选择题(共50分)一、选择题(每小题2分,共50分。
每小题只有一个....选项符合题意)1.下列说法正确的是 A.元素周期表中铋元素的数据见右图,Bi元素的质量数是209 B.H216O与H错误!未找到引用源。
O互为同素异形体 C.ab X n-含有的电子数为a-n D.原子序数为29的元素位于元素周期表的第四周期ⅠB族2.下列化学用语或命名正确的是 A.次氯酸的结构式:H-Cl-O B.含有10个中子的氧原子的符号:818OC.S2-的结构示意图D.NH4Cl的电子式:3.下列物质的颜色按“红、橙、黄、绿、蓝、紫”顺序排列的是①C uSO4•5H2O ②A gI ③溴的四氯化碳溶液④F eSO4•7H2O ⑤KM nO4溶液⑥碱性酚酞溶液A.⑥③②④①⑤B.⑤④③①②⑥C.⑥③①②④⑤D.②③①④⑤⑥4.既能通过金属单质与足量Cl2反应得到,也能通过金属单质与酸反应得到的是A.FeCl2B.NaCl C.FeCl3D.CuCl25.用下列方法测定空气中的污染物含量:将一定体积的空气通入吸收剂,并测定其电导的变化(溶液中离子浓度越大,它的电导就越大),如测定H2S的含量,若用CuSO4溶液吸收,可测定很大浓度范围内的H2S,但电导变化不大;若用浓溴水吸收,仅限于低浓度范围内的H2S,但有很高的灵敏度。
现要兼顾吸收容量与灵敏度,测定空气中Cl2的含量,则应选用下列吸收剂中的A.Na2SO3溶液 B.KI溶液 C.NaOH溶液 D.H2O6.下列各组性质比较中,正确的是①沸点:HF>HCl>HBr>HI ②离子还原性:S2->Cl->Br->I-③酸性:HClO4>HBrO4>HIO4④金属性:K>Na>Mg>Al⑤气态氢化物稳定性:HF>HCl>H2S ⑥半径:O2->F->Na+>Mg2+A.①②③B.③④⑤⑥C.②③④D.①③④⑤⑥7.X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是A.Y单质与氢气反应较Z剧烈B.最高价氧化物对应水化物酸性W比Z弱C.X单质氧化性强于Y单质D.X与W的原子核外电子数相差98.X、Y、Z、W、R属于短周期主族元素。
江西省赣州市会昌中学人教版高一化学下学期第二次质量检测测试卷一、选择题1.二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构与双氧水分子相似。
常温下,S2Cl2是一种橙黄色液体,遇水可发生反应,并产生能使品红褪色的气体。
下列说法中不正确的是A.S2Br2与S2Cl2结构相似,沸点S2Br2 > S2Cl2B.S2Cl2的结构式为Cl—S—S—ClC.S2Cl2中S显—1价D.2S2Cl2+2H2O=SO2↑+3S↓+4HCl【答案】C【详解】A. 组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,熔、沸点越高;S2Br2与S2Cl2结构相似,S2Br2相以分子质量较大,所以沸点S2Br2 > S2Cl2,A正确;B. 由题中信息分子结构与双氧水分子相似,双氧水的结构式为H-O-O-H,所以S2Cl2的结构式为Cl-S-S-Cl,B正确;C. 氯和硫都是第3周期元素,氯的非金属性较强,所以S2Cl2中Cl显-1价,S显+1价,C错误;D. 由题中信息S2Cl2遇水可发生反应,并产生能使品红褪色的气体,可知反应后生成二氧化硫,所以S2Cl2与水发生反应的化学方程式为2S2Cl2+2H2O=SO2↑+3S↓+4HCl,D正确;故选C。
2.下列说法不正确...的是( )A.生铁和钢都是铁和碳的合金B.氯化钙是漂白粉的有效成分C.玻璃、水泥属传统硅酸盐产品D.氧化铝陶瓷是新型无机非金属材料【答案】B【详解】A.生铁和钢都是铁合金,含有的杂质元素主要是碳,因此二者都是铁和碳的合金,A正确;B.漂白粉的主要成分是氯化钙、次氯酸钙,有效成分是次氯化钙,B错误;C.玻璃、水泥的主要成分是硅酸盐,因此都属于传统硅酸盐产品,C正确;D.氧化铝陶瓷、高温结构陶瓷、生物陶瓷都是新型无机非金属材料,D正确;故合理选项是B。
3.下列说法正确的是( )A.晶体硅常用于制造光导纤维B.碳酸钠常用于治疗胃酸过多C.明矾常用于自来水的消毒杀菌D.高压钠灯常用于道路和广场照明【答案】D【详解】A.二氧化硅用于制造光导纤维,晶体硅可用于制造晶体管及太阳能电池,A错误;B.碳酸氢钠常用于治疗胃酸过多,而碳酸钠溶液碱性强,对人会产生一定的腐蚀作用,因此不能用于治疗胃酸过多,B错误;C.明矾具有净水作用但无强氧化性,因此常用于自来水的净化,但不能对水进行消毒杀菌,C错误;D.高压钠灯发出的黄光穿透力强,因此常用于道路和广场照明,D正确;故合理选项是D。
江西2018年高一化学下册期中考试试题(带参考答案)江西省横峰中学2,则在其气态氢化物中X元素的化合价为A.5n-2 B.3n-12 C.3n-6 D.n-1013.钢铁发生吸氧腐蚀时,正极发生反应的电极反应式为A.Fe -2e-= Fe2+ B.Fe -3e- = Fe3+C.O2 +2H2O +4e- = 4OH- D.2H+ + 2e- = H2 ↑14.可逆反应2NO2 2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是①单位时间内生成n mol O2 的同时生成2n molNO ②单位时间内生成n mol O2 的同时生成2n molNO2 ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为221的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态A、①④B、②④C、①③④D、①②③④⑤15.有A、B、C、D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4中,A极为负极②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D ③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为( )A.A B C D B.A C D B C.C A B D D.B D C A16.温度为500℃时,反应4NH3+5O2 4NO+6H2O在5L的密闭容器中进行,半分钟后NO的物质的量增加了03mol,则此反应的平均速率 (x)为()A、(O2)=001mol/(L s)B、(NO)=008mol/(L s)C、(H2O)=0003mol/(L s)D、(NH3)=002mol/(L s)二、非选择题(共52分)二.填空题(7小题,共43分)17.(4分)在 H, H, H, Mg, Mg, O, O, O中共有______种元素,______种原子,中子数最多的是。
江西省会昌中学2018-2019学年高一化学上学期第一次月考(10月)试题可能用到的相对原子质量H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Cu 64一、选择题(每题只有一个正确选项,每题3分,共48分)1.遇到下列情况,采用的措施正确的是()A.不慎将浓硫酸沾到皮肤上,立即用大量的氢氧化钠溶液冲洗B.如果少量酒精失火燃烧,立即用水浇灭C.炒菜时油锅着火,立即盖上锅盖D.发现家中天然气泄漏,立即打开抽油烟机2.下列叙述正确的是()A.1 mol O2的质量为32g/mol B.摩尔是国际单位制中的一个基本物理量C.3.01×1023个CO2分子的质量为22g D.H2O的摩尔质量为18g3.下列实验操作中错误..的是A.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处B.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热C.分液操作时,分液漏斗下层液体应从下口放出,上层液体应从上口倒出D.萃取操作时,所选萃取剂溶解溶质能力应大于原溶剂且与原溶剂互不相溶4.现有三组溶液:①汽油和氯化钠溶液;②39%的乙醇溶液;③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )A.分液、萃取、蒸馏 B.蒸馏、萃取、分液C.萃取、蒸馏、分液 D.分液、蒸馏、萃取5.有一种气体的质量是14.2g,体积是4.48升(标况),该气体的摩尔质量是()A.28.4 B.28.4g·mol-1C.71 D.71g·mol-1 6.将30mL 0.5mol/L NaCl溶液加水稀释到500mL,稀释后溶液中NaCl的物质的量浓度为:A.0.03mol/L B.0.3mol/L C.0.05mol/L D. 0.04mol/L 7.用N A表示阿伏加德罗常数,下列叙述正确的是()A.标准状况下,22.4LH2O含有的分子数为 N AB.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 N AC.常温常压下,分子总数为N A的N2和O2的混合气体占有的体积为22.4LD.若1 molCl2所占体积为22.4L,则其所处状况一定为标准状况8.0.5 L AlCl3溶液中Cl-为9.03×1022个,则AlCl3溶液的物质的量浓度为()A.0.1 mol·L-1 B.1 mol·L-1 C.3 mol·L-1 D.1.5 mol·L-19.下列说法中正确的是A.1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol/LB.从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol/LC.配制500 mL 0.5 mol/L的CuSO4溶液,需62.5 g胆矾D.中和100 mL 1 mol/L的H2SO4溶液,需NaOH 4 g10.某氯原子的质量是a g,12C原子的质量是b g,用N A表示阿伏加德罗常数的值,下列说法中正确的是()①该氯原子的相对原子质量为12a/b②该氯原子的摩尔质量是aN A g③m g该氯原子的物质的量为m/(aN A)mol④a g该氯原子所含的电子数为17 molA.①③ B.②④ C.①② D.②③11.下列叙述正确的是()A.物质的量浓度为0.5 mol/L的MgCl2溶液,含有Cl-个数为N AB.V mL硫酸铁溶液中含有mg SO42-,则Fe3+的物质的量浓度为6.94m/V mol·L-1C.将58.5 g NaCl溶解于1 L水中配成溶液,所得溶液的物质的量浓度为1 mol·L-1D.18g H2O含有8N A个质子12.能够用来鉴别BaCl2、NaCl 、Na2CO3三种物质的试剂是()A.AgNO3溶液 B.稀硫酸 C.稀盐酸 D.稀硝酸13.下列叙述中正确的是( )①标准状况下,1 L HCl和1 L H2O的物质的量相同②标准状况下,1 g H2和14 g N2的体积相同③28 g CO的体积为22.4 L④两种物质的物质的量相同,则它们在标准状况下的体积也相同⑤在同温同体积时,气体物质的物质的量越大,则压强越大⑥同温同压下,气体的密度与气体的相对分子质量成正比A.①②③B.②⑤⑥ C.②③⑥ D.④⑤⑥14.用98%的浓H2SO4(p=1.84g/cm3)配制1mol/L的稀硫酸100mL,按配制溶液时仪器的选用顺序排列,选择正确的是( )①玻璃棒②胶头滴管③ 100mL容量瓶④托盘天平⑤ 50mL烧杯⑥10mL量筒⑦ 100mL量筒⑧移液管⑨滴定管A.⑥③⑧⑤①② B.⑥⑤③①⑨② C.④⑤③②①⑨ D.⑥⑤①③②15.设N A表示阿伏加德罗常数,下列说法正确的是( )A.1 mol氦气中有2N A个氦原子 B.14 g氮气中含N A个氮原子C.2 L 0.3 mol·L-1Na2SO4溶液中含0.6N A个Na+D.18 g水中所含的电子数为18N A16.有BaCl2和NaCl的混合溶液a L,将它均分成两份。
2017—2018学年第二学期期中考试高一年级化学试卷相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 S 32 Al 27 Fe 56 Cu 64 Cl 35.5第Ⅰ卷 选择题(共48分)一、选择题(每小题只有一个正确选项符合题意,每小题3分,共48分) 1、化学与生活、社会发展息息相关,下列有关说法不正确的是( ) A . 在元素周期表的金属和非金属分界线附近寻找半导体材料B .“青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化C .“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应D. 氢氧燃料电池是一种能量转换率较高、符合绿色化学理念的新型动力能源 2、简单原子的原子结构可用下图来形象表示:其中·表示质子或电子,°表示中子,则下列有关的叙述中,不正确的是( )A .①②③具有相同的质子数B .①②③互为同位素C .①②③是三种粒子的化学性质几乎完全相同D .①②③具有的电子数不同 3、下列化学用语中,正确的是( ) A .次氯酸的结构式:H —O —Cl B .氮气的电子式:∶N∶∶∶N∶ C .CO 2分子的电子式:O =C =O D .用电子式表示氯化氢分子的形成过程: 4、下列叙述正确的是( )A .碘晶体受热转变为碘蒸气,吸收的热量用于断裂共价键B .元素周期表中从ⅢB 族到ⅡB 族10个纵行的元素都是金属元素C .多电子原子中,在离核较近的区域内运动的电子能量较高D .两个非金属元素原子间只可能形成共价键,而含金属元素的化合物中一定含离子键 5、下列说法中正确的是( ) A .氢键是一种较弱的化学键B .NH 3的稳定性很强,是因为其分子间能形成氢键C .最外层能达到稳定结构的微粒只有稀有气体的原子D .常温下Cl 2、Br 2、I 2状态由气态到固态变化的主要原因是分子间作用力在逐渐增大 6、设N A 为阿伏伽德罗常数的数值,下列说法正确的是( )①③A.1mol/L的NaCl溶液中含有的离子总数为2N AB.1 mol Na2O2与CO2完全反应时转移电子数为2N AC.标准状况下,22.4LH2O含有的 H—O键数为2N AD.18g 18O2中含有的中子数为10N A7、下列反应符合如图图示的是()A. 铝片与盐酸的反应B. NH4Cl晶体的分解反应C. 酸碱中和反应D. 氧化钙与水反应8、在下列条件的水溶液中可以大量共存的粒子组是()A. 使酚酞变红的溶液中:Na+、HCO3-、Cl-、NO3-B. 含大量H+的溶液中:Na+、K+、NO3-、AlO2-C. 无色溶液中:SO42-、Cl-、Al3+、NH4+D. 含大量Fe3+的溶液:Na+、Mg2+、NO3-、I-9、下列有关叙述正确的是()A. Na2O2晶体中阳离子与阴离子个数比为1︰1B. H2O比H2S稳定,H—S键比H—O键更易断裂C. D和T的中子数相同,质子数不同,互为同位素D. HF、HCl、HBr、HI的沸点逐渐增大10、下图是课外活动小组设计的用化学电源使LED灯发光的装置。
下列说法不正确的是()A.铜片表面有气泡生成,且溶液中SO42-向该电极移动B.装置中存在“化学能→ 电能→ 光能”的转换C.如果将硫酸换成柠檬汁,导线中仍有电子流动D.如果将锌片换成铁片,电路中的电流方向不变11、五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。
A和B、D、E均能形成共价型化合物。
A和B形成的气态化合物在水中呈碱性,C和E形成化合物CE。
下列说法不正确的是()A. B离子的半径大于C离子的半径B. 将C的单质放入CuSO4溶液中会有蓝色沉淀产生C. E的最高价氧化物对应水化物的化学式为HEO4D. A和B、D、E均能形成共价化合物,其中稳定性最弱的是A、E形成的化合物12、下列物质中既含有离子键又含有共价键的是()A.CaCl2 和 NaOH B.CO2和 NaOHC.KOH和Na2O2 D.CaO 和 Na2O213.、W、X、Y、Z是原子序数依次增大的四种短周期主族元素。
其中X、Y为金属元素,W和Z同主族。
Z的核外电子数是W的2倍,W和Z的质子数之和等于X和Y的质子数之和。
下列说法正确的是()A.原子半径: X>Y> W > ZB.W和X组成的化合物一定是碱性氧化物C.Z对应的气态氢化物中所有原子均达到8电子稳定结构D.向W、X、Y组成的化合物水溶液中滴入稀盐酸至过量,溶液先变浑浊后澄清14、下列说法正确的是()A. CO、NO、NO2都是大气污染气体,在空气中都能稳定存在B. 焦炭炼铁、发酵粉烘焙糕点均会产生温室气体C. 二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性D. 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后,溶液呈红色15、下列表示对应化学反应的离子方程式不正确的是()A.向Al2(SO4)3溶液中加入过量氨水:Al3++ 3NH3·H2O = Al(OH)3↓+ 3NH4+B.用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+=I2+2H2OC.碳酸氢钙溶液中加入足量烧碱溶液:Ca2+ +2HCO3-+2OH-=CaCO3 ↓+CO32- +2H2OD.钾与H2O反应:K+2H2O=K++2OH-+H2↑16、镁一空气电池的工作原理如图所示,电池反应方程式为:2Mg+O2+2H2O=2Mg(OH)2。
有关该电池的说法正确的是()A. 通入氧气的电极为负极B. 电池工作时,溶液中的Na+由负极移向正极C. 负极的电极反应为Mg-2e-+2OH-=Mg(OH)2D. 当电路中转移0.04 mol电子时,参加反应的O2为体积224ml第Ⅱ卷非选择题(共52分)二、填空题(共52分)17、(9分)(1)在11H、21H、31H、2312Mg、2412Mg和6529Cu中共有______种元素,______种原子。
(2)在①CaCl2、②KOH、③He、④H2SO4、⑤Na2O2、⑥I2中,不含离子键的是(填序号),含有极性共价键的是(填序号)。
(3)电子表所用的某种钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应式为:Zn+2OH--2e-=ZnO+H2O Ag2O+H2O+2e-=2Ag+2OH-电池的负极是_____(写电极符号),正极发生的是____________反应(填反应类型),总反应式为___________________________________。
18、(11分)下表列出了①~⑨九种元素在周期表中的位置:(1)元素⑧对应的简单离子的结构示意图是____________。
(2)以上元素中,化学性质最不活泼的是(填元素符号)。
(3)写出元素⑤形成的单质在空气中燃烧的化学方程式______________________,这一反应是____________(填“吸热”或“放热”)反应。
(4)用电子式表示④与⑤形成的A2B型化合物的形成过程___________________________。
(5)在这些元素的最高价氧化物对应水化物...中,酸性最强的化合物的分子式是:,与元素⑥的最高价氧化物对应水化物...发生反应时的离子方程式为(6)③的简单氢化物与③的最高价氧化物对应的水化物反应的生成物中含有的的化学键有。
19、(8分)Ⅰ.由A、B、C、D四种金属按下表中装置进行实验。
二价金属C的质量增加A上有气体产生(1)装置甲中负极的电极反应式是,装置乙中正极的电极反应式是。
(2)四种金属活泼性由强到弱的顺序是。
Ⅱ.美国阿波罗宇宙飞船上使用了一种新型发电装置—氢氧燃料电池,其构造如图所示,其中a、b两个电极均由多孔的碳炔组成,该电池的负极反应式为_________________,若该电池工作时溶液中增加1molH2O,则理论上电路中通过电子的物质的量为________mol。
20、(14分)某研究性学习小组设计了一组实验验证元素周期律。
Ⅰ.甲同学在a、b、c、d四只烧杯中分别加入50 mL冷水,再各滴加几滴酚酞试液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
(1)甲同学设计实验的目的是验证:同一主族,从上到下金属元素的原子失电子能力逐渐增强;同一周期,从左到右金属元素的原子失电子能力逐渐___________________;(2)反应最剧烈的烧杯中金属是_______(填字母序号);A.钠B.镁C.铝D.钾(3)实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验目的,请你帮助选择下列合适的方法_________(填字母序号)。
A.把镁、铝的金属块换成金属粉末B.把烧杯中的冷水换成热水C.把烧杯中的冷水换成盐酸D.把烧杯中的冷水换成氢氧化钠溶液Ⅱ.乙同学设计实验探究碳、硅元素的非金属性的相对强弱。
根据要求完成下列各题(1)实验装置:(1)填写所示仪器名称:B__________(2)实验步骤:连接仪器、_____________、加药品后,打开 a、然后滴入浓硫酸,加热(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)①铜与浓硫酸反应的化学方程式是________________________________;装置E中酸性KMnO4溶液的作用是_____________________________;②能说明碳元素的非金属性比硅元素非金属性强的实验现象是__________________;试管F中发生反应的离子方程式为_____________________。
③依据试管 D 中的反应,能否证明S的非金属性强于C的非金属性___(填“能”或“否”)。
21、(10分)X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:元素相关信息X X的单质为密度最小的气体Y Y的氢化物的水溶液呈碱性Z Z是地壳中含量最高的元素W W的一种核素的质量数为35,中子数为18(1)W________________ 。
(2)X与Y可形成一种化合物Y2X4,请写出该化合物的电子式__________,工业合成Y的简单氢化物的化学方程式为________________。
(3)X和Z组成的既含有极性共价键又含有非极性共价键的化合物的结构式是______________;此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为______________(4)写出铜和Y的最髙价氧化物的水化物的稀溶液反应的离子方程式______________。
(5)W最高价氧化物的水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28 mol电子发生转移时,共产生9 mol气体,写出该反应的化学方程式______________。