质谱解析举例
- 格式:ppt
- 大小:649.50 KB
- 文档页数:41




红外光谱解析方法1、分子式不饱和度的计算:Ω不饱和度就是分子结构中达到饱和所缺的一价原子的“对”数,N4、N3、N1分别为分子式中四价、三价及一价元素的数目 2、例4:计算黄酮化合物(C16H10O2)的不饱和度分子结构因为双键为9个。
环数为3,所以不饱和度为12。
例1 某无色或淡黄色液体,具有刺激味,沸点为145.5℃,分子式为C8H8,其红外光谱如图14-29,试判断其结构解:(1)Ω=(2+2×8-8)/2=5,可能有苯环(2)特征区第一强峰1500cm-1粗查:1500~1675cm-1,为νC=C振动区1500cm-1可能为苯环的骨架振动特征峰。
细找:按基团查附录、芳香烃类栏,根据该表所提供的数据找到未知的光谱上取代苯的五种相关峰。
①νФ-H3090、3060及3030cm-1②泛频峰2000-1667cm-1的峰形为单取代峰形③νC=C苯环骨架振动1600、1575、1500及1450cm-1共振环④δф-H1250-1000cm-1出现弱峰⑤γф-H 780及690cm-1(双峰)单取代苯(3)特征区第二强峰1630cm-1粗查:该峰可能起源于νC=C,因苯环已确定,故初步指认为烯烃。
细查:查附录一:(二)烯烃类栏,同样找到烯烃的四种相关峰。
①ν=CH3090、3060及3030cm-1②νC=C1630m-1③δ=CH1430-1290cm-1,出现中强峰④γ=CH990及905cm-1(双峰)落在单取代范围内第二强峰归属:乙烯基单取代。
未知物可能结构,苯乙烯。
4、查标准光谱与Sadtler光谱的81K苯乙烯的光谱完全一致。
结论:未知物为苯乙烯。
核磁共振氢谱的解析核磁共振谱能提供的参数主要是化学位移,原子核的裂分峰数,偶合常数以及各组峰的峰面积积分高度等.一、峰面积与氢核数目的关系(一)峰面积1.概念:在1H-NMR,各吸收峰覆盖的面积。
2.决定因素:峰面积与引起该吸收的氢核数目成正比。
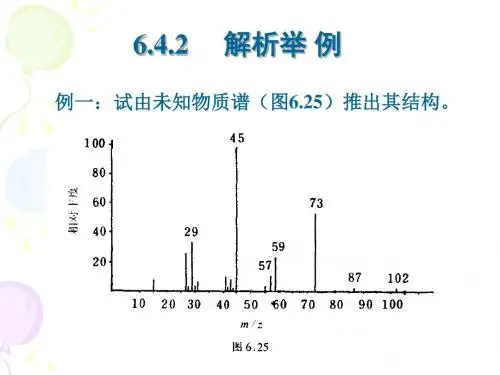

质谱图怎么分析质谱图是一种重要的分析技术,广泛应用于物质结构分析、化学定量分析等领域。
本文将通过详细介绍质谱图的原理和分析方法,以及几个常见的应用案例,来深入探讨质谱图的分析过程。
一、质谱图的原理质谱图是通过分析样品中的离子,利用其质量与电荷比的特征,来获取样品的化学信息。
其原理可以概括为以下几个步骤:1.样品的蒸发与电离:样品首先被蒸发,形成气态或带电态的离子。
这可以通过热蒸发、电子轰击或激光蒸发等方法实现。
2.离子的分离与加速:离子经过一个激发或过滤装置,根据其质量与电荷比进行分离,并通过电场加速。
3.离子的检测与记录:离子经过检测器,转化为可观测的电信号,并记录下来。
4.质谱图的解析:根据离子的质量与电荷比,将记录的信号表示为质谱图,进而分析样品的成分和结构。
二、质谱图的分析方法质谱图分析主要依靠质谱仪的仪器参数与样品特征的匹配,常用的分析方法包括以下几种:1.质量谱库比对法:将质谱图与质量谱库中的标准质谱图进行比对,通过相似度计算来识别样品成分。
2.质量谱碎片规律法:通过分析样品离子的裂解规律,推测样品的化学结构以及反应机制。
3.谱峰的分析法:通过对质谱图中峰的位置、形状、相对强度等特征进行定性和定量分析。
4.同位素峰的分析法:利用同位素的相对丰度比例,来推测样品中元素的含量和化学环境。
三、质谱图的应用案例1.药物研发:质谱图常用于药物分子的结构确认与质量控制,根据药物分子的质谱图可以准确地确定化合物的结构和分子量,以及确认附加物的存在。
2.环境分析:质谱图在环境中有机物的污染分析中有着广泛的应用,可以检测大气、水体、土壤等样品中的有害物质和残留物。
3.食品安全:质谱图可用于食品中农药、兽药、食品添加剂等的残留检测,保障食品质量和人体健康。
4.煤矿安全:质谱图能够分析煤矿中的可燃气体成分,为煤矿安全生产提供技术支持和预警。
5.生物医学研究:质谱图能够分析生物样品中的代谢产物、蛋白质、核酸等分子,为生物医学研究提供重要数据。


在一定的实验条件下,各种分子都有自己特征的裂解模式和途径,产生各具特征的离子峰,包括其分子离子峰、同位素离子峰及各种碎片离子峰。
根据这些峰的质量及强度信息,可以推断化合物的结构。
如果从单一的质谱信息还不足以确定化合物的结构或需进一步确证的话,可借助于其他的手段,如红外光谱法、核磁共振波谱法、紫外-可见吸收光谱法等。
质谱图的解释,一般要经历以下几个方面的步骤:⑴ 确定分子量;⑵ 确定分子式,除了上面阐述的用质谱法确定化合物分子式外,也常用元素分析法来确定。
分子式确定之后,就可以初步估计化合物的类型;⑶ 计算化合物的不饱和度(也叫不饱和单元)Ω(也有的用U表示):Ω=1+n4+式中n4、n3、n1分别表示化合物分子中四价、三价、一价元素的原子个数(通常n4为C原子的数目,n3为N原子的数目,n1为H和卤素原子的数目)计算出Ω值后,可以进一步判断化合物的类型Ω=0时为饱和(及无环)化合物Ω=1时为带有一个双键或一个饱和环的化合物Ω=2时为带有二个双键或一个三键或一个双键加一个环的化合物(其他以此类推)Ω=4时常是带有苯环的化合物或多个双键或三键。
⑷ 研究高质量端的分子离子峰及其与碎片离子峰的质量差值,推断其断裂方式及可能脱去的碎片自由基或中性分子,这些可以从前面的表8-2、表8-3查找参考。
在这里尤其要注意那些奇电子离子,这些离子一定符合“氮律”,因为它们的出现,如果不是分子离子峰,就意味着发生重排或消去反应,这对推断结构很有帮助。
⑸ 研究低质量端的碎片离子,寻找不同化合物断裂后生成的特征离子或特征系列,如饱和烃往往产生15+14n质量的系列峰;烷基苯往往产生91-13n质量的系列峰。
根据特征系列峰同样可以进一步判断化合物的类型。
⑹根据上述的解释,可以提出化合物的一些结构单元及可能的结合方式,再参考样品的来源、特征、某些物理化学性质,就可以提出一种或几种可能的结构式。
⑺验证:验证有几种方式——由以上解释所得到的可能结构,依照质谱的断裂规律及可能的断裂方式分解,得到可能产生的离子,并与质谱图中的离子峰相对应,考察是否相符合;——与其他的分析手段,如IR、NMR、UV-VIS等的分析数据进行比较、分析、印证;——寻找标准样品,在与待定样品的同样条件下绘制质谱图,进行比较;——查找标准质谱图、表进行比较,常用标准谱图有:①S.R. Heller,G.W.A.Milne EPA/NIH Mass spectral Data base, U.S.Government printing office,Washington,1978②Eight pe ak Index of Mass spectra,The mass spectrometry Data’centrey, The Royal of chemistry,1983③E.Stenhagen,S.Abrahamsson,F.W.McLafferey,Registy of Mass spectral Data,vol.1-4,John wiley,1974谱图解释例举:[例1]某化合物的化学式是C8H16O,其质谱数据如下表,试确定其结构式解:⑴ 不饱和度Ω=1+8+=1,即有一个双键(或一个饱和环);⑵ 不存在烯烃特有的41及41+14n系列峰(烯丙基的α断裂所得),因此双键可能为羰基所提供,而且没有29(HC O+)的醛特征峰,所以可能是一个酮;⑶ 根据碎片离子表,为43、57、71、85的系列是及离子,分别是C3H7+、CH3CO+,C4H9+、C2H5CO+,C5H11+、C3H7CO+及C6H13+、C4H9CO+离子;⑷ 化学式中N原子数为0(偶数),所以m/e为偶数者为奇电子离子,即86、58的离子一定是重排或消去反应所得,且消去反应不可能,所以是发生麦氏重排,羰基的γ位置上有H,而且有两处γ-H。

质谱,即质量的谱图。
物质的分子经物理作用或化学反应等途径形成带电粒子,某些带电粒子可进一步断裂。
如用电子轰击有机化合物(M),使其产生离子的过程如下:每一离子的质量与所带电荷的比称为质荷比(m/z ,曾用m/e表示)。
不同质荷比的离子经质量分离器一一分离后,由检测器测定每一离子的质荷比及相对强度,由此得出的谱图称为质谱。
下面为甲醇的质谱分析实例。
表1-1甲醇的质谱数据图1-5 甲醇的质谱图从质谱分析中可以得到有机化合物分子结构信息,上图中只失去一个电子的离子(m/z 32)被称为分子离子。
其质荷比与母体分子的分子量相等。
母体分子或分子离子裂解形成碎片离子,这种裂解与分子结构有密切关系。
此外,谱图中同位素离子的丰度与天然元素中同位素的丰度有相关性,由此可推测样品中某种元素的存在。
质谱分析与核磁共振波谱及红外光谱分析相结合,便可以确定有机化合物的分子结构。
质谱分析中常用术语和缩写式如下:质谱图上反应各离子的质荷比及丰度的峰被称为某离子峰。
在质谱图上可以看到各种离子及其相对强度,这些信息与分子结构有关。
本章主要介绍电子电离质谱中各种离子的形成、特点及其在质谱解析中的作用。
第一节分子离子分子离子(M+。
)是质谱图中最有价值的信息,是测定化合物分子量的依据。
用高分辨质谱可以直接测定化合物的分子式。
用低分辨质谱得到的数据,结合同位素离子、碎片离子也可以推测化合物的分子式。
一、分子离子的形成分子失去一个电子后形成分子离子。
一般来讲,从分子中失去的电子应该是分子中束缚最弱的电子,如双键或叁键的π电子、杂原子上的非键电子等,失去电子的难易顺序为:杂原子> C=C > C-C > C-H易难有机化合物在质谱中的分子离子稳定度有如下次序:芳香环 > 共轭烯 > 烯 >环状化合物 > 羰基化合物 > 醚 >酯 > 胺 > 酸 > 醇 >高度分支的烃类。


专题十一质谱仪基本知识点质谱仪是一种精密仪器,是测量带电粒子的质量和分析同位素的重要工具:一个质量为m、电荷量为q的粒子,从容器A下方的小孔S1飘入电势差为U的加速电场,其初速度几乎为零,然后经过S3沿着与磁场垂直的方向进入磁感应强度为B的匀强磁场中,最后打到照相底片D上(如图).则粒子进入磁场时的速率为v=2qUm,在磁场中运动的轨道半径为r=1B 2mUq.例题分析一、质谱仪的工作原理例1质谱仪原理如图所示,a为粒子加速器,电压为U1;b为速度选择器,磁场与电场正交,磁感应强度为B1,板间距离为d;c为偏转分离器,磁感应强度为B2.今有一质量为m、电荷量为e的正粒子(不计重力),经加速后,该粒子恰能通过速度选择器,粒子进入分离器后做匀速圆周运动.求:(1)粒子的速度v为多少?(2)速度选择器的电压U2为多少?(3)粒子在B2磁场中做匀速圆周运动的半径R为多大?(对应训练一)如图是质谱仪的工作原理示意图,带电粒子被加速电场加速后,进入速度选择器.速度选择器内相互正交的匀强磁场的磁感应强度和匀强电场的场强分别为B 和E .平板S 上有可让粒子通过的狭缝P 和记录粒子位置的胶片A 1A 2.平板S 下方有磁感应强度为B 0的匀强磁场.下列表述正确的是( )A .质谱仪是分析同位素的重要工具B .速度选择器中的磁场方向垂直纸面向外C .能通过狭缝P 的带电粒子的速率等于E BD .粒子打在胶片上的位置越靠近狭缝P ,粒子的比荷越小(对应训练二)质谱仪是一种测定带电粒子质量和分析同位素的重要工具,它的构造原理如图所示,离子源S 产生的各种不同正离子束(速度可看为零),经加速电场加速后垂直进入有界匀强磁场,到达记录它的照相底片P 上,设离子在P 上的位置到入口处S 1的距离为x ,可以判断( )A .若离子束是同位素,则x 越大,离子质量越大B .若离子束是同位素,则x 越大,离子质量越小C .只要x 相同,则离子质量一定相同D .只要x 相同,则离子的比荷一定相同二、质谱仪的应用例2 如图所示为质谱仪的原理图,M 为粒子加速器,电压为U 1=5000V ;N 为速度选择器,磁场与电场正交,磁感应强度为B 1=0.2T ,板间距离为d =0.06m ;P 为一个边长为l的正方形abcd的磁场区,磁感应强度为B2=0.1T,方向垂直纸面向外,其中dc的中点S开有小孔,外侧紧贴dc放置一块荧光屏.今有一比荷为qm=108C/kg的正离子从静止开始经加速后,恰好通过速度选择器,从a孔以平行于ab方向进入abcd磁场区,正离子刚好经过小孔S打在荧光屏上.求:(1)粒子离开加速器时的速度v;(2)速度选择器的电压U2;(3)正方形abcd边长l.(对应训练一)质谱仪是测带电粒子质量和分析同位素的一种仪器,它的工作原理是带电粒子(不计重力)经同一电场加速后垂直进入同一匀强磁场做圆周运动,然后利用相关规律计算出带电粒子的质量.其工作原理如图所示,虚线为某粒子的运动轨迹,由图可知()A.此粒子带负电B.下极板S2比上极板S1电势高C.若只增大加速电压U,则半径r变大D.若只增大入射粒子的质量,则半径r变小(对应训练二)现代质谱仪可用来分析比质子重很多倍的离子,其示意图如图所示,其中加速电压恒定.质子在入口处从静止开始被加速电场加速,经匀强磁场偏转后从出口离开磁场.若某种一价正离子在入口处从静止开始被同一加速电场加速,为使它经匀强磁场偏转后仍从同一出口离开磁场,需将磁感应强度增加到原来的12倍.此离子和质子的质量比约为()A.11 B.12 C.121 D.144专题训练1.如图所示,粒子源P会发出电荷量相等的带电粒子。