初三化学5单元经典题型
- 格式:doc
- 大小:133.50 KB
- 文档页数:2

(必考题)初中九年级化学上册第五单元《化学方程式》经典习题(含答案解析)一、选择题1.如图是“尾气催化转换器”将汽车尾气中有毒气体转化为无毒气体的微观示意图,其中不同的圆球代表不同的原子。
下列说法错误的是( )A .该反应一定不是化合反应B .图中的反应物全部是化合物C ..参加反应的两种分子个数比为1:1D .该反应生成了三种生成物 2.图中表示氢原子,表示氮原子,在一定条件有如下图反应发生,下列有关叙述错误的是A .该反应为化合反应B .该反应前两种物质均为单质C .该反应前后三种物质的化学计量数之比为4:1:2D .一个分子中含有三个氢原子和一个氮原子3.下图是某个化学反应的微观模拟示意图。
从图中获得的有关信息不正确...的是A .反应前后原子种类和个数个数不变B .反应前是混合物,反应后是化合物C .化学反应中分子可分为原子D .该反应为分解反应4.刚刚过去的9月27日,我省太原卫星发射中心用长征四号乙运载火箭,以一箭双星的方式成功发射环境减灾二号A 、B 卫星。
此次发射所使用的燃料为四氧化二氮和偏二甲肼,其燃烧的反应为2822422C H N +2N O 2CO 3N 4X ↑+↑+点燃,其中X 的化学式为A .NH 3B .N 2OC .H 2OD .C 2H 45.在一个密闭的容器中放入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下,下列说法正确的是物质甲乙丙丁反应前质量/g93221反应后质量/g x3417A.乙是该反应的催化剂B.x的值为2C.丙可能是单质D.该反应可能是水通电分解6.甲型H1N1流感的蔓延,是对人类健康的重大威胁。
从中草药“八角”中提取莽草酸是生产抗甲型H1N1流感药物“达菲”的主要原料,其化学式为C7H10O5.下列关于莽草酸的说法中,不正确的是A.莽草酸是由碳、氢、氧三种元素组成的B.莽草酸可在氧气中完全燃烧生成CO2和H2OC.莽草酸中含有7个碳原子、10个氢原子和5个氧原子D.莽草酸的相对分子质量为1747.某反应的微观示意图如下,下列说法正确的是A.生成物一定是混合物B.化学反应前后原子的种类不变C.该反应的生成物一定是氧化物D.反应后各元素化合价不变8.一定条件下,甲、乙、丙、丁四种物质在密闭容器中反应,测得反应前后各物质的质量分数如图所示,下列说法正确的是()A.丁一定是该反应的催化剂B.该反应中甲、丙的质量比为 1∶5C.该反应中乙、丙的质量比为 2∶5D.该反应一定是分解反应9.某反应过程的微观示意图如图。

九年级化学单元测试题第五单元化学方程式(测试时间45分钟满分100分)班级学号姓名成绩一、选择题:(本题有10小题,每小题3分,共30分。
每小题只有一个选项符合题意)1.物质发生化学变化时,反应前后一定发生变化的是 ( ) A.原子种类B.物质的质量总和 C.分子种类 D.元素的质量2.电解水得到氢气和氧气的质量比为 ( ) A.4:8 B.1:8 C.2:1 D.1:163.下列叙述完全符合质量守恒定律的是 ( ) A.水结成冰前后,质量保持不变B.50mL水和50 mL乙醇混合后总体积小于100 mLC.在100g过氧化氢溶液中,含有30g过氧化氢和70g水D.1.2g碳与3.2g氧气恰好完全反应可生成4.4g二氧化碳4.纳米材料Cr2O3具有较大的比表面的优良的吸收电磁波的特征,能使雷达探测的信号大大减弱,可用于飞机、导弹等武器装备上。
纳米材料Cr2O3中铬元素(Cr)的化合价是 ( ) A.+1 B.+2 C.+3 D.+65.“绿色奥运”是2008年北京奥运会的主题之一。
为减轻大气污染,在汽车尾气排放口加装“三效催化净化器”,在不消耗其它物质的情况下,可将尾气中的CO、NO转化为参与大气循环的无毒混合气体。
试推测,该无毒混合气体是()A、N2和CO2B、CO2和NO2C、CO2和O2D、CO2和SO26.修建高速中爆破时经常要用到黑火药,黑火药爆炸时反应如下:S+2KNO3+3C =K2S+X+3CO2。
其中X的化学式为( )A.N2B.NO2C.NOD.N2O7.在一密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,测得反应前后各物物质甲乙丙丁反应前的质量(g) 20 50 80 30反应后的质量(g) 0 100 10 x第 1 页共5 页第 2 页 共 5 页请根据质量守恒定律判断x 的值 ( )A .50B .40C .10D .708.下列化学方程式中正确的是 ( )A.2Fe +6HCl=2FeCl 3+3H 2↑B.2NaOH +K 2CO 3=2KOH +Na 2CO 3C.C +O 2 COD. CO +CuO CO 2↑+Cu 9.在化学反应X + 2Y ==== Z 中,3g X 和足量Y 充分反应后生成8g Z ,则参加反应的Y 的质量为 ( )A. 2.5 gB. 3 gC. 5 gD. 6 g10.下图是用来表示物质间发生化学变化的模型示意图,图中“ 、 元素的原子。

考试范围:xxx;满分:***分;考试时间:100分钟;命题人:xxx 学校:__________ 姓名:__________ 班级:__________ 考号:__________一、选择题1.在一个密闭容器中放入M、N、P、Q四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如表:物质M N P Q反应前质量/g181232反应后质量/g待测26212对该反应认识正确的是()A.M可能是单质也可能是化合物,N可能是单质B.P一定是该反应的催化剂C.参加反应的M和Q的质量比是13:12D.M、Q两种物质中的元素种类一定与N物质中元素种类相同2.如图所示:2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是()A.根据质量守恒定律可推知,1个乙分子中含有2个A原子B.该反应前后一定有元素的化合价发生了改变C.该反应中甲、乙和丙的分子个数比是2:2:3D.该反应属于分解反应3.下图是某个化学反应的微观模拟示意图。
从图中获得的有关信息不正确...的是A.反应前后原子种类和个数个数不变B.反应前是混合物,反应后是化合物C.化学反应中分子可分为原子D.该反应为分解反应4.在一个密闭容器中,有甲、乙、丙、丁四种物质在一定条件下充分反应,测得反应前后各物质的质量如下表,下列说法错误的是物质甲乙丙丁反应前质量/g522022反应后质量/g待测11285A.该反应是分解反应B.甲可能该反应的催化剂C.乙、丙变化的质量比为9:8 D.反应后甲的质量为05.如图是乙烯和水反应生成酒精的微观模拟图。
下列说法不正确的是A.1个乙烯分子由2个碳原子和4个氢原子构成B.参加反应的两物质的分子个数比为1:1C.参加反应的乙烯和水质量比28:2D.该化学反应属于化合反应6.某化学反应(甲+乙→丙+丁)反应物和生成物的微观示意图及反应前后的质量如下表所示。
物质甲乙丙丁微观示意图反应前质量/g3220010反应后质量/g0x y z下列有关该反应的说法正确的是A.甲物质由碳原子和氢原子直接构成B.该反应属于分解反应C.参加反应的反应物分子个数比为1∶1 D.X+Y+Z=2337.如图是某反应的微观示意图,下列有关该反应的说法不正确的是A.乙属于单质B.相对分子质量最小的是NH3C.生成丙和丁的质量比为1:3D.氢元素的化合价在反应前后没有变化8.6.4g某物质在氧气中燃烧,恰好生成2.8g一氧化碳、4.4g二氧化碳和7.2g水,关于该物质有下列判断:①一定含碳元素和氧元素;②一定不含氧元素;③可能含氧元素;④一定含氧元素;⑤分子中C、H原子个数比为1:8;⑥分子中C、H、O原子个数比为1:4:1.其中正确的是A.①②⑤B.①②⑥C.①③⑥D.①④⑥9.如图两幅微观示意图揭示了化学变化的微观实质。

人教版九年级上册化学第5单元测试题及答案第五单元测试题(一)一、选择题(本大题包括12小题,每小题1分,共12分。
每小题的4个选项中只有1个符合题意)1.下列现象不能用质量守恒定律解释的是( )A .蜡烛燃烧时慢慢变短B .打开盛酒精的瓶盖,酒精的质量变小C .镁带燃烧后,固体的质量增加D .澄清石灰水露置在空气中,质量变大2.化学反应前后肯定没有发生变化的是( )①原子数目;②分子数目;③元素种类;④物质种类;⑤原子种类;⑥物质的总质量。
A .①④⑥B .①③⑤⑥C .①②⑥D .②③⑤3.下列化学方程式书写正确的是( )A .P +O 2=====点燃P 2O 5B .H 2O 2=====MnO 2H 2↑+O 2↑C .2H 2O=====通电2H 2↑+O 2↑D .Mg +O 2=====点燃MgO 24.从化学方程式4P +5O 2=====点燃2P 2O 5总结出的下列信息中,正确的是( )①反应条件是点燃②反应前后元素的种类不变③反应前后分子的总数不变④参加反应的物质是磷和氧气A .①②③B .①②④C .①③④D .②③④5.氮化硅是一种性能优异的无机非金属材料,可通过以下反应来制备:3SiO 2+6C +2X=====高温Si 3N 4+6CO ,此化学方程式中X 的化学式是( )A .N 2B .SiC .NOD .CO 26.在化学反应A 2+BC===B +A 2C 中,反应物BC 与生成物B 的质量关系如图所示。
若2 g A 2和80 g BC 恰好完全反应,则生成A 2C 的质量为( )A .64 gB .18 gC .80 gD .9 g7.在“2A +3B===2C +4D”的反应中,已知8 g 物质A 完全反应生成11 g 物质C和9 g 物质D 。
若A 的相对分子质量为32,则物质B 的相对分子质量是( )A .64B .48C .32D .608.为减少温室气体二氧化碳的排放,可以将二氧化碳进行转化。
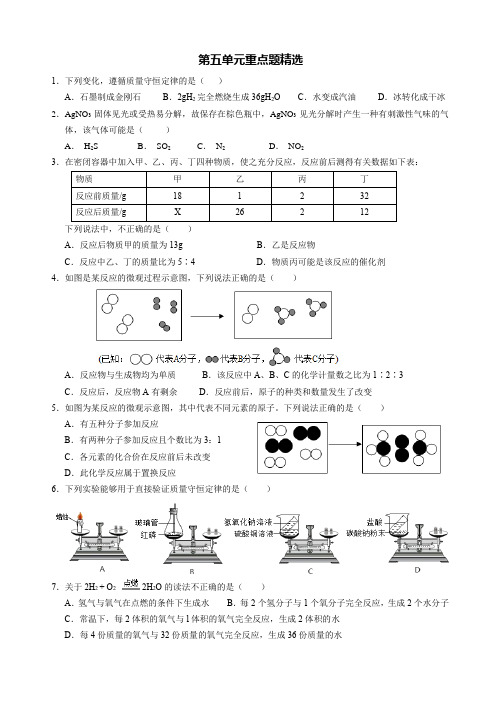
第五单元重点题精选1.下列变化,遵循质量守恒定律的是()A.石墨制成金刚石B.2gH2完全燃烧生成36gH2O C.水变成汽油D.冰转化成干冰2.AgNO3固体见光或受热易分解,故保存在棕色瓶中,AgNO3 见光分解时产生一种有刺激性气味的气体,该气体可能是()A.H2S B.SO2 C.N2D.NO23.在密闭容器中加入甲、乙、丙、丁四种物质,使之充分反应,反应前后测得有关数据如下表:下列说法中,不正确的是()A.反应后物质甲的质量为13g B.乙是反应物C.反应中乙、丁的质量比为5∶4 D.物质丙可能是该反应的催化剂4.如图是某反应的微观过程示意图,下列说法正确的是()A.反应物与生成物均为单质B.该反应中A、B、C的化学计量数之比为1∶2∶3C.反应后,反应物A有剩余D.反应前后,原子的种类和数量发生了改变5.如图为某反应的微观示意图,其中代表不同元素的原子。
下列说法正确的是()A.有五种分子参加反应B.有两种分子参加反应且个数比为3:1C.各元素的化合价在反应前后未改变D.此化学反应属于置换反应6.下列实验能够用于直接验证质量守恒定律的是()7.关于2H2 + O2 2H2O的读法不正确的是()A.氢气与氧气在点燃的条件下生成水B.每2个氢分子与1个氧分子完全反应,生成2个水分子C.常温下,每2体积的氧气与l体积的氧气完全反应,生成2体积的水D.每4份质量的氧气与32份质量的氧气完全反应,生成36份质量的水8.甲和乙在一定条件下反应生成丙和丁。
结合微观示意图分析,下列结论正确的是()A.丙的相对分子质量为32g B.生成的丙和丁的分子个数比为2:1C.发生反应的甲和乙的质量比为22:3 D.反应前后分子种类不变9.如图表示某化学反应的微观过程,有关反应的说法正确的是()A.该反应属于复分解反应B.反应前后分子种类和数目不变C.甲物质中氮、氢元素的质量比为1∶3 D.参加反应甲、乙物质的分子个数比为4∶510.密闭容器中盛有CH4和O2的混合气体,点燃使其充分反应,CH4全部转化为CO、CO2和H2O,待容器恢复至室温,测得容器内混合气体中碳元素的质量分数为36%,则反应前CH4和O2的质量比为()A.4 ∶13 B.3 ∶10 C.2 ∶7 D.1∶411.通常情祝下,铜不和稀硫酸反应。

人教版九年级上册化学《第五单元》同步测试题一、单选题1.化学反应前后一定没有发生变化的是①原子数目②分子数目③元素种类④物质种类⑤原子种类⑥物质的总质量A.①②④⑥B.①③⑤⑥C.①②③⑥D.②③④⑤2.不能用质量守恒定律解释的现象是A.铜丝加热后质量增加B.铁丝燃烧,其固体质量增加C.水受热蒸发D.长时间放置的过氧化氢,质量会减少3.下列现象中,能用质量守恒定律解释的是A.10g水受热变成10g水蒸气B.打开盛酒精的试剂瓶瓶盖,酒精质量逐渐变小C.10mL水与10mL酒精混合后体积小于20mLD.纸在空气中燃烧后化为灰烬,灰烬的质量比纸的质量小4.某化合物在空气中完全燃烧,测得生成物中含有二氧化碳、水蒸气、二氧化硫,下列对该化合物的推断正确的是A.一定含有碳、氢、硫元素B.一定含有碳、氢、氧元素C.只含有碳、氢元素D.一定含有碳、氢、氧元素,可能含有硫元素5.如图是某反应的微观示意图(一种小球代表一种元素的原子),下列说法错误的是A.该反应中共有3种元素B.图中反应物都由原子构成C.该反应的本质是原子的重新组合D.该反应前后分子的种类发生改变6.化学反应:A+2B=C+D,5.6克A跟7.3克B恰好完全反应,生成12.7克C。
现要制得0.4D,则所需A的质量为A.5.6克B.11.2克C.14.6克D.无法计算7.下列化学方程式书写正确的是A.电解水:2H2O 通电2H2+O2↑B .铁丝在氧气中燃烧:4Fe+3O 2点燃2Fe 2O 3C .实验室制氧气:2KMnO 4=K 2MnO 4+MnO 2+O 2↑D .镁在空气中燃烧:2Mg+O 2点燃2MgO8.硝酸铵可发生如下反应:2NH 4NO 3=2N 2↑+O 2↑+4X ,则X 的化学式为A .H 2B .H 2OC .H 2O 2D .HNO 39.某物质在空气中燃烧,化学方程式如下222X+5O 3CO +4H O 点燃。
X 的化学式是A .4CH B .38C H C .26C HD .4CH O 10.关于化学方程式22CO 2C+O 点燃的读法正确的是A .碳加氧气等于一氧化碳B .两个碳和一个氧气点燃,生成两个一氧化碳C .碳和氧气在点燃的条件下反应生成一氧化碳D .每两份质量的碳和一份质量的氧气完全反应,生成两份质量的一氧化碳11.在一定条件下,甲和乙反应生成丙和丁的微观示意图如下。
九年级化学第五单元测试题及答案一、选择题(本题共有10小题,每小题2分,共20分,每小题只有一个正确答案1.为了探究水电解的微观过程,某同学做了一些如下图所示的分子、原子的模型,若用“”表示氢原子,用“”表示氧原子,其中能保持氢气化学性质的粒子模型是(2.已知某两种物质在光照条件下能发生化学反应,其微观示意图如下:(说明:一种小球代表一种原子则下列说法正确的是(A .图示中的反应物都是单质B .图示中共有4种分子C .该反应属于分解反应D .该图示不符合质量守恒定律 3. 如图是四位同学讨论某个化学方程式的场景。
他们所描述的化学方程式是( A .4P+5O 22P 2O 5 B .C+O 2CO 2 C .S+O 2SO 2 D .2H 2+O 22H 2O4.下列化学方程式书写正确的是( A .氧化汞加热分解:HgOHg+O 2↑B .铁在氧气中燃烧:4Fe+3O 2点燃==2Fe 2O 3 C .通电分解水:2H 2O 通电==2H 2↑+ O 2↑ D .碳在氧气中燃烧:C+O 2 通电== CO 25.红磷在密闭容器(含有空气内燃烧,容器内有关的量随时间变化的图象正△6.对于化学方程式 C+O 2CO 2 表示的意义,叙述错误..的是 A .在点燃的条件下,碳和氧气生成了二氧化碳B .碳加氧气反应生成二氧化碳C .每12份质量的碳和32份质量的氧气完全反应能生成44份质量的二氧化碳D .在点燃的条件下,每一个碳原子和一个氧分子化合生成一个二氧化碳分子 7. 在一个密闭容器内有A 、B 、C 、D 四种物质,在一定条件下充分反应,测得A .该闭容器中发生的化学变化属于分解反应B .反应后密闭容器中A 的质量为22gC .该反应中A 、B 、C 、D 四种物质(参加反应或生成的质量比为22∶9∶111∶84D .密闭容器中发生的化学变化属于化合反应8.下列物质在一定条件下都会分解,生成氧气,若相同质量的下列物质完全分解,生成O 2的质量最多的是A .HgOB . KMnO 4C .H 2OD .KClO 39.元素R的每4个R原子与5个氧分子化合生成2个R的氧化物分子,则在此氧化物里,元素R的化合价为A.+3价B.+4价C.+5价D.+6价10.一定质量的某种化合物在空气中完全燃烧后,生成8.8gCO 2和5.4g 水,则该化合物可能是下列的(①CH 4;②C 2H 4;③C 2H 6;④C 2H 5OHA .①② B.②③ C .③④ D.①④二、本大题共6小题,共34分 11.(5分(1用化学用语填空: 2个硫原子 ;3个五氧化二氮分子。
人教版九年级化学上册第五单元测试题附答案详解Document number【980KGB-6898YT-769T8CB-246UT-18GG08】第五单元 化学方程式(考试时间为45分钟,试卷满分为100分)一、选择题(每小题只有1个选项符合题意,每小题4分,共24分) 1.在2H 2+O 2=====2H 2O 的反应中,反应前后肯定发生变化的是( )。
A .元素的种类 B .分子的种类 C .物质的质量总和 D .各种原子的数目2.下列说法中,正确的是( )。
A .10 g 酒精和50 g 水混匀后形成60 g 酒精溶液,这符合质量守恒定律B .细铁丝在氧气中燃烧后,生成物质量比细铁丝的质量大,这不符合质量守恒定律C .2 L 氢气和1 L 氧气反应,生成3 L 水D .1 g 氢气和8 g 氧气恰好完全反应,生成9 g 水3.在密闭容器中加热蔗糖可产生碳和水,由此可以说明( )。
A .蔗糖是由碳和水组成的纯净物 B .蔗糖是由碳和水组成的混合物 C .蔗糖分子是由碳元素和水分子构成的 D .蔗糖是由碳元素、氢元素和氧元素组成 4.下列化学方程式的书写中,正确的是( )。
A .Zn +HCl=== ZnCl 2+H 2 B .4Fe +3O 2=====2Fe 2O 3C .2KMnO 4=== K 2MnO 4+MnO 2+O 2↑D .S +O 2=====SO 2↑5.下图形象地表示某反应前后反应物与生成物分子及其数目的变化,其中““ ”“ ”分别表示A 、B 、C 3种不同的分子。
该反应的化学方程式中A 、 B 、C 前的化学计量数之比为( )。
点燃 △ 点燃 点燃反应前反应后A.4∶1∶3 B.3∶1∶2 C.4∶1∶2 D.3∶1∶36.已知化学反应:2A+B===2C+D,当10 g A和8 g B刚好完全反应后,生成6 g C。
如果要得到3 g D,则参加反应的B的质量是( )。
九年级化学第五单元(化学方程式)测试试卷班级: 姓名:可能用到的相对原子质量: C:12 H:1 O:16 K:39 Mn:55一.选择题:(每小题2分,共40分)1. 质量守恒定律揭示了化学反应中:A. 反应条件B. 哪些物质是反应物C. 哪些物质是生成物D. 反应物和生成物的质量关系2. 化学反应前后,一定发生改变:A. 分子种类B. 原子的相对质量C. 原子个数D. 原子种类3. 天文学家观察到“百武”彗星因受到越来越强的阳光照射而产生喷气现象。
喷出气体包括:CO、CH3OH(甲醇)、HCHO(甲醛)、HCN(氢氰酸)等有毒物质和水蒸气。
根据这一信息可以推测:A.“百武”彗星至少含有C、H、N、O元素B.“百武”彗星中存在单质和化合物C.“百武”彗星是一个液态混合物D.“百武”彗星可能存在生命4. 等质量的下列物质完全燃烧,消耗氧气的质量最多的是:A.H2 B.C C.S D.Mg5. 17世纪人们认为水能变土,1768年科学家拉瓦锡对此进行研究。
他将一定量的蒸馏水加入特殊的蒸馏器,反复加热蒸馏101天,发现蒸馏器内产生少量沉淀,称得整个蒸馏装置的总质量没变、水的质量也没变、沉淀的质量等于蒸馏器减少的质量。
对于这项研究的说法错误的是:MnO 2 点燃 A. 精确称量是科学研究的重要方法 B. 水在长时间加热后能转变为土C. 物质变化过程中总质量守恒D. 沉淀物来自于蒸馏器本身6. 有X 、Y 两元素,使12g X 2与XY 3反应生成24gC ,化学方程式为:X 2+XY 3=3C 。
则X 、Y 两元素的相对原子质量之比:A. 1:1B. 1:2C. 3:1D. 3:47. 在3B +2A=C 的反应中,10gA 与足量的B 反应能生成22gC ,则A 、B 、C 三种物质的相对分子质量之比为:A .3∶2∶1B .12∶10∶22C .4∶5∶22D .5∶4∶228. 加热6.32 g KMnO 4,当剩余物的质量为5.68 g 时,停止加热,则剩余物中含有的物质是:A. KMnO 4B. KMnO 4、K 2MnO 4、MnO 2C. K 2MnO 4、MnO 2D.KMnO 4、K 2MnO 49. 2O 3 B. 2KClO 3====2KCl+3O 2↑C. 4P+5O 5D. 2C 2H 2+5O 2====4CO 2+2H 2O10. 在反应3Cu +8HNO 3=3Cu(NO 3)2+2X ↑+4H 2O 中的X 的化学式是:A. N 2B. NOC. NO 2D. N 2O 511. 下列叙述中正确的是:A. 镁带在空气中燃烧后,生成物的质量跟原镁带的质量相等B. 按任意体积混合后的氢气和氧气的总质量,跟反应后生成水的质量相等C. 二氧化硫气体通入氢氧化钠溶液时,溶液增加的质量就是被吸收的二氧化硫的质量D. 煤球燃烧后质量减轻,这不符合质量守恒定律12. 镁在空气中燃烧,生成氧化镁,其固体质量变化可用图表示,则(80-48)克表示的质量为:A. 生成物O 2的质量C. 参加反应的镁的质量D. 生成物MgO 与参加反应的O 2的质量和九年级化学单元测试(化学方程式) 2005.11第 3 页共6 页△13. 若23克某正一价元素的单质和8克氧气恰好完全反应,所生成氧化物的相对分子质量是:A . 31 B. 46 C. 54 D. 6214. 下列四个反应中生成物都是C,如果C的化学式为A2B3,则该反应的化学方程式为:A. AB2 + B2 = 2CB. AB2 + 2B2 = 2CC. 2AB2 + B2 =2CD. 4AB + B2 =2C15. 氯酸钾与二氧化锰按7:3的质量比均匀混合,加热至不再产生氧气为止,残余固体中,氯化钾的质量分数:A. 等于70%B. 大于70%C. 小于70%D. 等于100%16. 某可燃物4.6g 在足量氧气充分燃烧,生成8.8g 二氧化碳和5.4g 水,则该可燃物的组成为:A. 一定含碳、氢、氧三种元素元素B. 一定含碳、氢元素,可能含氧元素C. 一定含碳、氢元素,不含氧元素D. 所含元素大于三种17. 用I2O5可以测定空气受CO污染的程度,发生反应的化学方程式如下:I2O5+ 5CO====I2+ 5CO2,根据生成CO2的多少,可以判定CO的含量,关于这个反应,下列说法正确的是:A. 参加反应的I2O5的质量等于生成I2的质量B. 参加反应的各物质中的氧原子总数等于生成的CO2中氧原子的总数C. 参加反应的I2O5和CO的质量比等于生成I2和CO2的质量比D. 反应物所含元素种类与生成物所含元素种类不同18. 硫和磷的单质各A g分别在氧气中充分燃烧,得到二氧化硫M g,得到五氧化二磷N g,M 和N的关系正确的是:A. M=NB. M<NC. M>ND. M=N=6419. 化学方程式 2A+B====C+2D中,A、B、C的相对分子质量依次分别为103、71、160,则D相对分子质量为:A. 58.5B. 117C. 114D. 1420. A和B的混合物212 g恰好完全反应生成C和D,已知2A+5B====4C+2D,测得C与D的质量比为44∶9,则生成的C的质量为:A.176 gB.141.3 gC.44 gD.36 g二.填空题:(每空1分,化学方程式2分,共26分)21. 在反应S + O 2SO 2中,若生成m 个SO 2分子,则参加反应的氧原子个数为 .22. 现以2H 2O 2H 2↑ +O 2↑ 为例,请用分子和原子的观点解释质量守恒定律。
九年级上册化学第五单元测试卷一、选择题(每题3分,共30分)1. 化学反应前后,肯定没有变化的是()原子的数目分子的数目元素的种类④物质的总质量⑤物质的种类。
A. ④B. ④C. ⑤D. ④⑤.2. 在化学方程式aC_2H_6+bO_2{点燃}{===}mCO_2+nH_2O中,各化学式系数之间的关系正确的是()A. 2m = aB. 3n = 2aC. 3n = aD. 2b = 2m + n3. 下列化学方程式书写正确的是()A. 4P + 5O_2↑{点燃}{===}2P_2O_5B. Fe + O_2{点燃}{===}Fe_3O_4C. C + O_2=CO_2D. 2Mg + O_2{点燃}{===}2MgO4. 镁在空气中燃烧反应如下:2Mg+O_2{点燃}{===}2MgO,现有3g镁在足量的氧气中完全燃烧,可得到氧化镁的质量为()A. 5gB. 6gC. 8gD. 10g5. 根据化学方程式A + 3B = 2C + 2D,已知A和B的相对分子质量之比为7:8,当2.8gA与一定量B恰好完全反应后,生成3.6gD,则生成C的质量为()A. 9.6gB. 8.8gC. 6.8gD. 4.4g6. 下列关于化学方程式意义的叙述中,不正确的是()A. 化学方程式可以表明反应物、生成物和反应条件。
B. 化学方程式可以表明各反应物和生成物之间的质量比。
C. 化学方程式可以表明各反应物和生成物之间的粒子数目比。
D. 化学方程式可以表明化学反应的快慢。
7. 在反应X + 2Y = R+ 2S中,已知R和S的相对分子质量之比为22:9,当1.6gX 与Y完全反应后,生成4.4gR,则在此反应中Y和S的质量比是()A. 16:9B. 23:9C. 32:9D. 46:98. 化学方程式2H_2+O_2{点燃}{===}2H_2O的正确读法是()A. 氢气加氧气等于水。
B. 两个氢分子加一个氧分子等于两个水分子。
初三化学三四单元练习
1、二氧化硫是由 和 组成的,一个干冰分子是由 构成的。
氯化钠由 构成的。
2、已知1个氨分子由1个氮原子和3个氢原子构成,每个氢原子的核电荷数为1;每个氮原子核内有7个中子,氮原子的相对质量为14。
则1个氨分子里共有 个质子, 个中子, 个原子核, 个电子。
整个氨分子 (填“显”、“不显”)电性。
3、铁原子分别失去两个电子、三个电子,变成 和 (填符号)。
4、人体的生长不能缺乏维生素,而大多数维生素不能在体内合成,必须从食物中摄取。
维生素C 就主要存在与蔬菜和水果中。
其化学式为C 6H 8O 6,则维生素C 的分子中共含有 中原子,其中碳、氢的原子个数比为 ,其相对分子质量为 。
5.写出下列物质的化学式或名称:
碳酸钾_____ 氯化钡_____ FeCl 2______ 硝酸铜__ _ 硫酸铝_______ Ne_____ AgCl____ Na 2CO 3______ Ca(OH)2_____ 硫酸钠_____ 氯化铵______ 高锰酸钾______ Fe 2(SO 4)3 ______ Ne ______ 氯气______
6、用化学符号表示:
①2个铝原子 ②3个氧分子 ③2个氯化氢分子 ④2个亚铁离子____⑤3个铵根离子___ ⑥2个碳酸根离子_____ ⑦氧化镁中镁元素的化合价
7、指出下列式子中“2”的含义:
SO 2 2Ar 2Mg 2+ 前2 后2
2SO 42-前2 后2 CaO
8、下列物质、空气、液氧、水、二氧化碳、水银、铜绿、石灰水(用化学式填写,混合物用名称填写) ①、属于混合物的是 ②、 属于化合物的是
③、属于单质的是 ④、 属于氧化物的是
9、在反应 过氧化 水 + 氧气这个反应中,一定发生改变的微粒的是 , 一定不发生改变的微粒是 ,生成的新的微粒是 。
10、写出我们学过的化学反应符号表达式。
⑴与氧气的反应:
①木炭充分燃烧 木炭不充分燃烧
②红磷燃烧 ③硫粉燃烧
④铁丝燃烧 ⑤镁带燃烧
⑥氢气燃烧 ⑦一氧化碳燃烧
⑧铜丝加热
⑵实验室制气体:
①用高锰酸钾制氧气 ②用双氧水制氧气
MnO 2
-2
二、填空题
11.(7分)A 元素的原子结构示意图为: A 元素在化学反应中容易 _____电子变成________离子,属于_________元素(填金属或非金属);B
,该离子带______个单位正电荷,该元素的原子核外总共有_______个电子。
A 、B
元素形成化合物的化学式(用A 、B 表示)为_____________。
12.
(7分)用化学符号表示:
⑴钠元素
⑵三个磷原子
⑶氩气 ⑷氮气
⑸两个氧分子
⑹2个钙离子____________ ⑺-2价的硫元素___________
13.(5
分)下列符号中“2”所表示的意义:
①(4分)2CO 2 ;。
②(1
分)2CL。
14.(6分)原子序数11—17元素的符号和原子结构示意图如下,请结合下图回答:
Na Mg Al Si P S Cl ⑴原子序数为15的原子质子数为 最外层有 电子。
⑵结合上图用符号表示下列内容:①原子序数为13的原子形成的离子符号是__________。
②分子中含有两个原子物质的化学式 ;③原子序数为12、17的元素组成化合物的化学式 。
⑶从11—17,随着原子序数的增加,其原子结构(或元素的性质)呈现出的变化规律是 (任写一
条)。
15.(5分)北京时间2008年5月12日14时28分,在四川汶川县发生8.0级地震,给广大灾区人民群众造成巨大的损失。
地震之后要开展疾病预防工作。
在预防消毒过程中常用到过氧乙酸(其化学式为 CH 3COOOH ),过氧乙酸是被广泛使用的高效消毒剂,它无色且具有辛辣味,具有强氧化性,与过氧化氢一样不稳定,温度稍高即可分解放出一种常见单质气体,并生成醋酸。
根据以上材料回答:
(1)过氧乙酸由 ___ 种元素组成,相对分子质量为 。
(2)过氧乙酸的物理性质是:__________________;其化学性质是:________ ___。
(3)下列说法正确的是( )
A.过氧乙酸由C 、H 、O 三种原子构成 B .过氧乙酸中C 、H 元素质量比是1:2
C.过氧乙酸的相对分子质量是76克 D .过氧乙酸中O 元素的质量分数约为63.2%。